Метахронный процесс что это
Метахронный рак
Содержание Скрыть
Метахронный рак относится к редким типам заболеваний, характеризующихся развитием злокачественных опухолей. При отсутствии терапии на первых стадиях развития прогноз неблагоприятный, так как патологический процесс затрагивает многие органы и системы.
Общее представление
Метахронный рак относят к одной из форм двухстороннего поражения. Новообразования формируются на парных или с одинаковой гистологической структурой органах. В первую очередь он формируется только на одном, а спустя некоторое время распространяется и на парный орган.
Метахронный рак – редкое онкологическое заболевание, поражающее любые системы и органы. Возникает на фоне генетической предрасположенности, облучения, воздействия канцерогенов.
В начале развития симптоматика отсутствует. Далее появляется головокружение, слабость, головные боли, снижение веса, желтушность кожи, анемия.
Диагностируют рак с помощью результатов анализа крови, теста на онкомаркеры, УЗИ, рентгена, МРТ, КТ. Основной метод лечения – хирургическое вмешательство.
Заболевание встречается с одинаковой частотой как у мужчин, так и у женщин в возрасте от 35 лет.
Какие органы и ткани поражает
Особенностью метахронного рака является то, что патологический процесс распространяется на парне органы. Развитию образований подвержены почки, легкие, молочные железы, яичники.
Кроме этого, развитию новообразования подвержены маточные трубы, бронхи, мочеточники, надпочечники.
Вариантов развития патологии существует множество. Но специалисты выделяют только два основных типа: метахронный и синхронный.
В первом случае поражение обоих органов происходит с большим интервалом. При этом после образования одной опухоли проходит от полугода до года. В этом случае устанавливается первично-множественный метахронный рак.
Но если время между возникновением новообразований составляет менее 6 месяцев, устанавливается первично-множественный синхронный рак.
В результате множества различных вариантов развития патологии специалисты выделяют метахронно-синхронный и синхронно множественный.
В свою очередь, первично-множественный рак подразделяют на:
Кроме этого, подобные опухоли способны сочетаться с доброкачественными образованиями.
Определение типа заболевания позволяет подобрать правильный курс терапии и исключить развитие осложнений.
Провоцирующие факторы
Специалистами не установлено точных причин развития патологии. Но выделен ряд провоцирующих факторов.
Считается, что главным из них является генетическая предрасположенность. Также ученые считают, что новообразования подобного типа возникают в результате воздействие вредных веществ и облучения.
Это могут быть химические или токсические вещества. В группу риска входят люди, работающие на вредном производстве.
К провоцирующим факторам также относится курение, употребление спиртных напитков, проживание в районах с неблагоприятной атмосферой, неправильное питание, травмы.
По мнению специалистов, мутация клеток может происходить на фоне уже имеющегося образования доброкачественного течения.
Клиническая картина
Симптомы метахронного рака разнообразны, но на первой стадии развития не проявляются. На ранних этапах возникают общие признаки, которые сопровождают любое новообразование злокачественного характера. К ним относятся слабость, головные боли, головокружение, снижение аппетита, потеря веса.
По мере увеличения размеров образования в зависимости от его локализации возникают специфические признаки. У пациентов наблюдаются желтушность кожных покровов, нарушение работоспособности пищеварительной системы, болезненные ощущения в области локализации очага патологического процесса.
Среди симптомов наблюдаются бессонница, анемия, изменение цвета каловых масс, понос, тошнота и рвота. Пациенты жалуются на повышенную потливость, стремительное снижение веса.
При достижении новообразования больших размеров возникают признаки интоксикации, выражающиеся в ухудшении состояния, сонливости, чрезмерной слабости.
Диагностика
Установление точного диагноза затруднено, так как метахронный рак часто маскируется под другие заболевания.
При появлении симптомов специалист проводит внешний осмотр, устанавливает имеющиеся жалобы и назначает инструментальные и лабораторные методы диагностики.
В первую очередь пациенту следует сдать кровь на установление наличия онкомаркеров, воспалительного процесса и степени поражения внутренних органов.
Для определения локализации очага патологического процесса и выявления метастатических поражений используются ультразвуковое, эндоскопическое исследование, рентген с применением контраста.
В некоторых случаях назначается магнитно-резонансная или компьютерная томография. Послойное сканирование тканей отличается большой информативностью и позволяет получить точные данные.
На основе полученных результатов устанавливается диагноз, определяется степень распространения патологического процесса, наличие метастазов, назначается курс терапии.
Методы лечения
Терапия при метахронном раке проводится комплексно, особенно при установлении метастатических поражений.
Первично-множественные опухоли
Первично множественные опухоли – неоплазии, возникающие одновременно или через определенный промежуток времени и не являющиеся метастазами друг друга. Могут быть доброкачественными или злокачественными, мультицентрически располагаться в одном органе, возникать в парных органах, локализоваться в пределах одной системы или нескольких систем. Возникают в результате соматических мутаций или наследственных генетических аномалий. Диагностируются на основании клинических симптомов, лабораторных и инструментальных исследований. Тактика лечения определяется типом, распространенностью, локализацией и степенью злокачественности новообразований.
Общие сведения
Первично множественные опухоли – две или более неоплазии различного генеза, одновременно либо последовательно развившиеся в одном или нескольких органах. В большинстве случаев диагностируются два новообразования. Три узла обнаруживаются у 5-8% пациентов. Случаи четырех и более неоплазий являются крайне редкими и рассматриваются как казуистические. В последние десятилетия отмечается резкое увеличение количества первично множественных опухолей, однако истинная частота их развития пока является предметом исследований.
Согласно статистическим данным, первично множественные опухоли выявляются у 13% пациентов с онкологическими заболеваниями, однако некоторые специалисты указывают, что эта цифра может быть заниженной из-за возможных диагностических ошибок (при определении независимого процесса, как метастаза первичного новообразования) и гибели некоторых больных до появления симптомов второй неоплазии. Лечение первично множественных опухолей осуществляют онкологи, гастроэнтерологи, эндокринологи, маммологи, гинекологи и специалисты в других сферах медицины (в зависимости от локализации новообразований).
Первое упоминание о множественных неоплазиях встречается в трудах Авиценны, который более тысячи лет назад описал двухсторонний рак молочных желез. В XIX веке описания первично множественных опухолей стали все чаще встречаться в специализированной литературе. Наиболее существенный вклад в определение понятия и изучение данной патологии внес немецкий хирург Бильрот. В частности, он первым дал определение подобным патологическим состояниям, отнеся к первично множественным опухолям новообразования различной структуры, локализующиеся в разных органах и дающие собственные метастазы.
В первой половине XX века формулировка Бильтота была пересмотрена. В настоящее время первично множественными опухолями считаются неоплазии, которые могут располагаться в одном или в разных органах. Основным условием отнесения заболеваний к этой категории является одновременное или последовательное появление в организме нескольких независимых друг от друга очагов трансформации клеток. Второе и последующие новообразования не должны возникать в результате контактного распространения, лимфогенного или гематогенного метастазирования.
Причины
Непосредственной причиной развития солитарных и первично множественных опухолей являются генетические мутации, обусловленные несколькими факторами. С учетом особенностей этиопатогенеза различают три основных типа неоплазий: возникшие в результате спонтанных соматических мутаций, образовавшиеся вследствие индуцированных соматических мутаций, являющиеся результатом передающихся по наследству генетических мутаций. Следует учитывать, что подобное разделение является достаточно условным. На практике, скорее, можно выделить преобладающую причину развития, которая сочетается с другими, менее значимыми факторами.
При первично множественных опухолях перечисленные мутации могут сочетаться. Возможны любые комбинации, например, первое новообразование развивается спонтанно, второе – в результате индукции; первое является наследственным, второе – индуцированным; оба рака имеют одну и ту же природу (наследственность, воздействие экзогенных факторов) и т. д. При этом у больных первично множественными опухолями отмечается преобладание индуцированных и наследственных мутаций.
В числе наиболее значимых факторов, индуцирующих развитие первично множественных опухолей, рассматривают курение, проживание в неблагоприятных экологических зонах, профессиональные вредности (контакт с химическими мутагенами на некоторых производствах, превышение установленных нагрузок у радиологов), многократные рентгенологические обследования, лучевую терапию и химиотерапию предшествующих онкологических заболеваний. Вероятность возникновения первично множественных опухолей также повышается при нарушениях питания, иммунодефицитных состояниях, гормональных расстройствах и некоторых эндемических заболеваниях.
В список наследственных синдромов, сопровождающихся облигатным развитием или повышенной вероятностью возникновения онкологических поражений, включают более 100 заболеваний. Первично множественные опухоли развиваются или могут развиться при трети таких заболеваний. Наиболее известными синдромами являются МЭН-1, МЭН-2 и МЭН-3, при которых выявляются множественные эндокринные неоплазии. Кроме того, первично множественные опухоли могут диагностироваться при синдроме Линча, синдроме Гарднера, болезни Гиппеля-Линдау, синдроме Пейтца-Егерса и других.
Классификация
Существует несколько классификаций, созданных на разных этапах изучения данной патологии. Современные специалисты обычно используют классификацию Бебякина, разработанную в 1974 году. Согласно этой классификации выделяют следующие типы первично множественных опухолей:
Диагностика
Основой успешной диагностики первично множественных неоплазий является комплексный подход, разработанный с учетом особенностей возникновения и течения этой группы заболеваний. Одной из наиболее распространенных проблем при обнаружении первично множественных опухолей является отсутствие четкой клинической картины, характерной для каждого новообразования. Проявления неоплазий могут накладываться друг на друга, симптомы одного из поражений могут быть слабо выраженными, маскироваться под неопухолевое заболевание или имитировать признаки отдаленных метастазов.
Хотя бы частично решить эту проблему позволяют продуманные планы первичного и последующих обследований, составленные с учетом возможности развития первично множественных опухолей. Так, при локализации солитарного новообразования в зоне молочной железы специалисты уделяют пристальное внимание состоянию второй молочной железы и внутренних женских половых органов, при расположении неоплазии в области желудка – состоянию толстого кишечника, кожи, яичников, матки и молочных желез и т. д. План обследования в каждом конкретном случае составляется индивидуально. Решающую роль при постановке диагноза обычно играют радиологические методики (рентгенография, КТ), УЗИ, МРТ и гистологические исследования.
Вероятность развития первично множественных опухолей у онкологических больных в 6 раз выше, чем в среднем по популяции. С учетом этого обстоятельства, все пациенты с такими заболеваниями после лечения должны находиться под диспансерным наблюдением и проходить регулярные обследования. Такая мера позволяет выявлять рецидивы первичной неоплазии и диагностировать метахронные первично множественные опухоли. Риск развития второго онкологического поражения увеличивается в возрасте 55-70 лет, что должно учитываться при планировании обследования пациентов.
Лечение первично множественных опухолей
Лечение синхронных неоплазий осуществляется одновременно. В зависимости от локализации новообразований и состояния больного хирургическое вмешательство может проводиться единовременно либо быть поэтапным. При планировании очередности операций при первично множественных опухолях учитывают степень распространенности каждого онкологического процесса. В ряде случаев по поводу одного новообразования может быть проведено радикальное лечение, по поводу другого – симптоматическое или паллиативное.
При выборе консервативных методик ориентируются на чувствительность каждой опухоли к радиотерапии и различным химиопрепаратам. Тактика лечения метахронных первично множественных опухолей соответствует тактике лечения солитарных новообразований аналогичных стадий и локализаций. Прогноз определяется видом, расположением, стадией и степенью злокачественности первично множественных опухолей. Отдаленные результаты лечения метахронных неоплазий примерно совпадают с результатами терапии одиночных образований. При синхронных процессах прогноз ухудшается.
Первично-множественный рак: синхронный и метахронный
Несмотря на стремительный рывок в развитии современной медицины, диагностики и фармацевтики, раковые заболевания до сих пор являются самыми тяжёлыми и не всегда поддаются лечению. Прогноз терапевтического курса онкологических заболеваний во многом зависит от того, какие органы поражены, стадии заболевания, локализации опухоли и ее величины, возраста пациента.
Часто у больного появляется несколько злокачественных новообразований одновременно. Развитие онкологии в этих случаях связано в основном с мутациями на генетическом уровне. Положительный прогноз во многом зависит от своевременной диагностики рака и правильно подобранного лечения.
Немного истории
Определение первично-множественного рака представлено на картинке:
Самое первое упоминание о множественных опухолях произошло более 1000 лет тому назад. В своих трудах Авиценна рассказал о двустороннем раке молочных желез. Но первооснователем учения о первичной множественности опухолей принято считать Т. Billroth. Именно он более чем 100 лет назад впервые опубликовал свои работы, в которых он рассказывал о появлении у пациентов двух или даже более злокачественных новообразований.
Немецкий нейрохирург Billroth в своих трудах описал разные структуры новообразований, которые локализуются в различных органах, возможные причины их появления, симптоматику и прочее. Во второй половине XX века труды Billroth были пересмотрены, в них были внесены некоторые коррективы. Уже в начале девяностых годов было опубликовано более 30 000 различных статей и наблюдений, касающихся данной проблемы.
Что это такое?
Первично-множественный рак — это особый вид онкологической патологии, при которой развивается несколько опухолей сразу или спустя какое-то время. Данные новообразования не всегда носят патологический характер, они могут находиться как в одном и том же органе, появляться в парных органах, в пределах одной системы органов или в пределах нескольких систем органов. Чаще всего первично-множественные опухоли возникают из-за различных мутаций на генетическом уровне.
Первично-множественный синхронный рак подразумевает под собой появление второй (или нескольких последующих) опухоли в течение полугода после диагностирования первого новообразования.
Первично-множественный метахронный рак подразумевает диагностику последующих новообразований спустя полгода после обнаружения первой опухоли.
Причины
Основной причиной возникновения первичной множественности опухолей считаются генетические мутации, возникающие из-за определенных факторов. Принято выделять три вида неоплазии:
Чем опасны соматические мутации, расскажем на картинке:
Часто вышеперечисленные виды мутации могут сочетаться между собой, возможны их различные комбинации. Основными причинами возникновения мутации считаются:
Вероятность развития первично-множественного рака у пациентов, уже перенесших онкологическое заболевание, в 6 раз выше, чем у людей, которые не сталкивались с онкологией.
Поэтому после окончания лечения онкологического заболевания, пациентам необходимо регулярно проходить назначенную врачом диагностику, которая может включать в себя:
Какие есть онкомаркеры, и о чем они могут сказать, опишем на картинке:
Развитие первично-множественного рака у людей, уже перенесших рак, повышено из-за того, что во время лечения они зачастую проходили курс терапии, который может стать фактором, повлекшим за собой мутацию.
Диагностика
Важно отнестись к появлению ракового заболевания серьезно. Врачи-онкологи никогда не исключают возможность развития первично-множественного рака. Поэтому они проводят ряд дополнительных диагностических мер. Например, если у женщины был диагностирован рак правой молочной железы, то врачи также регулярно проверяют состояние левой груди, а также уделяют особое внимание состоянию органов мочеполовой системы.
Пациенты, страдающие онкологическими заболеваниями, должны регулярно посещать своего лечащего врача, сдавать все необходимые анализы и проходить всю назначенную специалистом диагностику.
К основным методам диагностики, помогающим определить онкологию, относятся:
Посмотрите видео с рассказом о важности МРТ при определении рака на ранних стадиях:
В то же время особо важную роль играет и сбор анамнеза. Специалист расспрашивает о длительности симптоматики, интенсивности болей, возможных причинах появления возникшей симптоматики, о генетической предрасположенности к ряду заболеваний. Доктор узнает данные о повседневной жизни, условиях рабочей деятельности и окружающей среды, наличии иммунодефицитных заболеваний и состоянии иммунитета.
К сожалению, диагностика онкологических злокачественных заболеваний до сих пор часто происходит на поздних стадиях болезни. Часто это случается из-за того, что пациенты слишком поздно обращаются за помощью врачу. В некоторых случаях заболевание протекает абсолютно бессимптомно и на ранних стадиях пациент практически не чувствует никаких изменений в своем организме.
Лишь на поздней стадии пациент начинает чувствовать себя плохо, жалуется на болевые ощущения, резкое ухудшение общего состояния. В некоторых случаях пациенты даже при наличии определенной симптоматики, которая является признаком заболевания, не обращаются к специалисту, в надежде, что симптомы в скором времени пройдут. Тем самым они усложняют ситуацию, и заболевание прогрессирует дальше.
Термины синхронности и метахронности
При обнаружении двух или более опухолей одновременно или в течение 6 месяцев после появления первой, говорят о синхронных опухолях и о синхронности. Если после диагностирования второй и последующих опухолей прошло 6-12 месяцев, то принято говорить о метахронных новообразованиях и метахронности опухолей.
Существует также разделение первично-множественных опухолей на следующие виды:
Лечение
Лечение первично-множественных опухолей всегда назначается индивидуально, учитывая ряд факторов, таких как:
Лечение врачами-онкологами назначается лишь после тщательного сбора анамнеза, знакомства с клинической картиной заболевания и проведения ряда необходимых диагностических мер.
К хирургическому вмешательству прибегают лишь в том случае, если другие консервативные методы лечения не приносят положительной динамики, или если стадия заболевания настолько запущена, что положительного результата с применением только консервативных методов лечения не добиться.
Стратегия терапевтического курса во многом зависит от состояния здоровья пациента, главной целью лечения является сохранение органов. Рак метахронный и синхронный часто лечится с помощью следующих методов/средств:
Оперативное лечение первично-множественных опухолей может проводиться одновременно, то есть в ходе одной операции удаляются все опухоли и метастазы. Терапия может идти поэтапно — в этом случае проводится несколько оперативных вмешательств по удалению опухолей.
О паллиативном лечении принято говорить в том случае, если удаление опухолей не приведет к положительному результату. С помощью методов паллиативного лечения снижается болевая симптоматика заболевания, оказывается психологическая помощь больному и его семье. Основной целью данного вида лечения является улучшение качества жизни пациентов, страдающих тяжелыми, смертельными, неизлечимыми заболеваниями. Важно помнить, что с помощью паллиативной терапии не ускоряется и не отдаляется наступление смерти.
Существует несколько советов, которых можно придерживаться, чтобы ускорить процесс лечения и улучшить общее состояние:
Профилактика
Сохраните себе памятку «Как защитить себя от рака?»:
К сожалению, не существует профилактических средств, которые полностью бы исключили возможность развития какого-либо онкологического заболевания, в том числе и первично-множественного рака. Но с помощью определенных правил можно снизить риск развития онкологии. К основным правилам относятся:
Даже после полнейшего излечения от онкологических заболеваний, необходимо регулярно посещать врача в целях контроля.
Анализы на рак – тема следующего видео. Как распознать рак, расскажут ведущие программы «Жить здорово»:
Метахронный процесс что это
С улучшением выживания онкологических больных после проведенного лучевого лечения проблема долгосрочных рисков от лучевой терапии, в том числе риск развития второй опухоли, становится все более важной [1, 4, 7, 8]. Известно, что заболеваемость индуцированным лечением раком на 14 % выше в сравнении с населением в целом [5]. Исследования сообщили, что у пациентов, подвергнутых лучевой терапии, есть небольшая (RR 1·1-1·4) повышенная опасность второго рака по сравнению с теми, кто не подвергался лучевой терапии [3, 6].
В настоящее время в рандомизированных клинических испытаниях (Фаза III) наиболее объективно определяется и проверяется только такой показатель, как общая выживаемость. Вместе с тем появление новых видов лечения и многообразие обработки полученных в ходе исследований данных привели к использованию таких показателей, как выживаемость без прогрессирования и время оценки неэффективности лечения [2]. Однако, хотя эти показатели в последнее время часто используются, они еще плохо определены и определения различаются в разных испытаниях, что ограничивает их использование в качестве первичных показателей. Более того, эта изменчивость определений влияет на оценку эффективности лечения.
В 2013 году был опубликован Протокол проекта DATECAN [2]. Проект DATECAN должен привести к разработке рекомендаций, которые могут быть использованы в качестве руководящих принципов в исследованиях, что должно привести к стандартизации определений времени до наступления события в рандомизированных клинических испытаниях, позволяя выполнить соответствующие сравнения результатов будущих исследований [2].
Цель исследования: определить выживаемость больных первично-множественным метахронным раком после лучевой терапии первой опухоли с учетом вида (бета-терапия, гамма-терапия, фотонная – глубокая рентгеновская, фотонная-рентгеновская) и способа (близкофокусная, аппликационная, внешнее дистанционное облучение, внутриполостная, дистанционная и внутриполостная, дистанционная и внутритканевая, открытыми полями) лучевой терапии и риск возникновения неблагоприятного исхода в период лечения.
Материал и методы исследования
Материалом исследования являлись архивные данные по лечению больных в Челябинском окружном онкологическом диспансере (ГБУЗ ЧОКОД). Мы выделили группу из 232 больных, у которых впоследствии после лучевой терапии первой опухоли возникли первично-множественные метахронные опухоли. Для статистической обработки результатов исследования мы использовали программы IBM SPSS Statistics Version 22.0.0.0; Statistica Version 10.0.0.0.
Результаты исследования и их обсуждение
Средний возраст больных на момент установления диагноза первичной опухоли составил 60,23 лет (от 18 до 85 лет). Интервал времени от появления первой опухоли до появления второй опухоли составил в среднем 91,81 месяц, интервал времени от начала лучевой терапии первой опухоли до появления второй опухоли составил в среднем 87,90 месяцев. В группах живых (134 человека) и умерших (98 человек) больных интервал времени от начала лучевой терапии первой опухоли до появления второй опухоли составил в среднем соответственно 97,05 и 75,42 месяцев. При анализе сроков возникновения второй опухоли по критерию однородности дисперсий (статистика Ливиня) для сроков возникновения второй опухоли от начала лучевой терапии достоверные различия вышеуказанного показателя в группах живых и умерших получены не были (показатели значимости = 0,156). В результате проведенного однофакторного дисперсионного анализа определено, что дисперсия между средними значениями срока развития второй опухоли от начала лучевого лечения всего в 3,5 раза выше, чем внутригрупповая дисперсия (F = 3,545; значимость = 0,061).
В среднем в группе пациентов, получивших лучевую терапию первой опухоли, пациенты прожили 129,41 месяцев от момента установки диагноза первой опухоли, 127,03 месяца от начала лучевого лечения первой опухоли и 37,64 месяца от момента появления второй опухоли.
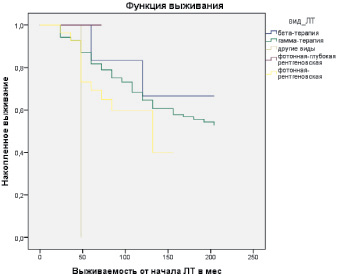
На следующем этапе исследований мы определили выживаемость больных в зависимости от вида лучевой терапии (бета-терапия, гамма-терапия, фотонная – глубокая рентгеновская, фотонная-рентгеновская) (рис. 1).
Среднее время выживания после бета-терапии и гамма-терапии было одинаковым и составило 204,00 месяца, после фотонной глубокой рентгентерапии – 60,00 месяцев, после фотонной рентгеновской – 125,88 месяцев (рис. 1).
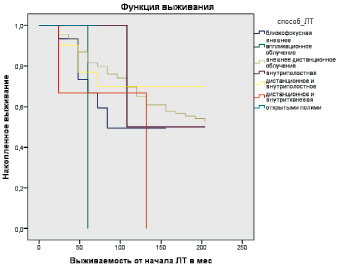
На следующем этапе наших исследований мы определили выживаемость больных в зависимости от способа лучевой терапии (близкофокусная, аппликационная, внешнее дистанционное облучение, внутриполостная, дистанционная и внутриполостная, дистанционная и внутритканевая, открытыми полями) (рис. 2).
По данным рис. 2, среднее время выживания после применения близкофокусной терапии составило 83,25 месяца, после внешнего аппликационного облучения – 54,00 месяца, после внешнего дистанционного облучения, внутриполостной терапии и сочетанной терапии (дистанционное и внутриполостное облучение) время выживания было одинаковым и составило 204,00 месяца, после сочетания дистанционной и внутриполостной терапии – 123,00 месяца и после облучения открытыми полями – 60,00 месяцев (рис. 2).
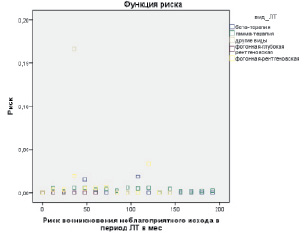
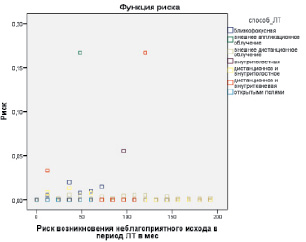
На следующем этапе наших исследований мы определили риск возникновения неблагоприятного исхода в период лечения больных в зависимости от вида и способа лучевой терапии (рис. 3, 4).
По данным рис. 3, риск возникновения неблагоприятного исхода в период лечения при бета-терапии несколько повышался в интервалах 48 и 108 месяцев, при гамма-терапии риск возникновения неблагоприятного исхода в период лечения повышался в интервалах 12, 36, 48 и 96 месяцев, при фотонной рентгеновской терапии риск возникновения неблагоприятного исхода в период лечения повышался в интервалах 36, 72 и 120 месяцев (рис. 3).
Рис. 1. Выживаемость больных в зависимости от вида лучевой терапии
Рис. 2. Выживаемость больных в зависимости от способа лучевой терапии
Рис. 3. Риск возникновения неблагоприятного исхода в период лечения в зависимости от вида лучевой терапии
Рис. 4. Риск возникновения неблагоприятного исхода в период лечения в зависимости от способа лучевой терапии
По данным рис. 4, риск возникновения неблагоприятного исхода в период лечения при близкофокусной лучевой терапии несколько повышался в интервалах 36 и 72 месяцев, при внешнем аппликационном облучении риск возникновения неблагоприятного исхода в период лечения повышался в интервале 48 месяцев, при внешнем дистанционном облучении риск возникновения неблагоприятного исхода в период лечения повышался в интервале 204 месяца, при внутриполостной терапии – в интервале 96 месяцев, при сочетании внутриполостной терапии и дистанционного облучения – в интервале 36 месяцев, при сочетании дистанционной и внутритканевой терапии риск возникновения неблагоприятного исхода в период лечения повышался в интервалах 12 и 120 месяцев (рис. 4).
Таким образом, наше исследование показало, что наибольшая выживаемость больных с первично-множественными метахронными опухолями отмечается в группах больных с бета- и гамма-терапией с внешним дистанционным облучением первой опухоли, а наименьшая – в группе больных с глубокой фотонной рентгентерапией и близкофокусной терапией первой опухоли. При этом риск возникновения неблагоприятного исхода в период лечения повышался по интервалам неодинаково для различных видов и способов лучевой терапии.
Рецензенты:
Яйцев С.В., д.м.н., профессор, заведующий кафедрой онкологии, ГБОУ ВПО ЮУГМУ, г. Челябинск;
Жаров А.В., д.м.н., профессор кафедры онкологии, лучевой диагностики и лучевой терапии, ГБОУ ВПО ЮУГМУ, г. Челябинск.