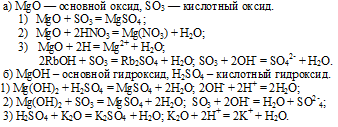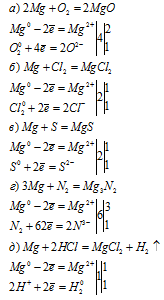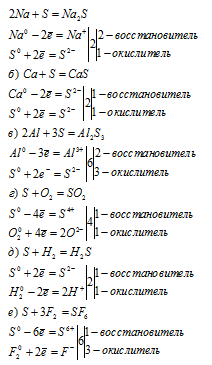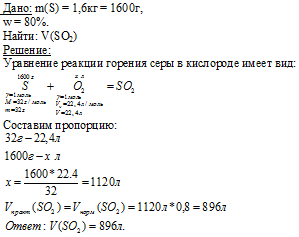Металлические свойства фосфора выражены сильнее чем
Характеристика химических элементов на примере фосфора, калия и магния
При взаимодействии Р2О5 с основными оксидами и основаниями он дает соли:
6. Высший гидроксид фосфора — фосфорная кислота Н3РО4, проявляет все типичные свойства кислот:
взаимодействие с основаниями и основными оксидами:
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами:
7. Летучего водородного соединения калий не образует, а образует гидрид калия KH.
Вопрос 2.
Вопрос 3.
Магний — простое вещество, для него характерна металлическая кристаллическая решетка; он обладает металлическим блеском, электропроводностью.
Аллотропия химических элементов
Вопрос 4.
Аллотропия — явление существования химического элемента в виде нескольких простых веществ, различных по строению и свойствам (так называемых аллотропных форм).
а) В молекулах состава S2 реализуется ковалентно-неполярный тип связи (т.е. не происходит смещения электронной пары, образующей связь).
б) В молекулах состава Н2S реализуется ковалентно-полярный тип связи, т.к. происходит смещение электронной пары к более электроотрицательному атому — сере (S):
Физические свойства ромбической серы (S2):
вещество лимонно-желтого цвета, устойчивое до t = 95,6 °С, растворяется в сероуглероде (CS2), анилине, бензоле, феноле.
Уравнения реакций:
Вопрос 5.
Неметаллические свойства кремния выражены слабее, чем у фосфора, но сильнее, чем у алюминия.
Вопрос 6.
а) У азота кислотные свойства выражены сильнее, чем у фосфора, т.к. в группах сверху вниз происходит усиление основных и ослабление кислотных свойств.
б) У серы кислотные свойства выражены сильнее, чем у фосфора, так как в периодах слева направо происходит усиление кислотных и ослабление основных свойств.
Вопрос 7.
Вопрос 8.
Вопрос 9.
Нет, нельзя. Прежде всего, из-за различия в степенях окисления. В оксиде сера имеет степень окисления 6+. В сернистой кислоте — 4+. Высшему оксиду SO3 соответствует серная кислота H2SO4. Сернистой кислоте H2SO3 соответствует оксид SO2.
Данные соответствия можно показать гидролизом оксидов:
Характеристика химических элементов на примере фосфора, калия и магния
При взаимодействии Р2О5 с основными оксидами и основаниями он дает соли:
6. Высший гидроксид фосфора — фосфорная кислота Н3РО4, проявляет все типичные свойства кислот:
взаимодействие с основаниями и основными оксидами:
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами:
7. Летучего водородного соединения калий не образует, а образует гидрид калия KH.
Вопрос 2.
Вопрос 3.
Магний — простое вещество, для него характерна металлическая кристаллическая решетка; он обладает металлическим блеском, электропроводностью.
Аллотропия химических элементов
Вопрос 4.
Аллотропия — явление существования химического элемента в виде нескольких простых веществ, различных по строению и свойствам (так называемых аллотропных форм).
а) В молекулах состава S2 реализуется ковалентно-неполярный тип связи (т.е. не происходит смещения электронной пары, образующей связь).
б) В молекулах состава Н2S реализуется ковалентно-полярный тип связи, т.к. происходит смещение электронной пары к более электроотрицательному атому — сере (S):
Физические свойства ромбической серы (S2):
вещество лимонно-желтого цвета, устойчивое до t = 95,6 °С, растворяется в сероуглероде (CS2), анилине, бензоле, феноле.
Уравнения реакций:
Вопрос 5.
Неметаллические свойства кремния выражены слабее, чем у фосфора, но сильнее, чем у алюминия.
Вопрос 6.
а) У азота кислотные свойства выражены сильнее, чем у фосфора, т.к. в группах сверху вниз происходит усиление основных и ослабление кислотных свойств.
б) У серы кислотные свойства выражены сильнее, чем у фосфора, так как в периодах слева направо происходит усиление кислотных и ослабление основных свойств.
Вопрос 7.
Вопрос 8.
Вопрос 9.
Нет, нельзя. Прежде всего, из-за различия в степенях окисления. В оксиде сера имеет степень окисления 6+. В сернистой кислоте — 4+. Высшему оксиду SO3 соответствует серная кислота H2SO4. Сернистой кислоте H2SO3 соответствует оксид SO2.
Данные соответствия можно показать гидролизом оксидов: