Метоклопрамид или мотилиум что лучше
Нарушения моторики органов пищеварения и общие принципы их коррекции
Практически любое заболевание органов пищеварения сопровождается нарушением их моторной функции. В одних случаях они определяют характер клинических проявлений, в других — скрываются на втором плане, однако присутствуют практически всегда.
Практически любое заболевание органов пищеварения сопровождается нарушением их моторной функции. В одних случаях они определяют характер клинических проявлений, в других — скрываются на втором плане, однако присутствуют практически всегда. И это закономерно, т. к. характер моторики находится под контролем и в тесной связи с состоянием органов пищеварения, также как под контролем нервных и гуморальных механизмов более высокого уровня.
Все состояния, связанные с нарушением моторики органов пищеварения, можно подразделить на две большие группы. В первом случае рассматриваемые нарушения связаны с патологическим процессом в том или ином отделе пищеварительной системы, например, при язвенной болезни двенадцатиперстной кишки или при колитах. Моторика может изменяться при сдавлении кишки извне, наличии препятствия в ее просвете или увеличении объема ее содержимого, как, например, наблюдается при осмотической диарее. В других случаях моторика меняется вследствие нарушения ее регуляции со стороны нервной или эндокринной систем. Эта группа заболеваний получила название функциональных, что подчеркивает вторичность и обратимость развивающихся изменений. В то же время длительно существующие функциональные нарушения моторики органов пищеварения рано или поздно приводят к их «органическому» поражению. Так, функциональный гастроэзофагеальный рефлюкс может стать причиной рефлюкс-эзофагита, т. е. привести к формированию гастроэзофагеальной рефлюксной болезни, а синдром раздраженного кишечника — к развитию хронического колита. Таким образом, благоприятное течение функциональных нарушений, на котором акцентируют внимание и Римские критерии, является таковым только на определенном временном промежутке. Следует также подчеркнуть, что функциональные заболевания особо актуальны для педиатрической практики, т. к. составляют у детей подавляющую часть всех заболеваний органов пищеварения. Распространенность функциональных нарушений в структуре заболеваний желудочно-кишечного тракта у детей не только велика, но продолжает ежегодно расти. Так, синдром функциональной диспепсии наблюдается в 30–40% случаев, хроническая дуоденальная непроходимость — в 3–17% [1].
Все моторные нарушения пищеварительной трубки можно сгруппировать следующим образом:
Клиническая симптоматика нарушений моторики органов пищеварения многообразна и зависит от локализации процесса, его характера и первопричины. Они могут проявляться диареей или запором, рвотой, регургитацией, болями или дискомфортом в животе и многими другими жалобами.
Соматические симптомы (жалобы) больного представляют собой, по существу, интерпретацию психической сферой человека информации от рецепторов, расположенных во внутренних органах. На ее формирование оказывает влияние не только патологический процесс как таковой, но также особенности нервной системы и психической организации пациента. Реальная жалоба, представляемая таким образом врачу, определяется характером патологии, чувствительностью рецепторов, особенностями проводящей системы и, наконец, интерпретацией информации от органов на уровне коры больших полушарий. При этом последнее звено нередко оказывает решающее влияние на характер жалоб, нивелируя их в одних случаях и усугубляя — в других, а также придавая им индивидуальную эмоциональную окраску.
Поток импульсов от периферических рецепторов определяется уровнем их чувствительности или гиперчувствительности к действию повреждающих стимулов, проявляющейся снижением порога их активации, увеличением частоты и длительности импульсов в нервных волокнах с усилением афферентного ноцицептивного потока. При этом незначительные по своей силе стимулы (например, растяжение стенки кишки) могут провоцировать интенсивный поток импульсов в центральные отделы нервной системы, создавая образ тяжелого поражения с соответствующей ответной вегетативной реакцией.
Можно, таким образом, выделить три уровня формирования соматического симптома (жалобы), например боли: органный, нервный, психический. Генератор симптома может располагаться на любом уровне, однако формирование эмоционально окрашенной жалобы происходит только на уровне психической деятельности. При этом болевая жалоба, сгенерированная без поражения органа, может ничем не отличаться от таковой, возникшей вследствие истинного повреждения.
Как и в случае боли, жалобы, связанные с нарушением моторики желудочно-кишечного тракта, могут быть сформированы на уровне пораженного органа (желудка, кишечника и т. п.), связаны с нарушением регуляции этих органов со стороны нервной системы, но также могут быть сгенерированы независимо от состояния органа, в связи с особенностью психоэмоциональной организации пациента. По сравнению с механизмом возникновения боли, различие связано лишь с направлением нервной импульсации: в случае болей имеет место «восходящее» направление, а генератором жалобы может стать вышележащий уровень без участия нижележащего, тогда как в случае нарушения моторики желудочно-кишечного тракта наблюдается обратная ситуация: «нисходящая» импульсация с возможностью генерации симптома нижележащим органом без участия вышележащего. Наконец, возможна генерация нисходящего стимула на сегментарном уровне в ответ на патологический восходящий импульс, например, при гиперреактивности рецепторов. Механизмы, связанные со снижением порога чувствительности рецепторов кишечника в сочетании со стимуляцией его со стороны верхних регуляторных центров, активизирующихся на фоне психосоциальных влияний, наблюдаются, в частности, при синдроме раздраженного кишечника.
Таким образом, любой симптом (жалоба) становится таковым только при обработке разрозненной нервной импульсации высшими отделами. Истинная соматическая жалоба определяется поражением того или иного внутреннего органа, а различные отделы нервной системы выполняют функции связующего звена и первичной обработки данных, передавая последние на уровень психики или в обратном направлении. В то же время генератором соматоподобных жалоб может быть сама нервная система и ее высшие отделы. При этом психический уровень является абсолютно самодостаточным и здесь могут «зарождаться» жалобы, не имеющие своего прообраза на соматическом уровне, но не отличимые от истинных соматических симптомов. Именно эти механизмы лежат в основе нарушений моторики функционального характера. Дифференцировка первичного уровня симптома (жалобы) имеет принципиальное значение для правильной постановки диагноза и выбора оптимального плана лечения.
Нарушения моторики органов пищеварения любого происхождения неизбежно вызывают вторичные изменения, главными из которых является нарушение процессов переваривания и всасывания, а также нарушение микробиоценоза кишечника. Перечисленные нарушения усугубляют моторные нарушения, замыкая патогенетический «порочный круг» [2].
Органы пищеварения обладают электрической активностью, определяющей ритм и интенсивность мышечных сокращений и моторики в целом. Вопрос о локализации электрического водителя ритма желудочно-кишечного тракта остается открытым. Проведенные исследования показали, что водитель ритма желудка расположен в проксимальной части большой кривизны, а для тонкой кишки данную роль играет проксимальный отдел двенадцатиперстной кишки (некоторые авторы локализуют его в области впадения общего желчного протока), который генерирует медленные электрические волны наиболее высокой для всей тонкой кишки частоты. Кроме того, доказано, что любая зона желудочно-кишечного тракта является источником ритма для каудально расположенных сегментов или становится таковым в определенных условиях. Скорость распространения основного электрического ритма в различных отделах желудочно-кишечного тракта неодинакова и зависит от его функционального состояния и водителя ритма. Для желудка она колеблется от 0,3–0,5 см/сек (в фундальном отделе) до 1,4–4,0 см/сек (в антральном отделе). Следует отметить, что всегда существует градиент как основного электрического ритма, так и ритмических сокращений гладких мышц желудочно-кишечного тракта по частоте и скорости проведения возбуждения в каудальном направлении [3, 4, 5, 6].
Для оценки характера моторики органов пищеварения могут использоваться рентгенологические (контрастные) и электрофизиологические методы исследования (электрогастроэнтеромиография). Последние в настоящее время получили новый импульс для развития и внедрения в практику на основе новой технической базы и компьютерных технологий, позволивших в реальном времени проводить сложный математический анализ полученных данных. Метод основан на регистрации электрической активности органов пищеварения.
Коррекция нарушений моторики органов пищеварения сводится к решению трех задач:
Так как первопричиной функциональных нарушений чаще всего является нарушение нервной регуляции органов пищеварения, первая задача в этом случае должна решаться гастроэнтерологами в тесном контакте с невропатологами, психоневрологами и психологами после тщательного обследования пациента [7]. В случае первичной патологии органов пищеварения, например при язвенной болезни, на первое место выходит лечение основного заболевания.
Вторая задача решается назначением постуральной терапии, коррекцией питания и медикаментозными средствами. Постуральная терапия наиболее важна при коррекции гастроэзофагеального рефлюкса. Рекомендуется обеспечить возвышенное положение головного конца кровати пациента, избегать тесной одежды и тугих поясов, физических упражнений, связанных с перенапряжением мышц брюшного пресса, глубоких наклонов, длительного пребывания в согнутом положении, поднятия руками тяжестей более 8–10 кг на обе руки. Детям грудного возраста следует придавать вертикальное положение во время кормления и непосредственно после кормления. В питании следует ограничить или снизить содержание животных жиров, повысить содержание белка, избегать раздражающих продуктов, газированных напитков, уменьшить разовый объем (можно увеличить частоту) приема пищи. Кроме того, не следует есть перед сном. Больным с ожирением рекомендуется снизить вес. Эти и некоторые другие задачи у детей грудного возраста решаются назначением специальных антирефлюксных смесей. По возможности следует избегать приема препаратов, снижающих тонус нижнего пищеводного сфинктера, в т. ч. седативных, снотворных, транквилизаторов, теофиллина, холинолитиков, бета-адреномиметиков. В случае курения его необходимо прекратить.
При патологии кишечника исключаются плохо переносимые (вызывающие появление боли, диспепсии) и способствующие газообразованию продукты: жирные блюда, шоколад, бобовые (горох, фасоль, чечевица), капуста, молоко, черный хлеб, картофель, газированные напитки, квас, виноград, изюм. Ограничиваются свежие овощи и фрукты. Другие продукты и блюда назначают в зависимости от преобладания в клинической картине диареи или запора.
В целом диета определяется основным заболеванием.
С целью медикаментозной коррекции моторики органов пищеварения применяются прокинетики и спазмолитики. Список прокинетиков, применяющихся отечественными гастроэнтерологами, относительно невелик. К ним относятся метоклопрамид, домперидон и тримебутин.
Действие домперидона (Мотилиум), также как и метоклопрамида (Церукал, Реглан), связано с их антагонизмом по отношению к дофаминовым рецепторам желудочно-кишечного тракта и, как следствие, усилением холинергической стимуляции, приводящей к повышению тонуса сфинктеров и ускорению моторики. В отличие от домперидона, метоклопрамид хорошо проникает через гематоэнцефалический барьер и способен вызывать серьезные побочные эффекты (экстрапирамидные расстройства, чувство сонливости, усталости, беспокойство, а также галакторею, связанную с повышением в крови уровня пролактина), что заставляет избегать его применения в педиатрической практике. Единственной ситуацией, когда метоклопрамид оказывается незаменимым, является экстренное купирование рвоты, т. к. другие прокинетики не выпускаются в инъекционных формах. Мотилиум назначается в дозе 2,5 мг на 10 кг массы тела 3 раза в день в течение 1–2 месяцев. Побочные эффекты Мотилиума (головная боль, общая утомляемость) встречаются редко (у 0,5–1,8% больных).
Изучается также влияние на моторику и возможность применения при функциональных расстройствах как у взрослых, так и у детей аналогов соматостатина (октреотида). Было показано, что соматостатин снижает моторику желудочно-кишечного тракта и может с успехом применяться при ряде функциональных расстройств, однако конкретные показания и способ применения еще не разработаны [8, 9].
Особое место среди препаратов, влияющих на моторику, занимает лоперамид (Имодиум). Точкой фармакологического приложения этого препарата являются опиатные рецепторы толстой кишки, воздействие на которые приводит к значительному, зависимому от дозы, более выраженному по сравнению с тримебутином, замедлению моторики. Лоперамид является высокоэффективным симптоматическим противодиарейным средством и может использоваться в комбинации с другими препаратами. Применение его должно быть достаточно осторожным, т. к. на фоне замедления моторики кишечное всасывание повышается, что может привести к тяжелой интоксикации, особенно у больных с инфекционной диареей или выраженным дисбактериозом кишечника.
Во многих случаях, помимо нарушений пропульсивной активности, имеет место спазм сфинктеров. В этих случаях ключевыми препаратами становятся спазмолитики, не только нормализующие мышечный тонус, но также устраняющие боль. Спазмолитическими эффектами в отношении органов пищеварения обладают несколько групп лекарственных средств. К ним относятся М-холинолитики (начиная с ушедшего из клинической практики атропина), миотропные спазмолитики, действующие через подавление фосфодиэстеразы (например, дротаверин (Но-шпа)), селективный блокатор кальциевых каналов клеток кишечника (пинаверия бромид (Дицетел)) и высокоэффективный модулятор Na+- и K+-каналов (мебеверин (Дюспаталин)).
Дротаверин, ингибиторуя фосфодиэстеразы IV, повышает концентрации цАМФ в миоцитах, что приводит к инактивации киназы миозина, тормозит соединение миозина с актином, снижая сократительную активность гладкой мускулатуры, и способствует расслаблению сфинктеров и снижению силы мышечных сокращений.
Пинаверия бромид (Дицетел) блокирует потенциалзависимые кальциевые каналы миоцитов кишечника, резко снижая поступление в клетку внеклеточных ионов кальция и тем самым предотвращая мышечное сокращение. Особенностями препарата является его селективность в отношении органов пищеварения, включая желчевыводящие пути, а также способность снижать висцеральную чувствительность, не влияя на другие органы и системы, включая сердечно-сосудистую.
Особенностью мебеверина (Дюспаталина) является его двойное действие. С одной стороны, он блокирует быстрые Na+-каналы, препятствуя деполяризации мембраны мышечной клетки и развитию спазма, нарушая при этом передачу импульса от холинергических рецепторов. С другой стороны, мебеверин блокирует наполнение Сa++-депо, истощая их и ограничивая тем самым выход К+ из клетки, что препятствует развитию гипотонии. Таким образом, мебеверин обладает модулирующим действием на сфинктеры органов пищеварения, при котором возможно не только снятие спазма, но также предотвращение избыточной релаксации. Особенностью Дюспаталина является его форма выпуска: 200 мг мебеверина заключены в микрогранулы, покрытые рН-чувствительной оболочкой, а сами микрогранулы заключены в капсулу. Таким образом достигается не только наибольшая эффективность препарата, но также пролонгирование его действия во времени и на протяжении всего желудочно-кишечного тракта. Постепенно высвобождающийся из гранул препарат обеспечивает равномерное действие в течение 12–13 часов. Дюспаталин назначается внутрь за 20 мин до еды по 1 капсуле 2 раза в день (утром и вечером).
Мебеверин выпускается с 1965 г., и многолетний опыт его применения показал не только эффективность препарата, но и его безопасность. Важной особенностью препарата является отсутствие антихолинергических эффектов, что значительно расширяет область его применения.
При метеоризме назначаются препараты, уменьшающие газообразование в кишечнике за счет ослабления поверхностного натяжения пузырьков газа, приводя к их разрыву и предотвращая тем самым растяжение кишечной стенки (и соответственно — развитие боли). Может использоваться симетикон (Эспумизан) и комбинированные препараты: Панкреофлат (панкреатические ферменты + симетикон), Юниэнзим с МПС (растительные ферменты + сорбент + симетикон).
При запорах показано назначение слабительных препаратов и/или прокинетиков, однако в последней группе препаратов отсутствуют эффективные средства, допущенные к применению в педиатрической практике, а из слабительных средств наиболее эффективным и безопасным во всех возрастных группах средством является лактулоза (Дюфалак).
Главной особенностью лактулозы является ее пребиотическое действие. Пребиотики представляют собой частично или полностью неперевариваемые компоненты пищи, которые избирательно стимулируют рост и/или метаболизм одной или нескольких групп микроорганизмов, обитающих в толстой кишке, обеспечивая нормальный состав кишечного микробиоценоза. С биохимической точки зрения в эту группу нутриентов входят полисахариды и некоторые олиго- и дисахариды.
В результате микробного метаболизма пребиотиков в толстой кишке образуются молочная кислота, короткоцепочечные жирные кислоты, углекислый газ, водород, вода. Углекислый газ в большой степени преобразуется в ацетат, водород всасывается и выводится через легкие, а органические кислоты утилизируются макроорганизмом, причем значение их для человека трудно переоценить.
Лактулоза представляет собой дисахарид, состоящий из галактозы и фруктозы. Ее пребиотический эффект был доказан в многочисленных исследованиях. Так, в рандомизированном двойном слепом контролируемом исследовании на 16 здоровых добровольцах (10 г/день лактулозы в течение 6 недель) было показано достоверное нарастание числа бифидобактерий в толстой кишке [10].
Слабительный эффект лактулозы непосредственно связан с ее пребиотическим действием и обусловлен значительным увеличением объема содержимого толстой кишки (примерно на 30%) в связи с ростом численности бактериальной популяции. Увеличение продукции кишечными бактериями короткоцепочечных жирных кислот нормализует трофику эпителия толстой кишки, улучшает ее микроциркуляцию, обеспечивая эффективную моторику, всасывание воды, магния и кальция. Частота побочных эффектов лактулозы значительно ниже по сравнению с другими слабительными средствами и не превышает 5%, причем в большинстве случаев их можно считать незначительными. Безопасность лактулозы определяет возможность ее применения даже у недоношенных детей, доказанную в клинических испытаниях [11, 12].
Доза лактулозы (Дюфалака) подбирается индивидуально, начиная с 5 мл 1 раз в день. При отсутствии эффекта дозу постепенно (на 5 мл каждые 3–4 дня) увеличивают до получения желаемого эффекта. Условно максимальной дозой можно считать у детей до 5 лет 30 мл в сутки, у детей 6–12 лет — 40–50 мл в сутки, у детей старше 12 лет и взрослых — 60 мл в сутки. Кратность приема может составлять 1–2 (реже — 3) раза в день. Курс лактулозы назначают на 1–2 месяца, а при необходимости — и на более длительный срок. Отменяют препарат постепенно под контролем частоты и консистенции стула.
Регуляторами моторики в определенной степени являются также адсорбенты, среди которых первое место занимает Смекта. Важно, что смектит (действующее начало препарата Смекта), помимо непосредственно адсорбирующего действия, обладает свойствами мукоцитопротекции и способствует замедлению моторики и благоприятно влияет на состав кишечной микрофлоры, являясь синергистом пробиотиков.
Третья задача при коррекции расстройств моторики — воздействие на нарушения, возникшие на фоне дискинезии пищеварительного тракта. Нарушения моторики (как замедление, так и ускорение) приводят к нарушению нормальных процессов переваривания и всасывания и изменению состава внутренней среды кишки. Изменение состава внутренней среды в кишке отражается на составе микрофлоры с развитием дисбактериоза, а также усугубляет уже имеющиеся нарушения пищеварительных процессов, в частности, вследствие изменения рН кишечного содержимого. В дальнейшем возможно повреждение эпителия, развитие воспалительного процесса, знаменующего переход от функциональных нарушений к заболеванию с вполне определенным морфологическим субстратом. Таким образом, с одной стороны, для коррекции нарушенной моторики целесообразно использование препаратов, обладающих пребиотической активностью (в т. ч. лактулоза), а, с другой стороны, в комплекс лечения функциональных нарушений пищеварительного тракта, при необходимости, должны включаться препараты панкреатических ферментов (предпочтительно высокоэффективные микросферические, например, Креон), адсорбенты (Смекта), пробиотки (Бифидум-бактерин форте и аналогичные).
В целом, определение состава терапии должно быть строго индивидуальным, учитывающим патогенетические особенности процесса у конкретного пациента с обязательной коррекцией первопричины расстройств моторики органов пищеварения.
Перспективы применения нового прокинетика с двойным механизмом действия в терапии гастроэзофагеальной рефлюксной болезни
И.В. Маев, А.А. Самсонов, А.Н. Одинцова, Е.В. Белявцева, М.Г. Задорова
ГОУ ВПО РГМУ Росздрава, Москва Обсуждаются проблема развития гастроэзофагеальной рефлюксной болезни (ГЭРБ) и тактика ее лечения с учетом основных патогенетических механизмов. На сегодняшний день ведущим направлением в лечении ГЭРБ является кислотосупрессивная терапия, в частности, с использованием ингибиторов протонной помпы (ИПП). Однако с учетом того, что даже самые эффективные ИПП не влияют на первопричину болезни – нарушение двигательной функции пищеварительного тракта, при лечении больных ГЭРБ дополнительно показано использование лекарственных средств, обладающих прокинетическим эффектом на верхние отделы желудочно-кишечного тракта. Препаратом нового поколения прокинетиков является итоприда гидрохлорид (Ганатон) – антагонист дофаминовых D2-рецепторов и блокатор ацетилхолинестеразы. Особенности фармакодинамики и фармакокинетики Ганатона позволяют применять его у больных ГЭРБ в режиме длительной противорецидивной терапии как в комбинации с ИПП, так и в виде монотерапии.
Ключевые слова: гастроэзофагеальная рефлюксная болезнь, нижний пищеводный сфинктер, дуодено-гастральный рефлюкс, прокинетики, итоприда гидрохлорид, ингибиторы протонной помпы
В развитии многих распространенных гастроэнтерологических заболеваний, в первую очередь гастроэзофагеальной рефлюксной болезни (ГЭРБ), важную роль играют нарушения двигательной функции пищеварительного тракта. В основе развития ГЭРБ лежит нарушение моторно-эвакуаторной функции органов эзофагогастродуоденальной зоны, приводящее к систематическим, длительным забросам в пищевод желудочного и дуоденального содержимого, являющегося повреждающим агрессивным агентом для слизистой оболочки пищевода.
Патогенетические механизмы развития ГЭРБ
Считается, что ГЭРБ развивается как результат дисбаланса между агрессивным воздействием забрасываемых компонентов и трехступенчатой системой защиты пищевода, включающей противорефлюксные барьеры, механизмы очищения от кислоты и тканевую резистентность [1–3]. Компоненты, определяющие повреждающие свойства забрасываемых веществ, представлены соляной кислотой, пепсином, солями желчных кислот (связанными и свободными) и панкреатическими ферментами. Повреждение пищевода определяется значением рН желудочного содержимого. Если значение рН нейтральное или щелочное, как у пациентов после гастрэктомии или с атрофическим гастритом, повреждающими агентами являются свободные соли желчных кислот и ферменты поджелудочной железы. Вместе с тем ионы водорода являются основным повреждающим агентом рефлюктата, причем их способность оказывать повреждающее действие зависит и от времени воздействия, и от концентрации, т. е. от рН [2, 4].
Антирефлюксные барьеры, представляющие первую ступень трехступенчатой защиты пищевода, включают нижний пищеводный сфинктер (НПС), интраабдоминальный сегмент пищевода, диафрагмальные ножки, диафрагмально-пищеводную связку, розетку слизистой оболочки и острый угол Гиса [5]. Большое значение придается снижению базального давления в области НПС [6]. НПС и диафрагма – главные структуры, ответственные за создание высокого давления (от 10 до 30 мм рт. ст.) в желудочно-пищеводном переходе. Эта зона предотвращает рефлюкс, поскольку отделяет две смежные зоны низкого давления: в полости желудка (на 5 мм рт. ст.выше атмосферного давления) и в полости пищевода (на 5 мм рт. ст. ниже атмосферного давления). Тоническое давление, создаваемое гладкой циркулярной мышцей НПС, усиливается при сокращении ножек диафрагмы во время вдоха и выдоха и в моменты, когда повышается внутрижелудочное давление, например при чихании, кашле, наклоне туловища [5]. В покое тоническое сокращение НПС поддерживается кроме внутренностного тонуса его мышцы холинергическими возбуждающими нейронами. Краткое расслабление НПС при проглатывании пищи сопровождается перистальтической волной, которая закрывает и очищает просвет пищевода.
Как у здоровых людей, так и при ГЭРБ наблюдается такое явление, как преходящее, транзиторное расслабление НПС [7, 8], которое вызывается чаще всего растяжением стенок желудка при приеме пищи для уменьшения внутрижелудочного давления путем сброса воздуха из газового пузыря желудка (отрыжка воздухом). При этом кроме отрыжки воздухом (часто при расслаблении НПС) возникновение рефлюкса желудочного содержимого объясняется тем, что преходящие расслабления НПС сохраняются в зоне высокого давления так же длительно (около 20 секунд), как и расслабления НПС, инициированные глотанием, но при этом не возникает очищающей просвет пищевода перистальтической волны [9]. У больных ГЭРБ описанные явления отмечаются часто, длительно [10] и являются причиной появления симптомов заболевания (изжоги, отрыжки, срыгивания).
В целом при ГЭРБ описаны три основные ситуации, когда возникает патологический рефлюкс: при преходящем расслаблении НПС, недостаточной функции НПС и вследствие повышенного внутрибрюшного давления.
Причина частого преходящего расслабления НПС при ГЭРБ остается неясной. Вместе с тем все большее число исследователей склоняются к мнению о взаимосвязи патологии запирательного механизма НПС при ГЭРБ с нарушенной моторной активностью желудка, его замедленным опорожнением, приводящим к растяжению стенок органа, или с повышенной чувствительностью к нормальному растяжению желудка, в т. ч. на фоне воспалительного процесса в стенке желудка [11–14]. По мнению Трухманова А.С., с патофизиологической точки зрения ГЭРБ является кислотозависимым заболеванием, развивающимся на фоне первичного нарушения двигательной функции верхних отделов пищеварительного тракта [11]. Более того, ряд авторов утверждают, что нарушение моторной функции желудка может быть важным, если не главным, фактором возникновения и развития ГЭРБ [13, 15–17]. Особое внимание уделяется таким нарушениям моторики желудка и 12-перстной кишки, как желудочные дисритмии, сопровождающиеся замедленной эвакуацией из проксимальных отделов желудка, нарушения антродуоденальной координации и дуодено-гастральный рефлюкс (ДГР) [18–21]. Примечательно, что для антродуоденальной дискоординации характерными симптомами являются изжога, отрыжка кислым, горьким, срыгивание пищи, т. е. характерные симптомы ГЭРБ.
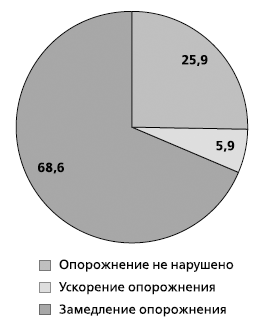
При изучении нами моторной активности желудка и 12-перстной кишки методом динамической гастросцинтиграфии у 204 пациентов с ГЭРБ выявлено значительное преобладание (68,6%) случаев замедленной желудочной эвакуации (рис. 1). Причем при III степени ГЭРБ по классификации Savary–Miller данный тип дисмоторики наблюдался в 100% случаев.
Рис. 1. Частота выявления нарушений эвакуаторной
функции желудка у больных ГЭРБ
(данные динамической гастросцинтиграфики) (%)
Периферическая компьютерная электрогастроэнтерография (ПКЭГЭГ) в 76% случаев выявила изменения по типу функциональной дискоординации моторики желудка и 12-перстной кишки. Причем до приема пищи 23,2% пациентов демонстрировали сниженную электрическую активность желудка при нормальных показателях моторной активности 12-перстной кишки с последующей нормализацией моторики желудка после приема пищи. У 45,8% больных натощак обнаружена повышенная электрическая активность 12-перстной кишки с нормализацией моторной активности после пищевой стимуляции при неизмененных показателях электрической активности желудка, т. е. транзиторная гиперкинезия 12-перстной кишки. В 31% случаев были выявлены пониженные показатели электрической активности 12-перстной кишки натощак, которые нормализовались после пищевой стимуляции с одновременным отсутствием каких-либо изменений электрической активности на частотах желудка. Характерно, что во всех трех случаях, но с разной частотой, наблюдался ДГР, который значительно чаще (93%) регистрировался у пациентов со вторым вариантом дисмоторики.
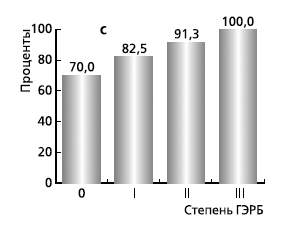
В целом частота выявления ДГР у всех больных ГЭРБ методом ПКЭГЭГ составила 82,4%, возрастая прямо пропорционально степени тяжести болезни (рис. 2). Это подтверждает данные о том, что с ростом степени тяжести ГЭРБ растет и число смешанных рефлюксов (содержимое желудка + содержимое 12-перстной кишки). Такая закономерность не может не учитываться, т. к. именно смешанные рефлюксы в большом числе случаев приводят к такому грозному осложнению ГЭРБ, как пищевод Барретта (появление в пищеводе цилиндроклеточной метаплазии плоского эпителия с угрозой развития в дальнейшем аденокарциномы).
Рис. 2. Частота выявления ДГР
у пациентов ГЭРБ методом ПКЭГЭГ
Также важную роль в патогенезе ГЭРБ играет нарушение моторики самого пищевода, включающее изменение силы и продолжительности перистальтических сокращений, повышение или снижение тонуса его сфинктеров. В патогенезе ГЭРБ имеют значение ослабление перистальтики пищевода, которое приводит к замедлению его опорожнения и снижению сократительной способности стенок пищевода при рефлюксе; снижение давления НПС; избыточная релаксация и деструктуризация его антирефлюксной функции [2].
Немаловажная роль в возникновении моторных нарушений пищевода и желудка, лежащих в основе развития ГЭРБ, отводится дисбалансу парасимпатического и симпатического звеньев нервной регуляции органов желудочно-кишечного тракта (ЖКТ) и как следствие его – нарушению перистальтической активности. Вегетативная регуляция моторно-эвакуаторной активности органов эзофагогастродуоденальной зоны осуществляется с участием основных рецепторов (холинергических, адренергических, дофаминергических, серотониновых, мотилиновых, холецистокининовых) и важнейших мессенджеров, включая гастроинтестинальные гормоны, стимулирующие (ацетилхолин, мотилин, гастрин, серотонин, инсулин, субстанция Р) и тормозящие, угнетающие моторную активность (дофамин, секретин, холецистокинин, оксид азота, глюкагон, соматостатин, энкефалины, вазоактивный интестинальный пептид). Одним из важнейших мессенджеров, оказывающих угнетающее влияние на гладкомышечные элементы желудка, является дофамин, секретируемый в отдельных участках желудочной стенки и действующий через специализированные, здесь же расположенные дофаминовые рецепторы. Дисбаланс координирующего действия стимуляторов и ингибиторов моторики органов пищеварительного тракта, выражающийся, к примеру, в избыточной дофаминовой активности, приводит к гипомоторной дискинезии пищевода, желудка, 12-перстной кишки вплоть до появления некоординированных сокращений, антордуоденальной дискоординации, функциональному гастро- и дуоденостазу. При этом часто наблюдается параллельное снижение давления в НПС, развиваются недостаточность кардии и патологический гастроэзофагеальный рефлюкс.
Определенное значение в развитии моторных нарушений, лежащих в основе патогенеза ГЭРБ, имеют влияние на моторику некоторых компонентов пищи (жиров, шоколада, цитрусовых, томатов, кофе, алкоголя и др.), а также прием медикаментозных средств (холинолитиков, β-адреноблокаторов, антагонистов кальция и доноров оксида азота – нитратов) и курение.
К органическим причинам, приводящим к развитию ГЭРБ, относят рефлюкс при грыже пищеводного отверстия диафрагмы, связанный с исчезновением угла Гиса – важного анатомического элемента запирательного механизма кардии [2].
Все вышесказанное указывает на то, что нарушение моторной активности верхних отделов ЖКТ в патогенезе ГЭРБ является определяющим фактором, который создает условия для контакта агрессивного содержимого желудка со слизистой оболочкой пищевода, возникновения морфологических изменений и клинических проявлений болезни.
Тактика лечения ГЭРБ
Вместе с тем на сегодняшний день ведущим направлением в лечении ГЭРБ является устранение закисления в пищеводе путем блокады кислотной продукции, осуществляемой обкладочными железами желудка с помощью ингибиторов протонной помпы (ИПП); связывания агрессивных компонентов желудочного содержимого; создания препятствия для контакта последних со слизистой оболочкой пищевода (путем применения антацидов, альгинатов).
Следует сказать, что данный подход к лечению ГЭРБ продиктован, с одной стороны, реальными успехами в купировании не только клинических, но и морфологических проявлений болезни, предотвращением осложнений, а при длительной поддерживающей кислотосупрессивной терапии – и стабилизацией состояния на нормальных показателях закисления пищевода. С другой стороны, до последнего времени в арсенале терапевта, гастроэнтеролога отсутствовали эффективные и безопасные средства для коррекции моторных расстройств у больных ГЭРБ, которые бы позволяли осуществлять достаточно длительный контроль моторики, не вызывая побочных эффектов, свойственных имеющимся на фармакологическом рынке прокинетикам.
В связи с этим на сегодняшний день препаратами выбора в лечении ГЭРБ, эффективно подавляющими кислотную секрецию в желудке, являются ИПП, особенно последнего поколения (пантопразол, рабепразол). При эрозивных формах болезни они становятся обязательным компонентом.
Однако следует иметь в виду, что даже самые эффективные на сегодняшний день ИПП не влияют на первопричину болезни – нарушенную функцию запирательного механизма кардии, моторику желудка и 12-перстной кишки, поэтому после прекращения их приема у большей части больных сравнительно быстро возникает рецидив заболевания. В ряде случаев ИПП не устраняют некоторые симптомы, чаще всего ассоциируемые с нарушением моторики пищевода и желудка, гиперчувствительностью желудка к растяжению. В подобных случаях при лечении больных ГЭРБ дополнительно показано использование прокинетиков.
Разбирая особенности средств, обладающих прокинетическим эффектом на верхние отделы ЖКТ, необходимо отдельно остановиться на следующих препаратах:
Опыт применения перечисленных прокинетиков при ГЭРБ, особенно таких препаратов, как метоклопрамид, домперидон и цизаприд, как в нашей стране, так и за рубежом достаточно велик, однако из-за большого спектра побочных эффектов, вызываемых препаратами прежних поколений, и кратковременности их действия целесообразность применения последних нередко ставилась под сомнение [25, 26].
Ганатон в лечении ГЭРБ
Препаратом нового поколения прокинетиков, хорошо зарекомендовавшим себя (по данным нескольких мета-анализов) при лечении ГЭРБ и функциональной диспепсии, зарегистрированным за рубежом, а с 2007 г. и в России, является итоприда гидрохлорид – Ганатон (от “gastric natural tone” – восстанавливающий нормальный тонус желудка). Это новый препарат с комбинированным механизмом действия, являющийся антагонистом дофаминовых D2-рецепторов и блокатором ацетилхолинестеразы. Итоприда гидрохлорид активизирует высвобождение ацетилхолина, одновременно препятствуя его деградации. Он обладает минимальной способностью проникать через гематоэнцефалический барьер, не влияет на продолжительность интервала Q-T и не взаимодействует с лекарственными средствами, метаболизирующимися ферментами системы цитохрома Р450, в т. ч. ИПП, часто применяемыми в лечении ГЭРБ и функциональной диспепсии. Итоприда гидрохлорид оказывает выраженное противорвотное действие, усиливает пропульсивную моторику желудка и ускоряет его опорожнение.
Открытые клинические исследования итоприда гидрохлорида в США, Японии, Германии, Индии и других странах показали высокую клиническую эффективность препарата у больных функциональной диспепсией, хроническим гастритом, диабетическим гастропарезом и ГЭРБ. Препарат отличает хорошая переносимость и отсутствие значимых побочных эффектов. У пациентов с функциональной диспепсией и диабетическим гастропарезом итоприд эффективно стимулирует сократительную способность желудка, ускоряет его опорожнение, устраняет антродуоденальную дискоординацию [27–29].
При использовании итоприда гидрохлорида в составе комбинированной терапии с ИПП у пациентов с ГЭРБ обнаружено, что данный прокинетик достоверно усиливает сократительную активность НПС, что подтверждается увеличением давления в его области, а также усиливает моторную активность желудка, ускоряет желудочную эвакуацию и нормализует нарушенную гастродуоденальную координацию [30]. Важной положительной стороной использования итоприда при ГЭРБ является не только быстрый и стойкий клинический эффект, но и возможность его длительного применения без развития каких-либо значимых побочных эффектов. Так, Inoue K. и соавт. (1999), применяя итоприд по 50 мг 3 раза в сутки в течение 7 недель у больных хроническим гастритом с явлениями рефлюкс-эзофагита, получили хороший клинический эффект: исчезновение жалоб у 67% пациентов с изжогой в отсутствие побочных эффектов [31].
Имеется и отечественный положительный опыт использования Ганатона для лечения больных ГЭРБ. Так, Минушкин О.Н. и Лощинина Ю.Н. (2008) проводили лечение больных ГЭРБ 0–I стадии рецидивирующего течения препаратом Ганатон (в режиме монотерапии) в стандартной дозе (50 мг 3 раза в сутки) в течение 25 дней. На фоне монотерапии Ганатоном изжога была полностью купирована к концу первой недели у 90% больных, а эпителизация эрозий пищевода после полного курса лечения зарегистрирована у всех пациентов с эрозивной формой ГЭРБ. Зарегистрирована также положительная динамика вегетативного статуса и показателей качества жизни пациентов по шкале SF-36 (Short-Form Health Survey).
Таким образом, с появлением на отечественном рынке эффективного и безопасного прокинетика итоприда гидрохлорида (Ганатона) открываются новые возможности проведения полноценной патогенетической терапии ГЭРБ, включая коррекцию моторных расстройств пищевода, желудка и 12-перстной кишки, восстановление их нормальной миоэлектрической активности и взаимной координации.
Применение Ганатона у больных ГЭРБ возможно как в режиме монотерапии при легких формах болезни, так и в составе комбинированного с ИПП лечения.
По-видимому, с учетом особенностей фармакодинамики и фармакокинетики препарата Ганатон возможно его применение у больных ГЭРБ в режиме длительной противорецидивной терапии и в комбинации с ИПП, и в режиме монотерапии. При этом не исключена коррекция стандартных доз обеих составляющих в сторону уменьшения.