Метортрит или методжект что лучше
Новое в лечении ревматоидного артрита
В последнее время тактика лечения ревматоидного артрита значительно изменилась. Новое в лечении ревматоидного артрита – это отказ от выжидательной позиции и раннее назначение агрессивного курса терапии. Это привело к тому, что специалистами была признана обратимость патологического процесса на ранних стадиях заболевания при назначении активной терапии сразу после установления диагноза.
Врачи клиники «Парамита» используют самые современные методы и лекарственные препараты для помощи больным ревматоидным артритом, сочетая их назначение с методами восточной терапии.
Ревматоидный артрит в цифрах
По современным представлениям ревматоидный артрит (РА) – это сложное многофакторное, хроническое, неуклонно прогрессирующее, системное аутоиммунное заболевание, в основе которого лежит длительный воспалительный процесс в организме с язвенно-деструктивным поражением и разрушением суставов.
Поражение РА населения составляет около 1% всего населения земного шара. Болеют лица любого возраста, от младенцев до пожилых людей, чаще женщины. По статистике ревматоидный артрит был установлен на 1-м году заболевания у 57,9% пациентов, остальные лечились по поводу недифференцированного (неустановленного вида) артрита (НДА), а это значит, не получали необходимой терапии. Еще через год у 33% больных этой группы был выявлен РА, то есть, их лечение замедлилось еще почти на год.
Новейшие принципы лечения РА
В последние десятилетия сформировались основные принципы терапии ревматоидных поражений, их придерживаются специалисты всего мира.
Принцип первый – ранее выявление
Лечить ревматоидные процессы непросто, результат во многом зависит от результатов обследования, установленного диагноза и предполагаемого прогноза болезни. Выявить ревматоидную патологию на ранней стадии сложно, так как похожие симптомы наблюдаются и при других заболеваниях. Поэтому очень большое значение придается выявлению РА и установлению развернутого диагноза, позволяющего сделать прогноз течения болезни у данного больного и назначить ему адекватные лечебные мероприятия.
Диагноз ревматоидного артрита ставится на основании:
ФК (функциональный класс) ревматоидного процесса позволяет оценить сохранность трудовых навыков. По степени их нарушения выделяют 4 ФК.
Диагноз должен включать в себя клиническую и рентгенологическую стадии заболевания, активность патологического процесса, наличие/отсутствие РФ и системных поражений. Это позволит подобрать больному наиболее подходящую схему лечения.
Принцип второй – раннее назначение медикаментозной терапии
Схемы лечения ревматоидного артрита нового поколения учитывают клинически подтвержденный факт, что при раннем назначении активных лечебных мероприятий патологический процесс можно остановить и даже повернуть вспять. Поэтому главной целью является раннее выявление заболевания с назначением адекватного лечения, а непосредственными задачами:
Современная тактика ведения ревматоидных поражений – это агрессивная тактика, когда больному назначается комплексное лечение с максимальными дозировками основных (базисных) противовоспалительных препаратов (БПВП). При этом противовоспалительные средства подбираются по результатам обследования. Раз в квартал проводится текущее обследование с целью проверки результативности проводимой базисной терапии. В состав медикаментозной терапии обязательно вводятся биологические препараты.
Принцип третий – сокращение симптоматической терапии
Новое в лечении ревматоидного артрита – это еще и подход к симптоматической терапии. Сейчас отказались от стандартных схем применения обезболивающих и общих противовоспалительных средств. Их назначают строго индивидуально при наличии воспалительной боли и обязательно сочетают с приемом базисных медицинских препаратов.
Допускается даже нерегулярный прием лекарств из группы нестероидных противовоспалительных препаратов (НПВП) – их принимают по мере необходимости максимально короткими курами или одноразово, используя только один препарат этой группы. Это связано с побочными эффектами НПВП – они вызывают эрозивно-язвенные поражения желудочно-кишечного тракта (ЖКТ). Еще одна опасность применения этой группы препаратов в том, что на ранних стадиях заболевания они быстро снимают все симптомы заболевания и создают иллюзию полного выздоровления. Это часто приводит к отказу больного от дальнейших лечебных мероприятий и прогрессированию ревматоидного процесса.
Еще одна группа препаратов для лечения ревматоидных поражений – глюкокортикостероиды (ГКС). Они оказывают, как симптоматическое, так (частично) и патогенетическое действие, подавляя процесс разрастания соединительной ткани в суставах, деструкцию хрящевой и костной ткани. На первых начальных стадиях ревматоидного процесса их назначают только при наличии выраженного болевого синдрома воспалительного характера – ГКС отлично снимают воспаление и боль, после чего их отменяют.
Но есть категории больных, в основном это лица преклонного возраста, которым не подходят препараты базисной терапии. В таких случаях эту роль берут на себя ГКС, назначаемые продолжительными курсами в низких дозировках. Иногда их вводят в суставы. Назначение их требует регулярного обследования больного из-за возможных побочек: остеопороза, язвенных процессов в ЖКТ и т.д.
В последние годы препараты этой группы все чаще назначают короткими курсами в высоких дозировках (пульс-терапия). Показаниями для таких процедур лечения являются тяжелые системные поражения (сердца, печени, почек).
Принцип четвертый – двигательная активность
Она необходима для профилактики контрактур и анкилозов (снижение объема движений в суставе или его полная неподвижность), а также мышечных атрофий необходима даже в период обострений – назначается щадящий комплекс лечебной физкультур – ЛФК. По мере улучшения состояния больного нагрузки увеличиваются.
Одновременно назначаются курсы лечебного массажа и физиотерапевтических процедур, усиливающих эффект ЛФК. Для сохранения нормального положения конечности назначают ношение ортезов, но только по нескольку часов в день – постоянное ношение ортезов считается неприемлемым. Двигательная активность значительно улучшает качество жизни больных с ревматоидными поражениями.
Препараты для медикаментозного лечения
Все препараты от ревматоидного артрита делятся на симптоматические и базисные. Симптоматические – это НПВП и ГКС, а базисные – синтетические и биологические.
Лекарственные средства этой группы угнетают образование фермента циклооксигеназы (ЦОГ). ЦОГ делится на два вида: ЦОГ-2, участвующую в синтезе простагландинов, поддерживающих воспаление и боль, и ЦОГ-1, поддерживающую синтез простагландинов, стимулирующих секрецию слизи в органах пищеварения и защищающих стенки органов от различных воздействий.
НПВП, подавляющие только ЦОГ-2 (Нимесулид, Мелоксикам), – это лекарства нового поколения. Они обладают селективным (избирательным) действием и почти не имеют побочного действия на ЖКТ при правильном применении. Они также применяются в современной практике.
Глюкокортикоидные гормоны
Глюкокортикоиды (Преднизолон, Дексаметазон, Метипред) назначаются при тяжелом течении ревматоидных процессов, сильных болях и поражении внутренних органов. В зависимости от состояния пациента эти препараты назначают или достаточно длительно малыми дозами (например, пожилым больным с противопоказаниями для базисной терапии), или короткими курсами очень большими дозами (пульс-терапия). Введение гормональных препаратов в полость сустава может приостановить его воспаление и формирование контрактуры.
Синтетические базисные противовоспалительные препараты
Синтетические базисные препараты применяются достаточно давно, но не потеряли своей актуальности. Курс начинается с назначения одного препарата этой группы. При высокой активности РА лечение начинают с Метатрексата, при средней и небольшой – с Сульфасалазина или Плаквенила. За эффективностью терапии тщательно наблюдают и если эффект есть, но недостаточный, присоединяют еще один базисный препарат (синтетический или биологический). Если эффекта нет, препарат меняют.
Биологические (генно-инженерные) БПВП – биологические агенты
Внутрисуставные инъекции гиалуроновой кислоты
Хондропротекторы что это как выбрать, насколько они эффективны
Почему Методжект?
За последние годы многочисленные исследования подтвердили необходимость как можно более раннего начала интенсивного лечения метотрексатом до достижения контроля над заболеванием с помощью оптимальной терапевтической дозы. Однако этот подход может быть ограничен в связи с непереносимостью пациентами высоких пероральных доз. В некоторых случаях эффективность лечения удается повысить, вводя метотрексат (Методжект) подкожно.
Основанием для рассмотрения возможности перевода пациентов на парентеральное введение метотрексата является необходимость в увеличении терапевтической дозы для обеспечения максимальной эффективности и уменьшении симптоматических нежелательных явлений. Парентеральное введение метотрексата продемонстрировало явное терапевтическое преимущество по сравнению с пероральным применением.
В последние годы разработка генно-инженерных биологических препаратов привела к необходимости перехода на более эффективные методы применения метотрексата. Большинство ГИБП требуют одновременного назначения БПВП (как правило, метотрексата), как для повышения их эффективности, так и снижения риска развития нейтрализующих антител к этим препаратам. В большинстве исследований ГИБП назначались в комбинации с метотрексатом, что приводило к значительному повышению эффективности лечения ревматоидного артрита. ГИБП являются высокоэффективными, но в тоже время достаточно дорогостоящими.
Перевод пациентов на парентеральный путь введения метотрексата (Методжект) с целью достижения оптимального контроля над заболеванием может снизить потребность в назначении дорогостоящих генно-инженерных биологических препаратов.
Таким образом, основными причинами для перевода на парентеральный путь введения (внутримышечное или подкожное) метотрексата являются:
Содержание
Дерматология в России
Зарегистрируйтесь!
Если Вы врач, то после регистрации на сайте Вы получите доступ к специальной информации.
Если Вы уже зарегистрированы, введите имя и пароль (форма в верхнем правом углу или здесь).
О препарате Методжект
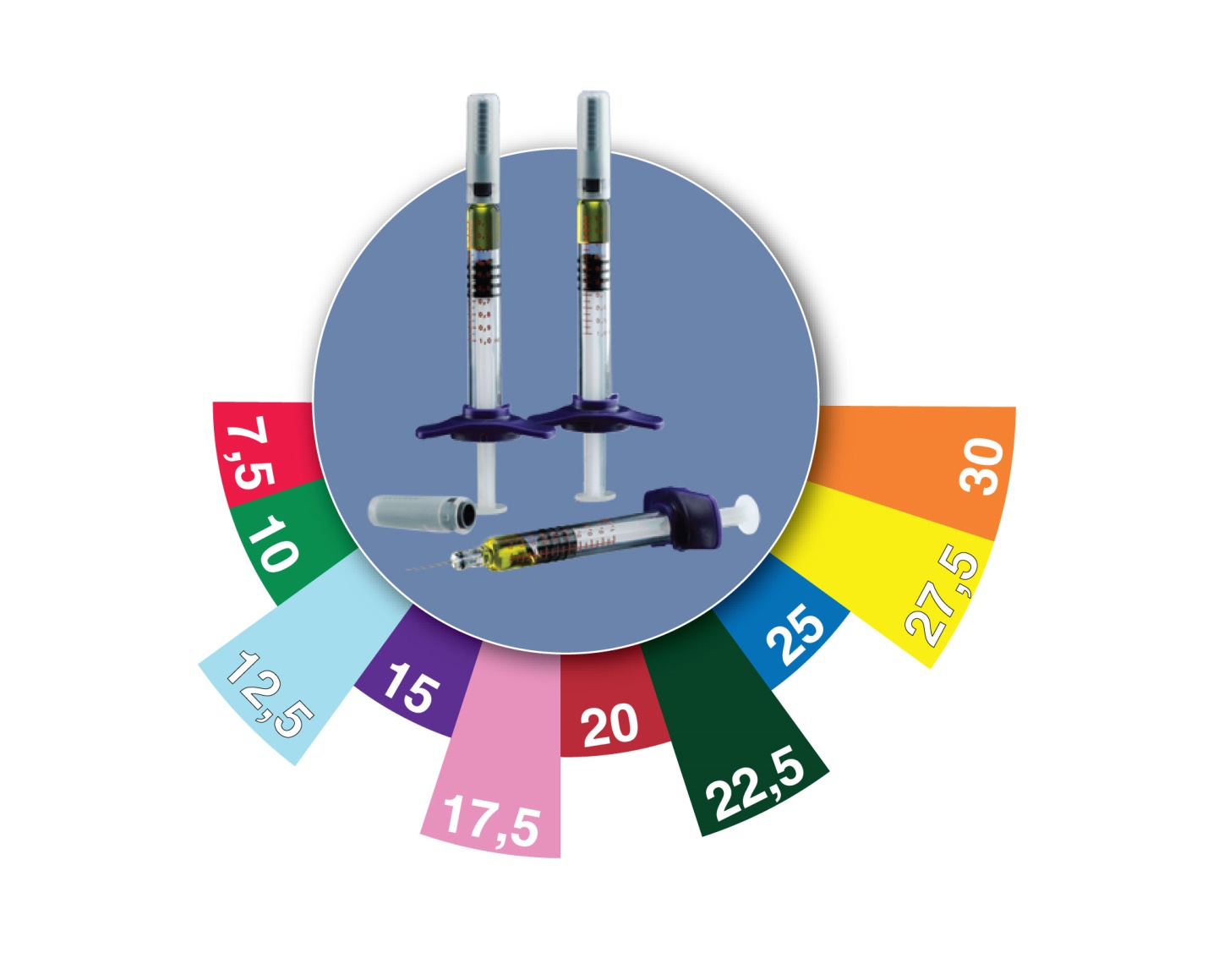
Теперь доступно 10 дозировок
Метотрексат – наиболее часто назначаемый базисный противовоспалительный препарат в терапии ревматоидного артрита у взрослых и ювенильного идиопатического артрита у детей, также широко используемый для лечения псориаза и псориатического артрита.
Методжект® – метотрексат в предварительно заполненных (уже готовых к использованию) шприцах, созданный специально для пациентов с ревматоидным артритом, ювенильным идиопатическим артритом, псориазом и псориатическим артритом и производимый в Германии. В виде инъекций метотрексат более эффективен и вызывает меньше побочных эффектов со стороны желудочно-кишечного тракта.
Предварительно заполненные шприцы с Методжектом® безопасны и просты в использовании, а также минимизируют риск передозировки, благодаря уникальному цветовому кодированию (индивидуальной окраске стопора поршня шприца и упаковки для каждой дозировки). Специальная система обеспечивает безопасное соединение иглы и шприца, а стопор поршня минимизирует риск случайного проливания препарата. Форма шприца специально разработана таким образом, чтобы препарат можно было ввести самостоятельно даже при наличии деформации суставов рук.
Лечебный эффект Методжекта® проявляется через 4-8 недель после начала терапии и нарастает в течение первых 6 месяцев. Терапия может продолжаться длительное время, вплоть до нескольких лет. Перерыв в лечении обычно вызывает ухудшение течения заболевания.
Методжект® вводится один раз в неделю, желательно в один и тот же день недели, подкожно. Препарат может храниться при комнатной температуре. Наиболее часто встречающиеся нежелательные явления Методжекта®– это снижение аппетита, тошнота, диспепсия, стоматит. При появлении любых нежелательных явлений, пожалуйста, свяжитесь с Вашим лечащим врачом. В период лечения Методжектом® строго рекомендуется еженедельный прием фолиевой кислоты. Фолиевая кислота – витамин В9, уменьшающий возможные неблагоприятные эффекты метотрексата.
Если Вы нуждаетесь в хирургической операции, планируете беременность, кормите грудью или Вам назначены другие препараты, пожалуйста, проконсультируйтесь с Вашим лечащим доктором.
Более подробная информация содержится в инструкции по медицинскому применению препарата. Проконсультируйтесь со своим лечащим доктором относительно всех вопросов, касающихся применения Методжекта®.
Литература
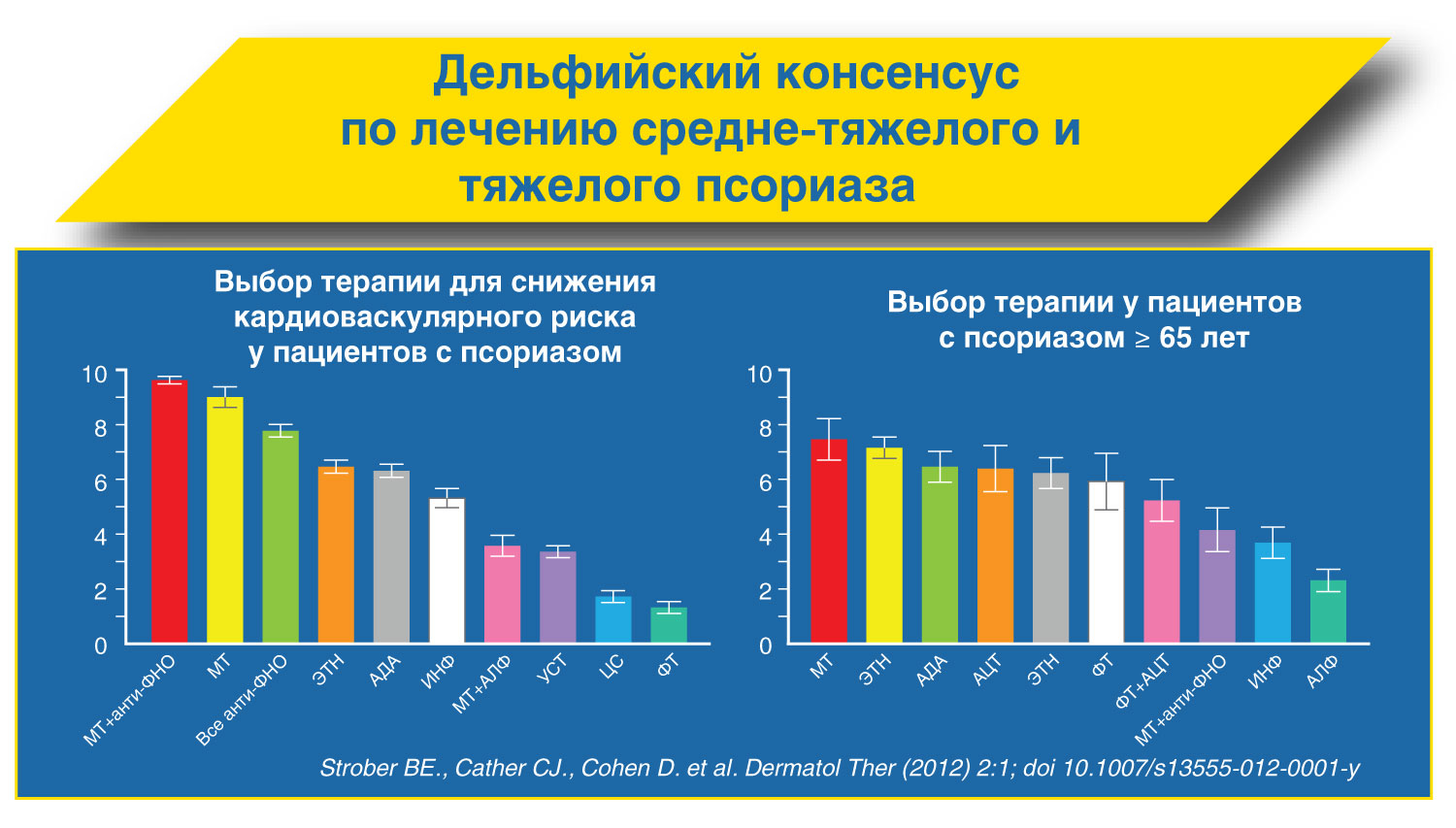
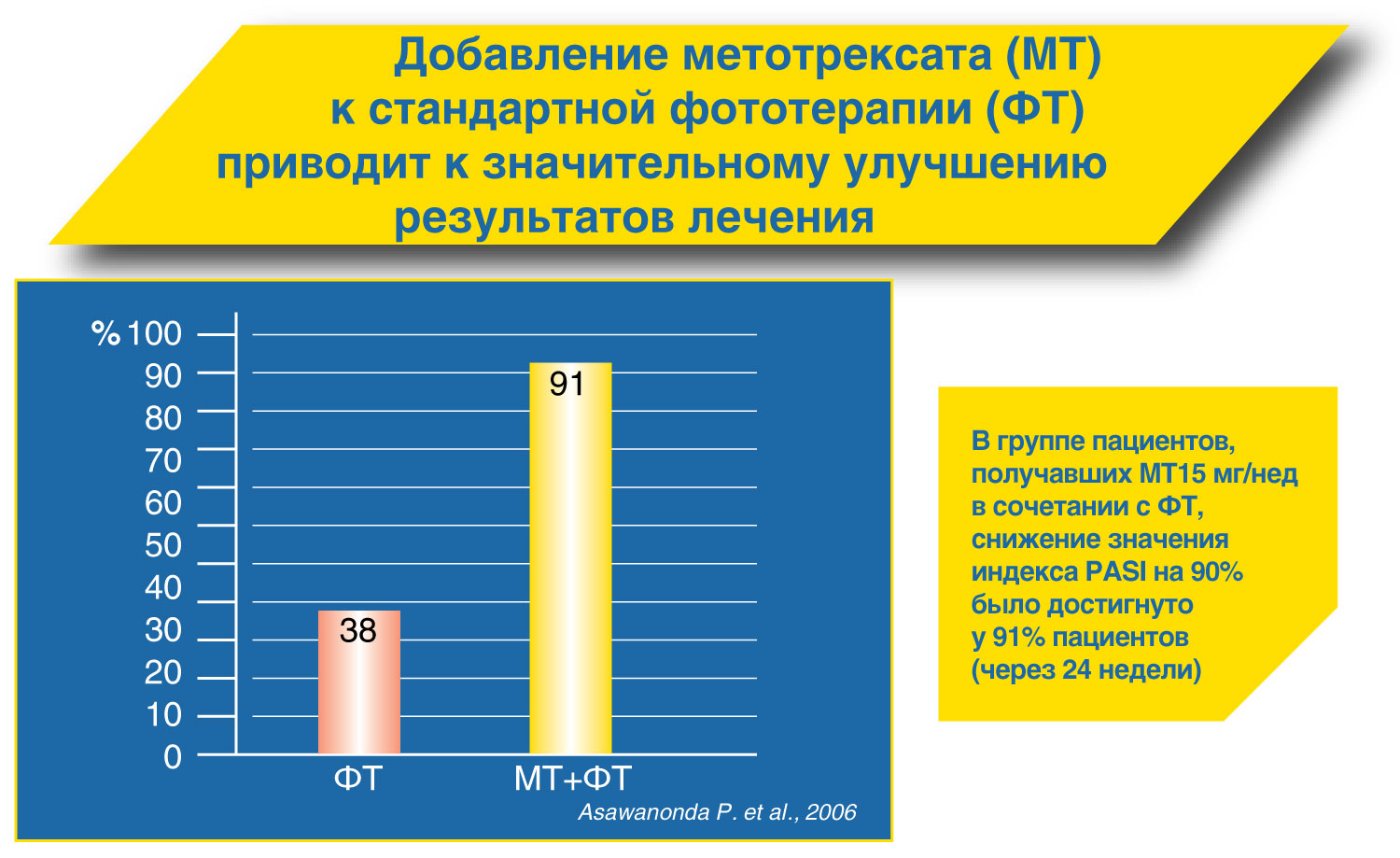
Рекомендации по лечению псориаза Метотрексат может быть рекомендован для терапии (в т.ч. долгосрочной) псориаза средне-тяжелого и тяжелого течения.
Парентеральный путь введения метотрексата является предпочтительным ввиду лучшей биодоступности препарата.
Начальная доза препарата при парентеральном применении составляет 15 мг/нед, при необходимости она может быть увеличена до 30 мг/нед
После достижения терапевтического эффекта возможна поддерживающая терапия в минимальной эффективной дозе (не более 22,5 мг/нед)
Через 24 часа после применения метотрексата обязателен прием 5 мг фолиевой кислоты Метотрексат обладает несомненными фармако-экономическими преимуществами по сравнению с другими препаратами для системной терапии псориаза.
*Федеральные клинические рекомендации по ведению больных псориазом (РОДВ, 2015)
*European S3-Guidelines on the systemic treatment of psoriasis vulgaris. Update 2015
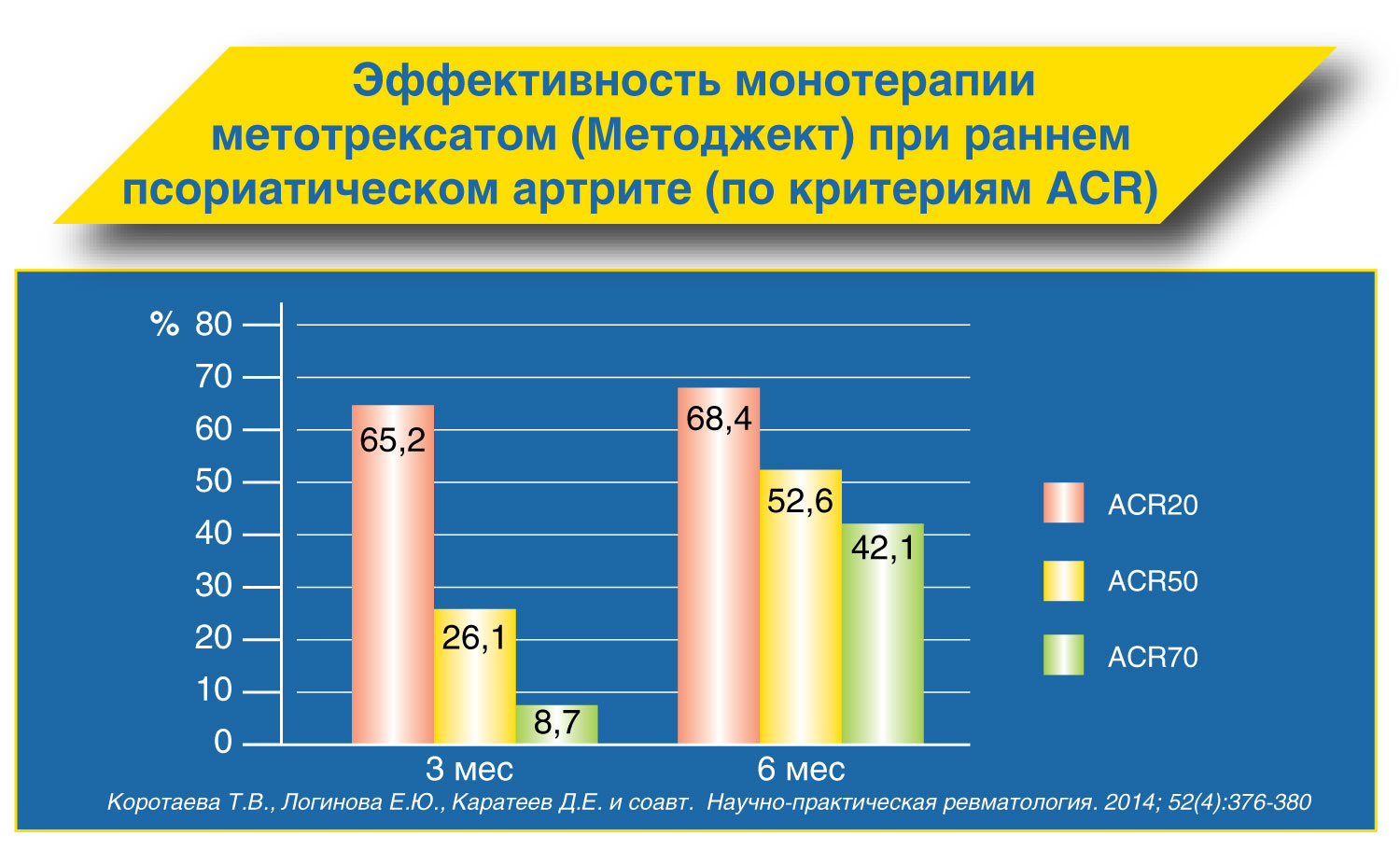
Метотрексат в терапии псориатического артрита (рекомендации EULAR)
У больных с активным псориатическим артритом первым среди базисных противовоспалительных препаратов следует назначать метотрексат.
Лечение метотрексатом следует начинать с дозы 10 мг/нед с увеличением на 5 мг каждые 2-4 нед (до 25 мг/нед) в зависимости от эффективности и переносимости.
Парентеральное введение метотрексата обеспечивает большую биодоступность при меньшем риске возникновения нежелательных реакций.
На фоне лечения метотрексатом обязателен прием фолиевой кислоты через 24 часа после введения метотрексата.
Метотрексат в дерматологии: от теории к практике

Метотрексат зарекомендовал себя как высокоэффективное средство для лечения псориаза с 1953 г. Эффективность метотрексата обусловлена его цитотоксическим и противовоспалительным действием. Согласно проекту клинических рекомендаций Российского общества дерм
Abstract. Methotrexate has established itself as a highly effective treatment for psoriasis since 1953. The effectiveness of methotrexate is due to its cytotoxic and anti-inflammatory effects. According to the draft clinical guidelines of the Russian Society of Dermatovenereologists and Cosmetologists, the use of methotrexate is justified in many skin diseases. A long history and accumulated practical experience of application do not raise doubts about the effectiveness of methotrexate due to its unique pharmacological properties, namely, anti-inflammatory, immunomodulatory and cumulative effects, which allow the drug to occupy a leading position in the treatment of many skin diseases. The article describes in detail the metabolism of methotrexate and its pharmacodynamics. According to a review of modern data from the world literature, the authors presented recommendations for treatment with methotrexate, its use in children, monitoring during treatment, and also drew attention to the indications in special situations (infections, vaccinations, contraception, etc.). For citation: Gallyamova Yu. A., Asoskova A. V. Methotrexate in dermatology: from theory to practice // Lechaschy Vrach. 2021; 5 (24): 46-51. DOI: 10.51793/OS.2021.11.97.010
Резюме. Метотрексат зарекомендовал себя как высокоэффективное средство для лечения псориаза с 1953 г. Эффективность метотрексата обусловлена его цитотоксическим и противовоспалительным действием. Согласно проекту клинических рекомендаций Российского общества дерматовенерологов и косметологов применение метотрексата обосновано при многих заболеваниях кожи. Длительная история и накопленный практический опыт применения не вызывают сомнения в эффективности метотрексата, обусловленной его уникальными фармакологическими свойствами, а именно противовоспалительным, иммуномодулирующим и кумулятивным эффектами, которые позволяют препарату занимать лидирующие позиции в терапии многих кожных заболеваний. В статье подробно раскрыты метаболизм метотрексата и его фармакодинамика. Согласно обзору современных данных мировой литературы авторы представили рекомендации по лечению метотрексатом, применению его у детей, мониторингу во время лечения, а также обратили внимание на показания при особых ситуациях (инфекции, прививки, контрацепция и т. д.).
Метотрексат (MT), ранее известный как аминоптерин, первоначально синтезирован в 1940-х гг. для лечения злокачественных новообразований 2. Только позднее МТ стал применяться для лечения ревматоидного артрита (РА), что связано с его способностью ингибировать воспаление и пролиферацию соединительной ткани. Со временем аминоптерин постепенно заменялся менее токсичным МТ – первое документально подтвержденное клиническое применение МТ для лечения РА зафиксировано в 1951 г. [4]. После проведения слепого плацебо-контролируемого исследования в 1980-х гг. полностью раскрыт клинический потенциал препарата для лечения РА [5]. Уже в 1986 г. MT был допущен Управлением по контролю за продуктами и лекарствами США (FDA), которое в первый раз одобрило применение МТ только при угрожающих жизни опухолевых заболеваниях либо у пациентов с псориазом или РА с тяжелым, инвалидизирующим течением, которые не отвечают на другие формы терапии, однако впоследствии показания были значительно расширены 8.
В настоящее время МТ прочно вошел в практику дерматолога и используется не только в лечении псориаза, но и ряда других заболеваний кожи. Столь широкое применение препарат получил из-за удачного соотношения «стоимость/эффективность/токсичность», хотя вопрос токсичности по-прежнему остается актуальным [9, 10].
Длительная история и накопленный практический опыт применения не вызывают сомнения в эффективности МТ, но в то же время оставляют в тени его уникальные фармакологические свойства, а именно противовоспалительный, иммуномодулирующий и кумулятивный эффекты, которые позволяют ему занимать лидирующие позиции в терапии многих кожных заболеваний.
Следует обратить внимание на разносторонние свойства МТ: противовоспалительный эффект опосредован аденозиновыми путями, а ингибирование синтеза нуклеиновых кислот в активированных Т-клетках и кератиноцитах объясняет некоторые иммуномодулирующие эффекты препарата. Кроме того, МТ может быть преобразован в полиглутамильные производные, которые аккумулируются в клетках и потом точно так же с легкостью могут обратно трансформироваться в активную форму и транспортироваться из клетки [8].
Играя роль антагониста фолиевой кислоты, МТ конкурентно ингибирует активность фолатзависимых ферментов и синтез пурина и пиримидина, необходимых для производства ДНК и РНК в быстро делящихся злокачественных клетках [11]. Это основной противоопухолевый механизм МТ, который действует при высоких дозах.
Нарушение фолатного цикла в организме объясняет основной побочный эффект препарата – гепатотоксичность и нефротоксичность, которые встречаются крайне редко при назначении невысоких доз в дерматологии. МТ подвергается метаболизму после первого прохождения через печень и превращается в активный метаболит. Небольшая доля МТ выводится с желчью, а также происходит некоторая энтерогепатическая рециркуляция. Однако основной путь выведения препарата – это почечная экскреция. МТ фильтруется клубочками и дополнительно подвергается активной канальцевой секреции и реабсорбции 13.
Окончательная связь между дефицитом фолиевой кислоты и гепатотоксичностью экспериментально не подтверждена. Однако прием фолиевой кислоты на фоне терапии МТ значительно снижал частоту побочных эффектов со стороны печени [8, 16]. Назначение фолиевой кислоты нивелирует и другие токсические явления, такие как цитопения, желудочно-кишечная непереносимость и стоматит, которые имитируют проявления дефицита фолиевой кислоты [17].
Нарушение функции почек возникает намного реже, чем поражения печени. Возможно снижение скорости клубочковой фильтрации, а вот почечная недостаточность вероятна только при уже существующей, сильно нарушенной функции почек и то только индуцированная высокими дозами МТ [18, 19].
В дерматологии практически не прибегают к высоким дозировкам МТ, как это принято в онкологии, и даже редко достигают высоких доз, используемых в ревматологии. Поэтому дерматологам более интересен второй механизм МТ – противовоспалительный, который реализуется именно в небольших дозировках [20].
Так, было доказано, что низкие дозы МТ снижают пролиферацию Т-лимфоцитов [21]. В частности, L. Genestier, R. Paillot, S. Fournel доказали, что МТ ингибирует антиген-опосредованную пролиферацию Т-клеток за счет индукции апоптоза [22]. Однако нарушение пролиферации Т-лимфоцитов было полностью обратимо при назначении тимидина или фолиевой кислоты. Тот факт, что назначение фолиевой кислоты не сказывается на эффективности терапии МТ, позволяет предположить иные механизмы действия препарата [23].
Кроме того, аденозин снижает экспрессию молекул адгезии, тем самым уменьшая хемотаксис и адгезию полиморфно-ядерных лейкоцитов [27].
Последние исследования показали, что механизм противовоспалительного действия МТ является более комплексным и не ограничивается аденозин-опосредованным эффектом. J. Meephansan и соавт. в недавнем исследовании установили, что МТ способен существенно снижать уровень ИЛ-22-цитокина, способствующего пролиферации кератиноцитов и поддержанию воспалительных процессов в дерме при псориазе [28].
В результате новейших исследований раскрыты и другие механизмы воздействия МТ на воспаление. Препарат является блокатором Jak-киназы [29], обрывая передачу сигнала от целого ряда провоспалительных цитокинов и интерлейкинов: ИЛ-6, ИЛ-15, ИЛ-21, ИЛ-23, ИЛ-2, ИФН-γ, ИЛ-12 [30], играющих существенную роль в патогенезе псориаза [31].
В последние годы раскрыто еще одно свойство МТ: ингибирующее действие на продукцию простагландина Е2 (PGE2). Простагландины являются основными медиаторами повреждения суставов. При псориатическом артрите PGE2 действует как медиатор боли и воспаления и способствует разрушению костей и суставов [32]. Высокие уровни PGE2 обнаруживаются в синовиальной жидкости суставов при РА. В клинической литературе не так много данных о влиянии MT на производство PGE2, но достаточно экспериментальных работ, доказывающих его ингибирующее действие на синтез PGE2 [32, 33].
Свойства МТ на этом не заканчиваются. Внутриклеточное накопление полиглутаматов приводит к устойчивой эффективности препарата и позволяет вводить его 1 раз в неделю, несмотря на относительно короткий период полувыведения из плазмы [14, 34].
Важно и то, что при приеме внутрь препарат метаболизируется в активную кислоту с помощью метаболизма бактерий [14]. Биодоступность МТ относительно высока – в пределах 64-90%. Однако она широко варьирует у пациентов и снижается с увеличением дозы выше 15 мг/нед с эффектом плато, что свидетельствует о насыщении кишечных транспортеров [35, 36]. Кроме того, следует учитывать индивидуальные особенности кишечной микрофлоры. Поэтому ряд исследований показал более высокую биодоступность инъекционной формы MT [35, 36]. Инъекция MT приведет к линейному, пропорцио-нальному дозе увеличению концентрации препарата в крови и отсутствию эффекта плато [35], при этом концентрация МТ в синовиальной жидкости сравнима с уровнем, обнаруженным в плазме [37].
Применение парентерального МТ, особенно подкожное, в последнее время вызывает большой интерес, так как несколько работ доказали большую клиническую эффективность и лучшую переносимость инъекционной формы по сравнению с пероральной. Жалобы со стороны желудочно-кишечного тракта в виде тошноты и диареи отмечаются чаще при пероральной форме МТ, а переход к парентеральному введению препарата значительно снижает частоту данных жалоб [43].
В литературе есть рекомендации при сохранения активности заболевания, даже при высоких дозах или появлении побочных эффектов, перед отменой препарата рассмотреть вопрос о замене его перорального приема на подкожное введение [44]. Доза для подкожной инъекции соответствует пероральной, хотя с учетом различий в биодоступности между лекарственными формами более низкие дозы при подкожном введении МТ тоже могут быть эффективными. Все это позволяет врачу варьировать дозировки при возникновении побочных эффектов [20].
В настоящее время у дерматологов особой популярностью пользуется препарат Метортрит (метотрексат), показавший эффективность и удобство дозирования подкожных инъекций. Препарат Метортрит выпускается в готовых предварительно заполненных шприцах для подкожного введения. Использование препарата Метортрит в преднаполненных шприцах позволяет исключить нарушение дозирования, что снижает риски неэффективности и нежелательных явлений (НЯ) для пациентов как в стационаре, так и при самостоятельном введении в домашних условиях.
Специально разработанные шприцы с широкими ушками идеально подходят для применения пациентами с деформированными суставами кистей рук при псориатическом артрите. Это позволяет больному проводить манипуляции в домашних условиях самостоятельно, безопасно и без риска потери действующего вещества.
Рекомендации по лечению МТ
В проект Клинических рекомендаций 2020 г. Российского общества дерматовенерологов и косметологов включены следующие нозологии, при которых рекомендовано назначать МТ в дозировке до 25 мг в неделю:
1) буллезный пемфигоид тяжелой степени тяжести;
2) гнездная алопеция;
3) псориаз, при резистентности к проводимой наружной терапии, распространенных высыпаниях (при псориазе средней или тяжелой степени тяжести);
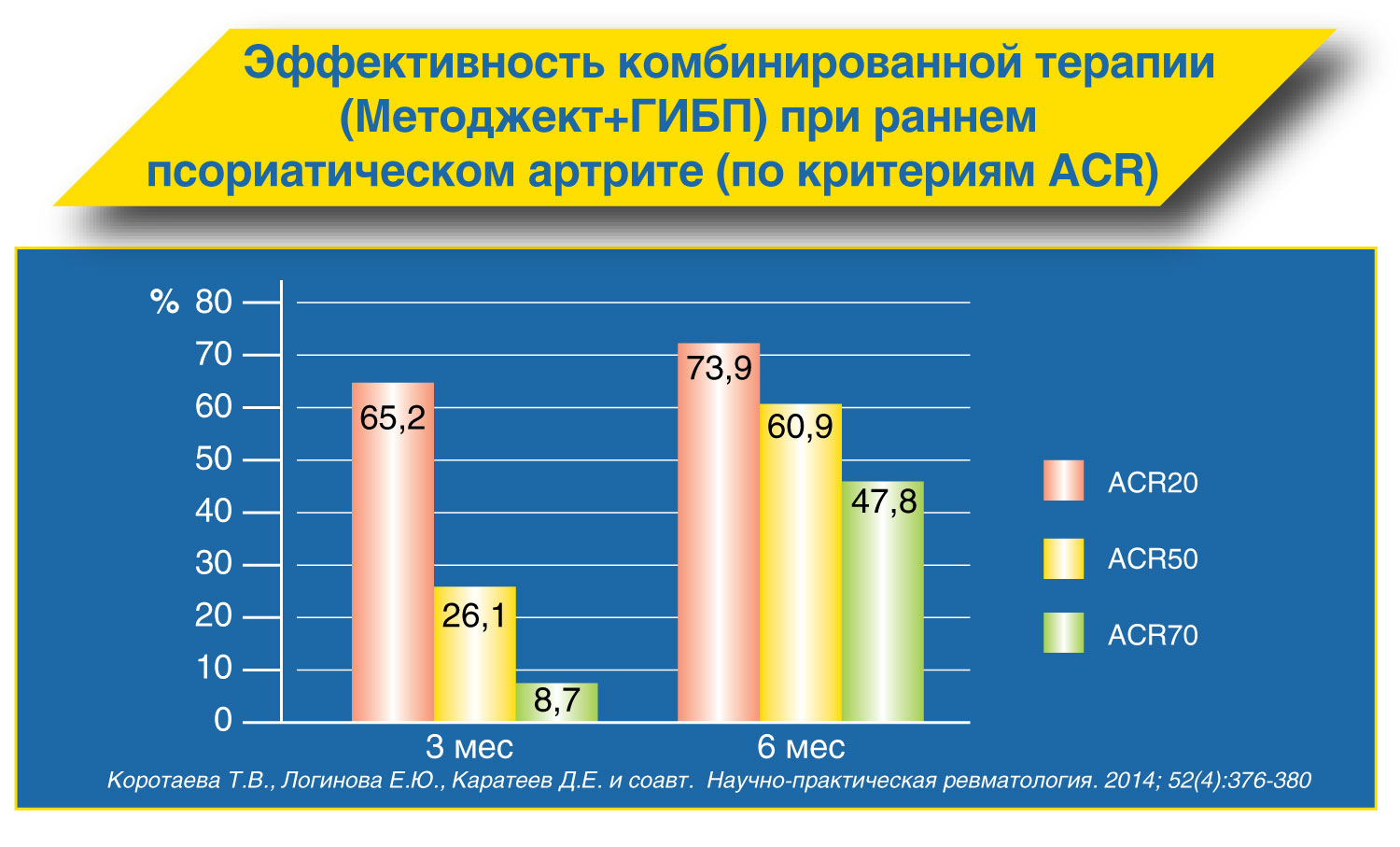
4) псориаз артропатический;
5) в качестве резервного препарата при наличии резистентности к антималярийным препаратам при красной волчанке;
6) лихеноидный питириаз (острый лихеноидный вариолиформный питириаз);
7) питириаз красный волосяной отрубевидный;
8) хроническая почесуха взрослых, упорное течение;
9) пузырчатка (для повышения эффективности терапии глюкокортикостероидами и уменьшения их курсовой дозы);
10) локализованная склеродермия, ювенильная локализованная склеродермия при неэффективности фототерапии, прогрессировании, тяжелом течении заболевания и отсутствии противопоказаний с целью купирования активности и улучшения прогноза заболевания;
11) грибовидный микоз на поздних стадиях, а также в случае неэффективности или недостаточном ответе на ранее проведенную наружную терапию и/или фототерапию и/или терапию интерфероном-α вне зависимости от стадии.
Учитывая высокую эффективность МТ и наличие достаточных клинических наблюдений, показания к его назначению были расширены в 2020 г. Препарат рекомендуется оффлэйбл:
1) в случае неэффективности проводимой терапии красного плоского лишая всех форм и локализаций;
2) пациентам с экстрагенитальным склероатрофическим лихеном при неэффективности фототерапии.
МТ применяется перорально, подкожно или внутримышечно. Согласно Российским клиническим рекомендациям препарат назначают по возрастающей схеме, начиная с 10 мг/неделю и добавляя по 5 мг каждые 2-4 недели до максимальной дозы 20-25 мг/неделю в зависимости от эффективности и переносимости 40.
Как уже говорилось выше, предпочтение отдается подкожному введению препарата. В повседневной клинической практике существует большое разнообразие режимов дозирования МТ. Полный перечень дозировок присутствует у препарата Метортрит 10 мг/мл: 7,5 мг (0,75 мл), 10 мг (1 мл), 12,5 мг (1,25 мл), 15 мг (1,5 мл), 17,5 мг (1,75 мл), 20 мг (2 мл), 22,5 мг (2,25 мл), 25 мг (2,5 мл).
Пациентов следует предупредить о том, что терапевтический эффект проявится через 4-8 недель после повышения дозы [41]. После достижения максимальной дозы 25 мг в неделю необходимо оценить ответ на терапию через 3 месяца и прекратить лечение, если оно неэффективно [42].
После достижения ремиссии цель терапии будет заключаться в снижении дозы лекарства до минимально возможной, которая обеспечит контроль над заболеванием и адекватную переносимость. На практике дерматологи стараются уходить от МТ, избегая поддерживающих доз.
При лечении МТ не следует забывать об адъювантной терапии. В Российских клинических рекомендациях указано, что на фоне лечения МТ рекомендуется назначать фолиевую кислоту в дозе не менее 5 мг, но не более 25 мг в неделю через 24 часа после приема МТ [45, 46].
Применение у детей
Как ни странно, рандомизированных клинических исследований терапии МТ у детей с псориазом не проводилось, хотя он часто используется в педиатрической практике. Однако в научной литературе все-таки можно встретить ретроспективные публикации об эффективности применения МТ у детей, даже начиная с 2-летнего возраста [47, 48].
МТ, как правило, хорошо переносится в педиатрической популяции. Стандартные рекомендации: 0,2-0,4 мг/кг 1 раз в неделю [49]. Профиль побочных эффектов аналогичен взрослым, и мониторинг, как правило, такой же.
Мониторинг
Согласно Российским клиническим рекомендациям в начале лечения МТ и при увеличении его дозы необходимо проводить контроль уровня АЛТ и АСТ, билирубина, креатинина, а также клинический анализ крови каждые 2 недели в течение 2 месяцев, а затем – каждые 3 месяца; клиническую оценку НЯ и/или факторов риска также необходимо делать во время каждого визита пациентов.
При появлении признаков инфекции очередной прием препарата следует пропустить до их полного исчезновения. Рекомендации Британской ассоциации дерматологов по безопасному применению МТ представлены в таблице [20].
Особые случаи
Алкоголь
Нет никаких доказательств, указывающих на безопасный уровень потребления алкоголя во время приема МТ, поэтому всем пациентам рекомендовано исключить потребление алкоголя [20].
Контрацепция
МТ является тератогеном и вызывает специфическую эмбриопатию, поэтому противопоказан беременным женщинам. Необходимо использовать двойной метод контрацепции во время лечения и в течение 3 месяцев после последнего приема препарата [50].
МТ выделяется с грудным молоком и поэтому не должен использоваться при грудном вскармливании [20].
Дискуссия о влиянии МТ на сперматогенез все еще продолжается, а точных научных данных пока не получено, поэтому Британская ассоциация дерматологов рекомендует отсрочить планируемое зачатие ребенка на период лечения и срок до 3 месяцев после последнего приема препарата [20].
Гепатиты В и С
Если у пациента есть признаки активного гепатита В (высокий уровень репликации ДНК вируса гепатита В в сыворотке крови, повышение активности аланинаминотрансферазы (AЛT) и выявление е-антигена вируса гепатита В (HBeAg)), он подвергается риску обострения заболевания. В связи с этим гепатит В является абсолютным противопоказанием к терапии МТ.
Ю. А. Галлямова, доктор медицинских наук, профессор
А. В. Асоскова 1
ФГБОУ ДПО РМАНПО Минздрава России, Москва, Россия
Метотрексат в дерматологии: от теории к практике/ Ю. А. Галлямова, А. В. Асоскова
Для цитирования: Галлямова Ю. А., Асоскова А. В. Метотрексат в дерматологии: от теории к практике // Лечащий Врач. 2021; 5 (24): 46-51. DOI: 10.51793/OS.2021.11.97.010
Теги: кожа, псориаз, лечение, противовоспалительный эффект, иммуномодулирующий и кумулятивный эффект

.gif)