Метрономная терапия что это
Метрономная терапия что это
Наш клинический опыт свидетельствует, что продленная адъювантная системная терапия способна улучшить результаты лечения больных раком молочной железы. Это подтверждено назначением адъювантной гормонотерапии тамоксифеном или ингибиторами ароматазы в течение 5-10 лет у больных с наличием рецепторов стероидных гормонов в опухоли. У больных с наличием гиперэкспрессии HER2 назначение трастузумаба в течение года значительно снижает риск прогрессирования. Однако для больных с тройным негативным фенотипом отсутствуют мишени для гормональной или таргетной терапии, поэтому им проводится только адъювантная химиотерапия продолжительностью 18-24 недели. Представляется актуальным поиск поддерживающей системной терапии после окончания этапа адъювантной терапии у больных с тройным негативным фенотипом. Учитывая длительный характер поддержки, планируемая химиотерапия должны обладать минимальной токсичностью. В качестве такой терапии была предложена метрономная терапия с включением циклофосфамида и метотрексата, которая продемонстрировала свою эффективность в лечении больных метастатическим раком молочной железы и обладала минимальной токсичностью.
Международная группа по изучению рака молочной железы (IBCSG) инициировала в 2000 году рандомизированное исследование III фазы, в котором больные операбельным раком молочной железы с отрицательными стероидными рецепторами после проведения оперативного вмешательства, лучевой терапии и стандартной адъювантной химиотерапии были рандомизированы в группу наблюдения или поддерживающей терапии в течение года [1]. В качестве поддерживающей терапии назначали циклофосфамид 50 мг ежедневно и метотрексат 2,5 мг 2 раза в день 1 и 2 дни каждой недели. Поддерживающая терапия назначалось в течение 56 дней с момента окончания адъювантной химиотерапии. В исследование включались больные c T1-3 независимо от наличия метастазов в подмышечных лимфоузлах и с отсутствием рецепторов эстрогенов и прогестерона в опухоли (экспрессия менее 10% опухолевых клеток по данным иммуногистохимии). Поскольку исследование планировалось задолго до момента, когда трастузумаб стал обязательным компонентом адъювантной терапии у больных с гиперэкспрессией HER2, разрешалось включать пациенток как с тройным негативным фенотипом, так и с гиперэкспрессией HER2. После 2005 года больные с гиперэкспрессией HER2 получали трастузумаб адъювантно в течение года. Больные наблюдались ежемесячно в течение поддерживающей терапии, затем каждые 6 месяцев. Основным критерием эффективности была безрецидивная выживаемость.
За период с января 2001 по декабрь 2012 года в исследование было включено 1086 больных. Средний возраст пациенток составил 52 года, 45% из них были в пременопаузе, у 42% имелись метастазы в подмышечные лимфоузлы, T3 стадия диагностирована у 54% пациенток. У 19% больных отмечена гиперэкспрессия HER2 (из этих 204 больных – 106 (52%) получали трастузумаб), у 75% – был тройной негативный рак. Органосохраняющая операция была выполнена у 73% больных, лучевая терапия была проведена 82% пациенткам. Наиболее частыми режимами адъювантной химиотерапии были комбинации на основе антрациклинов (60%) и с включением таксанов и антрациклинов (26%). Группы были хорошо сбалансированы.
Среди больных, рандомизированных в группу поддержки, 13% ее не получали. Среди 473 больных, получивших поддержку, 456 – информировали о дозах и сроках приема препаратов. Оказалось, что суммарная доза циклофосфамида и метотрексата составила 89% и 60% от запланированных. Поддержка ранее запланированного срока была прекращена у 141 больной. Основными причина отмены были токсичность, отказ больной от продолжения лечения и прогрессирование заболевания.
При медиане наблюдения 6,9 лет 5-летняя безрецидивная выживаемость составила 78,1% для больных в группе поддержки и 74,7% в группе наблюдения, и эти различия были статистически недостоверны (HR=0.84, p=0.14). В группе тройного негативного рака относительный риск снижения прогрессирования составил 20% (5-летняя безрецидивная выживаемость 78,7% и 74,6% в группе поддержки и наблюдения соответственно), а при сочетании тройного негативного фенотипа и наличия метастазов в подмышечных лимфоузлах снижение относительного риска на 28% (72,5% и 64,6%). В исследовании не было отмечено позитивного влияния поддержки на улучшение безрецидивной выживаемости у больных с гиперэкспрессией HER2. Проведение поддержки не влияло существенно на показатели общей выживаемости. Проведение поддерживающей терапии сочеталось с развитием токсичности 3-4 степени у 14% больных (основными были повышение трансаминаз и лейкопения). Также авторы не выявили миелодисплазию ни у одной больной.
Таким образом, авторы делают вывод, что проведение поддерживающей терапии с помощью метрономной терапии циклофосфамидом и метотрексатом у больных с отсутствием стероидных гомонов в опухоли нецелесообразно. Метрономная поддержка не показана больным с гиперэкспрессией HER2, так как для них существует эффективная адъювантная таргетная терапия трастузумабом. У больных с тройным негативным фенотипом поддержка метрономной терапией приводит к недостоверному снижению риска прогрессирования. Значительное, хотя и недостоверное (из-за небольшого количества больных) снижение риска отмечено у больных с наличием метастазов в подмышечные лимфоузлы. Это важный факт с учетом крайне плохого прогноза этих пациенток и отсутствием эффективных методов снижения риска прогрессирования. Поэтому авторы планируют проведение исследования с использованием поддерживающей терапии у больных тройным негативным фенотипом и наличием метастазов в подмышечных лимфоузлах. Есть еще перспективная точка использования поддерживающей терапии. Известно, что больные тройным негативным фенотипом и отсутствием полной регрессии опухоли после неоадъювантной терапии имеют крайне неблагоприятный прогноз. В недавнем исследовании было показано, что назначение им капецитабина в качестве адъювантной терапии на 42% снижает относительный риск прогрессирования [2]. Следовательно, разработка длительной поддерживающей терапии с помощью перорального приема небольших доз цитостатиков (и капецитабин в ежедневной дозе 1000-1250 мг/м 2 в два приема может считаться оптимальным кандидатом) остается перспективным подходом у больных тройным негативным фенотипом адъювантно в случае наличия метастатического поражения подмышечных лимфоузлов или пост-неоадъювантно в случае отсутствия полной морфологической регрессии опухоли.
Ключевые слова: рак молочной железы, адъювантная терапия, поддерживающая терапия, метрономная терапия.
Метрономная терапия: место в лечении злокачественных опухолей
Авторы: В.А. Чубенко, Л.А. Загорская, В.С. Чубенко, Ф.В. Моисеенко, Н.Х. Абдулоева, А.С. Жабина, М.М. Крамчанинов, К.В. Шелехова, А.А. Мелдо, Е.М. Зыков, А.А. Кудрявцев, Е.В. Напольская, В.М. Моисеенко
Одной из стратегий преодоления возможной резистентности на фоне современного лекарственного лечения является метрономная терапия злокачественных опухолей. Это хроническое непрерывное введение низких доз лекарственных препаратов с целью воздействия как на опухолевые клетки, так и на их микроокружение для того, чтобы изменить естественную историю роста злокачественных опухолей и увеличить продолжительность жизни больных.
Целью работы было изучить эффективность метрономного режима циклофосфамида и метотрексата у больных различными злокачественными опухолями.
Материалы и методы. Проанализирован опыт применения схемы метрономной терапии циклофосфамид и метотрексат за 3,5 года в Онкоцентре. Из 678 больных подавляющее большинство (377) составили пациенты старшей возрастной группы. При этом 343 больных находились в ослабленном и тяжелом состоянии (ECOG 2-4). МТ назначалась в различных линиях лечения, но в основном, при развитии резистентности к стандартной терапии (со 2-й и более). С точки зрения нозологии, больные были крайне гетерогенны (рак толстой кишки – 103, рак молочной железы – 84, опухоли головы и шеи – 80, рак легкого –78 и первично-множественные опухоли – 72). Степень распространения процесса занимала, как правило, 2 и более органов. Чаще встречались аденокарциномы и плоскоклеточный рак.
Результаты. Объективный ответ опухоли на лечение составил 8,1%. При этом стабилизация процесса – 68,9%. Прогрессирование было зарегистрировано в 23% случаях. Медиана времени до прогрессирования составила 7 месяцев. Схема метрономной терапии переносилась удовлетворительно и не имела выраженной клинически значимой токсичности.
Выводы. Работа демонстрирует клиническую эффективность применения метрономного режима циклофос-
фамид и метотрексат при различных злокачественных новообразованиях.
Внимание
Этот раздел сайта содержит профессиональную специализированную информацию.
Вы являетесь дипломированным медицинским специалистом?
Метрономная терапия что это
Клинический научно-практический центр специализированных видов медицинской помощи (онкологический), Санкт-Петербург, Россия
Введение
На сегодняшний день перспективным методом лекарственного лечения злокачественных новообразований являются стратегии, основанные на поиске и подавлении «триггерных» мишеней с учетом биологии роста опухоли [1]. К ним относятся следующие ингибиторы:
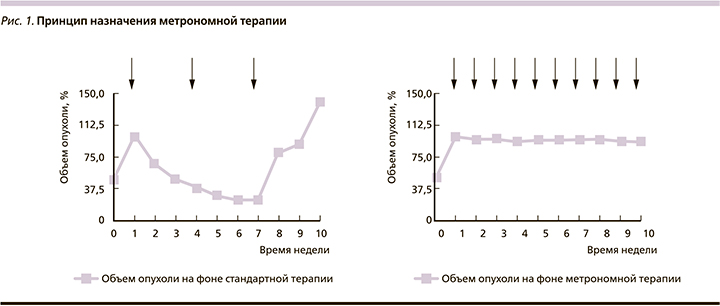
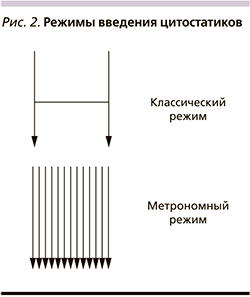
В итоге в арсенале клинического онколога принципиально имеются следующие возможности воздействия на злокачественные клетки: цитостатики, таргетная терапия, иммунотерапия и экспериментальные направления, целью которых служат регуляция метаболизма опухоли и эпигенетическая терапия. В результате подобные методы, безусловно, приводят к увеличению продолжительности жизни. Например, лекарственная терапия современными препаратами увеличивает медиану общей выживаемости больных раком молочной железы (РМЖ) с 32 до 50 месяцев [2],толстой кишки с 5–6 до 30 [3], желудка с 3–5 до 16 [4], легкого с 3,9 до 36 месяцев [5]. С другой стороны, иммунотерапевтические принципы лечения позволяют обсуждать 20%-ную возможность излечения. К сожалению, подобные успехи в большинстве своем характерны для определенной группы больных с учетом специфических предиктивных факторов [6]. В общей популяции подобная тенденция не столь выражена. Это обусловлено многими факторами, к которым относятся особенности кинетики роста, гетерогенность опухолевой популяции, опухолевая эволюция, репопуляция клеток, лекарственная резистентность, микроокружение или опухолевый матрикс, эпигенетические нарушения, тканевая иммуносупрессия, константы гомеостаза (pH, гликемия), стволовые клетки [7]. С целью возможности преодоления подобной резистентности опухолевых клеток разрабатываются новые стратегии терапии. К ним относится метрономная терапия (МТ) злокачественных опухолей. Это один из вариантов dose-dense терапии, в котором химиопрепараты назначаются через определенные короткие промежутки времени (часы, дни, недели) в низких (10–40% от терапевтической) дозах с целью увеличения продолжительности жизни больных неизлечимыми диссеминированными солидными опухолями [8]. Концепция применения метрономной терапии заключается в торможении роста злокачественных клеток, что теоретически снизит вероятность достижения «летального» объема опухоли и тем самым может повлиять на показатели выживаемости (рис. 1).
Метрономная терапия: от истоков к современности
История МТ началась с работ J. Folkman, который предположил возможность терапевтического воздействия на опухолевый ангиогенез [9]. В 1991 г. в лаборатории R. Kerbel было показано влияние цитостатиков на сосудистое русло в опухоли. В дальнейшем исследования Klement и Browder продемонстрировали возможность достижения значительного торможения роста опухоли низкими дозами химиопрепаратов на различных преклинических моделях. В то же время Hanahan предложил термин «метрономная терапия» [10].
Механизм действия МТ заключается в снижении пролиферации и ангиогенного потенциала эндотелиоцитов в опухоли, повышении экспрессии тромбоспондина-1, подавлении функции циркулирующих эндотелиальных клеток, блокаде мобилизации клеток-предшественниц эндотелиоцитов из костного мозга, а также в нормализации структуры сосудистой сети и в повышении перфузии опухолевой ткани.
Кроме того, обсуждается значительное влияние низких доз цитостатиков на регуляцию иммунной системы организма в виде повышения иммуногенности и возможности презентации антигенов, на мобилизацию антиген-презентирующих клеток, подавление функции Т-регуляторов и на повышение активности цитотоксических лимфоцитов. Несомнен факт их прямого воздействия на опухолевые клетки [11].
В качестве примера изучено антиангиогенное действие препаратов, связывающих микротрубочки. Оно заключается в повышении динамической нестабильности микротрубочек, нарушении переориентации центра организации микротрубочек, ослаблении сигнала от рецептора сосудистого эндотелиального фактора роста 2-го типа, пониженнии активации интегрина, ингибировании сигнала FAK/паксиллин/AKT, потере Hsp90, ингибировании активации eNOS, нарушении образования фокальных контактов, пониженной пролиферации и поляризации клеток, подавлении миграции клеток, разрушении связи микротрубочка+белок TIP, реорганизации актина в стресс-волокна, ингибировании сигнала Ras/Erk/Net (Elk3), повышении фосфорилирования MLC и сократимости актиномизина, изменении сигнала Rho-GTP-аза, разрушении VE-кадгерина, ингибировании сигнала VE-кадгерин/β-катенин/AKT, ингибировании образования трубочек, повышении проницаемости клеток, в регрессии капиллярных трубочек [12].
Эффективность МТ продемонстрирована во многих клинических исследованиях. Объективный ответ опухоли на лечение в среднем составлял 19–34% [15]. Мета-анализ 22 исследований метрономного режима при РМЖ, в который были включены 1360 больных, показал клиническую эффективность в 55% случаев, время до прогрессирования 6 месяцев — 56% больных и 2-летнюю общую выживаемость — 40% [15]. Среди особенностей подобных работ можно выделить следующие: в основном исследования I—II фаз, гетерогенность включенных пациентов, эмпирический выбор цитостатиков и режима, использование в качестве оценки эффективности лечения объективного ответа, а не общей выживаемости. В целом для МТ при РМЖ предпочтение отдавалось препаратам с высокой биодоступностью при применении внутрь и возможности частого внутривенного введения цитостатиков. В качестве примера назначение пожилым больным винорелбина внутрь в метрономном режиме приводило к увеличению времени до прогресирования болезни до 9,2 месяца [16].
Эффективность комбинации метрономного режима применения цитостатиков была продемонстрирована в исследовании VICTOR-2. В нем приняли участие 80 больных, из которых у 28 был диагностирован тройной негативный фенотип РМЖ. Капецитабин и винорелбин назначались в 1-й (35 больных) и 2-й линиях (45 больных) лечения. Частота объективного ответа составила 35,5 и 25,6% соответственно. Время до прогрессирования, превысившее 1 год, регистрировалось более чем у 20% больных. При этом клинически значимой токсичности практически не наблюдалось: фебрильная нейтропения была зарегистрирована у 0,4%, а слабость у 0,7% больных [17]. Низкая токсичность при применении метрономного режима применения цитостатиков послужила основанием исследования тройной комбинации препаратов в низких дозах при РМЖ. В исследовании VEX время до прогрессирования на фоне метрономного применения циклофосфамида, капецитабина и винорелбина в первой линии лечения составило 25,1 месяца [18]. Несмотря на активное изучение новых метрономных доз винорелбина, в клинические рекомендации лечения РМЖ в Российской Федерации входят следующие эффективные режимы его применения: 60 мг/м2 внутрь в 1-й, 8-й и 15-й дни; с 22-го дня — 80 мг/м2 1 раз в неделю.
По сравнению со стандартным режимом введения метрономный винорелбин демонстрирует схожую эффективность при более низкой токсичности. В исследовании XeNa объективный ответ опухоли составил 21,4 и 20,8%, клиническая эффективность — 37 и 41%, общая выживаемость — 660 и 701 день соответственно [19].
Заключение
Таким образом, МТ представляет собой новую парадигму лекарственного лечения в связи с интегрирующим воздействием как на опухолевые клетки, так и на их микроокружение. Данный подход демонстрирует клиническую эффективность определенной группы больных, резистентных к стандартной терапии. При этом длительная стабилизация процесса (более 6 месяцев), вероятно, может быть суррогатным маркером увеличения продолжительности жизни. С учетом механизма действия низких доз цитостатиков перспективным считается комбинация препаратов с различными терапевтическими опциями (иммунотерапия, антиангиогенная терапия).
На сегодняшний день подобная стратегия терапии требует изучения предиктивных маркеров. А с целью получения доказательной базы, безусловно, необходимо проведение масштабных рандомизированных исследований.
Литература
1. Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation. Cell. 2011;144(5):646–74. Doi: 10.1016/j.cell.2011.02.013.
2. Engel, J., Schubert-Fritschle G., Emeny R., Hölzel D.Breast cancer: are long-term and intermittent endocrine therapies equally effective? J Cancer Res Clin Oncol. 2020 May 29. Doi: 10.1007/s00432-020-03264-0.
3. Aggarwal H., Sheffield K.M., Li L., et al. Primary tumor location and survival in colorectal cancer: A retrospective cohort study. World J Gastrointest Oncol. 2020;12(4):405–23. Doi: 10.4251/wjgo.v12.i4.405.
4. Yarema R., Оhorchak М., Hyrya P., et al. Gastric cancer with peritoneal metastases: Efficiency of standard treatment methods. World J Gastrointest Oncol. 2020;12(5):569–81. Doi: 10.4251/wjgo.v12.i5.569.
5. Xu E., David E.A., Ding L., et al. Sequence of biologic therapies and surgery affects survival in non-small cell lung cancer. J Surg Oncol. 2020. May 20. Doi: 10.1002/jso.25937.
6. Cristescu R., Mogg R., Ayers M., et al. Pan-tumor genomic biomarkers for PD-1 checkpoint blockade-based immunotherapy. Science. 2018;362(6411):eaar3593. Doi: 10.1126/science.aar3593.
7. Murciano-Goroff Y.R., Warner A.B., Wolchok J.D.The future of cancer immunotherapy: microenvironment-targeting combinations. Cell Res. 2020. Doi: 10.1038/s41422-020-0337-2.
8. Hanahan D., Bergers G., Bergsland E. Less is more, regularly: metronomic dosing of cytotoxic drugs can target tumor angiogenesis in mice. J Clin Invest. 2000;105(8):1045–47. Doi: 10.1172/JCI9872.
9. Abdollahi A., Hlatky L., Huber P.E. Endostatin: the logic of antiangiogenic therapy. Drug Resist Updat. 2005;8(1–2):59–74. Doi: 10.1016/j.drup.2005.03.001.
10. Bocci G., Kerbel R.S. Pharmacokinetics of metronomic chemotherapy: a neglected but crucial aspect. Nat Rev Clin Oncol. 2016;13(11):659–73. Doi: 10.1038/nrclinonc.2016.64.
11. André N., et al. Metronomics: towards personalized chemotherapy? Nat Rev Clin Oncol. 2014. Doi: 10.1038/nrclinonc.2014.89.
12. Schwartz E.L. Antivascular actions of microtubule-binding drugs. Clin Cancer Res 2009;15(8):2594–601. Doi: 10.1158/1078-0432.CCR-08-2710.
13. Shaked Y., Pham E., Hariharan S. Evidence Implicating Immunological Host Effects in the Efficacy of Metronomic Low-Dose Chemotherapy. Cancer Res. 2016;76(20):5983–993. Doi: 10.1158/0008-5472.CAN-16-0136.
14. Briasoulis E., Aravantinos G., Kouvatseas G. Dose selection trial of metronomic oral vinorelbine monotherapy in patients with metastatic cancer: a hellenic cooperative oncology group clinical translational study. BMC Cancer. 2013;13(1):263. Doi: 10.1186/1471-2407-13-263.
15. Cazzaniga M.E., Munzone E., Bocci G. Pan-European Expert Meeting on the Use of Metronomic Chemotherapy in Advanced Breast Cancer Patients: The PENELOPE Project. Adv Ther. 2019;36(2):381–406. Doi: 10.1007/s12325-018-0844-4.
16. De Iuliis F., Salerno G., Taglieri L., et al. On and off metronomic oral vinorelbine in elderly women with advanced breast cancer. Tumori. 2015;101(1):30–5. Doi:10.5301/tj.5000207.
Метрономная химиотерапия
27.05.2019 | Статьи и новости | 2019-05-27 13 августа 2019
Метрономная химиотерапия, химиотерапия с низкими дозами: алопеция уменьшается до 1% — это надежда будущего.
Преимущества метрономной химиотерапии при лечении рака в Италии
Низкая токсичность, хороший иммунный ответ и мало побочных эффектов. Это преимущества метрономной химиотерапии, которая, как было показано, очень эффективна, особенно при распространенных формах рака.
При метрономной химиотерапии уменьшаются побочные эффекты, резко уменьшается даже выпадение волос, но при этом сохраняется или даже увеличивается эффективность лечения. Именно это и продемонстрировала метрономная химиотерапия — новый подход к лечению опухолей в клиниках Италии. Этот метод заключается в непрерывном введении лекарственных препаратов в низких дозах, а не в высоких дозах (максимально переносимых) для коротких циклов при интервалах 2 или 3 недели, как это делается при стандартной химиотерапии.
Стратегия, успешно апробированная в Италии при метастатическом раке молочной железы, одобренная европейскими директивами по этому новообразованию и которая с сегодняшнего дня будет приобретать все большее распространение благодаря новой Международной школе по метрономической химиотерапии.
Разные дозы, разные эффекты
Исследования показывают, что разные дозы и время введения одного и того же лекарственного средства вызывают разные воздействия на опухолевую клетку, но прежде всего на то, что ее окружает, то есть так называемую опухолевую микросреду. Поэтому, модулируя дозу и скорость введения, можно в конечном итоге оказывать различное действие: на сосуды опухоли, на стимуляцию иммунного ответа или на раковые стволовые клетки.
В отличие от обычной химиотерапии, которая оказывает сильное прямое воздействие на опухолевые клетки, основной целью метрономной терапии является, по сути, неоваскуляризация(т.е. образование новых кровеносных сосудов), которые питают опухоль. И одним из ее преимуществ является низкая токсичность для костного мозга. Ясно, что ключевой ролью в этом подходе является выбор правильной дозы препарата, что требует идентификации одного биомаркера.
Как функционирует метрономическая химиотерапия
Метрономика не только оказывает прямую токсичность на опухолевые клетки, но и влияет на их микроокружение, поскольку она ингибирует неопластический ангиогенез, другими словами, механизм образования новых кровеносных сосудов, отвечающих за рост опухоли и метастазирование.
Ее эффективность продемонстрирована при некоторых формах рака молочной железы, рака легких, лимфом, злокачественных новообразований у детей и во многих случаев опухолей на поздних стадиях. Она не только эффективна и имеет профиль низкой токсичности, она также способна модулировать иммунный ответ, уменьшая побочные эффекты — у менее чем 1% пациентов наблюдается алопеция и неврологическая токсичность менее чем у 5%. Не говоря уже об огромной экономии, которую предлагает оральная терапия в домашних условиях.
«Некоторым это может показаться второстепенным, но с помощью этой терапии я не потеряла свои волосы, как это могло бы случиться с традиционным химиотерапией», — говорит Антонелла Парма, пациентка, которая проходит курс лечения в течение 9 месяцев: «Кроме того, меня не заставляют часто проводить обследования крови. Я делаю свои проверки, когда я иду в больницу, чтобы забрать таблетки для терапии. В принципе, я могу продолжать жить обычной жизнью».
Метрономная терапия что это
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
Метрономная химиотерапия винорелбином как оптимальный вариант лечения в реальной клинической практике
Журнал: Онкология. Журнал им. П.А. Герцена. 2017;6(5): 64-69
Болотина Л. В., Королева Л. А. Метрономная химиотерапия винорелбином как оптимальный вариант лечения в реальной клинической практике. Онкология. Журнал им. П.А. Герцена. 2017;6(5):64-69.
Bolotina L V, Koroleva L A. Metronomic chemotherapy with vinorelbine as the optimal treatment option in real clinical practice. P.A. Herzen Journal of Oncology. 2017;6(5):64-69.
https://doi.org/10.17116/onkolog20176564-69
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
Представлены современные взгляды на лечение распространенных форм немелкоклеточного рака легкого и рака молочной железы с использованием режимов метрономной химиотерапии на основе винорелбина. Представлены собственные клинические наблюдения, подтверждающие эффективность и безопасность метрономного режима винорелбина в лечении этих нозологий.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
Рак молочной железы (РМЖ) и рак легкого (РЛ) на протяжении многих лет занимают лидирующие позиции в структуре онкологической заболеваемости в мире [1]. В Российской Федерации РМЖ также является наиболее частым злокачественным новообразованием у женщин, РЛ занимает 3-е место, уступая, помимо РМЖ, лишь колоректальному раку. В 2015 г. в РФ были зарегистрированы 67 189 новых случаев РМЖ и 60 351 вновь заболевших РЛ [2]. Несмотря на значительные изменения в подходах к лечению этих двух нозологий за последние годы, что связано в первую очередь с выделением определенных биологических и молекулярных характеристик опухолевых клеток, химиотерапия остается важнейшим компонентом противоопухолевого лечения для большинства больных на одном из этапов течения заболевания. Серьезные изменения претерпели и взгляды на химиотерапевтические режимы, применяемые при диссеминированных процессах. Пришло понимание необходимости четкой стратификации больных при выборе лечебных подходов в зависимости от поставленной цели. Зачастую признается более оправданным (рациональным) отказ от использования высокоэффективных, но токсичных препаратов при диссеминированных процессах, особенно у возрастных, соматически отягощенных или ослабленных больных. С другой стороны, иногда возникает соблазн использовать лишь поддерживающую симптоматическую терапию, что лишает части больных потенциального шанса продлить жизнь и улучшить ее качество за счет купирования симптомов заболевания. Не менее 15% больных РМЖ и 50% РЛ на момент установления диагноза имеют метастатический или нерезектабельный процесс, а у подавляющего большинства остальных метастазы будут диагностированы в дальнейшем. При выборе первой линии терапии несомненно учитываться будет возможность применения таргетных препаратов — анти-HER-терапии для РМЖ и ингибиторов тирозинкиназы для немелкоклеточного РЛ (НМРЛ). Для РМЖ также будет оценена возможность назначения средств гормональной терапии как менее токсичного и удобного вида лечения. Из новых весьма привлекательных и перспективных препаратов нельзя не оценить возможности блокатора контрольной точки PD1 пембролизумаба, который уже доказал свою эффективность у больных НМРЛ в первой линии по сравнению с платиносодержащим дуплетом [3]. Однако следует учесть, что применение пембролизумаба в первой линии возможно лишь в случае НМРЛ с уровнем экспрессии PD-L1 на 50% опухолевых клеток и более. Кроме того, этот вид лечения может назначаться больным с функциональным статусом ECOG 0—1, так как ответ на терапию ожидается не ранее чем через 3 мес, пациентам без метастатического поражения головного мозга и иммунных заболеваний. Во всех остальных клинических ситуациях предполагается использование цитостатиков. Таким образом, химиотерапия (ХТ) остается основным вариантом лечения для большинства пациентов с метастатическим и нерезектабельным НМРЛ.
Выбор химиотерапевтического режима основывается на возможности применения препаратов платины, исходя из функциональных характеристик пациента и сопутствующей патологии. Конечно, платиносодержащие режимы являются приоритетными как для плоскоклеточного рака, так и для аденокарциномы. Когда же использование таких дуплетов не представляется возможным, к применению рекомендуются монохимиотерапевтические режимы (моноХТ), которые могут использоваться также у пожилых и ослабленных больных (ECOG 2). Все чаще рассматривается возможность применения особого вида моноХТ у такой категории больных — режима метрономной химиотерапии. Особенностью такого подхода является назначение низких доз цитостатика без интервальных перерывов в лечении. Считается, что такой режим не только позволяет уменьшить токсичность лечения, но постоянное использование химиопрепарата предотвращает возникновение новых и тормозит рост существующих сосудов в опухоли, блокируя опухолевый рост [4]. Дополнительным эффектом метрономного режима принято рассматривать и способность индуцировать противоопухолевый иммунный ответ [5]. Одним из механизмов такого эффекта является увеличение антигенной презентации на опухолевых клетках и цитотоксической активности эффекторных иммунных клеток. Возможно, комбинация метрономных режимов ХТ с препаратами иммунной направленности позволит суммировать их противоопухолевое действие. С другой стороны, требуются исследования, которые могли бы подтвердить, что не будет угрозы снижения эффективности комбинированной терапии за счет снижения числа иммунокомпетентных клеток под воздействием цитостатика. Основными кандидатами на использование режима моноХТ при НМРЛ, согласно рекомендациям ESMO, будут пациенты моложе 70 лет с функциональным статусом ECOG 2 или пациенты старше 70 лет со статусом ECOG 0—2. Рекомендованными препаратами для использования являются гемцитабин, винорелбин или доцетаксел [6]. Более того, для этой категории пациентов режим монотерапии предлагается рассматривать как стандартный вариант лечения. Примечательными являются результаты исследования Miles, которые продемонстрировали целесообразность применения гемцитабина или винорелбина в качестве первой линии терапии у старшей возрастной категории больных. В этом исследовании было показано преимущество этих лечебных режимов по сравнению с наилучшей поддерживающей терапией, а между двумя цитостатиками выигрыш в отношении как медианы общей выживаемости, так и годичной выживаемости оказался на стороне винорелбина (8,3 мес против 6,5 мес; 38% против 28%) [7]. В результате проведенных исследований был сформирован портрет пациентов c НМРЛ, которые получат максимальный выигрыш от моноХТ. Параметрами для отбора будут являться возраст (старше 75 лет), функциональный статус (PS >1), а также сопутствующая патология, среди которой в первую очередь необходимо учитывать кардиальную, сниженный клиренс креатинина (менее 45—60 мл/мин), нейропатию или снижение слуха более I степени, снижение костномозговой функции.
Безусловно, выбор лекарственного средства для режима метрономной терапии должен соответствовать ряду условий. Во-первых, препарат используется неопределенно длительное время, что должно по возможности исключать необходимость венозного доступа. Во-вторых, препарат должен иметь доказанную эффективность при конкретной нозологии и иметь невысокую, легко контролируемую в амбулаторных условиях токсичность. Для НМРЛ наиболее оптимальным цитостатиком, соответствующим этим условиям, является винорелбин, имеющий пероральную форму. Эффективность метрономного режима пероральной формы при НМРЛ была изучена в небольших по численности, но достаточных по общему числу клинических исследованиях. В публикациях последних лет препарат изучался как у предлеченных больных, так и в качестве первой линии терапии [8—11]. Все исследователи использовали метрономный режим с назначением капсул в суточной дозе 40—50 мг 3 раза в неделю. Оценке подлежали частота объективного ответа (ЧОО), частота клинического ответа (ЧКО), медиана времени до прогрессирования болезни (мВДП) и медиана общей выживаемости (мОВ). В рамках проведенных исследований ЧОО колебалась от 9,5 до 20%, а ЧКО со стабилизацией не менее 12 нед составила 29—60%. При применении препарата в первой линии мВДП была равна 3—7 мес, в мОВ — 8—9 мес. Примечательно, что в исследовании Е. Kontopodis и соавт. [9] мОВ у предлеченных больных даже превысила эти показатели и была зафиксирована на уровне 9,4 мес. Необходимо подчеркнуть, что полученные результаты оказались очень близки с результатами применения платиновых дуплетов с гемцитабином и пеметрекседом (10,3 мес) [12]. При этом метрономный режим имеет бесспорно более благоприятный профиль токсических реакций. Так, любой вид как негематологической, так и гематологической токсичности III—IV степени регистрировался не более чем в 0,1% случаев, а такие нежелательные реакции, как тошнота, рвота и лейкопения III—IV степени, не были зафиксированы вовсе [9]. Казалось бы, длительность использования препарата в клинической практике сформировала четкое понимание его места в лечении НМРЛ. Однако и сегодня продолжаются исследования по расширению возможностей эффективного применения винорелбина в различных клинических ситуациях. Так, например, изучаются возможности применения метрономного режима винорелбина в качестве поддерживающей терапии с переключением (MANILA Trial). В рамках исследования Tempo-Lung1 оценивается сравнительная эффективность стандартного еженедельного режима пероральной формы винорелбина и режима метрономного приема (трижды в неделю) для пациентов, которым не могут быть назначены платиновые дуплеты. Таким образом, необходимо помнить о том, что для больных, имеющих противопоказания к использованию режимов на основе препаратов платины, адекватной альтернативой первой линии терапии являются режимы моноХТ (винорелбин или гемцитабин). Использование в первой линии режима метрономного применения винорелбина обеспечивает как минимум равную эффективность по сравнению с традиционным назначением препарата. Использование в режиме метрономной ХТ пероральной формы и благоприятный профиль безопасности расширяет круг больных, которым такая терапия может быть рекомендована.
Приводим клиническое наблюдение метрономного режима винорелбина в качестве первой линии при НМРЛ.
Больная У., 71 год. Клинический диагноз: периферический рак нижней доли левого легкого с централизацией IV стадии (сT2bN3M1). Метастатическое поражение крестца, контралатеральных средостенных и надключичных лимфатических узлов. Сопутствующие заболевания: ХОБЛ. Пневмосклероз. ДН II стадии. Атеросклероз аорты. Атеросклеротический кардиосклероз. Гипертоническая болезнь II стадии. Коксартроз слева. Ожирение. Морфологический диагноз: цитологическое исследование отпечатков мазков из бронха SX левого легкого (от 16.06.16): умереннодифференцированная аденокарцинома. Определение мутации EGFR от 30.06.16: ПЦР в режиме реального времени. Исследование выполнено с использованием набора EGFR RGQ PCR Kit («Qiagen») на термоциклере Rotor-Gene («Qiagen»). Результаты исследования: при исследовании полученного образца мутаций гена EGFR не выявлено. Исследование ALK от 01.07.16. Проведена FISH-реакция на гистологических стеклах с использованием зонда ALK (2р23) Break Kreatech FISH probes («Leica»). Проанализировано 50 клеток, перестройка гена ALK не обнаружена. Цитологическое исследование пунктата правого надключичного узла от 06.07.16: метастаз умереннодифференцированной аденокарциномы.
При поступлении жалобы на периодический кашель, одышку при умеренной физической нагрузке. Из анамнеза: в декабре 2015 г. отметила появление кашля. В августе 2016 г. при КТ органов грудной клетки выявлена опухоль левого легкого. При дообследовании в МНИОИ им. П.А. Герцена установлен периферический рак нижней доли левого легкого с централизацией сT2bN3M1, IV стадии с метастатическим поражением крестца, контралатеральных средостенных и надключичных лимфатических узлов. При МСКТ грудной полости с внутривенным контрастированием от 29.08.2016: в нижней доле левого легкого определяется опухолевое образование мягкотканной плотности размером 65×59 мм. Отмечается утолщение стенок сегментарных и субсегментарных бронхов SVIII, SIX, SX нижней доли за счет перибронхиальной инфильтрации, прилежащая паренхима уплотнена по типу матового стекла. Опухолевая инфильтрация распространяется к прикорневой зоне. Наблюдается обтурация просвета субсегментарных ветвей SХ. Легочный рисунок усилен, вероятно, за счет лимфангита. Левая нижняя легочная вена и нижняя ветвь левой легочной артерии проходят в толще опухоли, дефектов не выявлено. Определяются средние и нижние паратрахеальные лимфатические узлы диаметром до 11—12 мм. Костно-деструктивные изменения на исследованном уровне не выявлены (рис. 1). УЗИ 24.08.16 над- и подключичных областей, печени, почек, брюшной полости: в левой надключичной области определяется измененный лимфатический узел 6×3 мм. Печень незначительно увеличена (жировой гепатоз), очаговых образований не выявлено. В желчном пузыре конкремент 18×20 мм. В правой почке киста 45×35 мм. Заключение: картина жирового гепатоза, диффузные изменения поджелудочной железы, конкремент желчного пузыря, киста правой почки. Измененный лимфатический узел левой надключичной области. Учитывая распространенность процесса, на междисциплинарном консилиуме принято решение провести лекарственную терапию. В связи с отсутствием мутаций в генах EGFR и ALK, наличием клинически значимой сопутствующей патологии, а также функционального статуса ECOG 1, принято решение использовать режим моноХТ с исключением платиновых производных с добавлением золедроновой кислоты. С 30.08.16 начата моноХТ винорелбином в метрономном режиме 50 мг внутрь 3 раза в неделю. При контрольном МСКТ с внутривенным контрастированием от 05.10.16 отмечена положительная динамика: по сравнению с данными от 29.08.16 отмечается уменьшение размера образования нижней доли левого легкого до 48×26 мм, нормализация размеров бифуркационных и бронхопульмональных лимфатических узлов слева (рис. 2). При УЗИ надключичных областей, брюшной полости, забрюшинного пространства от 03.10.16 в надключичных областях с обеих сторон очаговой патологии нет. Печень, поджелудочная железа, в проекции надпочечников — без видимой очаговой патологии.


Учитывая достигнутый эффект, отсутствие каких-либо токсических реакций, лечение продолжено в прежнем режиме — винорелбин, капсулы 50 мг, 3 раза в неделю. Достигнутый эффект сохранялся в течение 5 мес, отрицательная динамика в виде умеренного роста ранее существовавших очагов зафиксирована в феврале 2017 г. Пациентка переведена на терапию паклитакселом в еженедельном режиме, на котором достигнута стабилизация процесса. С мая 2017 г. больная находится без лечения под тщательным динамическим наблюдением.
Таким образом, можно констатировать, что режим метрономной ХТ капсулами винорелбина является эффективным, нетоксичным, удобным вариантом противоопухолевого лечения больных НМРЛ, имеющих противопоказания к назначению препаратов платины. Использование этого режима позволило пациентке старшей возрастной группы получать амбулаторное лечение, сохраняя привычный образ жизни, а также отсрочить начало внутривенной терапии на полгода.
Изучение эффективности режимов метрономной ХТ крайне востребовано и при другой нозологии — метастатическом РМЖ (мРМЖ). Это обусловлено тем, что большинство пациенток, которым устанавливается диагноз РМЖ, относятся к старшей возрастной категории. Так, по данным статистики, в 2015 г. средний возраст больных, взятых на учет, составил 61,3 года [13]. Особый интерес представляет изучение режимов на основе винорелбина, так как препарат обладает высокой эффективностью при данной патологии и благоприятным спектром токсичности. В частности, препарат не имеет кардиальной токсичности, что очень важно для больных, получавших в режимах неоадъювантной/адъювантной терапии или первой линии антрациклины и таксаны или их комбинацию. Также необходимо отметить, что в силу отсутствия негативного влияния на миокард винорелбин является идеальным партнером для анти-HER2 таргетных препаратов. Метрономные режимы 2-компонентной терапии люминального HER2-негативного мРМЖ изучались в рамках исследования VICTOR-1, где использовалась комбинация винорелбина в капсулах с капецитабином [14]. Пациенткам в постменопаузе, получившим ранее антрациклины и таксаны, назначали винорелбин в дозе 40 мг 3 раза в неделю и капецитабин 500 мг 3 раза в сутки. Частота контроля роста опухоли (ПО + ЧО + стабилизация более 24 нед) составила практически 60% с медианой времени до прогрессирования заболевания более 1,5 лет. Токсичность же изученного режима оказалась минимальной. Отдельно в этом исследовании были проанализированы результаты лечения больных старшей возрастной группы с медианой возраста 76 лет. Частота клинического ответа среди них оказалась даже несколько выше и составила 66,7%, а частота нежелательных явлений III—IV степени не превысила 6%. К токсическим реакциям относились нейропатия, ладонно-подошвенный синдром, нейтропения. В 2017 г. были опубликованы результаты исследования эффективности и токсичности 3-компонентной комбинации пероральных цитостатиков у пациенток гормонопозитивным мРМЖ, получавших в качестве первой и последующих линий винорелбин 40 мг 3 раза в неделю, капецитабин 500 мг 3 раза в день и циклофосфан 50 мг в день [15]. Среди 108 женщин 43 получали первую линию терапии, 65 ранее проводились какие-либо варианты лекарственной терапии. Средний возраст составил 54 года, у 49% отмечены висцеральные метастазы, из них у 14 человек — три и более зон метастатического поражения. При медиане наблюдения за пациентами 36 мес контроль роста опухоли составил 81% у больных, получавших первую линию терапии и 74% при проведении терапии второй и последующих линий с медианой ВДП 25,1 и 11,2 мес соответственно. К 2 годам оставались живы 91 и 83% пациенток в зависимости от лечебной линии. Исследованная комбинация цитостатиков хорошо переносилась пациентками, токсических реакций IV степени зарегистрировано не было независимо от предлеченности больных. Токсичность III степени отмечалась в 3—5% и была представлена только ладонно-подошвенным синдромом и повышением уровня печеночных ферментов. Лейкопения не превышала II степени.
Таким образом, можно заключить, что метрономный режим винорелбина как в варианте монотерапии, так и в комбинациях с другими цитостатиками при высоком уровне противоопухолевой активности имеет благоприятный профиль токсичности у пациенток с гормонально-чувствительным мРМЖ, что позволяет проводить терапию длительное время.
Приводим клиническое наблюдение использования винорелбина при мРМЖ.
Больная К., 1952 г. р. Клинический диагноз: рак левой молочной железы IV стадии T4сN3M1 (метастатическое поражение костей, легких, лимфатических узлов средостения, периферических лимфатических узлов). Из анамнеза: впервые обнаружила опухоль в левой молочной железе в 2006 г., к врачам не обращалась до 2011 г. В феврале 2011 г. в связи с распадом опухоли и болевым синдромом обратилась в МНИОИ им. П.А. Герцена, где при обследовании установлен диагноз метастатического рака молочной железы, люминальный тип В. Гистология: инвазивный рост инфильтративного протокового рака G3. ИГХ: РЭ — реакция положительная (8 баллов); РП — реакция положительная (3 балла); HER2/neu 2 «+», FISH амплификации не обнаружено, Ki-67 — 28%. С учетом наличия распадающейся опухоли левой молочной железы на первом этапе лечения выполнена санационная мастэктомия. В послеоперационном периоде в связи с распространенностью процесса проведено 6 курсов ПХТ в режиме АТ (доксорубицин и доцетаксел) в сочетании с золедроновой кислотой, достигнута стабилизация процесса. После завершения химиотерапии назначены ингибиторы ароматазы, которые больная получала до 2013 г. В 2013 г. зарегистрировано прогрессирование заболевания в виде местного рецидива в области послеоперационного рубца с множественными внутрикожными отсевами (рис. 3).

По данным СКТ органов грудной и брюшной полостей от 07.03.13 в левой подмышечной области определяется опухолевый конгломерат 35×30 мм. В легочной ткани паравазально справа очаг размером до 4 мм, ниже до 8 мм. В SХ визуализируется узловое образование размером 10 мм на сосуде, прилежащее к бронху. Справа на медиастинальной плевре образование размером до 6 мм. В SVIII образование до 2 мм. Жидкости нет. В левом легком без патологии. В клетчатке средостения правые паратрахеальные лимфатические узлы до 0,7 см, правые трахеобронхиальные 1,2 см. В правом корне лимфатические узлы размером 0,9×0,7 см. В мягких тканях передней грудной стенки очаги отсевов 1,2×0,5—1,3×2,0 см. В правой подмышечной области единичные лимфатические узлы размером 0,7×0,4 см. В правых половинах тел позвонков остеобластические образования: ThIII — 1,1 см, ThIV — 1,1×1,3 см, ThVI — 2,1×1,3 см. В печени две кисты — в SVI и SVII до 0,7 см. В хвосте поджелудочной железы псевдокиста 0,5 см. На уровне нижних чашечек левой почки конкремент 0,9 см. В остальном без патологии. В теле LIV по верхней поверхности очаг уплотнения до 1,0×0,8 см, в правой подвздошной области 2 очага уплотнения 9×4 и 8×4 мм.
Учитывая отрицательную динамику на фоне гормональной терапии, объем опухолевого поражения и категорический отказ больной от применения внутривенных цитостатиков, рекомендован прием винорелбина в метрономном режиме. С марта 2013 г. начала прием винорелбина в капсулах 50 мг 3 раза в неделю. Клинически отмечалась положительная динамика в виде уменьшения числа внутрикожных отсевов, уплощение образований (рис. 4).

При СКТ органов грудной и брюшной полостей от 28.10.13: по сравнению с данными от 07.03.13 положительная динамика за счет уменьшения опухолевого конгломерата в левой подмышечной области до 33×24 мм (ранее 35×30 мм). В легочной ткани паравазально справа очаг прежнего размера, до 4 мм, ниже до 8 мм. Ранее определяемое узловое образование, прилежащее к бронху на сосуде в настоящее время не визуализируется. Справа на медиастинальной плевре образование прежнего размера, до 6 мм. В SVIII образование до 2 мм. Жидкости нет. В левом легком без патологии. В клетчатке средостения лимфатические узлы прежнего размера: правые паратрахеальные до 0,7 см, правые трахеобронхиальные 1,2 см, в корне правого легкого 0,9×0,7 см. В области мягких тканей грудной стенки визуализируется единичный очаг отсева 0,8×0,5 см. В правой подмышечной области единичные лимфатические узлы прежнего размера, 0,7×0,4 см. Сохраняются остеобластические очаги в позвонках прежнего размера в правой подвздошной кости — 9×4 и 8×4 мм. В печени сохраняются две кисты прежнего размера, до 0,7 см. В хвосте поджелудочной железы псевдокиста 0,5 см. На уровне нижних чашечек левой почки конкремент 0,9 см. В остальном без патологии. Учитывая достигнутую стабилизацию заболевания, отсутствие каких-либо токсических реакций, лечение продолжено в прежнем режиме до февраля 2014 г. В последующем больная получала лучевую терапию на область кожных поражений, гормонотерапию фулвестрантом.
Выводы
1. Метрономная Х.Т. представляет собой лечебную стратегию, обеспечивающую длительный контроль над заболеванием, что позволяет увеличить выживаемость пациентов НМРЛ и РМЖ.
2. Качество жизни и уровень токсичности являются важнейшими факторами выбора противоопухолевого препарата и режима его применения, поэтому метрономная ХТ представляется привлекательным вариантом лечения, так как имеет низкий уровень токсичности, что устраняет необходимость использования средств поддерживающей терапии (КСФ, антиэметиков и др.). Так как метрономный режим предусматривает частое применение препарата, пероральная форма является оптимальной для данного режима ХТ.
3. Эффективность винорелбина при НМРЛ и РМЖ, а также наличие формы препарата для перорального приема делает его одним из наиболее перспективных средств для использования в режиме метрономной ХТ.
4. Благоприятный профиль токсичности винорелбина расширяет возможности его назначения пациентам старшей возрастной группы, а также больным с выраженной сопутствующей патологией.
Авторы заявляют об отсутствии конфликта интересов.