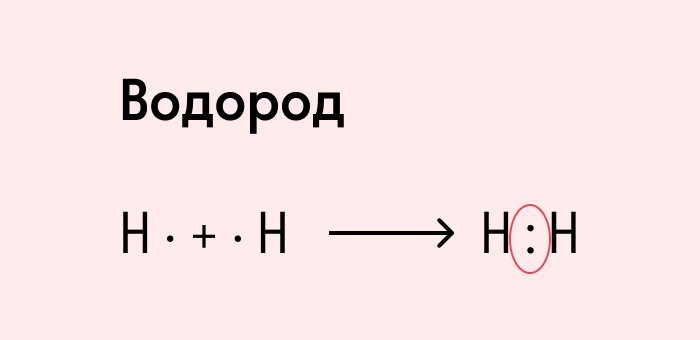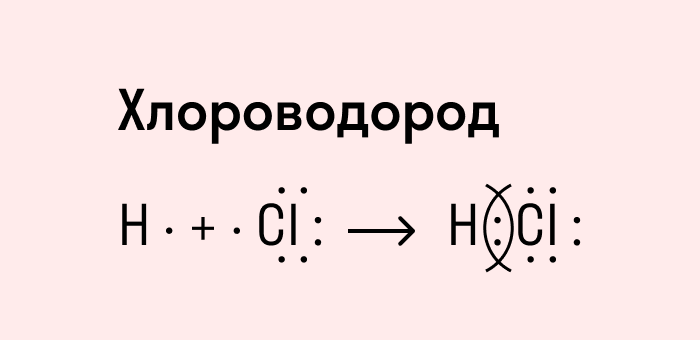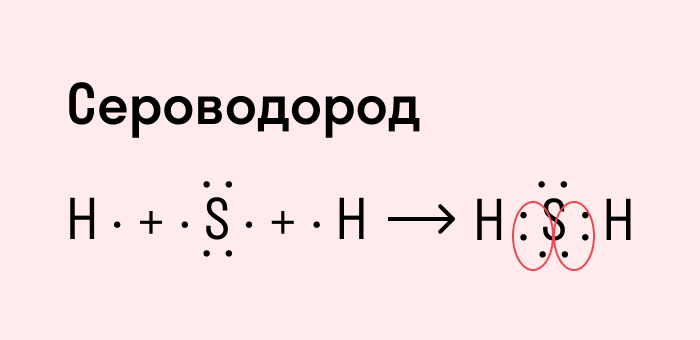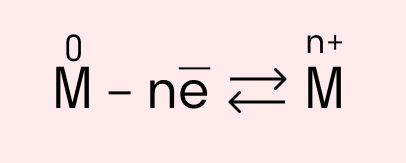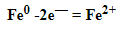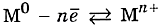Между чем возникает металлическая связь
Химическая связь
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Механизм образования химической связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
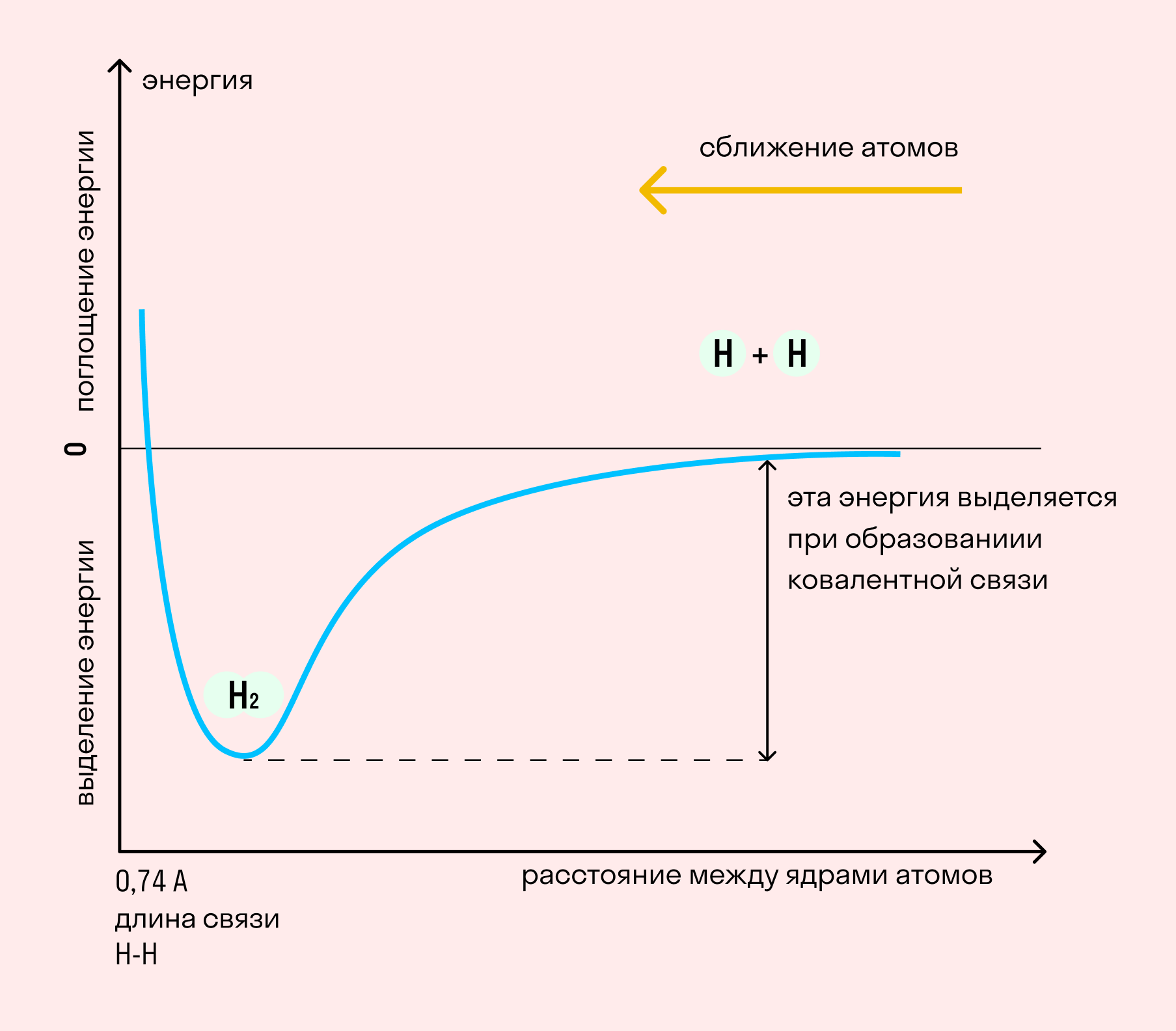
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Если это ковалентная связь — образуется атомная решетка, если водородная — молекулярная решетка, а если ионная или металлическая — соответственно, будет ионная или металлическая решетка. Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
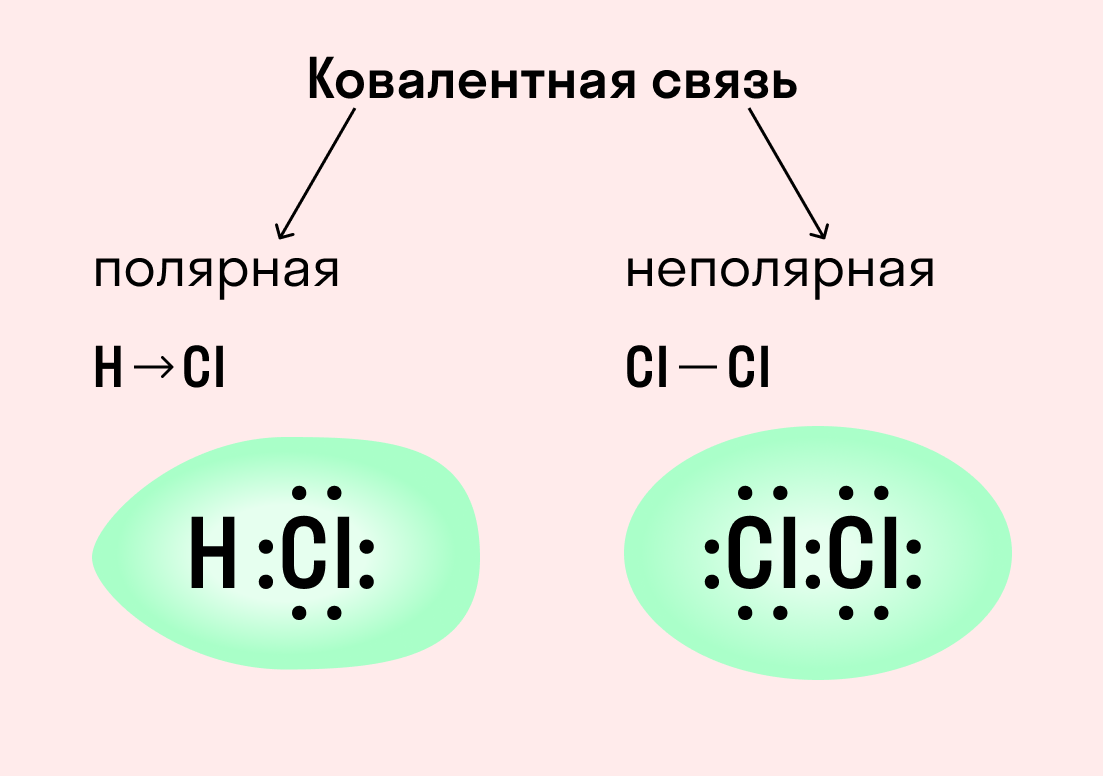
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:
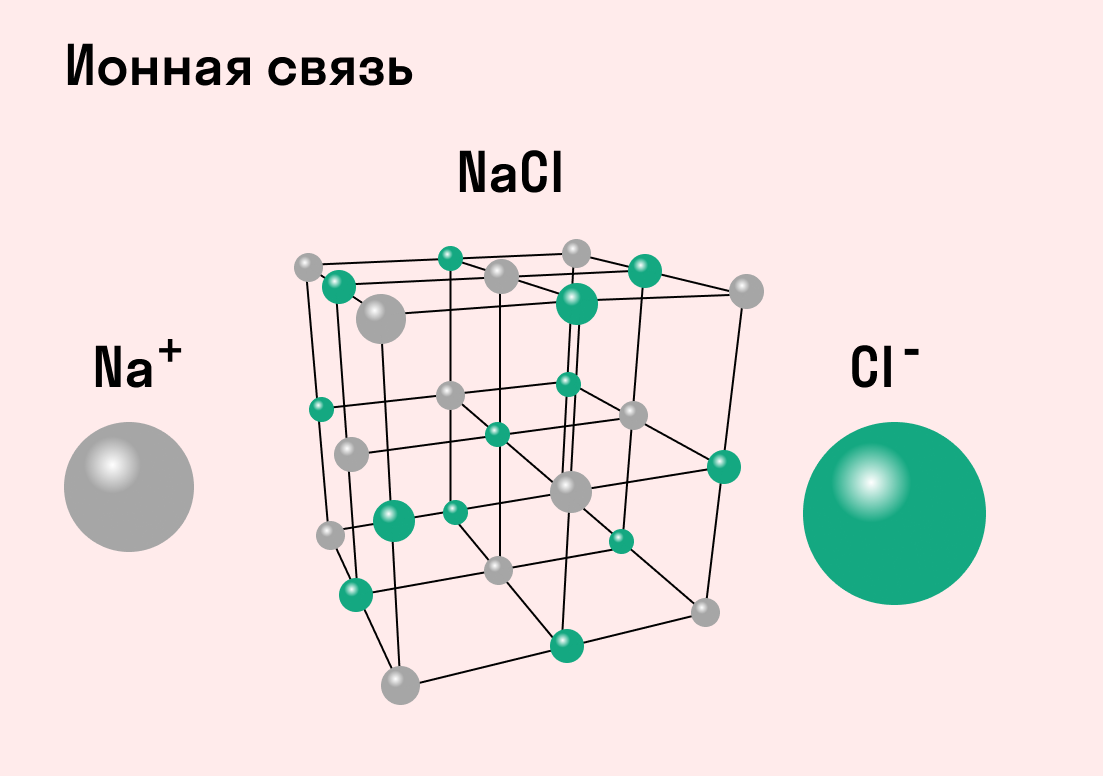
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Характеристики ионной связи:
не имеет направленности.
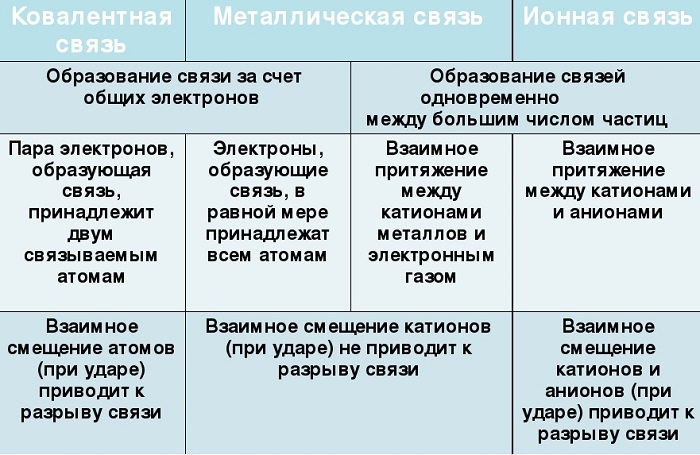
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Характеризуется появлением электронных пар, принадлежащих обоим атомам.
Характеризуется появлением и взаимным притяжением ионов.
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов.
Ионы с противоположными зарядами подвержены кулоновскому притяжению.
Имеет направленность и насыщенность.
Ненасыщенна и не имеет направленности.
Количество связей, образуемых атомом, называется валентностью.
Количество ближайших соседей атома называется координационным числом.
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО.
Образуется между металлами и неметаллами — веществами со значимо разной ЭО.
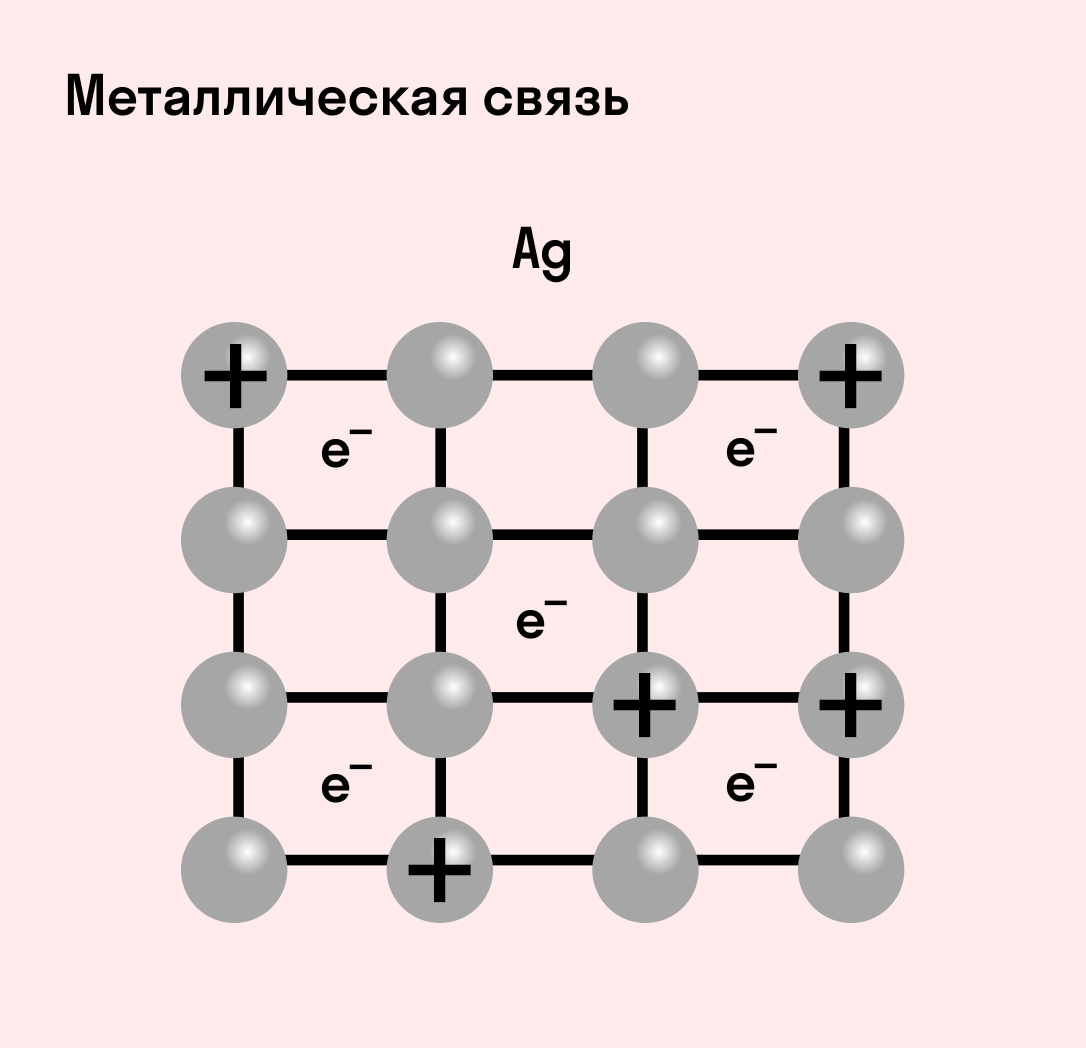
Металлическая связь
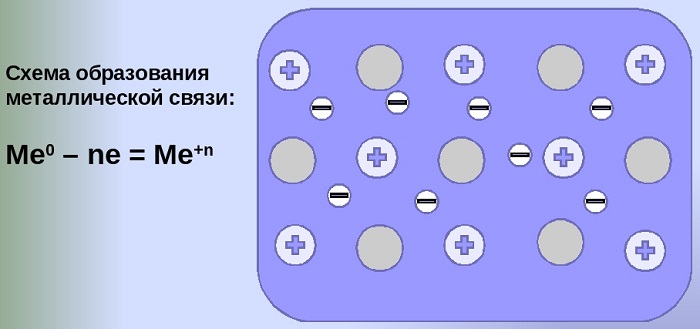
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Водородная связь
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
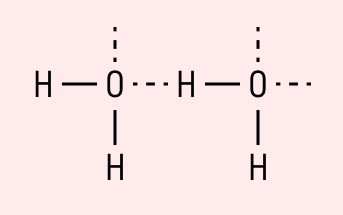
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
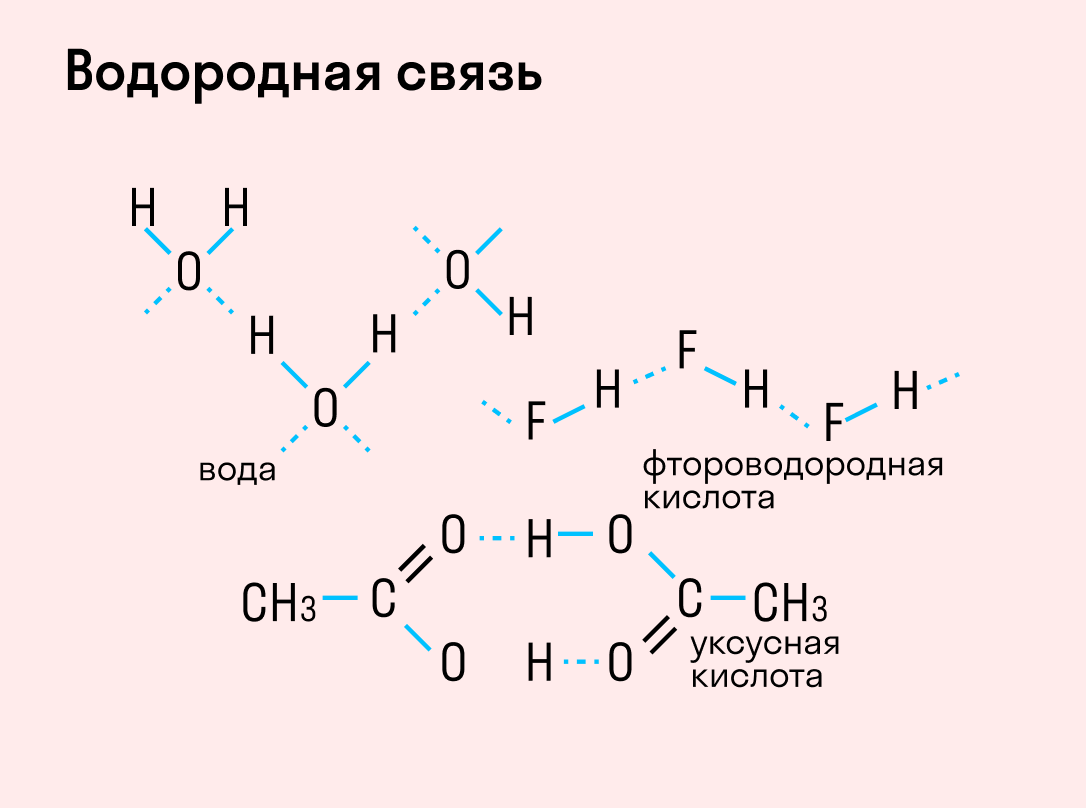
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Такое взаимодействие носит донорно-акцепторный характер. Донором электронов в данном случае выступают электроотрицательные элементы, а акцептором — водород.
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
Характеристики водородной связи:
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Определить тип химической связи в 8 классе поможет таблица.
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
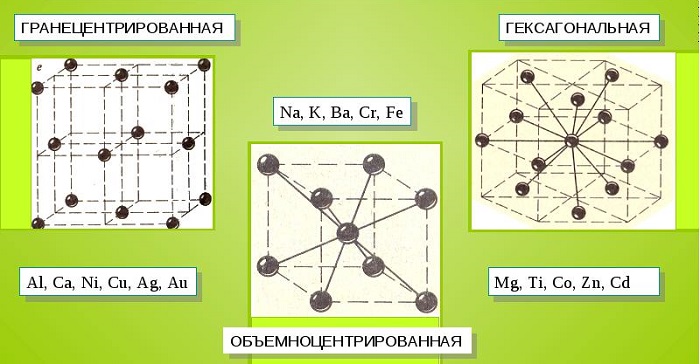
Характерные кристаллические решетки
Металлические кристаллы подразделяются на 3 основных типа:
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.
Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
Металлическая связь
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
Эти свойства связаны с существованием в металлах металлической связи:
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Образование металлической связи
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Особенности металлической связи
Отличие металлической связи от ковалентной
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
Прочность металлической связи
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.
Химия. 11 класс
§ 13. Природа и типы химической связи
Любое химическое соединение — молекулу (CO2), кристалл (NaCl), сложный ион ( ) — с точки зрения электронного строения можно представить в виде системы, состоящей из атомных ядер и связывающих их электронов. Взаимодействие, которое делает эту систему устойчивой, называют химической связью.
Химическая связь — это взаимодействие, в результате которого отдельные атомы объединяются в более сложные системы (молекулы, кристаллы, ионы и др.).
Химическая связь обусловлена действием сил притяжения и отталкивания между положительно заряженными ядрами и отрицательно заряженными электронами, то есть имеет электростатическую природу.
Электроны, которые принимают участие в образовании химических связей, называют валентными. Это электроны внешних электронных оболочек атомов.
Рассмотрим, как и почему образуется химическая связь.
Основным условием образования химической связи является понижение полной энергии системы ядер и электронов по сравнению с энергией изолированных атомов.
Уменьшение полной энергии системы ядер и электронов достигается в результате совместного использования электронов разными атомами. В зависимости от того, как в результате распределена электронная плотность, различают три типа химической связи: ковалентную, ионную и металлическую.
Механизмы образования этих связей вы уже рассматривали при изучении химии в 8–10-х классах. Здесь мы дополним понятие химической связи представлениями о состоянии электронов в атоме.
Между чем возникает металлическая связь
Ключевые слова конспекта: Металлическая химическая связь: ион-атомы и электронный газ. Физические свойства металлов и их применение на основе этих свойств. Чёрные и цветные металлы. Сплавы.
Подавляющее число химических элементов периодической системы Д. И. Менделеева относятся к металлам:
Анализ положения металлов в периодической системе и учёт особенностей строения их атомов позволяет сделать следующие выводы: атомы этих элементов содержат небольшое число электронов на внешнем слое (1—3), имеют сравнительно большой радиус атома и много свободных орбиталей, которые могут легко перекрываться. Поэтому валентные электроны свободно перемещаются от одних атомов, превращая их в ионы, к другим, связывая их.
В простых веществах-металлах осуществляется бесконечный процесс превращения атомов в ионы и обратно, который можно отразить с помощью схемы:
Эти же процессы происходят и в металлических сплавах.
Металлическая связь определяет и особое кристаллическое строение металлов и сплавов — металлическую кристаллическую решётку, в узлах которой расположены ион–атомы. Обобществлённые подвижные электроны не принадлежат какому–то определённому атому и способны перемещаться по всему объёму металла. В отсутствие в нём электрического поля эти электроны хаотически движутся и сталкиваются, чаще всего с ионами кристаллической решётки. В 1900 г. немецкий физик Пауль Друде предложил называть совокупность этих электронов электронным газом. Этот электронный газ прочно соединяет, как бы склеивает ионный остов металла. При механических нагрузках или нагреве газ не допускает разрыва металлической решётки, связывая положительные ионы. Поэтому при обработке металлов изменение их формы происходит без разрушения кристаллической решётки, так как её слои легко скользят один по другому.
Металлы электропроводны, потому что под действием электрического поля валентные электроны начинают направленное движение — возникает электрический ток. Металлы — это проводники первого рода, в отличие от растворов электролитов, которые относятся к проводникам второго рода.
Мы вряд ли представляем себе жизнь без электричества, которое поступает в каждый дом, в каждую квартиру по сети электрических проводов своеобразной кровеносной системе современной технической цивилизации. Лучше всего проводят электрический ток серебро, медь, золото, алюминий. Серебро и золото — дорогие металлы. Медь также недешёвый металл. Поэтому кабели линий электропередачи (ЛЭП) делают главным образом из алюминия.
Кстати, прочная опора линии электропередачи тоже металлическая. Прочность — одно из основных свойств большинства металлов, позволяющее использовать их в качестве конструкционных материалов. Один из наиболее прочных и в то же время лёгких металлов — титан. Этот металл и сплавы на его основе — незаменимые конструкционные материалы в самолётостроении и космической технике.
Все металлы теплопроводны. Это свойство, как и нетоксичность некоторых металлов, лежит в основе их применения для производства кухонной посуды: кастрюль, сковородок, противней. Батареи центрального отопления должны быстро нагреваться поступающей в них водой и эффективно отдавать теплоту окружающему воздуху, поэтому их тоже изготавливают из металла.
Самыми теплопроводными металлами являются те, которые хорошо проводят электрический ток: серебро, медь, золото, алюминий.
Металлы обладают металлическим блеском. Блестят они потому, что отражают лучи света, а не пропускают их, как стекло, и не поглощают, как сажа. Окраска большинства металлов серебристо–белая, так как они в равной степени отражают все лучи видимой части спектра. Золото и медь частично поглощают коротковолновое излучение, поэтому обладают окраской от жёлтой до красно–коричневой. Самые блестящие металлы — ртуть, палладий, серебро и алюминий, поэтому отражатели прожекторов, автомобильных фар и фонарей покрывают тонким слоем палладия, алюминия или хрома. Почти все измельчённые в порошок металлы, кроме магния и алюминия, теряют блеск и превращаются в серые или чёрные порошки.
Пластичность металлов в сочетании с блеском делают их незаменимым материалом для художников. Самым пластичным по праву считается золото. Из одного грамма этого металла можно вытянуть нить длиной 2 км или раскатать фольгу толщиной 0,00008 мм. Такой тонкий листочек даже в руки взять невозможно: он сразу прилипнет к коже. Это свойство находит своё применение: тонкими золотыми листочками покрывают купола церквей, скульптуры, деревянную резьбу.
Современная техника и промышленность нуждаются в металлических материалах с самыми разнообразными и трудно сочетаемыми свойствами, которых нет у чистых металлов. На помощь технологам приходят сплавы.
| Сплавы — это металлические материалы, получаемые из расплавов двух или более веществ, одно из которых — металл. |
Например, из железосодержащих руд выплавляют чугун — сплав железа с углеродом, в котором массовая доля углерода составляет от 2 до 4%. Чугун — хрупкий материал, изделия из которого получают не ковкой, а литьём, как из пластмасс. Из чугуна изготавливают различные массивные конструкции: корпуса станков, турбин, детали двигателей, ограждения. Настоящее произведение искусства — ограды мостов и решётки парков Санкт–Петербурга.
Если из чугуна удалить излишек углерода и довести его содержание до 1—2%, получится сталь. В отличие от чугуна, она пластична, ковка, имеет гладкую блестящую поверхность. Сталь можно прокатать в тонкий лист или железнодорожный рельс, вытянуть в проволоку, согнуть уголком.
Для придания стали специфических свойств в неё добавляют другие металлы — так называемые легирующие добавки. Используя их, выплавляют сотни разных сортов стали. Нержавеющая сталь содержит хром и никель. В жаропрочную сталь добавляют вольфрам. Молибден придаёт стали твёрдость. Алюминий добавляют в сталь, идущую на изготовление кузовов автомобилей.
| Железо и сплавы на его основе называют чёрными металлами, а соответствующую отрасль промышленности — чёрной металлургией. Все остальные металлы и сплавы называют цветными. |
Сплав меди с оловом, бронза, обладает хорошими литейными свойствами. Из неё отливают не только колокола и художественные изделия, но и подшипники, вентили, клапаны и детали машин.
Сплав меди с цинком называют латунью. Она прочнее меди, устойчива к атмосферной коррозии. Из латуни изготавливают трубки, шестерни, армейские знаки отличия, химическое оборудование.
Нарядные столовые приборы, посуду, недорогие украшения изготавливают из мельхиора — сплава меди с никелем. Несмотря на то, что никеля в этом сплаве всего 20%, мельхиор лишён медного цвета и по внешнему виду напоминает серебро.
Сплав алюминия с медью, магнием и марганцем называют дуралюмин (дюраль) и используют в самолёто-, судо- и машиностроении.
Конспект урока по химии «Металлическая химическая связь». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие: