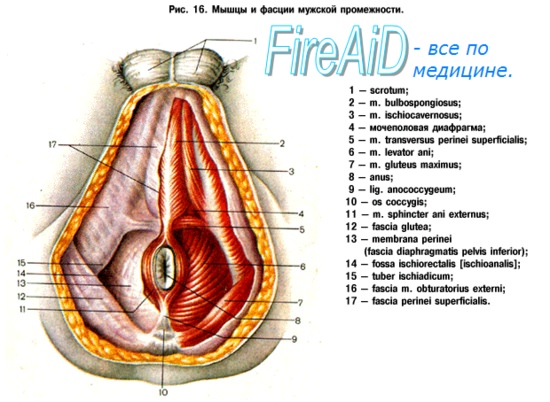
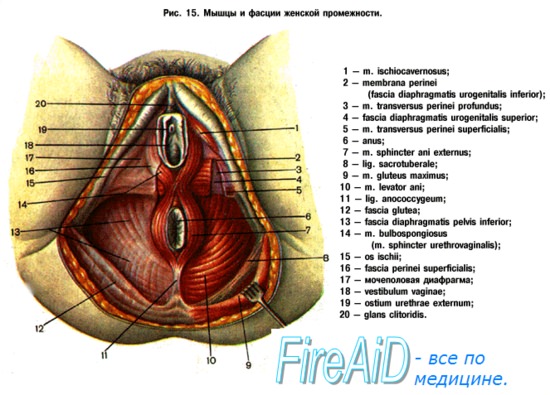
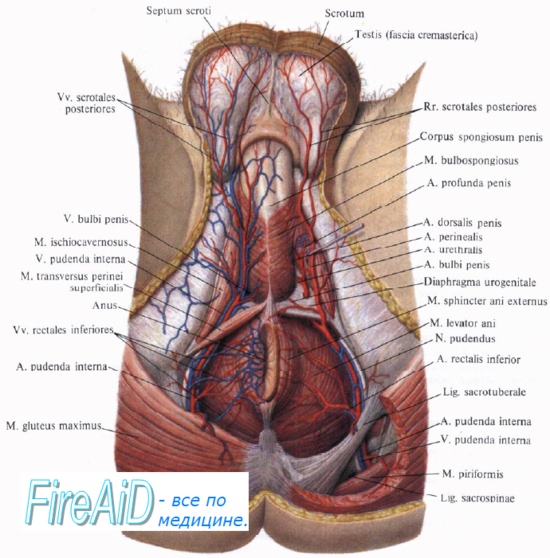
Мезоректальная фасция что это
Мезоректальная фасция что это
Несколько мышечных и фасциальных пространств разделяют полость таза на истинные или условные отделы и пространства. Эти пространства заполнены жировой или рыхлой соединительной тканью, некоторые содержат кровеносные сосуды, нервы, элементы лимфатической системы.
Наличие тазовых пространств определяет пути распространения патологических процессов (например, абсцессов), а фасциальные перегородки являются важными барьерами пространства, в пределах которого происходит первичное распространение опухолей. С хирургической точки зрения эти анатомические структуры определяют ход анатомической диссекции при тотальной мезоректумэктомии.
Анатомические структуры:
• Фасция Вальдеера.
• Фасция Денонвилье.
• Постанальное пространство (Кортни).
• Супра- и инфралеваторные пространства.
Анатомические особенности фасций и пространств таза
1. Сзади: внутритазовая фасция с двумя компонентами:
а. Висцеральный листок (собственная фасция прямой кишки): тонкий прозрачный листок окружающий мезоректум.
б. Париетальный листок (пресакральная фасция): покрывающий крестец и пресакральные вены.
в. Рыхлая соединительная ткань между передней поверхностью париетальной фасции и задней поверхностью висцерального листка; при слиянии двух листков в нескольких сантиметрах выше копчика формируется фасция Вальдеера.
2. Латерально: фасция прерывается вхождением гипогастрального и тазовых нервов и сплетений, а также гипогастральными сосудами на медиальных поверхностях боковых стенок таза.
3. Кпереди от прямой кишки: фасция Денонвилье расположена между мочевым пузырем и прямой кишкой: скорее условная, чем реально существующая фасциальная структура => отделяет переднюю поверхность прямой кишки ниже тазовой брюшины от мочевого пузыря, предстательной железы и семенных пузырьков или влагалища; содержит нейроваскулярные пучки, отходящие от тазового сплетения и внутренних подвздошных сосудов.
4. Мышца, поднимающая задний проход (леватор): разделяет таз на:
а. Супралеваторное пространство: между брюшиной и тазовой диафрагмой.
б. Инфралеваторное (экстрапельвикальное) пространство: ишиоанальные ямки, перианальное, межсфинктерное, подслизистое, поверхностное и глубокое позадианальные пространства.
Внимание: термин «ишиоректальный» устарел, поскольку прямая кишка не является границей вышеописанных структур!
в. Эти два отдела почти полностью изолированы друг от друга, за исключением сообщения супралеваторного пространства с ишиоанальным пространством через внутреннюю запирательную фасцию (медиальнее седалищной ости) => проводник супралеваторной инфекции к экстрапельвикальным пространствам.
6. Глубокое позадианальное пространство (Кортни): располагается позади анального канала и имеет билатеральное сообщение с ишиоанальными ямками => путь формирования подковообразного абсцесса. Поверхностное постанальное пространство: локализуется между анокопчиковой связкой и анокопчиковым швом.
7. Межсфинктерное пространство (пространство между внутренним и наружным анальными сфинктерами): место расположения анальных желез; в дистальном направлении сообщается с перианальным пространством.
8. Перианальное пространство: окружает нижнюю часть анального канала и продолжается латерально в подкожную жировую клетчатку ягодиц; содержит геморроидальное сплетение: наружное смешанное внутреннее геморроидальное сплетение; также содержит наиболее дистальную часть наружного и внутреннего анальных сфинктеров и волокна мышцы, сморщивающей кожу ануса, которые в виде септ разделяют перианальное пространство на компактные и неэластичные подпространства.
9. Подслизистое пространство: между внутренним анальным сфинктером и слизистой прямой кишки на уровне зубчатой линии, продолжается в подслизистый слой дистальной части прямой кишки: содержит внутреннее геморроидальное сплетение и мышечную пластинку слизистой.
Клиническое значение фасций и пространств таза:
• Тотальная мезоректумэктомия при раке прямой кишки: полная мобилизация прямой кишки до тазового дна с рассечением связки Вальдеера позади прямой кишки на уровне S3; диссекция кпереди с/без включения в препарат фасции Денонвилье.
• Повреждение целостности мезоректум (например, опухоль, неадекватная хирургическая техника) => контаминация опухолью операционного поля и увеличение риска рецидива.
• Повреждение пресакральной фасции => повреждение пресакральных вен с массивным кровотечением во время выделения прямой кишки.
• КТ/МРТ таза: визуализация ишиоанальной ямки имеющей вид треугольной пирамиды.
• Неэластичное перианальное пространство => из-за небольшого объема пространства такие процессы как гематома/абсцесс приводят к быстрому увеличению давления и интенсивной боли.
Учебное видео анатомии диафрагмы таза, промежности, мочеполовой диафрагмы
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Мезоректальная фасция что это
Как и многие другие опухоли, злокачественные новообразования колоректальной области подразделяются на эпителиальные, неэпителиальные (мезенхимальные и лимфомы), и вторичные образования согласно принципам классификации ВОЗ 2010 г. («Опухоли ободочной и прямой кишки», 2010). Из них, аденокарциномы, возникающие из клеток эпителия слизистой оболочки колоректальной области, составляют более 95% злокачественных опухолей ободочной кишки. Другие — редкие — типы опухолей включают в себя гастроинтестинальную стромальную опухоль (ГИСО), лимфому, нетипичную саркому и метастазы. Поскольку диагноз колоректального рака (КРР) основан на гистопатологической верификации путем колоноскопии, роль лучевых методов диагностики является вспомогательной и заключается в оценке преоперативных рисков, включая стадирование опухоли по TNM, определение поражения мезоректальной фасции с целью планирования лечения.
В некоторых случаях КРР приводит к существенным осложнениям, таким как обструкция, перфорация, ишемия, или инвагинация; в то же время эти проявления КРР могут быть идентифицированы с использованием соответствующих методов визуализации еще до колоноскопии (Kim et al.,2010а). В этой главе мы опишем стадирование опухоли по шкале TNM и оценку риска вне зависимости от стадии КРР. Будут также рассмотрены лучевые признаки других редких опухолей, таких как ГИСО, лимфома, и метастазов, которые могут быть применимы при определении характера КРР и в дифференциальной диагностике.
Во всем мире колоректальный рак (КРР) является третьей по частоте опухолью, обнаруживаемой и у мужчин, и у женщин. Факторами риска колоректального рака (КРР) являются возраст (старше 50 лет), принадлежность к мужскому полу, курение, злоупотребление алкоголем, особенности питания (употребление красного мяса, малого количества волокон и большого количества жира), ожирение, малоподвижный образ жизни, отягощенная наследственность, наличие полипов ободочной кишки, воспалительная болезнь кишечника, семейный аденоматозный полипоз (САП) и наследственный неполипозный колоректальный рак. Большинство случаев КРР являются спорадическими (80%), а остальные связаны с генными мутациями (20%) (Gollub et al., 2007). Патогенез КРР: в 70% случаев происходит развитие рака из аденомы, временной промежуток, необходимый для преобразования доброкачественной аденомы в злокачественную опухоль, равняется 7-10 годам; в остальных случаях рак возникает de novo (Полипы и рак ободочной кишки, 2008).
Гистопатологически колоректальные аденокарциномы подразделяются на опухоли высокой (10%), умеренной (70%) и низкой (20%) степени дифференцировки. Больше 50% случаев КРР приходится на сигмовидную и прямую кишку. Признаки и симптомы КРР могут варьировать, и включают в себя боль в животе, гематокезию, мелену, необъяснимую железодефицитную анемию, диарею, кишечную обструкцию, нарушение ритма дефекации. Тем не менее, не существует специфических симптомов рака толстой кишки на ранних стадиях. Десятки лет назад ирригоскопия с двойным контрастированием активно применялась в качестве важного метода диагностики. Однако в наши дни роль этого исследования крайне ограничена. На КТ и МРТ колоректальный рак часто проявляется асимметричным утолщением стенки короткого сегмента кишки с неправильной (либо не измененной) поверхностью. КРР на ранних стадиях может выглядеть как полиповидное или грибовидное образование без распространения за пределы кишки. На поздних стадиях КРР определяются мягкотканные «лучи», отходящие от стенки кишки и «пронизывающие» жировую клетчатку, окружающую ободочную или прямую кишку, где также могут быть обнаружены лимфатические узлы, расположенные вдоль сосудов.
В некоторых случаях дифференциальный диагноз между доброкачественными и злокачественными причинами утолщения стенки толстой кишки может быть затруднительным. Такие изменения, как асимметрия, отсутствие гаустр, нарушение «рисунка» слоев стенки и резкий переход между утолщенной и не измененной стенкой, свидетельствуют в пользу злокачественной опухоли.
а) Стадирование по шкале TNM. Рекомендации по стадированию колоректального рака (КРР) Американского объединенного комитета по раку (АОКР) (седьмая редакция) широко используются (табл. 19.1) при планировании терапии. Пациентам, страдающим раком ободочной кишки, обычно выполняется КТ органов брюшной полости и грудной клетки для определения стадии опухоли; в случаях рака прямой кишки также выполняется эндоректальная МРТ. Клинически, стратегия лечения при раке ободочной кишки редко меняется на основании определения Т или N стадии по результатам КТ, поскольку методом выбора в лечении по поводу множества типов рака ободочной кишки является колэктомия без неоадъювантной терапии. В то же время, методы лучевой диагностики больше подходят для определения отдаленных метастазов и инвазии в любой ближайший орган.
Однако при раке прямой кишки неоадъювантная терапия с последующей тотальной мезоректумэктомией (ТМЭ) является стандартом лечения для пациентов с ограниченно распространенной опухолью (Т3 или Т4, либо с наличием метастазов в регионарных лимфоузлах); таким образом, МРТ прямой кишки перед оперативным вмешательством выполняется с целью точного определения Т и N стадии и обнаружения поражения мезоректальной фасции.
б) Определение T стадии. Точное определение Т стадии требует правильной оценки глубины опухолевой инвазии. Общая точность определения стадии Т при использовании КТ составляет 41-82%, при использовании МРТ 71-91% («Полипы и рак ободочной кишки», 2008; Kim et al., 2010b).
1. Определение стадии Т1 и Т2. На стадии Т1 опухоль поражает слизистую оболочку и подслизистую основу, но не достигает мышечной пластинки (МП). На стадии Т2 происходит инвазия опухолью мышечной пластинки, но без распространения в жировую клетчатку за пределами ободочной кишки. Тем не менее, отличить стадию Т1 от Т2 достаточно сложно, даже при использовании МРТ. На КТ опухоль на стадии Т1 выглядят как выбухающее в просвет объемное образование без видимой деформации слоев стенки ободочной кишки (Dighe et al., 2008). Опухоль на стадии Т2 выбухает в просвет кишки, характеризуется асимметричным утолщением стенки, при этом окружающая жировая клетчатка остается светлой; не определяется признаков дезинтеграции мышечного слоя (Dighe et al., 2008). При использовании МРТ частичное сохранение высокой интенсивности сигнала от подслизистого слоя ниже опухоли, дающей средний по интенсивности сигнал на Т2 взвешенных томограммах, может стать признаком, полезным для дифференциальной диагностики между опухолями Т1 и Т2 (Costa-Silva и Brown, 2013). На практике, большинству пациентов, у которых обнаруживается рак прямой кишки на стадии Т1 и Т2, выполняется тотальная мезоректумэктомия, невзирая на то, какая именно стадия была установлена. Но, в то же время, встречаются случаи, когда требуется точно дифференцировать между собой стадии Т1 и Т2.
Например, когда хирург планирует ограниченную эксцизию чрезанальным доступом, при наличии высокого риска, связанного с резекцией, либо при тяжелом общем состоянии пациента может потребоваться точное определение Т стадии. К сожалению, точно отличить друг от друга стадии Т1 и Т2 невозможно при использовании КТ, и тяжело даже при МРТ; поэтому, когда точное определение Т стадии является критичным, рекомендуется эндоскопическая ультрасонография (ЭУС). При ЭУС можно определить, что нормальная стенка прямой кишки состоит из пяти чередующихся гипо- и гиперэхогенных концентрических слоев. Первый гиперэхогенный слой представляет собой поверхность слизистой оболочкой на границе с просветом. Второй гипоэхогенный слой соответствует мышечной пластинке слизистой оболочки, третий, гиперэхогенный, соответствует подслизистой оболочке. Четвертый и пятый гипо- и гиперэхогенный слои соответственно отражают мышечную оболочку и мезоректальный жир. Более тонкое разделение стенки прямой кишки при ЭУС помогает дифференцировать рак прямой кишки на ранних стадиях. Но, в то же время, недостатком ЭУС является тот момент, что этот метод является зависимым от врача, производящего исследование; требуется время, чтобы приобрести опыт в этой диагностической процедуре.
2. Определение стадии Т3 и Т4. Для опухолей, соответствующих стадии Т3, характерна инвазия в околоободочную (околопрямокишечную) жировую клетчатку. При использовании КТ и МРТ трудно отличить опухоль Т2 стадии с десмопластической реакцией от опухоли на ранней ТЗ стадии. В подавляющем большинстве случаев тонкие спикулы обусловлены десмопластической реакцией, в то время как при распространении опухоли за пределы кишки визуализируются толстые, узловидные тяжи; либо определяется выбухание контура с широким основанием (Nougaret et al., 2013). Опухоли на стадии Т4а прорастают в поверхность висцерального листка брюшины, по-разному покрывающего различные отделы ободочной и прямой кишки. Восходящая и нисходящая ободочная кишка покрыты висцеральной брюшиной только спереди и с латеральной стороны, в то время как поперечная ободочная и сигмовидная кишка покрыты брюшиной полностью. Верхняя часть прямой кишки покрыта висцеральной брюшиной спереди и с обеих боков, в средней части прямая кишка покрыта брюшиной спереди (Nougaret et al., 2013). Опухоли на стадии Т4а можно диагностировать на основании поражения брюшины, однако отличить опухоль на стадии Т3 от опухоли на стадии Т4а, полагаясь исключительно на данные лучевой диагностики, сложно. Положительным моментом является то, что рекомендуемое лечение на стадии Т3 и Т4а аналогично.
При раке ободочной кишки выполняются различные варианты колэктомии вне зависимости от того, отнесена ли опухоль к стадии Т3 или Т4а, при раке прямой кишки в обоих случаях требуется неоадъювантная химио- и лучевая терапия. Опухоли, достигшие стадии Т4b, прорастают в соседние органы; печень, смежные отделы кишечника, селезенку, поджелудочную железу, желудок, предстательную железу, семенные пузырьки, влагалище, матку или боковую стенку таза.
Определение T стадии рака прямой кишки с инвазией в анальные сфинктеры. Редко, при дистальной локализации рака прямой кишки могут поражаться анальные сфинктеры. В таких случаях инвазия опухоли во внутренний сфинктер означает стадию 1 или 2, распространение опухоли в область между сфинктерами — стадию 3, а прорастание в наружный сфинктер или окружающие органы — стадию 4 (Nougaret et al., 2013).
в) Определение N стадии. Стадия N означает метастазы в регионарных лимфатических узлах. Общая точность при идентификации метастазов в лимфоузлах с помощью КТ находится в диапазоне между 60 и 80%. Точность МРТ при определении стадии N в целом колеблется в широких пределах от 43 до 85% (Kim et al., 2010b).
Пути лимфогенного метастазирования. Метастазирование рака ободочной кишки в лимфоузлы происходит по путям лимфооттока вдоль регионарных сосудов, распределенных в брыжейке ободочной кишки. Изначально распространение рака ободочной кишки происходит главным образом в лимфоузлы, непосредственно прилежащие к ободочной кишке, находящиеся под брюшиной, вдоль стенки кишки. Затем лимфа оттекает в околоободчные лимфатические узлы, расположенные по ходу маргинальных сосудов; сосудов, обеспечивающих регионарный кровоток (например, подвздошно-ободочной или правой ободочной артерии); они образуют промежуточную группу лимфоузлов. В конечном счете лимфа попадает в главную группу лимфоузлов в месте отхождения верхней брыжеечной артерии (McDaniel et al., 1993). При раке прямой кишки отток лимфы из ее верхних отделов происходит в краниальную сторону вдоль верхней прямокишечной артерии и нижней брыжеечной артерии. Отток лимфы от нижней части прямой кишки может осуществляться двумя путями; в краниальном направлении через верхние прямокишечные лимфатические сосуды в нижние брыжеечные лимфоузлы, а также латерально через средние прямокишечные лимфатические сосуды во внутренние подвздошные лимфоузлы (Gowdra Halappa et al., 2012).
В некоторых случаях — при раке дистальных отделов прямой кишки вблизи анальных сфинктеров — возможно лимфогенное распространение в паховые лимфоузлы. Необходимо добавить, что в большинстве случаев вторичное поражение лимфатических узлов происходит на уровне опухоли либо выше. Нисходящее метастазирование (ниже уровня опухоли, каудально) встречается редко, за исключением случаев обструкции восходящих путей лимфооттока.
Характеристика лимфатических узлов и определение N стадии. В случаях наличия метастазов в 1-3 лимфатических узлах выставляется стадия N1, при вторичном поражении четырех и большего количества лимфоузлов — N2. Каждая из стадий в свою очередь предполагает разделение на подгруппы, например, N1a или N1b, в зависимости от количества лимфоузлов с метастатическим поражением. При раке прямой кишки в качестве регионарных лимфоузлов рассматриваются мезоректальные и внутренние подвздошные, даже если внутренние подвздошные лимфоузлы расположены вне области тотальной мезоректумэктомии. При наличии метастазов в других лимфоузлах, расположенных за пределами мезоректальной области, таких как наружные подвздошные, паховые, или лимфатические узлы в области общих подвздошных сосудов, подразумевается нерегионарная лимфаденопатия, и они расцениваются как отдаленные метастазы (М).
Стандартные критерии определения метастатического поражения лимфатических узлов посредством КТ четко не определены. Наиболее часто используемым признаком является размер лимфоузла. В случаях, когда лимфатический узел имеет размер больше 1 см в поперечнике, либо обнаруживается группа из трех и большего количества лимфоузлов, расположенных рядом, даже если размер любого из них меньше 1 см, предполагается их метастатическое поражение (Dighe et al., 2008). Но, в то же время, более чем в 50% случаев лимфатические узлы размером менее 5 мм оказывались вторично измененными, вследствие чего критерий размера нельзя считать достаточным сам по себе. При МРТ прямой кишки параметрами, позволяющими оценить лимфатические узлы на предмет метастатического поражения, являются характеристики краев, формы, внутренней однородности, а также размер (Kim et al., 2004). Критериями, позволяющими предположить метастатическое поражение лимфоузла, являются нечеткость или «лучистость» контура, внутренняя неоднородность интенсивности сигнала, а также округлая форма. Лимфоузлы правильной формы, с ровными краями и однородными сигнальными характеристиками расцениваются как доброкачественные. Размер лимфатического узла также является предиктивным критерием, который, тем не менее, однозначно не предполагает его метастатическое поражение (Beets-Tan et al., 2013).
г) Определение М стадии рака толстой кишки. Стадия М используется для оценки выраженности отдаленного метастазирования. КРР может метастазировать лимфогенным и гематогенным путями, путем диссеминации в полости брюшины; возможен также контактный путь метастазирования (непосредственная инвазия). Наличие отдаленных метастазов означает стадию М1, их отсутствие — МО. Стадия М1 в свою очередь подразделяется М1а и M1b. Стадия М1а означает, что метастазы имеются только в одном органе, в то время как M1b означает наличие метастазов в брюшине или вторичное поражение более чем одного органа. Органами, в которые чаще всего происходит отдаленное метастазирование, является печень, а затем легкие. Поскольку венозный отток от ободочной и прямой кишки осуществляется типично — через воротную вену, чаще всего гематогенные метастазы обнаруживаются в печени, затем следуют легкие, может также происходить метастатическое поражение головного мозга. Тем не менее, при раке дистальных отделов прямой кишки метастазы могут напрямую поражать легкие, минуя печень, поскольку средняя и нижняя прямокишечная вена впадают непосредственно в нижнюю полую вену (Gordon и Nivatvongs, 2007). В последнее время хирургическая резекция, если является возможной, становится методом выбора в лечении пациентов с метастазами КРР в печени.
Поэтому, в дополнение к точному обнаружению метастазов, рентгенологи должны учитывать возможность выполнения хирургического вмешательства, четко описывать локализацию, количество и размер вторичных очагов в печени при использовании методов диагностики, таких как МРТ с контрастным усилением печени препаратами гадоксетовой кислоты.
д) Циркулярный край резекции. Мезоректальная фасция, образованная висцеральным листком внутригазовой фасции, отражает уровень разреза при мезоректумэктомии, т. е. циркулярный край резекции (ЦКР). Эта фасция часто визуализируется на аксиальных и корональных Т2 взвешенных томограммах в виде тонкой пластинки с низкой интенсивностью сигнала. Поражение МРФ является независимым негативным прогностическим фактором. В некотором количестве исследований было показано, что инвазия МРФ тесно связана с рецидивом опухоли на ограниченном участке и низким уровнем выживаемости. Положительный ЦКР на МРТ прямой кишки означает, что наименьшее, измеренное по прямой расстояние между наиболее удаленным от центра краем зоны опухолевой инфильтрации и МРФ, составляет 1 мм и меньше. При использовании значения 1 мм в качестве оптимального порогового критерия оценки положительного ЦКР, специфичность МРТ в классификации ЦКР достигает 92%, а прогностическая ценность отрицательного результата 94% (Beets-Tan и Beets, 2011). Кроме того, потенциально угрожающий ЦКР определяется как расстояние 1-2 мм от края. Типы опухолевой инфильтрации, которые оцениваются при измерении ЦКР, включают в себя мезоректальное распространение опухоли, опухолевые депозиты, метастатическое поражение мезоректальных лимфоузлов, а также инвазию экстрамуральных сосудов (ИЭМС) (Nougaret et al., 2013). Мета-анализ применения МРТ для определения поражения ЦКР показал, что чувствительность метода колеблется в пределах 60-88%, а специфичность 73-100% (Gowdra Halappa et al., 2012).
е) Инвазия экстрамуральных сосудов. Прорастание опухоли в сосуды, располагающиеся вне стенки кишки, также является негативным прогностическим фактором, независимо от стадии TNM. ИЭМС определяется как состояние, при котором происходит инвазия опухоли в крупные сосуды, расположенные в мезоректальной области. Наличие ИЭМС связано с местным рецидивом, метастазированием, а также низким уровнем выживаемости. Такой тип инвазии может определяться на МР-томограммах прямой кишки наличием сигнала, имеющего интенсивность, характерную для опухоли, в сосуде; поражением сосудов и распространением опухоли через сосудистую стенку и вне ее с деформацией края сосуда (Nougaret et al., 2013). Прогностическая ценность положительного результата МРТ для ИЭМС подсчитана и характеризуется чувствительностью 62% и специфичностью 88% (Dewhurst и Mortele, 2013).
ж) Повторное стадирование после неоадъювантной химиолучевой терапии. Неоадъювантная ХЛТ с последующей тотальной ме-зоректумэктомией является стандартом лечения пациентов с местнораспространенным раком прямой кишки (ТЗ, Т4 или с метастазами в лимфоузлах). По результатам многих исследований использование неоадъювантной ХЛТ приводило к уменьшению частоты возникновения местного рецидива опухоли, а также к увеличению безрецидивной выживаемости и сохранению сфинктеров (Sauer et al., 2004). Приблизительно у 10-20% таких пациентов достигается полный ответ (CR) подтвержденный при гистопатологическом исследовании. Несмотря на то, что МРТ, выполняемая перед оперативным вмешательством без неоадъювантной ХЛТ, характеризуется относительно высокой точностью в определении Т стадии и оценке поражения циркулярного края резекции, точность при использовании методов визуализации при раке после лучевой терапии остается неудовлетворительной. Сообщается, что общая точность МРТ составляет приблизительно 50% при определении Т стадии рака после лучевой терапии, и около 66% при определении вовлечения ЦКР; снижение точности обусловлено сложностями дифференциальной диагностики лучевого фиброза и остаточной жизнеспособной опухоли (Kim et al., 2010b; Nougaret et al., 2013). Согласно отчету исследовательской группы MERCURY (The Magnetic Resonance Imaging in Rectal Cancer European Equivalence Study) для оценки степени опухолевой регрессии рака прямой кишки использовалась традиционная МРТ высокого разрешения (Costa-Silva и Brown, 2013; Patel et al., 2011).
Анализ осуществлялся на основании соизмерения пропорциональности сигнала различной интенсивности при использовании Т2 ВИ по сравнению с МРТ, выполненной до химиолучевой терапии. В итоге было сделано предположение, что области сигнала низкой интенсивности соответствуют зонам фиброза, в то время как области среднеинтенсивного и гиперинтенсивного сигнала отражают участки остаточной жизнеспособной опухоли. Между тем, классификация, приведенная Dworak et al., широко используется при гистопатологической оценке степени опухолевой регрессии при раке прямой кишки (Dworak et al., 1997). Гистопатологическая градация степени опухолевой регрессии осуществляется следующим образом: степень 0 (нет регрессии) означает отсутствие регрессии; степень 1 (минимальная регрессия) означает наличие доминирующего объемного образования с явным фиброзом и (или) васкулопатией; степень 2 (умеренная регрессия) означает преимущественные фиброзные изменения с малым количеством опухолевых клеток или групп клеток, которые легко обнаружить; степень 3 (практически полная регрессия) подразумевает крайне малое количество опухолевых клеток, которые с трудом обнаруживаются при микроскопии, в фиброзной ткани, с наличием слизистого компонента либо без такового; степень 4 (полная регрессия) означает отсутствие клеток опухоли, образование состоит только из фиброзной ткани.
Кроме того, во многих исследованиях были получены многообещающие результаты при использовании диффузионно-взвешенной томографии (DWI) после неоадъювантной ХЛТ для прогнозирования полного ответа (CR); другие исследования предполагают, что DWI может использоваться для прогнозирования поражения мезоректальной фасции или местного рецидива опухоли (Kim et al., 2009; Park et al., 2011; Lambregts et al., 2011). Дополнительно может использоваться качественный анализ с использованием DWI и количественная оценка измеряемых коэффициентов диффузии (ADC) (Kim et al., 2011). В основе этих исследований лежит представление, что остаточную ткань опухоли можно отличить от постлучевого фиброза при DWI с высоким значением b-фактора, поскольку резидуальная опухоль характеризуется относительно высокой целлюлярно-стью и меньшим интерстициальным пространством по сравнению с фиброзной тканью. Однако использование DWI в качестве рутинной последовательности остается спорным моментом и требует дальнейшего подтверждения. В рекомендациях, опубликованных после конференции европейского сообщества радиологов по вопросам лучевой диагностики органов желудочно-кишечного тракта и брюшной полости (European Society of Gastrointestinal and Abdominal Radiology (ESGAR) в 2012 г., однозначно говорится о трудности реальной дифференциальной диагностики полного ответа (CR) и резидуальной опухоли при использовании как Т2 ВИ, так и DWI (Curvo-Semedo et al., 2011). По результатам исследований сообщается, что уменьшение объема опухоли после неоадъювантной ХЛТ соотносится с уровнем ответа опухоли при гистопатологическом исследовании; имеются также предположения, что уменьшение объема опухоли на 70-75% и больше после неоадъювантной ХЛТ означает хороший или полный ответ (Nougaret et al., 2013).
Также, другие исследования показали, что волюметрический анализ на основании DWI после ХЛТ превосходит Т2 ВИ либо качественный или количественный анализ DWI при прогнозировании полного ответа (На et al., 2013).
После неоадъювантной ХЛТ вторично измененные лимфоузлы могут исчезнуть либо показать снижение стадии N. Повторное стадирование поражения лимфоузлов после лучевой терапии может быть сложным, поскольку охарактеризовать край, форму, внутреннюю неоднородность, а также размер более мелких лимфоузлов может быть невозможно; кроме того, затруднять повторное стадирование могут постлучевые изменения (van der Paardt et al., 2013). Тем не менее, интересно, что исследования показали большую точность при повторном стадировании поражения лимфоузлов после облучения по сравнению с МРТ до проведения ХЛТ. Эти результаты можно объяснить меньшей распространенностью и относительно большим размером лимфатических узлов, в которых не произошло уничтожения клеток опухоли после неоадъювантной ХЛТ. Точность и прогностическая ценность отрицательного результата при повторном определении стадии N, согласно докладам, составляет 67-90% и 83-94% соответственно (Beets-Tan, 2013).
з) Частые осложнения, обусловленные колоректальным раком. КРР может сопровождаться различными осложнениями, например, обструкцией, инвагинацией, ишемией, перфорацией, формированием фистулы, открывающейся в ближайшие органы; кроме того, осложнения могут маскировать первичную опухоль. Самым частым осложнением, связанным с раком ободочной кишки, является обструкция. Злокачественные опухоли ободочной кишки, расположенные слева, чаще приводят к обструкции просвета, чем при правосторонней локализации опухоли, поскольку диаметр ободочной кишки слева меньше (Kim et al., 2010а). Частота возникновения обструкции кишечника, связанной с раком ободочной кишки, составляет 8-29%. Перфорация может возникать в области первичной опухоли вследствие некроза или в проксимальной части опухоли из-за повышения давления в просвете. Сообщается, что частота возникновения перфорации и возникновения абсцесса, связанных с раком ободочной кишки, составляет 2,5-10% и 0,3-4% соответственно. (Kim et al., 2010а). Несмотря на то, что инвагинация очень редко возникает у взрослых пациентов, приблизительно в 65% случаев она связана с новообразованиями. На КТ признаком инвагинации является визуализация одной части кишки (либо кишки с брыжеечной жировой клетчаткой) внутри другой. Рак ободочной кишки, провоцирующий возникновение инвагинации, может быть обнаружен в конечных отделах дистального инвагината, и приблизительно в 30% случаев является неотличимым от отечной кишки.
е) Другие редкие типы колоректального рака (КРР). В соответствии с принципами классификации ВОЗ от 2010 г., выделяется несколько гистологических вариантов рака ободочной и прямой кишки. Из них муцинозная аденокарцинома и перстневидноклеточный рак ободочной и прямой кишки составляют 5-15% и 0,6% (соответственно) от всех вариантов первичного КРР. Диагноз муцинозной аденокарциномы при гистопатологическом исследовании устанавливается при наличии внеклеточно расположенного муцина, занимающего более чем 50% объема опухоли, в то время как перстневидноклеточный рак определяется, когда более 50% клеток опухоли являются перстневидноклеточныйыми («Опухоли ободочной и прямой кишки», 2010). Другие типы КРР, такие как мелкоклеточный, плоскоклеточный, железисто-плоскоклеточный, медуллярный, недифференцированный рак, крайне редки. При КТ важными признаками, позволяющими установить гистологический тип опухоли, особенно, муцинозной аденокарциномы, являются мелкие внутриопухолевые обызвествления и включения муцина низкой плотности («Полипы и рак ободочной кишки», 2008). Примечательно, что на Т2 взвешенных и диффузионно взвешенных томограммах муцинозная аденокарцинома характеризуется большей интенсивностью сигнала, чем типичная колоректальная аденокарцинома, дающая средний по интенсивности сигнал (Kim et al., 2010b). В дополнение, метастазы муцинозной аденокарциномы колоректальной области в печени могут визуализироваться в виде объемных образований с высокой интенсивностью сигнала на Т2 взвешенных томограммах, вследствие чего ошибочно принимаются за кисты.
1. Поскольку диагноз КРР основан на гистопатологическом подтверждении посредством колоноскопии, роль методов лучевой диагностики является вспомогательной и состоит в оценке риска перед оперативным вмешательством, в т.ч. в определении стадии TNM и оценке поражения мезоректальной фасции с целью определения плана лечения.
2. При раке прямой кишки неоадъювантная ХЛТ с последующей тотальной мезоректумэктомией является стандартом лечения пациентов с местнораспространенными опухолями (Т3, Т4 или с наличием метастазов в регионарных лимфоузлах); МРТ прямой кишки перед оперативным вмешательством рекомендуется с целью точного определения стадии (местного распространения) и обнаружения поражения МРФ.
3. Поскольку точно дифференцировать опухоль на стадии Т1 и Т2 при использовании КТ невозможно, и затруднительно даже при применении МРТ, в случаях, когда это является критичным при планировании лечения, рекомендуется ЭУС.
4. На КТ и МРТ сложно отличить друг друга опухоли на стадии Т2 с наличием десмопластической реакции и рак на ранней Т3 стадии. В большинстве случаев наличие тонких спикул обусловлено десмопластической реакцией, в то время как толстые, узловидные тяжи или выбухание контура на широком основании являются основанием для предположения распространения опухоли за пределы стенки.
5. Предиктивные критерии для определения метастазов в лимфатических узлах включают в себя размытые или лучистые края, неоднородность интенсивности сигнала от внутренней части узла, а также округлую форму. Лимфоузлы, не отличающиеся друг от друга, с ровными краями, с однородной интенсивностью сигнала рассматриваются как доброкачественные. И, хотя размер лимфоузла также является прогностическим критерием, он не является признаком, однозначно свидетельствующим о его метастатическом поражении.
6. В случаях, когда наименьшее измеренное по прямой расстояние между самым наружным краем опухолевой инфильтрации и МРФ составляет 1 мм и меньше, предполагается позитивный ЦКР. Если это расстояние составляет 1-2 мм, ЦКР считается угрожающим.
7. Колоректальный рак (КРР) может сопровождаться различными осложнениями, например, обструкцией, инвагинацией, ишемией, перфорацией и формированием фистулы с прилежащими органами; осложнения могут маскировать первичную опухоль.
8. По мере увеличения размеров ГИСО чаще наблюдается тенденция к сохранению ровных краев и отодвиганию расположенных поблизости петель кишки или сосудов, чем инвазия и десмопластическая реакция, и эти изменения могут быть полезны в дифференциальной диагностике ГИСО и аденокарцином.
9. Лучевые признаки лимфомы ободочной и прямой кишки могут сочетаться с признаками других заболеваний колоректальной области. Тем не менее, специфические лучевые признаки, такие как однородное контрастное усиление, аневризматическая дилятация, не сопровождающаяся обструкцией, распространенная лимфаденопатия, а также относительно четкая демаркация очага поражения с сохранением жировой клетчатки могут быть полезны в диагностике местно ограниченных форм лимфомы ободочной и прямой кишки, особенно диффузной В-крупноклеточной лимфомы.
з) Список использованной литературы:
Редактор: Искандер Милевски. Дата публикации: 26.5.2019