Мг экв дм3 это что
Химические показатели качества воды
Характеристика основных показателей качества воды
К основным показателям качества относятся показатели, величина которых существенно, влияет на свойства подготовленной воды. Отклонения от заданных норм этих показателей ведут к образованию шлама, накипи и коррозии в котлах.
Общая жесткость, мг-экв/дм 3
Общей жесткостью воды называют сумму молярных концентраций эквивалентов ионов кальция и магния в воде. Эти элементы в природных условиях попадают в воду вследствие вымывания из карбонатных минералов и в результате биохимических процессов, происходящих в увлажненных слоях почв. Соли кальция и магния в отличие от других солей имеют обратную растворимость, а, именно, с повышением температуры воды уменьшается их растворимость, и при температуре близкой к кипению воды соли кальция и магния имеют свойство выпадать в осадок и прикипать к поверхности труб.
Щелочность, мг-экв/дм 3
Щелочность воды определяется суммой содержащихся в воде гидроксильных ионов и анионов угольной кислоты. Различают гидрокарбонатную, карбонатную и гидратную щелочность, сумма которых составляет общую щелочность.
Расход кислоты на титрование до значения рН 8,3 ед. (до изменения окраски по фенолфталеину с малиновой на бесцветную) выражает щелочность воды по фенолфталеину, расход кислоты на титрование до значения рН 4,5 ед. (до изменения окраски по метилоранжу или смешанному индикатору) совместно с предыдущим титрованием выражает общую щелочность.
Щелочность по фенолфталеину – это косвенный показатель присутствия или отсутствия свободной углекислоты: если есть щелочность по фенолфталеину, значит углекислота отсутствует, а рН выше 8,3ед.
Карбонатный индекс (мг-экв/дм 3 ) 2
Карбонатным индексом называется предельное произведение общей щелочности и кальциевой жесткости, выше которого протекает карбонатное накипеобразование с интенсивностью более 0,1 г/м 2 ×ч.
Карбонатный индекс (Ик) рассчитывается по формуле: Ик = Щ×ЖСа, (мг-экв/дм 3 ) 2
ЖСа – кальциевая жесткость воды, мг-экв/дм 3
Реагентная обработка подпиточной и сетевой воды комплексонатами наиболее эффективна при карбонатном индексе не более 8 (мг-экв/дм 3 ) 2 .
Мутность воды обусловлена содержанием взвешенных веществ в воде мелкодисперсных примесей нерастворимых или коллоидных частиц различного происхождения.
Мутность воды обуславливает и некоторые другие характеристики воды такие как:
Прозрачность по шрифту, см
Прозрачность, величина обратная мутности и содержанию взвешенных веществ, характеризует наличие в воде частиц песка, глины, ила, планктона, которые способствуют образованию шлама и отложений в котлах. Определение прозрачности по шрифту можно заменить на определение прозрачности по кольцу, как более удобное в эксплуатации.
Низкая прозрачность воды свидетельствует о присутствии шлама в системе и является основанием для назначения продувки котлов, грязевиков, гидропневмопромывки трубопроводов.
Взвешенные вещества – это нерастворимые твердые примеси различной степени дисперсности разнообразные по своему составу. Их обычно подразделяют на органические и минеральные. К первым относятся частицы гумуса, остатки растений и животных. Минеральные вещества представлены песком, тонкой глинистой взвесью, частичками минералов. Взвешенные вещества способствуют образованию шлама и отложений в котле.
Содержание соединений железа (в пересчете на Fe), мг/дм 3
Железо в природных водах встречается в виде органических и неорганических соединений, находящихся в коллоидном состоянии, или в виде тонкодисперсных взвесей (органокомплексы железа, гидроксиды окисного и закисного железа, сульфиды и т.д.) В поверхностных водах железо, обычно в окисной форме, содержится главным образом в органических комплексах (гуматы), а также в виде коллоидных и тонкодисперсных взвесей. В подземных водах при отсутствии растворенного кислорода железо преимущественно находится в виде двухвалентных ионов.
Железо способствует образованию шлама и отложений в котле. Двухвалентное железо способствует образованию и развитию коррозии трубопроводов.
Значение рН, единицы рН
При рН менее 8,3 ед. в воде присутствует углекислота, повышающая агрессивность воды, что способствует коррозии. При рН=8,3 ед. и более углекислота отсутствует. Значение рН более 8,5 – 9 ед. способствует образованию кальциевых отложений, поэтому допускается только при подпитке системы теплоснабжения химически очищенной водой (жесткость 0,1 – 0,5 мг-экв/дм 3 ).
Сухой остаток, солесодержание, мг/дм 3
Сухой остаток характеризует содержание в воде нелетучих растворенных веществ (главным образом минералов и органических веществ, температура кипения которых превышает 105-110°С). Солесодержание дополнительно к сухому остатку включает в себя летучие растворенные вещества.
Для природной воды величина сухого остатка равна сумме массовых концентраций анионов и катионов.
Удельная электропроводимость, мкСм/см
Содержание кислорода, мкг/дм 3
Кислород относится к агрессивным газам, которые являются агентами коррозии трубопроводов и оборудования.
Содержание углекислоты, мг/дм 3
Если количество свободной углекислоты в воде больше ее равновесной концентрации, то избыток СО2 называют агрессивной углекислотой, вызывающей коррозию трубопроводов и оборудования.
Содержание нефтепродуктов, мг/дм 3
Нефтепродукты это неполярные и малополярные углеводороды, составляющие главную и наиболее характерную часть нефти и продуктов ее переработки. По растворимости нефтепродуктов в воде различают три вида:
Нефтепродукты способствуют образованию маслянистой пленки на поверхностях нагрева, которая значительно увеличивает термическое сопротивление металла.
Содержание соединений кремния (в пересчете на SiO2), мг/дм 3
Содержание соединений кремния в водах обусловлено присутствием в грунте кварца и алюмосиликатных минералов (например, глины). Кремний способствует образованию твердых отложений в котле.
Содержание хлоридов, мг/дм 3
Источником хлоридов в исходной воде являются осадочные породы и продукты выветривания магматических пород. В химически очищенной воде повышение содержания хлоридов может быть обусловлено попаданием продуктов регенерации (NaCl, CaCl2, MgCl2).
Содержание хлоридов выше 50мг/дм 3 делает воду агрессивной: разрушает карбонатную пленку, усиливает эффект кислородной и углекислотной коррозии.
Содержание сульфатов, мг/дм 3
Сульфат-ионы являются важнейшим компонентом химического состава поверхностных вод. В маломинерализованных водах сульфаты находятся преимущественно в ионной форме. При увеличении минерализации они склонны к образованию ассоциированных нейтральных ионных пар типа CaSO4, MgSO4.
В поверхностные воды сульфаты поступают главным образом за счет процессов химического выветривания и растворения серосодержащих минералов, в основном гипса и ангидрита, а также окисления сульфидных минералов и серы.
При химическом связывании кислорода сульфитом натрия содержание сульфатов в обработанной воде увеличивается.
Сульфат-ионы способствуют как коррозионным процессам, так и накипеобразованию.
Окисляемость, мг/дм 3
Содержание полифосфатов, мг/дм 3
Полифосфаты являются основным рабочим веществом комплексонатов – реагентов, применяемых для стабилизационной обработки сетевой воды. Контроль содержания полифосфатов необходим для своевременной корректировки режима дозирования реагента.
Недостаток реагента в сетевой воде снижает эффективность обработки, что приводит к образованию отложений. Избыток реагента может привести к вымыванию загрязнений из трубопроводов и, соответственно, к снижению прозрачности, увеличению содержания железа в сетевой воде, а также к образованию «вторичных» фосфатно-кальциевых отложений.

Схему проезда, а также другую информацию о том как с нами связаться вы можете получить на странице «контакты»
Звоните, будем рады ответить на Ваши вопросы!
ООО «Воды Урала» г. Екатеринбург, ул. Парниковая, д.10, к.121.
Телефон (343) 306-89-09, факс (343) 368-69-34
Пользуясь сайтом, вы соглашаетесь с политикой конфиденциальности и даете согласие на обработку Ваших персональных данных
Определение жесткости воды из крана и методы ее смягчения
Жесткость воды – совокупная величина химических и физических качеств воды, которые связаны с содержанием в ней растворенных солей и щелочных металлов, преимущественно кальция и магния. Это так называемые «соли жесткости». Консультанты сайта «Сантехник Портал» помогут вам разобраться, как определить жесткость воды в домашних условиях и умягчить ее, если ее показатели зашкаливают.
Откуда берется жесткость и мягкость?
Несмотря на простую химическую формулу H2O, на самом деле, это очень сложное вещество природного происхождения с большим количеством микроэлементов. В любой органике есть водная основа с различной степенью жесткости. Что означит этот показатель?
Даже на ощупь можно определить, в какой жидкости были постираны вещи. Ткани, очищенные в мягкой среде, более пышные, мягкие, а в жесткой – грубые и тонкие на ощупь. Это объясняется тем, что ткани способны аккумулировать ионы минеральных элементов.
Источниками кальция (Ca2+), магния (Mg2+) и других щелочных металлов, являются естественные месторождения известняка, доломитов и гипса. Ионы данных микроэлементов приникают в жидкость в следствии реакции диоксида углерода с минералами, а также в результате процесса химического разложения горных пород. Поставщиком данных частиц служат также микробиологические процессы, происходящие в почве в месте водосбора.
В основном в маломинерализованных жидких средах превалирует жесткость на базе ионов кальция, но в редких случаях преобладает ионизация магния. С повышением уровня минерализации воды процент ионов кальция стремительно снижается и редко превосходит 1 г/л. Содержание же ионов магния в высокоминерализованной среде может досягать 5-71 г/л, а в соленых озерах – 10-20 г/л.
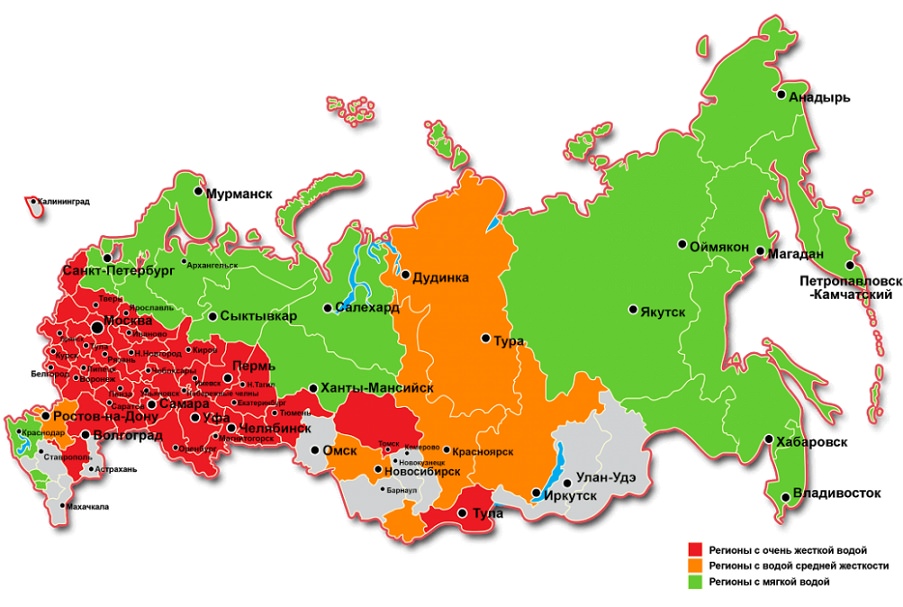
Жесткость поверхностных вод, в основном, меньше жесткости подземных сред. Жесткость поверхностных вод склонна к значительным сезонным колебаниям, достигая высшей точки в конце зимы и низшей в стадии половодья, когда тщательно разбавляется мягкой дождевой и талой жидкостью. Морская и океанская среды обладают очень высокой степенью жесткости – 90-300 и более мг-экв/дм3.
В чем измеряется жесткость?
С 2014 года в Российской Федерации введен межгосударственный стандарт ГОСТ 31865-2012 «Вода. Единица жесткости». Согласно обновленному ГОСТу, единицы измерения жесткости воды теперь выражаются в градусах жесткости (°Ж).
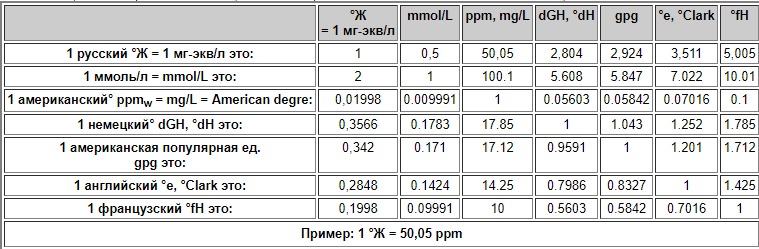
1 °Ж означает, что концентрация щелочноземельного элемента равна ½ его миллимоля на литр (1 °Ж = 1 мг-экв/л). В различных странах применяются разные внесистемные единицы — градусы жёсткости.
Перевод единиц и градусов жесткости воды в пересчете по кальцию разных систем измерения:
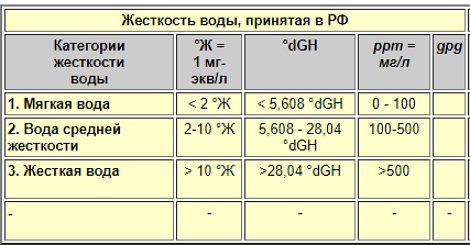
Нормы жесткости воды в России
Соли жесткости обладают разными свойствами. При разогреве, некоторые из них образуют в осадок в виде накипи, а некоторые — не выпадают. По этому признаку различают следующие виды жесткости воды:
Временная жесткость отличается наличием в воде не только катионов Ca2+, Mg2+ и Fe2+, но и гидрокарбонатных или бикарбонатных анионов (HCO3-).
При кипячении жидкости гидрокарбонаты распадаются, образуя плохо растворимый карбонат кальция, углекислый газ и воду:
Ca2+ + 2HCO3- = CaCO3↓ + H2O + CO2↑
Общая жесткость суммируется из постоянной и временной.
Таблица норм временной жесткости по данным ВСТ:
Рекомендации всемирной организации здравоохранения (ВОЗ) для питьевой воды:
Определенной рекомендуемой величины нет. По данной характеристика питьевая вода в Москве вполне соответствует рекомендациям ВОЗ.
Российские нормативные документы для питьевой воды регламентируют:
Норматив физиологической полноценности бутилированной воды:
По содержанию кальция и магния бутилированная вода высшей категории ничем не лучше воды из-под крана или из скважины.
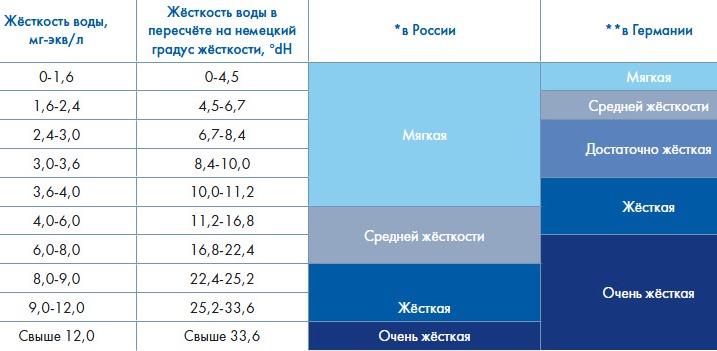
Для сравнения Эколайн привела следующие нормы жесткости в России и Германии:
Заметно, что в Европе требования к допустимой жесткости воды намного строже, чем в России.
Чем опасная жесткая и мягкая вода?
Требования к жесткости воды для приготовления пищи, питья и бытового применения находятся в зависимости от условий определенной местности.
Жидкость с повышенными или заниженными показателями оказывает негативное влияние не только на сантехнические приборы и бытовую технику, но и на здоровье человека.
Но прежде всего, степень жесткости влияет на вкус жидкости. Чрезмерно жесткая отличается привкусом горечи и металла, а слишком мягкая вода «невкусная».
Предел вкуса ионов кальция в питьевой среде составляет 2-6 мг-экв/л. Предел вкуса для ионов магния заметно ниже, поэтому самой приятной на вкус питьевой водой считается жидкость с показателем от 1,6 до 3 мг-экв/л.
Негативное влияние на технику
Использование жидкости с высоким уровнем жидкости от 4 мг-экв/л для бытовых нужд приводит к образованию отложений накипи на внутренних деталях сантехнических устройств, отопительных систем, бытовой техники (ТЭНы стиральных и посудомоечных машин).
Такую воду вообще не стоит применять в приспособлениях для нагрева жидких сред. Нагревательный элемент электрического бойлера, кофеварки, чайника, посудомоечной или стиральной машины в течение короткого времени обрастает слоем накипи. В результате процесс нагрева замедляется, а в дальнейшем прибор вовсе выходит из строя. Однако данную проблему легко решить, если прокипятить водонагреватель с растворенными в одном литре воды 50-100 г лимонной кислоты.
На сам процесс стирки вещей и мытья посуды тоже ухудшается от использования для этих целей жидкости с большим количеством солей. Порошок или моющее средство, растворяясь в обогащенной калием и магнием среде, образует большое количество пены. Повышенное пенообразование, в свою очередь, негативно влияет на эффективность очищающего процесса и на работу самого бытового агрегата.
Применение чрезмерно жесткого раствора солей для водных и банных гигиенических процедур приводит к образованию налета на кранах, смесительных узлах, шлангах, душевых лейках. В результате сантехнические детали в скором времени также выходят из строя.
Поэтому важно знать, как смягчить воду из скважины, если она подается на бытовые приборы и сантехнические устройства в частном доме.
Негативное влияние на человека
Иногда допускается использование воды с показателем жесткости до 10 мг-экв/л, однако длительное употребление такой жидкости оказывает отрицательное воздействие на здоровье человека. Повышенная жесткость вредна для кожи, ускоряя процессы старения, негативно воздействует на волосы, делая их ломкими и тонкими. Кроме того, такая жидкость плохо влияет на работу почек, сердца, органов пищеварения, а также создает лишнюю нагрузку на сосуды.
Всемирная организация здравоохранения не приводит конкретные данные, хотя неоднократно проводятся исследования, относительно того, как качество воды связано с возникновением болезней сердца, почек, сосудов и других органов.
При длительном употреблении воды с завышенным уровнем растворения солей замечаются существенные отклонения от нормы, проявляющиеся в деятельности следующих органов:
А вот миф о процессе образования камней в почках в результате употребления питьевой воды низкого качества успешно развенчан учеными. Камни появляются от нехватки кальция, который вымывается из костей и оседает в органах мочевыводящей системы.
Чрезмерно мягкая вода тоже плохо отражается на здоровье человека, нарушая водно-солевой баланс.
Всех перечисленных недугов и болезненных состояний можно избежать, если использовать многоступенчатый умягчитель воды. Сделать воду мягче, можно разнообразными методами даже в домашних условиях. Но прежде нужно узнать, какая в вашем кране жесткость воды и способы ее устранения, если этот показатель сильно завышен.
Как измерить жесткость?
Для оценки показателей градусов жесткости воды применяются следующие способы:
Под титрованием имеется в виду растворение в воде реагента необходимой концентрации. Содержание солей показывает реакция реагента с жидкостью. Изготовить реактив легко — необходимо лишь соединить кислоту с дистиллированной водой в установленных пропорциях. Приготовленный раствор угрозы не представляет.
Намного проще пользоваться готовыми тестами. Для этого нужно налить 5 мл воды в стакан, затем по каплям добавить в сосуд содержимое теста, после каждой капли жидкость требуется перемешивать. Продолжать добавлять реактив, пока цвет жидкости не станет зеленым вместо розового. Результаты сверить по таблице, которая продается вместе с тестами.
Как смягчить воду в домашних условиях?
Существует несколько методов сделать питьевую воду мягче. Те, кто хорошо учил химию в школе, прекрасно знакомы с некоторыми из них. Способы устранения жесткости воды из скважины и из-под крана:
Умеренно мягкая вода подходит для использования в любых целях: питья, стирки, мытья и пр.
Для этого нужно всего лишь довести жидкость до кипения, оставить на пару минут покипеть, после чего охладить до требуемой температуры.
Однако у этого способа есть серьезные недостатки:
Но и у этого метода имеются минусы:
Виды систем понижения жесткости воды:
Чтобы решить данную проблему, системы обратного осмоса оборудуются дополнительным модулем – минерализатором, который насыщает воду необходимыми минералами и солями. Недостатки: высокая стоимость и небольшая производительность.

Таким образом, можно легко выяснить, как смягчить воду в домашних условиях – кипячением, добавлением соды, уксуса, соли, лимонной кислоты или гашеной извести. Дистилляция и применение системы обратного осмоса тоже можно осуществить дома, но тогда заметно повышается стоимость одного литра отфильтрованной воды. Другие способы смягчения в домашних условиях трудноосуществимы.
Как откорректировать жесткость воды в аквариуме?
Чтобы сделать комфортную микросреду для существования аквариумных рыбок, важно применять жидкость подходящей жесткости, с установленным кислотно-щелочным балансом. Для повышения этого показателя используется известняк и мрамор. Чем мягче среда, тем быстрее повысится ее жесткость.
Другой способ ужесточения – химический, с внедрением хлористого кальция и магнезии. Максимальный эффект наступает при применении двух веществ сразу.
Для умягчения жидкой среды в аквариуме ее необходимо прокипятить. Чтобы снизить содержание солей в два раза, нужно осуществлять непосредственное кипячение в течение длительного времени — от 30 до 50 минут.
Другой способ смягчения – вымораживание. Воду для аквариума необходимо налить в пластиковый контейнер и поместить в морозилку. Затем растопить лед, охладить жидкость до нужной температуры и залить в аквариум.
Часто способы умягчения применяют комбинированно. К примеру, одну часть солей ликвидируют реагентным методом, а другую – при помощи катионного обмена.
Опреснение, обессоливание, удаление растворенных газов, железа, стабилизация – это специальные способы очистки. Так, если для снижения жесткости применяются методы катионирования или ионного обмена, речь идет об обессоливании. Жидкость, которая получается на выходе, не содержит ни анионов, ни катионов солей.
Жесткость воды – одно из важнейших ее свойств, зависящее от типа и количества содержащихся в ее составе солей. Смягчение стоит делать только после предварительного анализа, потому что любой умягчитель понижает содержание минеральных веществ. Сайт santehnikportal.ru предоставил 6 способов, как определить жесткость воды в домашних условиях, и 9 методов, как умягчить жидкость для разных целей.

Мг экв дм3 это что
Дата введения 2014-01-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Протектор» совместно с Закрытым акционерным обществом «Центр исследования и контроля воды»
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 24 октября 2012 г. N 52)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97
Код страны по МК (ИСО 3166) 004-97
Сокращенное наименование национального органа по стандартизации
Минэкономики Республики Армения
Госстандарт Республики Беларусь
4 Приказом Федерального агентства по техническому регулированию и метрологии от 29 ноября 2012 г. N 1484-ст межгосударственный стандарт ГОСТ 31865-2012 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2014 г.
5 Настоящий стандарт подготовлен на основе применения ГОСТ Р 52029-2003
7 ПЕРЕИЗДАНИЕ. Сентябрь 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге «Межгосударственные стандарты»
1 Область применения
Настоящий стандарт распространяется на природные (подземные и поверхностные) воды, включая источники питьевого водоснабжения, а также питьевую воду, в том числе расфасованную в емкости, и устанавливает единицу жесткости воды.
2 Общие положения
2.1 Жесткостью воды называется совокупность свойств, обусловленных концентрацией в ней щелочноземельных элементов, преимущественно ионов кальция ( ) и магния (
2.2 Жесткость воды выражается в градусах жесткости (°Ж).
Градус жесткости соответствует концентрации щелочноземельного элемента, численно равной его моля, выраженной в мг/дм (г/м ).

— концентрация щелочноземельного элемента, численно равная 1/2 его моля, выраженная в мг/дм (г/м ).
3* Соотношения национальных единиц жесткости воды, принятых в других странах, приведены в таблице А.1 приложения А.
* Нумерация соответствует оригиналу. Примечание изготовителя базы данных.
Приложение А
(справочное)
Соотношения национальных единиц жесткости воды, принятых в других странах