Миеломоноцитарный лейкоз что это
Содержание
Признаки и симптомы
Причина
Патогенез
Генетические мутации
Диагностика
Классификация
Подтипы лейкемии подразделяются на отдельные клинические единицы, чтобы их можно было диагностировать и лечить соответствующим образом. Лейкемии подразделяются на лимфоидные и миелоидные новообразования в зависимости от того, какие клетки костного мозга являются злокачественными. Миелоидные новообразования содержат острые и хронические лейкемии, миелодиспластические синдромы (МДС) и миелопролиферативные новообразования (МПН). MPN характеризуются повышенной продукцией миелоидных клеток крови с более высоким, чем обычно, количеством зрелых клеток. В отличие от MPN, MDS имеют дисфункциональную продукцию миелоидных клеток с уменьшенным количеством зрелых клеток. Многие из клеток, образующихся при МДС, выглядят ненормально, что известно как дисплазия. CMML демонстрирует характеристики обеих групп, поэтому его трудно классифицировать.
Классификация FAB
Классификация ВОЗ
Диагностические критерии
Критерии FAB
Критерии диагностики FAB следующие:
Критерии ВОЗ
Критерии постановки диагноза ВОЗ следующие:
Наличие двух или более фенотипических аномалий может помочь в диагностике CMML при отсутствии идентификации цитогенетических или диспластических признаков. Они могут включать экспрессию CD56 и / или CD2 или недостаточную экспрессию HLA-DR.
Прогноз
Факторы, влияющие на прогноз
CMML-2 имеет пониженную общую выживаемость по сравнению с CMML-1, при этом медиана выживаемости составляет 15 и 20 месяцев соответственно. Миелопролиферативный CMML (> 13×10 9 моноцитов / л) имеет меньшую выживаемость по сравнению с миелодиспластическим CMML. Количество тромбоцитов 10 9 / л снижает общую выживаемость. Уровень гемоглобина Системы подсчета очков
International Scoring System прогностический (IPSS) была разработана в середине 1990-х годов для оценки прогноза больных МДС. В этой системе случаи делятся на 2 группы; группа более низкого риска (подразделяется на низкий и средний-1) и более высокий риск (подразделяется на промежуточный-2 и высокий). Он использует процент бластов, количество цитопений и данные цитогенетики костного мозга, чтобы отнести случаи CMML к этим группам. В связи с разработкой балльной системы для МДС, более миелопролиферативные случаи CMML (WBC> 13×10 9 ) исключаются из балльной системы. Хотя балльная система IPSS используется в клинической практике, в каждой группе наблюдается высокая вариабельность. По этой причине разрабатываются новые методы оценки прогноза при МДС (и ХММЛ).
Прогностическая балльная система MD Anderson
Новый метод, разработанный с использованием данных онкологического центра Андерсона, показал, что уровень гемоглобина 2,5 x 10 9 / л,> 0% незрелых миелоидных клеток,> 10% бластов костного мозга вызывают снижение общей выживаемости. Эти данные позволяют разделить случаи CMML на группы низкого, среднего 1, среднего 2 и высокого риска. Эти группы имеют среднее время выживания 24, 15, 8 и 5 месяцев соответственно.
Оценка Дюссельдорфа
Шкала Дюссельдорфа разделяет случаи по четырем категориям, давая по одному баллу за каждую; бласты костного мозга ≥5%, ЛДГ> 200 Ед / л, гемоглобин ≤9 г / дл и количество тромбоцитов ≤100000 / мкл. Оценка 0 указывает на группу низкого риска, 1-2 указывает на группу среднего риска, а 3-4 указывает на группу высокого риска. Кумулятивная 2-летняя выживаемость с оценками 0, 1-2 и 3-4 составляет 91%, 52% и 9%; и риск трансформации AML составляет 0%, 19% и 54% соответственно.
Переливание крови и введение эритропоэтина используются для повышения уровня гемоглобина в случаях анемии.
Трансплантация гемопоэтических стволовых клеток остается единственным методом лечения CMML. Однако из-за позднего возраста начала и наличия других заболеваний такая форма лечения часто невозможна.
Эпидемиология
Отдельных эпидемиологических исследований CMML было мало из-за сложности классификации болезни. Заболеваемость CMML составляет менее 1 на 100 000 человек в год. Средний возраст постановки диагноза 65–75 лет. CMML имеет склонность к мужчинам, а не к женщинам, в соотношении 1,5–3: 1.
Острый миелоидный лейкоз
Острый миелоидный лейкоз – злокачественное заболевание системы крови, сопровождающееся неконтролируемым размножением измененных лейкоцитов, снижением количества эритроцитов, тромбоцитов и нормальных лейкоцитов. Проявляется повышенной склонностью к развитию инфекций, лихорадкой, быстрой утомляемостью, потерей веса, анемией, кровоточивостью, образованием петехий и гематом, болями в костях и суставах. Иногда выявляются изменения кожи и припухлость десен. Диагноз устанавливается на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, трансплантация костного мозга.
МКБ-10
Общие сведения
Острый миелоидный лейкоз (ОМЛ) – злокачественное поражение миелоидного ростка крови. Неконтролируемая пролиферация лейкозных клеток в костном мозге влечет за собой подавление остальных ростков крови. В результате количество нормальных клеток в периферической крови уменьшается, возникают анемия и тромбоцитопения. Острый миелоидный лейкоз является самым распространенным острым лейкозом у взрослых. Вероятность развития болезни резко увеличивается после 50 лет. Средний возраст пациентов составляет 63 года. Мужчины и женщины молодого и среднего возраста страдают одинаково часто. В старшей возрастной группе наблюдается преобладание лиц мужского пола. Прогноз зависит от вида острого миелоидного лейкоза, пятилетняя выживаемость колеблется от 15 до 70%. Лечение осуществляют специалисты в области онкологии и гематологии.
Причины острого миелоидного лейкоза
Непосредственной причиной развития ОМЛ являются различные хромосомные нарушения. В числе факторов риска, способствующих развитию таких нарушений, указывают неблагоприятную наследственность, ионизирующее излучение, контакт с некоторыми токсическими веществами, прием ряда лекарственных препаратов, курение и болезни крови. Вероятность возникновения острого миелоидного лейкоза увеличивается при синдроме Блума (низкий рост, высокий голос, характерные черты лица и разнообразные кожные проявления, в том числе гипо- или гиперпигментация, кожная сыпь, ихтиоз, гипертрихоз) и анемии Фанкони (низкий рост, дефекты пигментации, неврологические расстройства, аномалии скелета, сердца, почек и половых органов).
Острый миелоидный лейкоз достаточно часто развивается у больных с синдромом Дауна. Прослеживается также наследственная предрасположенность при отсутствии генетических заболеваний. При ОМЛ у близких родственников вероятность возникновения болезни повышается в 5 раз по сравнению со средними показателями по популяции. Самый высокий уровень корреляции выявляется у однояйцевых близнецов. Если острый миелоидный лейкоз диагностируется у одного близнеца, риск у второго составляет 25%. Одним из важнейших факторов, провоцирующих ОМЛ, являются заболевания крови. Хронический миелоидный лейкоз в 80% случаев трансформируется в острую форму болезни. Кроме того, ОМЛ нередко становится исходом миелодиспластического синдрома.
Ионизирующее излучение вызывает острые миелоидные лейкозы при превышении дозы 1 Гр. Заболеваемость увеличивается пропорционально дозе облучения. На практике имеет значение пребывание в зонах атомных взрывов и аварий на атомных электростанциях, работа с источниками излучения без соответствующих защитных средств и радиотерапия, применяемая при лечении некоторых онкологических заболеваний. Причиной развития острого миелоидного лейкоза при контакте с токсическими веществами является аплазия костного мозга в результате мутаций и поражения стволовых клеток. Доказано негативное влияние толуола и бензола. Обычно ОМЛ и другие острые лейкозы диагностируются спустя 1-5 лет после контакта с мутагеном.
В числе лекарственных средств, способных провоцировать острые миелоидные лейкозы, специалисты называют некоторые препараты для химиотерапии, в том числе ингибиторы ДНК-топоизомеразы II (тенипозид, этопозид, доксорубицин и другие антрациклины) и алкилирующие средства (тиофосфамид, эмбихин, циклофосфамид, хлорамбуцил, кармустин, бусульфан). ОМЛ также может возникать после приема хлорамфеникола, фенилбутазона и препаратов мышьяка. Доля лекарственных острых миелоидных лейкозов составляет 10-20% от общего количества случаев заболевания. Курение не только повышает вероятность развития ОМЛ, но и ухудшает прогноз. Средняя пятилетняя выживаемость и продолжительность полных ремиссий у курильщиков ниже, чем у некурящих.
Классификация острого миелоидного лейкоза
Классификация острого миелоидного лейкоза по версии ВОЗ очень сложна и включает в себя несколько десятков разновидностей заболевания, разделенных на следующие группы:
Тактика лечения, прогноз и продолжительность ремиссий при разных видах ОМЛ могут существенно различаться.
Симптомы острого миелоидного лейкоза
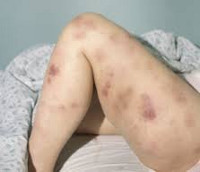
Клиническая картина включает в себя токсический, геморрагический, анемический синдромы и синдром инфекционных осложнений. На ранних стадиях проявления острого миелоидного лейкоза неспецифичны. Отмечается повышение температуры без признаков катарального воспаления, слабость, утомляемость, потеря веса и аппетита. При анемии присоединяются головокружения, обморочные состояния и бледность кожных покровов. При тромбоцитопении наблюдаются повышенная кровоточивость и петехиальные кровоизлияния. Возможно образование гематом при незначительных ушибах. При лейкопении возникают инфекционные осложнения: частые нагноения ран и царапин, упорные повторные воспаления носоглотки и т. д.
В отличие от острого лимфобластного лейкоза при остром миелоидном лейкозе отсутствуют выраженные изменения со стороны периферических лимфатических узлов. Лимфоузлы небольшие, подвижные, безболезненные. Иногда выявляется увеличение лимфатических узлов в шейно-надключичной области. Печень и селезенка в пределах нормы или незначительно увеличены. Характерны признаки поражения костно-суставного аппарата. Многие больные острым миелоидным лейкозом предъявляют жалобы на боли различной степени интенсивности в области позвоночника и нижних конечностей. Возможны ограничения движений и изменения походки.
В числе экстрамедуллярных проявлений острого миелоидного лейкоза – гингивит и экзофтальм. В отдельных случаях наблюдаются припухлость десен и увеличение небных миндалин в результате инфильтрации лейкозными клетками. При миелоидной саркоме (составляет около 10% от общего количества случаев острого миелоидного лейкоза) на коже пациентов появляются зеленоватые, реже – розовые, серые, белые или коричневые опухолевидные образования (хлоромы, кожные лейкемиды). Иногда при поражениях кожи обнаруживается паранеопластический синдром (синдром Свита), который проявляется воспалением кожных покровов вокруг лейкемидов.
В развитии острого миелоидного лейкоза выделяют пять периодов: начальный или доклинический, разгара, ремиссии, рецидива и терминальный. В начальном периоде острый миелоидный лейкоз протекает бессимптомно или проявляется неспецифической симптоматикой. В периоде разгара токсический синдром становится более выраженным, выявляются анемический, геморрагический и инфекционный синдромы. В период ремиссии проявления острого миелоидного лейкоза исчезают. Рецидивы протекают аналогично периоду разгара. Терминальный период сопровождается прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика и лечение острого миелоидного лейкоза
Решающую роль в процессе диагностики играют лабораторные анализы. Используют анализ периферической крови, миелограмму, микроскопические и цитогенетические исследования. Для получения образца тканей выполняют аспирационную биопсию костного мозга (стернальную пункцию). В анализе периферической крови больного острым миелоидным лейкозом обнаруживается снижение количества эритроцитов и тромбоцитов. Количество лейкоцитов может быть как повышенным, так и (реже) пониженным. В мазках могут выявляться бласты. Основанием для постановки диагноза «острый миелоидный лейкоз» становится обнаружение более 20% бластных клеток в крови либо в костном мозге.
Основой лечения острого миелоидного лейкоза является химиотерапия. Выделяют два этапа лечения: индукцию и консолидацию (постремиссионную терапию). На этапе индукции выполняют лечебные мероприятия, направленные на уменьшение количества лейкозных клеток и достижение состояния ремиссии. На этапе консолидации устраняют остаточные явления болезни и предотвращают рецидивы. Лечебную тактику определяют в зависимости от вида острого миелоидного лейкоза, общего состояния больного и некоторых других факторов.
Наиболее популярная схема индукционного лечения – «7+3», предусматривающая непрерывное внутривенное введение цитарабина в течение 7 дней в сочетании с одновременным быстрым периодическим введением антрациклинового антибиотика в течение первых 3 дней. Наряду с этой схемой в процессе лечения острого миелоидного лейкоза могут применяться другие лечебные программы. При наличии тяжелых соматических заболеваний и высоком риске развития инфекционных осложнений в результате подавления миелоидного ростка (обычно – у больных старческого возраста) используют менее интенсивную паллиативную терапию.
Программы индукции позволяет добиться ремиссии у 50-70% пациентов с острым миелоидным лейкозом. Однако без дальнейшей консолидации у большинства больных наступает рецидив, поэтому второй этап лечения рассматривается, как обязательная часть терапии. План консолидационного лечения острого миелоидного лейкоза составляется индивидуально и включает в себя 3-5 курсов химиотерапии. При высоком риске рецидивирования и уже развившихся рецидивах показана трансплантация костного мозга. Другие методы лечения рецидивных ОМЛ пока находятся в стадии клинических испытаний.
Прогноз острого миелоидного лейкоза
Прогноз определятся разновидностью острого миелоидного лейкоза, возрастом больного, наличием или отсутствием миелодиспластического синдрома в анамнезе. Средняя пятилетняя выживаемость при разных формах ОМЛ колеблется от 15 до 70%, вероятность развития рецидивов – от 33 до 78%. У пожилых людей прогноз хуже, чем у молодых, что объясняется наличием сопутствующих соматических заболеваний, являющихся противопоказанием для проведения интенсивной химиотерапии. При миелодиспластическом синдроме прогноз хуже, чем при первичном остром миелоидном лейкозе и ОМЛ, возникшем на фоне фармакотерапии по поводу других онкологических заболеваний.
Ювенильный миеломоноцитарный лейкоз
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «07» декабря 2017 года
Протокол № 34
Код(ы) МКБ-10:
Дата разработки/пересмотра протокола: 2017 год.
Пользователи протокола: ВОП, педиатры, детские онкологи, детские гематологи.
Категория пациентов: дети.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Европейская рабочая группа по МДС у детей выделила основные характерные признаки заболевания, позволяющие поставить диагноз ЮММЛ:
· Характерные клинические симптомы и относительная частота встречаемости:
— гепатоспленомегалия (свыше 97%);
— лимфаденопатия (76%);
— бледность (64%);
— лихорадка (54%);
— кожная сыпь (36%).
· Минимальные лабораторные критерии:
— отсутствие транслокации 9:22;
— бластные клетки (включая промоноциты) в к/м составляют менее 20%;
— моноцитоз в периферической крови более 1000/мкл;
· Дополнительные критерии (минимум два) для окончательного диагноза:
— спонтанный рост колоний гранулоцитарно-макрофагальных предшественников;
— повышение уровня фетального гемоглобина (больше возрастной нормы);
— наличие незрелых миелоидных предшественников в периферической крови;
— уровень лейкоцитов свыше 10 х 109/л;
— клональные хромосомные аномалии;
— гиперчувствительность миелоидных предшественников к GM-CSF.
Диагностические критерии
Жалобы и анамнез:
· недостаточная прибавка массы тела;
· задержки в физическом развитии;
· анемия с характерной утомляемостью, чрезмерной слабостью, побледнением покровов кожи;
· гипертермия;
· частая кровоточивость десен и носа;
· частые инфекционные осложнения;
· увеличение селезенки и печени;
· припухание лимфоузлов, расположенных в периферии.
Жалобы на слабость, недомогание в течение нескольких месяцев, повышение температуры тела, боли в костях и/или суставах, бледность, кровоточивость слизистых полости рта, носа, другие виды кровотечений, увеличение периферических лимфатических узлов, увеличение размеров живота, боли в животе, затруднённое носовое дыхание, одышка.
Изучается подробный анамнез заболевания (возраст на момент начала заболевания, клиническая симптоматика).
Физикальное обследование позволяет на первом этапе оценить степень тяжести состояния пациента, а также предположить данный диагноз на основании следующих данных.
При оценке клинического статуса больных необходимо обратить внимание на наличие:
· гепатоспленомегалии (отмечается выраженная гепатоспленомегалия; нередко селезенка достигает уровня верхней подвздошной кости);
· лимфаденопатии (пальпируются все группы периферических лимфоузлов, нередко лимфоузлы образуют конгломераты, встречаются лимфадениты);
· геморрагического синдрома;
· анемического синдрома;
· симптомов интоксикации (лихорадка, снижение аппетита, снижение веса, гипотрофия, слабость);
· сыпь – наличие сыпи имеет немаловажное значение, сыпь может быть представлена различными элементами, как правило, она имеет пятнисто-папулезный характер с преимущественной локализацией на верхней половине туловища и конечностях, в некоторых случаях сыпь сопровождается выраженным зудом, в некоторых случаях могут выявляться пятна типа «кофе с молоком», что может ассоциироваться с нейрофиброматозом 1 типа, в некоторых случаях выявляются ксантомные элементы, что требует исключения ювенильной ксантогранулемы. данное заболевание также может сочетаться с ЮММЛ;
· поражение органов дыхания, клинически проявляется кашлем, иногда с обструктивным компонентом, одышкой;
· очаги инфекции (преимущественно бактериального происхождения);
· паранеопластические симптомы (аутоиммунное поражение радужной оболочки глаз, периферической нервной системы, полисерозиты, артриты).
Физикальное обследование – оценка выраженности анемического, геморрагического, гиперпластического синдромов, инфекционного статуса, неврологического статуса.
Основные лабораторные исследования:
· ОАК – уровень гемоглобина, количество эритроцитов, лейкоцитов и их морфологические характеристики, ручной подсчет лейкоцитарной формулы, количество тромбоцитов и их морфологические характеристики, уровень ретикулоцитов;
· морфологическое исследование костного мозга – выполняется под общей анестезией. Проводится пункция костного мозга из четырех точек (передние и задние ости подвздошных костей). Из каждой точки изготавливается по 10 мазков. Три мазка из каждой точки окрашиваются азур-эозином по Романовскому-Гимзе. При анализе миелограммы необходимо оценить следующие показатели:
— клеточность костного мозга (нормоклеточный, гипоклеточный, гиперклеточный);
— соотношение основных ростков кроветворения: гранулоцитарный, эритроидный, мегакариоцитарный (сужение, расширение, нормальный уровень);
— клеточный состав, уровень бластных клеток, их морфологическая характеристика и принадлежность к определенной клеточной линии;
— относительное (%) содержание моноцитов и промоноцитов (промоноциты приравниваются к бластным клеткам);
— наличие диспоэза, морфологические характеристики диспоэза и степень вовлеченности ростков кроветворения.
· цитохимическое, цитогенетическое и молекулярногенетическое исследование костного мозга – выявление хромосомных нарушений (выполняются обязательно всем пациентам).
· трепанобиопсия костного мозга – не является обязательным исследованием при постановке диагноза. Однако трепанобиоптат костного мозга при ЮММЛ также имеет ряд особенностей: в большинстве случаев отмечается увеличение клеточности со значительным преобладанием миелоидного ростка и увеличением содержания клеток моноцитарного ряда. При специфической обработке трепанобиоптата обнаруживается атипичное расположение миелоидных предшественников (ALIP) в центральных отделах межбалочных пространств и выраженное периваскулярное скопление плазматических клеток.
Дополнительные лабораторные исследования:
· определение группы крови и резус-фактора;
· HLA-типирование пациента и сиблингов (при отсутствии родственного HLA-совместимого донора как можно раньше необходимо начать поиск HLA-совместимого неродственного донора).
· серологическое исследование маркеров гепатитов А, В, С, ВИЧ;
· биохимический анализ крови – обязательно исследуются уровни ЛДГ, АЛТ, АСТ, ЩФ, мочевина, креатинин, глюкоза, калий, натрий, кальций;
· коагулограмма – фибриноген, АЧТВ, ПТИ, МНО.
Основные инструментальные исследования:
· УЗИ органов брюшной полости, средостения, забрюшинного пространства, малого таза;
Дополнительные инструментальные исследования: по показаниям.
· КТ/МРТ органов брюшной полости – для верификации диагноза, исключения солидных образований
· электрокардиография;
· эхокардиография;
· определение уровня сывороточных иммуноглобулинов;
· проба Кумбса;
· рентгенография органов грудной клетки в двух проекциях, при необходимости отдельных участков скелета;
· компьютерная томография грудной клетки.
Показания для консультации специалистов:
· консультация узких специалистов – онколог, гематолог и другие по показаниям.
Диагностический алгоритм:
Хронический моноцитарный лейкоз
Хронический моноцитарный лейкоз — заболевание, характеризующееся моноклоновой пролиферацией клеточных элементов моноцитопоэза.
Патогенез (что происходит?) во время Хронического моноцитарного лейкоза:
Под хроническим моноцитарным лейкозом имеется в виду опухолевый процесс с существенным увеличением количества моноцитарных клеток в крови и костном мозге при нормальном или невысоком лейкоцитозе.
У некоторых больных хроническим моноцитарным лейкозом долго не наблюдается подавления эритроцитарного и тромбоцитарного ростков, возможно появление анемии, которая может несколько лет оставаться единственным признаком болезни.
Поскольку увеличение числа моноцитов и моноцитоидных клеток в периферической крови бывает реактивным, например при туберкулезе, макроглобулинемии Вальденстрема, раке, для диагностики хронического моноцитарного лейкоза иногда требуются более или менее длительное наблюдение за картиной крови, исключение иных соматических заболеваний как причины реактивного моноцитоза.
Заболевают хроническим моноцитарным лейкозом пожилые люди, как правило, старше 50 лет, редкую форму болезни представляет собой хронический моноцитарный лейкоз, развивающийся у детей первого года жизни.
Симптомы Хронического моноцитарного лейкоза:
Клиническая картина болезни долго не имеет характерных особенностей. Бессимптомность отличает хронический моноцитарный лейкоз от реактивного моноцитоза, означающего, как правило, обострение того процесса, которым он обусловлен (туберкулез, рак).
Анемия, как правило, нормо- или гиперхромная. Увеличение селезенки отмечено приблизительно у половины больных; существенного увеличения печени и лимфатических узлов не наблюдается.
Гематологическая картина болезни так же скромна, как и клиническая. Костномозговое кроветворение при этом лейкозе долго почти не нарушается. Соотношение лейкоцитов и эритроцитов близко к нормальному, хотя при исследовании обнаруживается многоклеточное разрастание костного мозга, причем крупные мононуклеары не образуют больших скоплений.
В крови больных хроническим моноцитарным лейкозом часто встречаются единичные ядросодержащие клетки красного ряда.
У большинства больных отмечается значительное ускорение СОЭ; в отдельных случаях это может служить одним из наиболее ранних лабораторных признаков болезни.
Диагностика Хронического моноцитарного лейкоза:
Диагностика хронического моноцитарного лейкоза основывается на моноцитозе в крови, моноцитозе в костном мозге, полиморфноклеточной гиперплазии костного мозга в трепанате с диффузным, не образующим пролифератов разрастанием клеток моноцитарного ряда, на выявлении высокого уровня лизоцима в сыворотке и моче больного.
По мере развития патологического процесса признаки подавления нормальных ростков кроветворения становятся все более выраженными, и еще до терминальной стадии выявляются умеренная тромбоцитопения и анемия. Процесс иногда заканчивается терминальной стадией, как при хроническом миелозе.
Продолжительность жизни больных хроническим моноцитарным лейкозом превышает 5-10 лет.
Лечение Хронического моноцитарного лейкоза:
Хронический моноцитарный лейкоз в доброкачественной стадии долго не требует никакого специального лечения. Больные с анемией нуждаются в повторных переливаниях эритроцитной массы. При нарастании тромбоцитопении и появлении геморрагического синдрома целесообразно назначить небольшие дозы глюкокортикостероидов. В терминальной (злокачественной) стадии процесса показан весь комплекс цитостатической терапии, применяемый для лечения острого лейкоза.
Наряду с формой хронического моноцитарного лейкоза, свойственной лицам старше 50-60 лет, есть хронический моноцитарный лейкоз детей. Как и у взрослых больных хроническим моноцитарным лейкозом, у детей основным проявлением остается постоянный моноцитоз в крови. Такую особенность можно принять за наследственную нейтропению, для которой тоже характерен моноцитоз. Предположение о наследственной нейтропении подкрепляется тем, что и то, и другое заболевание обнаруживают уже в период новорожденности.
В действительности картина крови при хроническом моноцитарном лейкозе отличается от таковой при наследственной нейтропении: при хроническом моноцитарном лейкозе нейтрофилы в крови есть всегда, возможен даже небольшой левый сдвиг в формуле, хотя бывает более или менее выраженная нейтропения. При хроническом моноцитарном лейкозе детей часто лейкоцитоз в крови, увеличение печени и селезенки. Данные признаки не характерны для наследственной нейтропении.
В развернутой стадии хронический моноцитарный лейкоз детей не требует применения цитостатических препаратов. Если процесс характеризуется выраженной анемией, нейтропенией или значительным увеличением лимфатических узлов, то следует длительное время вести больных на глюкокортикостероидной терапии, назначая препарат курсами по 15 мг/м2 в день в течение месяца с последующим перерывом в 3-4 месяца. При необходимости глюкокортикостероидного лечения целесообразно пользоваться методом пульс-терапии: препарат принимают 3 дня подряд или 3 раза через день одну неделю, суточная доза составляет при этом 30–40 мг/м2; интервалы между такими курсами зависят от эффекта и могут быть многомесячными. Переливания эритроцитной массы детям нужны при снижении гемоглобина до 55 г/л и ниже.
Впервые обнаруженные изменения зачастую ошибочно наводят врача на мысль об инфекционном мононуклеозе, особенно если они сочетаются с повышением температуры, катаральными явлениями в носоглотке, ангиной, которые нередки при данной форме лейкоза у ребенка, прежде всего при выраженной нейтропении.
Данную ситуацию разрешают наблюдение и повторные анализы крови, вновь повторно выявляющие моноцитоз, в конечном счете диагноз «лейкоз» уточняется с помощью исследования костного мозга. В костном мозге при хроническом моноцитарном лейкозе ребенка, как и у взрослого, имеется полиморфная миелоидная гиперплазия, хотя очаги скопления моноцитов могут быть более отчетливыми, чем у взрослого. Содержание клеток моноцитарного ряда в костном мозге повышено (достигая десятков процентов), причем наряду с моноцитами есть промоноциты и даже бластные клетки. Исследование костного мозга подтверждает диагноз лейкоза. Этот хронический лейкоз, как и другие, заканчивается терминальной стадией: в крови и костном мозге появляется бластоз, увеличиваются печень и селезенка, нередко повышается температура тела, не обусловленная инфекцией.
В отдельных случаях хронический моноцитарный лейкоз ребенка наряду с моноцитозом в крови сопровождается значительным увеличением и уплотнением подчелюстных лимфатических узлов, содержащих преимущественно зрелые моноцитарные элементы.
Длительность заболевания у ребенка с хроническим моноцитарным лейкозом может превышать 10 лет.