Миелосупрессия при химиотерапии что это
Миелосупрессия при химиотерапии что это
Применение гемопоэтических факторов было чрезвычайно распространено при поддерживающей терапии. Быстрое развитие знаний в области молекулярной биологии и биохимии гликопротеидных гормонов, которые регулируют гемопоэз, привело к их широкому практическому применению.
С момента их появления в 1989 г. повысились эффективность терапии миелосупрессии, вызванной XT, и качество защиты больной от инфекции. Этот класс веществ включает гранулоцитарный (Г-КСФ) и гранулоцитарно-макрофагальный колониестимулирующие факторы (ГМ-КСФ). Биологическая активность этих белков — комплексная и многофункциональная, стимулирует изменения в росте, дифференцировке, распределении и функциональном статусе зрелых клеток, а также их предшественников.
В первых исследованиях Г-КСФ и ГМ-КСФ вводили в основном в/в. Затем большинство исследований показало, что п/к введение 1 или 2 раза в сутки стимулирует миелоидный ряд клеток больше, чем 2—4-часовая в/в инфузия. Рекомендованная доза ГМ-КСФ — 250 мкг/м2, или 3—5 мкг/кг. Интересно, что по крайней мере в некоторых случаях довольно низкие дозы ГМ-КСФ могут обладать большей способностью стимулировать клетки миелоидного ряда, чем высокие дозы.
В клинических исследованиях также отмечалось повышение функции нейтрофилов с точки зрения адгезии, фагоцитоза и хемотаксиса; кроме того, ГМ-КСФ может активировать лимфоциты. Существует два типа Г-КСФ: филграстим и пэгфилграстим пролонгированного действия. Рекомендованная доза филграстима — 5 мкг, вводится п/к. Лечение необходимо начинать минимум через 24 ч после проведения химиотерапии (ХТ) и следует продолжать ежедневно, до тех пор пока абсолютное число нейтрофилов не превысит 10 000/мкл.
Не следует начинать следующий курс химиотерапии (XT) раньше 48 ч после введения последней дозы. Рекомендуемая доза пэгфилграстима — 6 мг. Препарат вводится п/к по крайней мере через 24 ч после окончания инфузии химиопрепаратов, в течение 14 дней не следует начинать химиотерапию (ХТ). Боль в костях — наиболее распространенный побочный эффект Г-КСФ. Другие, более редкие эффекты включают:
— пятнистую и узелковую кожную сыпь;
— обострение основныхаутоиммунныхзаболеваний;
— анафилактический шок (редко);
— умеренно повышенный риск тромбоза;
— теоретически возможно обострение основного злокачественного процесса.
Очевидно, что введение Г-КСМ или ГМ-КСМ ускоряет восстановление количества нейтрофилов до значимого уровня после применения стандартных доз химиотерапии (XT). Установлено, что Г-КСФ уменьшает вероятность лихорадочной нейтропении при использовании режимов химиотерапии (XT) с повышенным риском ее возникновения.
Существование гормонов, которые регулируют эритропоэз, предполагалось в течение 100 лет. В 1985 г. две независимые группы исследователей клонировали ген, ответственный за этот фактор роста. Он был маркирован как ген Еро. Почки — важнейший орган, продуцирующий эритропоэтин. Очевидно, местом синтеза у плода служит печень, и в последней трети гестационного периода продукция эритропоэтина начинает осуществляться почками. Эритропоэтин стимулирует деление и дифференцировку предшественников эритроцитов в костном мозге.
Эпоэтин-а — гликопротеид, полученный методом рекомбинации ДНК из клеток млекопитающих, в которые вводится ген человека Еро. Тканевая гипоксия считается ведущим стимулом для продукции эритропоэтина. Относительно небольшие потери крови (например, 1 ЕД) лишь умеренно стимулирует продукцию эритропоэтина. У большинства пациенток при использовании XT рано или поздно развивается анемия. Концентрация гемоглобина обычно находится в диапазоне 70—120 г/л, а гематокрит составляет примерно 25—30 %.
Этого достаточно, чтобы стимулировать эндогенную продукцию эритропоэтина. Однако оказалось, что чувствительность к эритропоэтину существенно снижена у больных, которые получали химиопрепараты.
Эпоэтин снижает необходимость переливания крови у больных с анемией и в целом способен улучшить качество жизни. Его назначают, когда гемоглобин падают ниже 100 г/л или когда имеются показания к переливанию крови. Однако до начала применения эпоэтина необходимо повысить количество железа. Многие практикующие врачи использовали эпоэтин в дозе 150 ЕД/кг п/к 3 раза в неделю в течение 12 нед. Доза может быть увеличена до 300 ЕД/кг. Другие врачи применяют эпоэтин ежедневно в дозе 60 ЕД/кг, увеличивая до максимальной дозы 90 ЕД/кг/сут.
Другой часто используемый способ представляет собой введение 40 000 ЕД/нед. с увеличением дозы до 60 000 ЕД у больных, у которых не был отмечен благоприятный эффект. Дарбэпоэтин-а представляет собой препарат пролонгированного действия, который вводится в дозе 3 мкг/кг каждые 3 нед. Побочные эффекты редки и включают повышение АД у больных с терминальной стадией почечной недостаточности. К другим нежелательным явлениям относятся отеки и диарея.
Все большее беспокойство вызывают недавно проведенные научные исследования, которые указывают на то, что эритропоэтиновый рецептор экспрессируется в некоторых линиях малигнизированных клеток, что ставит вопрос о возможной стимуляции роста опухолевых клеток этими препаратами. Более того, два больших рандомизированных научных исследования сообщили о значительном ухудшении контроля над опухолью и показателей выживаемости у больных, получавших эпоэтин. Следствием применение эпоэтина также были тромбоэмболические осложнения, которые, возможно, связаны с увеличением уровня гемоглобина.
Опрелвекин получают из Е. coli с помощью методов рекомбинантной ДНК. Белок очень похож на интерлейкин-11 (ИЛ-11) — тромбопоэтический фактор роста, непосредственно стимулирует пролиферацию гемопоэтических стволовых клеток и созревание мегакариоцитов, которые, в свою очередь, увеличивают продукцию тромбоцитов. ИЛ-11 продуцируется стромальными клетками костного мозга и принадлежит к семейству цитокинов. Обычная доза составляет 50 мкг/кг, которая вводится 1 раз в сутки и/к в живот или в боковую поверхность бедра.
Лечение необходимо начинать через 6—24 ч после завершения XT и продолжать до тех пор, пока минимальное содержание тромбоцитов не составит 50 000/мкл. Возможные побочные эффекты включают умеренную задержку жидкости, относительно кратковременное потемнение в глазах и кратковременное появление сыпи в месте введения препарата. Кроме того, ИЛ-11 следует применять с осторожностью у больных с предсердной аритмией в анамнезе. Сообщалось также об анафилактических реакциях.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Миелосупрессия при химиотерапии что это
МИЕЛОСУПРЕССИЯ
Это значительное снижение лейкоцитов и тромбоцитов в крови. Противоопухолевые лекарства оказывают воздействие на быстроделящиеся клетки костного мозга. Миелосупрессия развивается из-за того, что продолжительность жизни лейкоцитов и тромбоцитов является значительно меньшей по сравнению с эритроцитами. Пик такого состояния наступает через 1-2 недели после начала терапии.
Миелосупрессия может развиться у больного в результате химиотерапии, анемии, инфекции, аномального кровотечения. Поскольку при химиотерапии часто наблюдается угнетение функции костного мозга, надо регулярно мониторить гематологические показатели. Наиболее часто развивается нейтропения, чуть реже анемия и тромбоцитопения. При тяжёлой миелосупрессии способны развиться – массивное кровотечение или суперинфекция.
Это говорит о необходимости снижении доз химиотерапевтических средств. Лейкопения после курса химиотерапии развивается, как правило, через неделю.
Клиническими симптомами лейкопении после химиотерапии являются:
— Повышение температуры тела, лихорадка
Если специфическое лечение лейкопении отсутствует, вероятно развитие бактериальных осложнений. Могут значительно обостриться хронические инфекционные процессы. Это приводит к отмене противоопухолевого лечения, следствием чего может быть рецидивирование.
Как проявляет себя лейкопения после химиотерапии?
— Резко повышается температура тела, быстро развиваются симптомы интоксикации.
— Внезапно, без явной видимой причины, появляется чувство нехватки воздуха
— Возникают мышечные боли, ощущение «тика судорог»
— Появляется лихорадка на губах
— Возникают боли и вздутие живота
— Пациент жалуется на беспричинное частое и болезненное мочеиспускание
Миелосупрессия при химиотерапии что это
Поиск и подбор лечения в России и за рубежом
Разделы медицины
Пластическая хирургия, косметология и лечение зубов в Германии. подробнее.
Миелосупрессия, как осложнение химиотерапии
Самым грозным и частым осложнением химиотерапии злокачественных новообразований является миелосупрессия. Под миелосупрессией подразумевается понижение лейкоцитов и тромбоцитов в крови.
Противоопухолевые препараты оказывают прямое воздействие на быстроделящиеся клетки костного мозга. Миелосупрессия развивается из-за того, что продолжительность жизни лейкоцитов и тромбоцитов значительно уменьшается по сравнению с эритроцитами.
Пик данного состояния наступает через 1-2 недели после начала терапии. Серьезными осложнениями миелосупрессии могут быть инфекции и кровотечения.
Факторы, которые влияют на степень гематологической токсичности цитостатиков:
— Одновременное применение химиотерапии и лучевой терапии
— Функциональное состояние почек и печени
— Общее состояние больного
— Химиотерапия раковой опухоли в анамнезе
— Лучевая терапия раковой опухоли в анамнезе
— Метастатическое поражение костного мозга
— Методы введения цитостатиков
Миелосупрессия может развиться у больного в результате химиотерапии, анемии, инфекции, аномального кровотечения. Поскольку при химиотерапии часто наблюдается угнетение функции костного мозга, надо регулярно мониторить гематологические показатели. Чаще всего развивается нейтропения, реже анемия и тромбоцитопения. При тяжелой миелосупрессии могут развиться массивное кровотечение или суперинфекция, что свидетельствует о необходимости снижении доз химиотерапевтических препаратов. Иногда нужно даже прекращение химиотерапии. При возникновении любых осложнений химиотерапии обратитесь к специалисту Европейской клиники.
Записаться на консультацию в Европейскую клинику онкологии в Москве можно:
Информация
Наибольший в России опыт хирургического лечения больных с деформациями грудной клетки (ВДГК, КДГК, синдром Поланда).
На сегодняшний день спинальный хирург доктор Пекарский – самый востребованный в Израиле. Доктор Пекарский провел успешную операции на позвоночнике фигуристу Евгению Плющенко – видеорепортаж 1 канала.
Изготовление индивидуального импланта в зависимости от степени деформации. Прием ведет к.м.н., торакальный хирург Королев Павел Алексеевич.
Миелосупрессия
Костный мозг в большей или меньшей степени всегда реагирует угнетением своей работы на лучевую терапию, системное введение химиопрепаратов или терапию биологически активными агентами. Поскольку лечение рака селективно действует на быстрорастущие злокачественные клетки, а система кроветворения в норме есть органом который активно продуцирует клетки, то совершенно очевидно, что костный мозг подвергается влиянию такой терапии.
Способность цитостатических препаратов угнетать костный мозг выражена по-разному, что учитывается при составлении схемы лечения рака. Незначительное токсическое влияние на костный мозг имеют: Vincristine, Bleomycin, Asparaginase, Ifosphamide, 6-Mercaptopurine, Cisplatin, стероидные гормоны. Средняя токсичность проявляется у Carboplatin, Cyclophosphamide, Dacarbazine, Doxorubicin, 5-Fluorouracil, Methotrexate, Mitoxantrone. Выраженная токсичность проявляется при применении таких препаратов: Busulfan, Carmustine, Cytarabine, Dactinomycin, Etoposide, Lomustine, Melphalan, Nitrogen mustard, Paclitaxel, Vinblastine.
Угнетение костного мозга является побочным эффектом лучевого лечения рака в случаях когда поля облучения захватывают кости таза и грудину или когда осуществляют облучение всего тела перед трансплантацией костного мозга. Нейтропения возникает также при применении препаратов модификаторов биологического действия, таких, как Interferon-alpha и Interleukin-2 (IL-2). Терапия интерлейкином-2 сопровождается еще и тромбоцитопенией.
Нейтропения сопровождается ослаблением защитных сил организма и риском развития инфекционных осложнений. Если число нейтрофилов менее 0,5 • 109 / л крови – это опасно для жизни.
Лечение и профилактика:
— Уменьшение дозы химиопрепаратов или их отмена;
— Избегание, при возможности, одновременного применения цитостатиков и лучевой терапии;
— Увеличение интервалов между курсами химиотерапии;
— Прекращения лучевой терапии до восстановления нормального анализа крови;
— Питание, обогащенное белками и парентеральное питание;
— Гематопоэтические факторы роста гранулоцитов (Neupogen, Leukine);
— Кортикостероиды;
— Применение антибиотиков широкого спектра действия;
— Трансфузия лейкомассы (нейтрофилов);
— Назначения антигрибковых средств;
— Изоляция пациента;
— Гигиенический уход ;
Восстановление числа лейкоцитов происходит в течение 2-8 недель, в зависимости от степени миелосупрессии.
Тромбоцитопения возникает в результате уменьшения продукции тромбоцитов костным мозгом. Клинически тромбоцитопения проявляется петехиями, гематомами в местах инъекций, кровотечениями (из носовой и ротовой полостей, прямой кишки, вагины, уретры).
Лечение и профилактика:
— Избегать назначения антитромбоцитарных агентов (салицилаты, аспирин);
— Соблюдать рекомендованные дозы химиопрепаратов;
— Избегать инвазивных процедур, внутримышечных инъекций;
— Профилактика желудочно-кишечных кровотечений (антациды, диета);
— Применение препаратов прогестерона у женщин для ликвидации месячных;
— Трансфузия тромбоцитарной массы;
— Тромбоцитарный фактор роста Neumega (Oprelvekin, IL-11);
— Переливания крови;
— Витамины;
— Избегать механических травм и связанных с ними кровотечений (пользоваться мягкой зубной щеткой, электробритвою т.д.).
Анемия сопровождается такими симптомами, как бледность, утомляемость, одышка, стенокардия, сердцебиение – все это отображается на качестве жизни пациента. Факторы, влияющие на степень анемии: стадия заболевания, интенсивность химио-лучевой терапии, масса пациента.
Лечение и профилактика:
— Анемия легкой степени специального лечения не требует;
— Соблюдать рекомендованные дозы химиопрепаратов;
— Витамины группы В и С;
— Энтеральное и парентеральное питание;
— Erythropoietin (EPO, Epoetin alfa) – эритроцитарный колониестимулирующий фактор;
— Переливание одногруппной эритроцитарной массы (если гемоглобин
— Препараты железа, фолиевая кислота.
Как в фильмах не будет: что должен знать о химиотерапии каждый пациент
Химиотерапия — страшно и невыносимо. Об этом говорит нам медиапространство, и неудивительно, что из-за такой гиперболизации многие пациенты боятся ее едва ли не больше, чем самого заболевания. Однако ни один фильм и ни один роман не рассказывает, что это такое, как работает и насколько оправдан страх лекарственного лечения. Вместе с химиотерапевтом клиники «Луч» и научным сотрудником СПбКнПЦСВМП(о) Марией Степановой мы составили инструкцию для пациентов и разобрались, что такое лекарственная терапия и от чего зависит схема лечения.
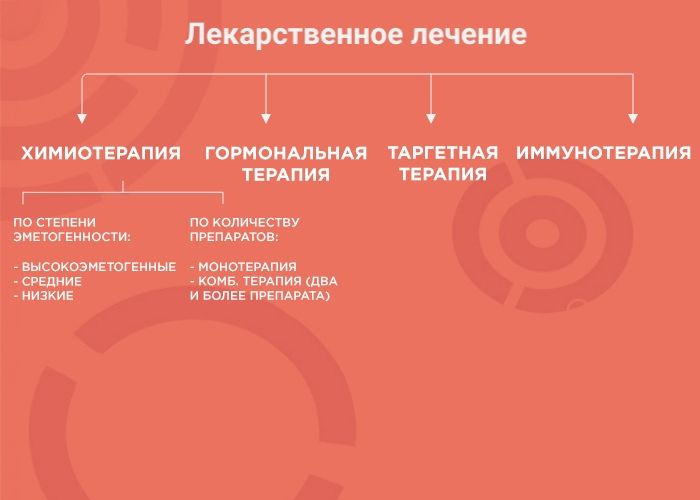
Что такое лекарственное лечение
Лекарственная терапия — один из вариантов лечения онкологических заболеваний. Ее возможности и эффективность зависят от типа злокачественного образования. В лекарственной терапии выделяется четыре вида: химиотерапия, наиболее изученный вид терапии; гормонотерапия; таргетная терапия (англ. target «цель, мишень») и иммунотерапия, самый молодой и мало изученный вид лечения. Чтобы понять, почему врач выбирает тот или иной вид терапии, давайте рассмотрим каждый из них более подробно.
Химиотерапия (ХТ)
Некоторые до сих пор ошибочно считают, что лекарственная терапия сводится исключительно к химиотерапии. Действительно, долгое время лекарственное лечение злокачественных опухолей отводилось цитостатикам, противоопухолевым препаратам, принцип действия которых — разрушение быстро делящихся клеток. В том числе — злокачественных.
— Для пациента, который беспокоится о выраженности тошноты важно знать, какие препараты входят в конкретно его схему лечения. Я всегда рассказываю об этом и при необходимости назначаю препараты для снижения побочных эффектов. Чаще всего это сочетание внутривенного и таблетированного вариантов противорвотных препаратов. Однако, плохое самочувствие может нагнать пациента уже дома, и тогда я обсуждаю это и назначаю препараты, которые он может принимать без надзора врача.
— Получается, как в фильмах бывает редко?
— Крайне редко! Конечно, мутить будет, и многие сравнивают это ощущение с токсикозом во время беременности. В таких случаях я рекомендую пить чай с имбирем, использовать жевательные резинки, карамель с кислым вкусом, соленые и кислые продукты.
При химиотерапии используют множество препаратов с разным механизмом действия, ориентированным под разные особенности опухоли. Поэтому врачи используют либо монотерапию (один препарат), либо комбинированное лечение (два и более препарата). Это позволяет усилить противоопухолевый эффект и уменьшить вероятность развития устойчивости опухоли к лечению.
Выделяют также чувствительные к ХТ опухоли (например, герминогенные опухоли, хорионкарциномы, лимфомы) и опухоли, малочувствительные к ХТ (меланома, некоторые виды сарком). Чтобы найти оптимальные варианты лечения для увеличения продолжительности жизни, сейчас активно ведутся клинические исследования о возможности комбинировать этот вид терапии с иммунотерапией.
Гормональная терапия (ГТ)
При гормональной терапии применяются препараты, подавляющие выработку в организме его естественных гормонов или их взаимодействие с рецепторами. Самый частый вариант опухоли, где применяется данный вариант лечения, — рак молочной железы (РМЖ). При выполнении иммуногистохимического (ИГХ) исследования и наличии положительных рецепторов эстрогена и/или прогестерона, оптимальной опцией лечения является гормонотерапия. С ее помощью, можно остановить опухолевый рост и даже добиться полного или частичного исчезновения опухоли.
— Особенность применения этих препаратов, в том что они в подавляющем случае в таблетированной форме и имеют приемлемую токсичность по сравнению с ХТ. Это позволяет пациентам совмещать лечение с работой, хобби и путешествиями.
Таргетная терапия (ТТ)
В отличие от ХТ таргетные (целенаправленные) препараты атакуют только опухолевые клетки. Опухоль для ТТ — своего рода мишень, уничтожение которой означает прекращение репликации (воспроизведения) клеток и метастазирования.
Все началось с того, что врачи отметили недостаточный эффект от цитостатиков и начали внедрять иммуногистохимические параметры. Иммуногистохимическое исследование (ИГХ) выявляет в образце ткани белки, специфичные для того или иного вида клеток. Это позволяет отличать один вид опухоли от другого и выявлять маркеры, которые отвечают за лекарственную чувствительность опухолевой ткани.
— Таргетная терапия начинается с немелкоклеточного рака легкого: в порыве клинических исследований врачи разработали препарат, который начали применять в рамках клинических исследований. Широкое использование Ирессы в клинической практике сопровождалось преимущественно разочарованиями, связанными с редкостью проявления лечебного эффекта. Загадка разрешилась достаточно быстро: анализ нуклеотидной последовательности гена EGFR, проведенный тремя независимыми исследовательскими коллективами, установил, что опухоли легких, характеризующиеся чувствительностью к Ирессе или Тарцеве, содержат мутированную форму этого рецептора. Таким образом, с 2009 года Ирессу внедрили в клиническую практику для пациентов имеющих мутацию в гене EGFR. Особенность механизма действия ТТ, заключается в блокировании мутации, в результате чего опухоль не может делиться, — поясняет Мария.
Побочные эффекты при таргетной терапии менее выражены, и пациенту чаще всего не нужно находиться в стационаре. Некоторые таргетные препараты используются в таблетированной форме, во время их приема качество жизни пациента значительно не страдает, и пациенты могут вести привычный образ жизни.
Иммунотерапия (ИТ)
Иммунотерапия — самая молодая отрасль лекарственного лечения. Существует несколько групп иммунопрепаратов с разными механизмами действия. Одни воздействуют на звено образования кровеносных сосудов в опухоли и блокируют их развитие (после чего опухоль перестает получать питание и погибает), а другие активируют и направляют иммунные силы организма на борьбу с опухолью. занимает много времени, имеет свой спектр побочных эффектов, а также требует внимания врачей и тщательной оценки динамики состояния пациента.
— По идее мы с помощью введения препаратов обучаем иммунную систему распознавать клетки опухоли и разрушать их. Это все равно что установить антивирус, — объясняет Мария.
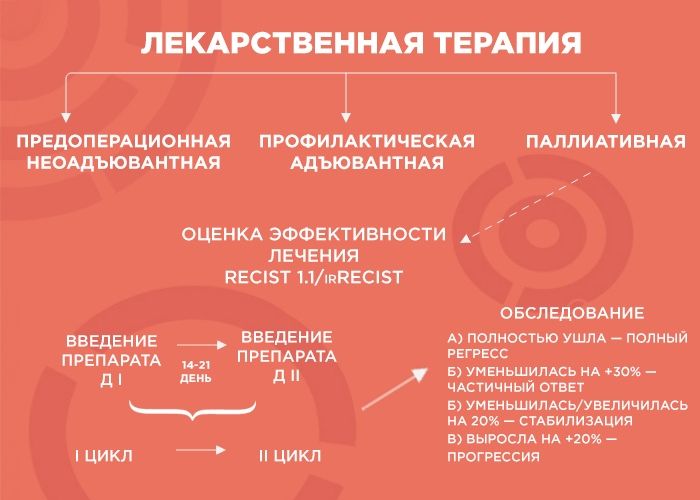
Цели и оценка эффективности лекарственного лечения
Лекарственная терапия бывает трех видов: предоперационная (неоадъювантная), профилактическая (адъювантная) и паллиативная (поддерживающая).
— Как проходит лечение в каждом из случаев?
— Начнем с предоперационной лекарственной терапии. Например, в отделение поступает пациент с диагнозом рак желудка. Результаты КТ показывают, что отдаленных метастатических очагов нет, однако в связи с распространением первичной опухоли операция на первом этапе невозможна. В этом случае лечение выглядит так: четыре курса терапии, затем — операция, а после нее — еще четыре курса адъювантной терапии. Зачем еще? Формально опухоль убрали, но есть риск возврата образования, и адъювантная терапия помогает его отсрочить.
Паллиативную терапию врач выбирает, когда хирургические методы бессильны (например, при отдаленных метастазах в легкие, печень, лимфоузлы и т.д.). Тогда лечение, в первую очередь, направлено на поддержание качества жизни пациента и контроль заболевания, и продолжительность лечения зависит от его эффекта. В химиотерапии врачи пользуются REСIST 1.1 — системой критериев оценки ответа опухоли на терапию, а в иммунотерапии — irRECIST.
— Объясню, как это работает, на примере пациента с опухолью толстой кишки и с множественными метастазами в печени и легких. Чтобы оценить серьезность ситуации, мы проводим обследование, выявляем наиболее измеряемые очаги и проводим два-три цикла химиотерапии. Большая часть курсов ХТ — введение препарата. Между первым введением и вторым — 14-21 дней — и этот временной промежуток называется циклом.
Далее мы смотрим и сравниваем. Если опухоль уменьшилась более чем на 30% — это частичный ответ, и нужно продолжать терапию до шести курсов. Если она ушла — это полный регресс, и тоже добавляем четыре курса, чтобы закрепить результат. Если опухоль увеличилась или уменьшилась на 20% — это стабилизация, мы делаем еще два курса и снова смотрим: если ситуация не изменилась, пациент отправляется на химиотерапевтические каникулы до прогрессирования заболевания, а потом схема повторяется.
Но если опухоль на фоне лечения выросла больше чем на 20% — мы имеем дело с прогрессией, вероятнее всего, это говорит нам об агрессивности опухоли. В этом случае я объясняю пациенту, что с ним происходит и почему мы меняем лечение.
— Как уговорить пациента на лечение?
— К каждому нужен индивидуальный подход. Я всегда говорю: «Химия может ухудшить ваше состояние, но бояться этого не стоит — мы попытаемся подобрать оптимальную симптоматическую терапию, которое уменьшит нежелательные явления». Если после этого во время лечения появятся данные о плохой переносимости, мы подумаем об уменьшении дозы цитостатика. Бывают случаи, когда я буквально уговариваю пациента пойти на терапию и объясняю ему, за что мы боремся. И объясняю это вне зависимости от серьезности случая — если при агрессивной опухоли человек настроен бороться до последнего, моя обязанность ему эту возможность дать.




.jpg)