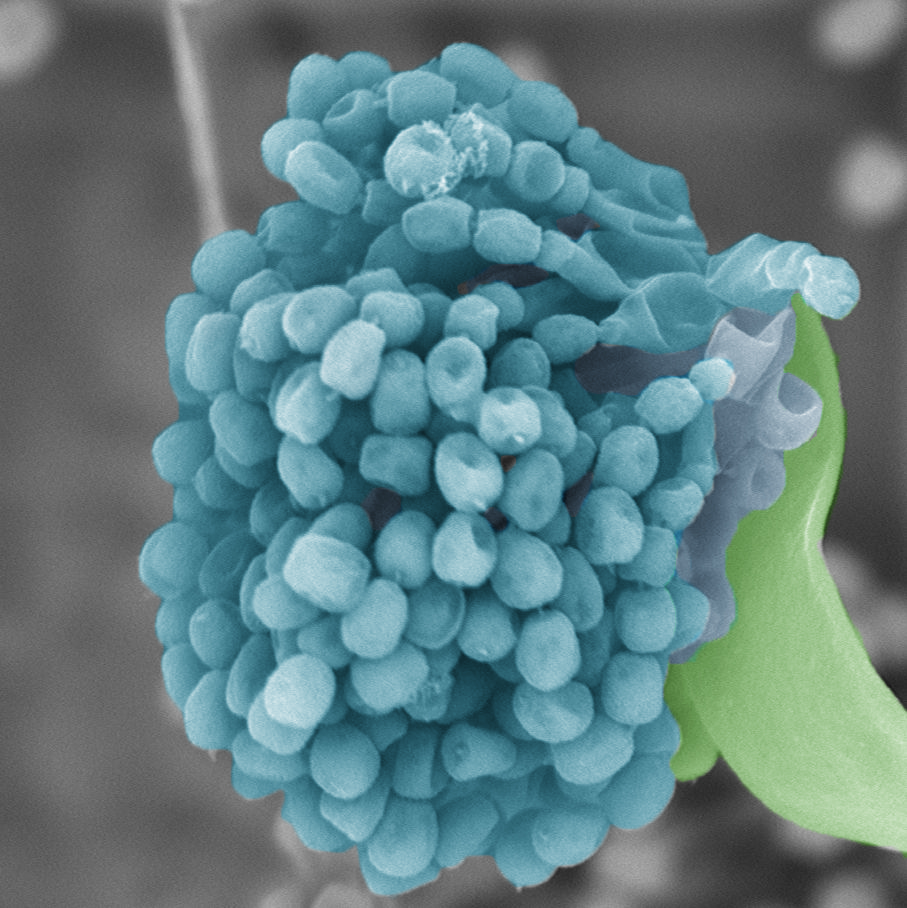
Микогенная сенсибилизация что это такое
Микогенная сенсибилизация что это такое
Современный взгляд на проблему микогенной аллергии
Автор статьи: Козлова Я.И., врач аллерголог-иммунолог, доцент кафедры клинической микологии, аллергологии и иммунологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава РФ, кандидат медицинских наук.
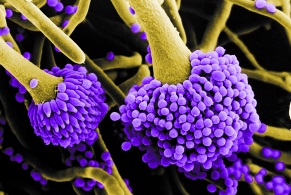
Выделяют две основные группы грибов:
Главные таксономические группы (классы) грибов: Ascomycetes, Basidiomycetes, Zygomycetes, Oomycetes и Deuteromycetes. Для практического использования более полезна экологическая классификация главных аллергенных грибов (таблица,1). Она объединяет группы микромицетов, которые спороносят при одинаковых условиях (например, увеличение концентрации спор в один и тот же сезон).
Таблица 1. Экологическая классификация главных аллергенных грибов
Ascomycetes:
Alternaria, Cladosporium, Epicoccum, Curvularia
На поверхности листьев, ванная комната
Увеличение концентрации при сухой ветреной погоде
Basidiomycetes:
Pleurotus, Ganoderma, Calvatia, Coprinus
На гниющих деревьях, в темных местах и парках
Преимущественно «outdoor». Возможна высокая концентрация в воздухе, не зависящая от внешних условий.
Deteromycetes:
Почва, мусор, сырые листья, склады, подвалы
Преимущественно «indoor». Увеличение концентрации при высокой влажности, сырости
Аллергенами грибов могут быть следующие их вещества:
Галактозамины, полисахариды входят в состав клеточной стенки грибов и служат распространенными аллергенами. Хотя чистые полисахариды являются Т-независимыми антигенами и индуцируют ответ В-лимфоцитов, примесь пептидов и липидов обеспечивает развитие всех видов иммунного ответа.
Наиболее важные аэроаллергены – Alternaria, Asperillus, Cladosporium, Penicillium.
Alternaria alternate принадлежит к Ascomycetes и является одним из важных аллергенных грибов. Выявлена связь между сенсибилизацией к Alternaria и угрожающей жизни астмой. Споры Alternaria обнаруживают в воздухе круглогодично с пиковыми уровнями в августе и осенью. Был выделен главный аллерген Alt a 1.
Cladosporium herbarum принадлежит к Deuteromycetes, обнаруживают преимущественно вне помещений и в отличие от Aspergillus, в холодном климате, например в Скандинавии. Концентрация спор Cladosporium достигает пика в весенне-осенний период и уменьшается с первыми заморозками. Было выделено три главных аллергена: Cla h 1, Cla h 2 и Cla h 4.Cladosporium содержит энолазу – главный аллерген в большинстве грибов.
Penicillium citrinum принадлежит к Deuteromycetes и является важным внутренним аллергеном. Как и Aspergillus, относится к «складским грибам» и присутствует в хранилищах зерна, фруктов и овощей. Смеси белых мягких сыров («Камамбер», «Бри», «Гаргонзола» и «Рокфор») содержат плесени, принадлежащие роду Penicillium. По данным современных исследований пациенты с аллергией на вдыхание спор плесени обычно не имеют аллергию на плесневой сыр.
Таблица 2. Характеристика главных грибковых аллергенов
Молекулярная масса, кДа
70 кДа гликопротеид
Белок теплового шока
Гомолог фибриногенсвязывающего белка C.albicans
Пероксисомный мембранный протеин
Гомолог грибкового рибофлавина
Гомолог растительной и бактериальной эндо-β-1,3-1,4-глюконазы
Белок теплового шока
Гомолог сериновой протеазы
Вакуольная сериновая протеаза
1,3 –рибосомный белок
Рибосомный белок Р2
Вакуольная сериновая протеаза
Рибосомный белок Р1
Пероксисомный мембранный белок
Белок теплового шока
Фактор элонгации 1β
Микогенная аллергия
Чтобы подчеркнуть роль микромицетов в развитии аллергических заболевании, в 1983 году в Гамбурге на совещании экспертов ВОЗ был предложен термин «микоаллергозы». Однако еще в 1726 году John Floyer описал развитие приступов удушья у больных БА после посещения ими винных подвалов. В 1873 году Blackley выявил роль грибов Chaetomium spp. и Penicillium spp. в провоцировании приступов БА.
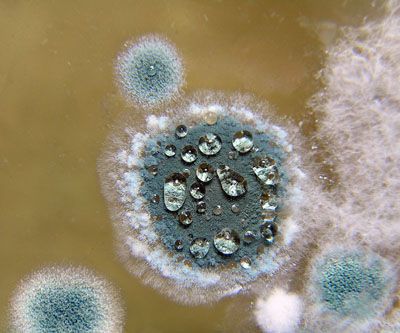
Диагностика микогенной аллергии
Cбор анамнестических данных – первый и очень важный этап выявления микогенной аллергии. Он подразумевает сбор не только сведений, полученных со слов пациента, но и анализ медицинской документации: данных амбулаторной карты больного, выписок из стационаров и т.д. У больного необходимо уточнить первые симптомы заболевания и время их появления, динамика развития, возможный контакт с плесневыми грибами дома или на работе, наличие аллергических реакций, наследственность по атопии, предшествующая терапия и ее эффективность.
На сегодняшний день врачи располагают следующими средствами специфической диагностики гиперчувствительности к грибковым аллергенам: кожные тесты и определение специфических IgE-антител (sIgE). Ингаляционный провокационный тест с антигенами Aspergillus spp. не рекомендован в связи с возможностью развития фатального бронхоспазма. К недостаткам кожного тестирования относят риск развития побочных реакций организма на дополнительную антигенную нагрузку, возможность возникновения ложноположительных и ложноотрицательных результатов. Кроме того, в настоящее время в России нет ни отечественных, ни зарубежных грибковых аллергенов для in vivo диагностики, представленных в Реестре в Министерстве Здравоохранения России.
Основными преимуществами методов специфической аллергодиагностики in vitro являются безопасность для больного и высокая информативность. Определение специфических IgE in vitro является одним из самых распространенных методов диагностики микогенной аллергии немедленного типа. Основными методами исследований являются иммуноферментный (ИФА), иммунохемилюминисцентный (ИХЛА), иммунофлюоресцентный (ИФЛА) анализы. В настоящее время большинство лабораторий используют одну из трех технологий. Однако наибольшее распространение получил иммуноферментный метод из-за его высокой специфичности и экономической доступности.
Компания Алкор Био разработала широкий спектр грибковых аллергенов. Биотинилированная форма аллергенов обеспечивает высокую чувствительность и специфичность иммуноферметного анализа. Основываясь на нашем опыте, можно с уверенностью утверждать, что тест-системы «АллергоИФА специфические IgE» производства Алкор Био являются оптимальным инструментом для подтверждения микогенной сенсибилизации у разных категорий больных.
Кроме того, в настоящее время идет поиск новых тестов, которые позволят выявить патогенетические механизмы аллергии, диагностировать и дифференцировать псевдоаллергические реакции. Одним из наиболее перспективных направлений аллергодиагностики in vitro, в том числе и для выявления микогенной аллергии, является тест активации базофилов специфическими аллергенами с помощью проточной цитометрии.
Тяжелая бронхиальная астма с микогенной сенсибилизацией (ТБАМС)
Предполагают, что тяжелое течение бронхиальной астмы отмечают у 10% больных, а сенсибилизацию к грибам выявляют у 33% таких пациентов. Таким образом, по данным экспертов LIFE (Leading International Fungal Education) расчетное количество больных тяжелой бронхиальной астмой с микогенной сенсибилизацией составляет 6,5 миллионов человек в мире и 231 000 человек в Российской Федерации. Влияние региональных и этнических факторов на распространенность тяжелой бронхиальной астмы в настоящее время не определено.
С тяжелой, жизненно-угрожающей бронхиальной астмой ученые связывают гиперчувствительность к грибам Alternaria spp. и Aspergillus spp. Для детей, сенсибилизированных к Alternaria spp. характерно развитие персистирующей астмы в зрелом возрасте. Однако, ассоциированная сAspergillus fumigatus бронхиальная астма не ограничивается тяжелым течением заболевания. Положительные кожные тесты и/или специфические IgE кAspergillus spp. часто выявляют у больных легкой или среднетяжелой контролируемой бронхиальной астмой.
Аллергический бронхолегочный аспергиллез (АБЛА)
Давно известно, что сенсибилизация к Aspergillus spp. – важный патогенетический этап в развитии такого тяжелого хронического заболевания легких, как АБЛА. Наиболее часто АБЛА осложняет течение бронхиальной астмы и муковисцидоза. Для больных из этих групп характерны нарушения защитных механизмов слизистых оболочек дыхательных путей, в том числе дефекты мукоцилиарного клиренса и функции эпителиальных клеток. Все это облегчает колонизацию дыхательных путей грибковыми спорами.
АБЛА был впервые описан K. Hinson и соавторами в 1952 году. По оценкам экспертов количество больных АБЛА в мире достигает около четырех миллионов человек, а в Российской Федерации – 175 тысяч. Распространенность АБЛА может варьировать в зависимости от этнической принадлежности и концентрации грибковых спор в воздухе. Известно, что многие исследователи связывают обострения АБЛА с воздействием окружающей среды. У больных АБЛА, как правило, отмечают плохо контролируемую бронхиальную астму, хрипы, кровохарканье и продуктивный кашель. Также характерно небольшое повышение температуры тела, потеря веса, недомогание, усталость. У 31-69% больных наблюдают отделение мокроты, содержащей коричневато-черные включения. При физикальном осмотре может быть выявлено осложнение АБЛА – легочная гипертензия. Кроме того, некоторые пациенты, которые получают базовую противоастматическую терапию, не имеют характерных симптомов, и АБЛА не может быть установлен при рутинном обследовании.
Учитывая особенности клинической картины, больные АБЛА обращаются за медицинской помощью к врачам разных специальностей – терапевтам, пульмонологам, аллергологам-иммунологам и др. Но, к сожалению, врачи недостаточно информированы о диагностике и лечении этого заболевания. Во многих странах, в том числе и в России, АБЛА часто не распознают вовремя. В развивающихся странах в 30% случаев устанавливают неправильный диагноз туберкулеза легких. Результаты исследований свидетельствуют, что период между появлением первых симптомов и постановкой диагноза АБЛА может составлять до 10 лет.
Международное общество микологии человека и животных (ISHAM) сформировало рабочую группу «АБЛА у больных бронхиальной астмой» для обобщения результатов современных исследований и составления руководств по диагностике и лечению этого заболевания. Предложенные новые диагностические критерии представлены в таблице 3. Они помогут практикующим врачам своевременно выявить АБЛА, предупредить прогрессирование заболевания и начать терапию.
Таблица 3. Новые диагностические критерии аллергического бронхолегочного аспергиллеза у больных бронхиальной астмой (R. Agarwal et al., 2013)
Факторы риска
Обязательные критерии
(оба должны присутствовать)
Дополнительные критерии
(должны присутствовать два из трех)
* Если пациент отвечает всем другим критериям, то уровень общего
IgE может быть менее 1000 МЕ/мл
**Характерные для АБЛА рентгенологические признаки могут быть временные (летучие инфильтраты) и постоянные (кольцевидные и параллельные тени, бронхоэктазы, плевролегочный фиброз)
Целями терапии АБЛА являются достижение контроля над астмой, профилактика и лечение обострений, предупреждение развития бронхоэктазов и хронического аспергиллеза легких. В качестве противовоспалительной терапии используют системные глюкокортикостероиды, а для уменьшения грибковой нагрузки в дыхательных путях – антимикотические препараты.
Аллергический микотический риносинусит (АМРС)
По данным современных авторов данной патологией страдает от 5 до 10% больных хроническим риносинуситом. Предполагают, что заболеваемость АМРС зависит от географического расположения региона. Наибольшую частоту АМРС выявляют в умеренных широтах, где относительно высокая влажность атмосферного воздуха. Ранее считали, что основными возбудителями АМРС, так же как и аллергического бронхолегочного аспергиллеза (АБЛА) являются Aspergillus spp. На современном этапе ведущую роль исследователи отводят феогифомицетам, в частности Bipolaris spp. Предполагают, что АМРС и АБЛА имеют сходные механизмы патогенеза. А именно развитие I и III типов реакций гиперчувствительности по Gell и Cumbs в ответ на ингаляционные грибковые антигены.
Из лабораторных признаков АМРС основными являются увеличение количества эозинофилов в периферической крови, повышение уровня общего IgE, выявление специфических IgE и IgG к грибковым антигенам в сыворотке крови. Уровень общего IgE при АМРС обычно высокий, и составляет более 1000 ЕД/мл. При проведении кожного тестирования для АМРС характерна положительная проба с Bipolaris spp, Aspergillus spp и другими грибковыми аллергенами.
Прогноз заболевания серьезный. Нераспознанный АМРС может вызывать значительные повреждения костной ткани, приводя к изменениям лицевого скелета. Присоединение бактериальной инфекции может способствовать развитию внутричерепных и орбитальных осложнений. Лечение состоит из комбинации хирургического вмешательства с оральными кортикостероидами. Антимикотические препараты в терапии АМРС не используются, хотя эта область требует дальнейшего изучения.
Лечение микогенной аллергии:

Заключение:
Роль микромицетов в развитии различных заболеваний человека более значима, чем принято считать. Гетерогенность аллергенов грибов – причина смешанных вариантов аллергических реакций и разнообразия клинических форм: от кожных до респираторных заболеваний. Таким образом, диагностика микогенной аллергии является актуальной задачей современной медицины. Гиперчувствительность к плесневым грибам – важный этап в патогенезе не только АБЛА, но и тяжелой бронхиальной астмы с микогенной сенсибилизацией, аллергического микотического риносинусита и других хронических заболеваний органов дыхания. Своевременное выявление этих заболеваний необходимо для назначения адекватной противовоспалительной и антимикотической терапии. В том случае, когда выполнение провокационных исследований связано с риском развития системных реакций, а для проведения кожных проб имеются противопоказания и нет доступных аллергенов, особенно важны лабораторные методы аллергодиагностики.
Микогенная аллергия
Роль грибковых микроорганизмов в развитии аллергических, токсико-аллергических и парааллергических процессов в организме человека остается недостаточно известной и сравнительно мало представлена в медицинской литературе (даже в специальных трудах по инфекционной аллергии).
П.Н. Кашкин и В.Я. Некачалов (1970) отмечают, что явления сенсибилизации организма, обусловленной патогенными и сапрофитными грибами, в современных условиях будут иметь тенденцию к нарастанию, причем не только у различных больных, но и в производственных условиях, например, аллергические реакции у медперсонала, лиц, занятых производством антибиотиков, у рабочих мукомольных, целлюлозобумажных комбинатов, пивоваренных и спиртовых заводов и т.д.
Иммунитет и специфическая сенсибилизация при микозах, возникающие в результате соответствующих заболеваний или иммунизации, подчиняются тем же закономерностям, что и многие другие инфекционные процессы бактериальной природы.
Микиды (Mykida), микоаллергнды — как отмечено, являются вторичными аллергическими проявлениями, наблюдаемыми при микозах.
Значительное клиническое разнообразие микотической аллергии может быть обусловлено:
— биологическими особенностями грибов-возбудителей микозов; большое значение при этом имеет природа гриба, его патогенные и аллергенные свойства. Степень специфической сенсибилизации, аллергические проявления в свою очередь неразрывно связаны с биохимическими особенностями грибов-возбудителей, различной структурой их антигенных комплексов и их инвазионной способностью, вирулентностью, вступающими во взаимодействие с факторами иммунной защиты.
Считают, что одной из причин, обусловливающих своеобразие иммуно-биологических реакций при грибковых заболеваниях (в отличие от бактериальных болезней) являются большой размер клеток грибов, их более сложный биохимический аппарат, своеобразный состав клеточной стенки возбудителей (эргостеролы, полисахариды и др.);
— ответной реакцией макроорганизма, его иммунобиологическим состоянием, специфическими и неспецифическими защитными реакциями. Иными словами, специфика взаимодействия между инфект-агентом и макроорганизмом существенно варьирует в зависимости от индивидуальных особенностей гомеостаза конкретного организма (состояние иммунного надзора, гормонального статуса, наличия сопутствующих заболеваний, генетических аномалий и др.). Это не может не отражаться на особенностях и своеобразии проявлений микотической аллергии;
— факторами внешней среды (например, возникновение «климатической астмы» микотической этиологии у лиц, недавно прибывших в регионы с непривычными климатическими условиями).
Впервые микоаллергнды (трихофигиды) были описаны в 1913 г Jadasson. Было отмечено, что у некоторых больных с трихофитией временами возникают более или менее распространенные, остро протекающие высыпания, иногда сопровождающиеся общими симптомами. Трихофитиды и другие микиды выявлялись чаще при нагноительных формах микозов (керион, паразитарный сикоз и др.), а также после рентгеновского облучения очагов поражения (в целях эпиляции), иньекций эмульсии скипидара и других принятых в то время лечебных процедур.
Обострения грибкового процесса с появлением вторичных (негрибковых) высыпаний наблюдались также у больных, которым вводился трихофитии с лечебной или диагностической целью. Установлено, что подобные высыпания часто исчезают без лечения через несколько дней и могут снова появиться после провоцирующих специфических и неспецифических воздействий.
Однако, в настоящее время проблема грибковой аллергии, особенно в связи с широким использованием антибиотиков, вышла далеко за пределы указанных характеристик. Существуют неопровержимые факты, свидетельствующие о роли микогенной сенсибилизации в развитии тяжелых аллергических заболеваний дыхательной системы (аллергические изменения легочной ткани с появлением астматоидного микогенного синдрома), кровеносных сосудов, пищеварительной системы (аллергические изменения кишок, ткани печени и др.), аллергических дерматозов.
При этом развившаяся аллергия значительно изменяет клиническое течение болезни, обусловливает стойкость к различным видам терапии, а иногда вызывает извращенные реакции вплоть до шока на введение препаратов (например, пенициллинов у больных с грибковыми заболеваниями, протекающими с различной интенсивностью). Учитывая это, в условиях возрастающей аллергизации населения следует более внимательно относиться к возможности микогенной сенсибилизации кожи и внутренних органов и ее тяжелым последствиям.
К сожалению, мало изученными остаются иммунозависимые изменения в лимфоидной ткани, которые, возможно, взаимосвязаны с хронизацией аллергического процесса. В частности, неясной остается роль лимфатической системы при аллергических заболеваниях кожи, в т.ч. обусловленных патогенными грибами.
Несмотря на клиническое разнообразие аллергических форм, можно отметить общие черты и характеристики микидов (независимо от природы возбудителя):
— наличие первичного очага микоза (на коже, слизистых оболочках или во внутренних органах) — и вторичный характер аллергических проявлений;
— в противоположность истинным микозам, грибковые элементы в очагах аллергических проявлений не выявляются (обычными лабораторными методами);
— провоцирующими факторами появления микидов могут быть нерациональная терапия е области первичного грибкового очага, общее или местное применение протиаомикробных антибиотиков, травма и др.;
— многообразие клинических проявлений аллергических форм микидов;
— нередко отсутствие определенных клинических форм микидов соответственно той или иной группе микозов или конкретному грибковому заболеванию;
— отличный от первичного грибкового очага клинический и патогистологический характер изменений в области микидов;
— стихание или регресс вторичных аллергических проявлений (отличающихся динамичностью) вслед за санацией первичного грибкового очага, а также под влиянием десенсибилизирующей терапии. К сожалению, это бывает не во всех случаях (в т.ч. при формировании истинного аллергического заболевания, например, микотической экземы, а также парааллергических реакций).
Таким образом, как отмечено, аллергия может ослабевать и даже полностью исчезать вслед за разрешением первичных микотических очагов, т.е. после выздоровления. С другой стороны, после микотических заболеваний могут развиваться длительно протекающие патологические процессы, в основе которых лежит аллергическая перестройка организма, обусловленная грибами. Возможно формирование также качественно новых парааллергические процессов (аллергические изменения во внутренних органах, кровеносных и лимфатических сосудах и др.). При неблагоприятных условиях моновалентная сенсибилизация может перерасти в поливалентную.
Следует отметить, что судьба микидов (включая остроту, интенсивность аллергических поражений и степень их распространения) неодинакова у разных больных. В одних случаях остро возникшие микиды довольно быстро исчезают (по мере стихания воспалительных явлений в основном очаге микоза аллергические проявления могут регрессировать и самостоятельно). У других больных они принимают весьма затяжное течение (месяцы, годы), нередко экзематизируются.
В некоторых случаях, хотя микиды становятся диссеминированными и сопровождаются общими острыми реакциями всего организма (озноб, повышение температуры тела, головная боль, артралгии, недомогание, полиаденит), процесс заканчивается благополучно после общей десенсибилизирующей терапии, постельного режима, симптоматического лечения. Однако, у некоторых предрасположенных больных при нарастании аллергической перестройки организма могут развиваться тяжелые патологические процессы (появление астматоидного компонента, аллергического поражения в сердечно-сосудистой системе, возможно — компонентов лимфатической системы).
Уменьшение интенсивности аллергических реакций в ответ на внутрикожное введение соответствующего аллергена служит одним из показателей десенсибилизации организма; ослабление яркости проявлений и исчезновение микидов — убедительный показатель эффективности десенсибилизирующей терапии. Следовательно, излечение первичного, аллергизирующего грибкового очага поражения является самым существенным и необходимым в достижении десенсибилизации организма и прочного исчезновения аллергических реакций (П.Н. Кашкин, В.Я. Некачалов, 1970).
Номенклатура аллергических клинических микотических форм (включая их синонимы и близкие термины) весьма разнообразны; микиды обозначались как: кандидомикиды, левуриды, микоаплергиды, эпидермофитиды, монилииды, микроспориды, споротрихиды, трихофитиды, фавиды, фитиды и др.
Возбудители микозов животных обладают более яркими антигенными и аллергенными свойствами. При дерматомикозах, вызываемых, например, патогенными грибами антропозоофильной группы (пушистый микроспорум, гипсовый трихофитон), наблюдаются яркие симптомы грибковой сенсибилизации. Так, выраженные аллергические проявления выявляются при инфильтративно-нагноительной трихофитии, вызываемой гипсовым трихофитоном (классический пример грибковой аллергии). При этом повышенная и в ряде случаев строго избирательная чувствительность к трихофитину сохраняется у перенесших инфильтративно-нагноительную форму трихофитии иногда в течение 20 и даже 40 лет.
В эксперименте на взрослых морских свинках, переболевших ранее или зараженных трихофитией во время беременности, показана возможность передачи повышенной чувствительности детенышам (СМ. Фрид и др.).
Характер аллергических сдвигов в организме при микозах стоп зависит от видового состава возбудителей. Так, трихофитон интердигитальный (Кауфманн-Вольф) и паховый эпидермофитон Сабуро являются сильными реактогенными микроорганизмами, тогда как красный трихофитон Кастеллани-Банга оказывается менее активным в аллергенном отношении дерматофитом.
Своеобразная картина аллергической перестройки организма наблюдается у взрослых больных с хронической трихофитией, обусловленной антропофильными видами дерматофитов. При этом обычно отмечается очень вялая реакция в отношении «своего» гриба (реакция на трихофитии часто негативная); в то же время на новый вид возбудителя у таких больных возникает резко выраженный гиперергический ответ (В.Я. Некачалов.1964).
При некоторых формах микозов (традиционными методами исследования) не удается установить аллергических сдвигов. Так, при глубоком микозе — криптококкозе (торулез, европейский бластомикоз Буссе-Бушке), несмотря на тяжесть поражения и значительные патологические изменения в тканях, сенсибилизация к грибам — возбудителям заболевания не выявляется.
Возможно, это связано с тем, что криптоккоки, проникая в ткань (нередко мозговую), как бы инкапсулируются, не вызывая при этом клеточной воспалительной реакции вокруг скоплений элементов гриба. Криптококкоз — один из немногих микозов, при котором у людей и животных не представляется возможным выявить кожную чувствительность к грибам или продуктам их жизнедеятельности. У переболевших не всегда можно обнаружить соответствующие антитела, связывающие комплемент и агглютинины.
В противоположность этому, при другом глубоком микозе — гистоплазмозе, поражающем преимущественно ретикуло-эндотелиальную систему (систему мононуклеарных фагоцитов — СМФ), отчетливо наблюдается выраженная специфическая аллергизация. При заражении гистоплазмозом положительные внутрикожные пробы с гистоплазмином (фильтрат жидких культур гриба) появляются раньше серологических реакций (агглютинации, преципитации, связывания комплемента) и сохраняются у переболевших многие годы.
Например, в эндемичных зонах Америки, где встречается этот микоз, около 80% населения реагируют положительно на гистоплаэмин, причем чувствительность к нему наблюдается, начиная с дошкольного и школьного возраста (антитела в крови у этих детей обычно отсутствуют). Полагают, что в этих случаях сохраняющаяся годами специфическая аллергия создает тот «защитный фон» макроорганизма, который обеспечивает устойчивость к новому заражению и «смягчает» течение повторных заболеваний в тех случаях, когда они возникают.
Аллергические пробы с гистоплазмином были с успехом использованы для эпидемиологического анализа заболеваемости населения в эндемичных местах. Этим же методом в основном пользовались при выявлении путей распространения инфекции и частоты заболеваний гистоплазмозом у домашних животных и птиц.
Особенно отчетливо выявляется специфическая аллергия к патогенному грибу и продуктам его жизнедеятельности при кокцидиоидозе (болезнь Посадас-Вернике), имеющем эпидемиологическое значение в Калифорнии (США), Аргентине и отмечаемое изредка в других странах (в том числе в бывшем СССР). При этом наблюдается резко выраженная аллергическая перестройка, отличающаяся высокой специфичностью и постоянством; иммунная перестройка проявляется и накоплением специфических антител.
Отмечено, что наиболее яркие проявления аллергии наблюдаются у больных с кожными поражениями в виде узловатой и экссудативной полиморфной эритемы. Аллергия при кокцидиоидном микозе сохраняется длительно (нередко почти всю жизнь); при этом положительные аллергические реакции выявляются у переболевших в течение многих лет. Полагают, что аллергия в этих случаях также носит защитный характер, способствует выздоровлению, «смягчает» тяжесть болезни, защищает организм от перехода инфекции в генерализованную (активную, потенциально летальную) форму и предохраняет от повторного заражения.
Кстати, у больных прогрессирующим кокцидиоидозом, кожные реакции бывают менее выраженными, а в терминальной стадии болезни — часто негативными (анергия). Аллергические реакции на кокцидиоидин используются в качестве одного из методов эпидемиологического обследования населения в неблагополучных по заболеванию регионах. При высокой специфичности они позволяют выявлять как больных, так и переболевших людей и некоторых сельскохозяйственных животных. Следовательно, аллергические реакции при кокцидиоидозе имеют диагностическое и прогностическое значение.
Аллергические внутрикожные пробы с кокцидиоидином дают отчетливую реакцию даже в разведении 1:1000 (при отрицательном ответе прибегают к разведению аллергена 1:100). Оценка реакции дается через 48 часов. При этом обширное покраснение, отечность, папулезный, а иногда и узловатый инфильтрат на месте введения кокцидиоидина сохраняется в течение нескольких дней (свидетельствует о высокой специфической Сенсибилизации организма).
Актиномикоз принадлежит к числу микозов, аллергизирующих больного. ДН. Аснину и Г.О. Сутееву удалось приготовить «актинолизат» (продукт спонтанного лизиса актиномицетов на питательной среде), который с успехом применяется для кожно-аплергических проб и для лечения больных. Актинолизат оказался весьма специфичным антигеном (однако, внесены коррективы в первоначальную оценку актинолизата и его специфичности). Вместе с тем, данные о сенсибилизации при актиномикозе нередко противоречивы. Например, неизвестны аллергические проявления актиномикоэа типа трихофитидов, левуридов, споротрихидов и др.
Кулага В.В., Романенко И.М., Афонин С.Л., Кулага С.М.