Микрофлора и микробиота в чем разница
Не все йогурты одинаковые — полезные статьи Активиа
Микробиота кишечника: что это такое и в чём её роль в организме человека
В нашем организме около 30 триллионов клеток и почти столько же бактерий.
Что такое микробиота?
По нашему телу микроорганизмы распределены неравномерно, и в местах обитания бактерий – нишах – формируется свое особенное микробное сообщество: на коже, в полости рта, дыхательных путях и кишечнике.
***Разная микробиота: собственные наборы бактерий для кожи, полости рта, лёгких, влагалища, кишечника.
Человек не приходит в этот мир с уже сформировавшейся микробиотой — она развивается и до, и после рождения.
Примерно к трем годам у ребенка полностью формируется микробиота [2]. В течение всей жизни она будет меняться незначительно [3], а в пожилом возрасте ее состав станет менее разнообразным из-за процессов старения и влияния привычной пищи [4].
Микробиом, микробиота, микрофлора — в чем разница?
Термины «микробиом» и «микробиота» часто используются как синонимы, но различия между ними все-таки есть.
Микробиота — это совокупность микроорганизмов определенной экосистемы (наше тело — тоже своего рода макроэкосистема для различных микроорганизмов). Ее составляют не только бактерии — она включает еще и дрожжи, вирусы, археи и другие виды микроорганизмов.
Микробиом — это совокупность генов микробиоты, ее коллективный геном.
Кто населяет наш кишечник?
Условно-патогенные (оппортунистические) бактерии для здорового человека обычно безвредны. Но они резко размножаются при негативном воздействии на организм. Если человек получил травму, произошел сбой в иммунной системе или нарушился баланс в составе микробиоты, нейтральные микробы могут стать патогенными. Например, из-за стресса на фоне приема антибиотиков растет число оппортунистических бактерий [8,9].
Функции кишечной микробиоты
Работа, которую выполняют бактерии кишечника, трудна и незаметна — по крайней мере, на первый взгляд. Однако именно микробиота нужна для выполнения нескольких важных функций организма [10]:
• Поддержка иммунитета. Микробиота нужна для эффективной работы иммунной системы: бактерии кишечника выступают в роли своеобразного «тренажера». А главное, обитатели микробиома постоянно конкурируют между собой, занимая свободное пространство, и места для патогенных микробов уже не остается.
• Синтез витаминов (К, группы В и других), которые всасываются в кишечнике вместе с пищей.
Этим перечнем функции микробиоты не исчерпываются. Исследования показывают [11], что бактерии в ее составе влияют на настроение, на работу нейромедиаторов и на уровень главного гормона стресса — кортизола.
Все эти функции — пищеварение, помощь иммунной системе, синтез витаминов — выполняют далеко не все бактерии. Микробиота — это целая экосистема, где каждая часть микроорганизмов отвечает за свою задачу. Фактически, это орган в органе со своими особенностями и функциями. Мы получаем его при рождении и растем вместе с ним, формируя свой собственный, уникальный профиль микробиома.
Что может влиять на микробиоту
Что же влияет на микробиоту?
Как улучшить микробиом кишечника
Вопросы и ответы о микробиоте
Различается ли микробиота толстого и тонкого кишечника?
Да, различается — и по составу (количественному и качественному), и по функциям. Микробиота тонкого кишечника отвечает за защиту слизистой оболочки, принимает активное участие в усвоении питательных веществ, участвует в иммунной защите нашего организма.
Микробиом толстого кишечника — это настоящий центральный реактор всего ЖКТ. От него зависит наше самочувствие. К тому же, в толстом кишечнике микробиоты в разы больше, чем в тонком. Поэтому мы чаще говорим о микробиоте толстого кишечника.
Как узнать состояние своей микробиоты?
Если исследование нужно для лечения, назначить его и интерпретировать полученные результаты должен только лечащий врач.
Связаны ли микробиоты разных органов?
Тем не менее, микробиоты могут влиять друг на друга. Например, продолжительный прием определенных лекарств может привести к тому, что микробы желудка будут попадать в кишечник и там размножаться, приводя к дисбиозу.
Что такое «пересадка микробиоты»?
Это еще один способ восстановить баланс микроорганизмов, когда бактерии доставляются не стандартным способом, через весь ЖКТ, а сразу в нужную часть кишечника. Так микробы оказываются на нужном месте быстрее, но пересадка весьма трудоемка, и используют ее редко, только при очень тяжелых заболеваниях. Чаще всего достаточно классических методов лечения.
Микробиота кишечника и пробиотики / синбиотики для модуляции иммунитета у тяжелобольных пациентов
Микробиота кишечника и пробиотики / синбиотики для модуляции иммунитета у тяжелобольных пациентов
Резюме
1. Введение
Рисунок 1. Концепция дисбаланса иммунной системы, вызванного травмой.
Дисфункция кишечника, в том числе кишечного эпителия, кишечной иммунной системы и кишечной микробиоты, является одним из причинных факторов прогрессирования заболевания [5]. Утрата полезных микробов, распространение патобионтов и потеря разнообразия определяются как «дисбиоз», который может изменить иммунитет хозяина [6]. В частности, кишечная микробиота и микробные метаболиты, такие как короткоцепочечные жирные кислоты ( SCFAs ) и триметиламин N-оксид ( ТМАО ), связаны с такими заболеваниями человека, как аллергические и иммунные расстройства, рак, сердечно-сосудистые заболевания и неврологические расстройства [7]. В этом обзоре кратко рассказывается о том, как микробиота кишечника приводит к системному воспалению и кишечной терапии в условиях критического состояния.
Как только происходит инсульт, он вызывает значительные фенотипические изменения в иммунной системе. У травмированного хозяина после тяжелой травмы развивается воспаление, которое называется синдромом системной воспалительной реакции ( SIRS ). Если состояние SIRS затягивается, оно прогрессирует до стадии синдрома полиорганной дисфункции ( MODS ). Воспаление и иммуносупрессия совпадают с началом сепсиса, и в этой концепции развивается стойкое воспаление, иммуносупрессия и синдром катаболизма ( PICS ) [8]. Было показано, что это провоспалительное состояние в основном обусловлено макрофагами, причем регуляторные Т-клетки являются медиаторами этой компенсаторной реакции после травмы.
2. Кишечное происхождение сепсиса и системного воспаления.
В клинических исследованиях бактериальная транслокация присутствовала в брыжеечных лимфатических узлах примерно у 15 % пациентов, перенесших лапаротомию [16], и примерно у 35% пациентов, перенесших гепатэктомию по поводу рака желчных протоков [17]. В лимфе преобладали облигатные анаэробы, такие как группы Clostridium coccoides и Bacteroides fragilis. Эти результаты предполагают, что кишечный барьер после травмы может позволить бактериям и медиаторам кишечного происхождения проникать в брыжеечную лимфу и в кровоток и активировать системную воспалительную реакцию.
3. Микробиота кишечника у тяжелобольных пациентов.
Таблица 1. Фекальная флора у пациентов с тяжелым синдромом системного воспалительного ответа (SIRS)
Таблица 2. Концентрация органических кислот в кале и pH у пациентов с тяжелым синдромом системного воспалительного ответа (SIRS).
Рисунок 2. Изменения в составе микробиоты кишечника. Репрезентативные случаи, показывающие пропорции микробиоты.
4. Иммунные реакции через кишечную микробиоту.
5. Эффекты пробиотиков и синбиотиков при критических заболеваниях.
5.1. Влияние пробиотиков на кишечник и иммунитет
5.2. Эффективность пробиотиков и синбиотиков при диарее
Сообщалось, что диарея продлевает пребывание в отделении интенсивной терапии (ОИТ) и увеличивает смертность в ОИТ [48]. Hickson et al. сообщили, что у 135 пациентов больницы, получавших антибиотики и L. casei, L. bulgaricus и Streptococcus thermophiles, лишь у 12% в группе пробиотиков наблюдалась диарея по сравнению с 34% в контрольной группе [49]. Метаанализ показал, что Saccharomyces boulardii, L. rhamnosus GG или B. longum использовались для демонстрации профилактики диареи в условиях больницы [50].
В условиях отделения интенсивной терапии Bleichner et al. сообщили, что у 128 пациентов ОИТ количество дней с диареей было сокращено в группе, получавшей S. boulardii [51]. Shimizu et al. сообщили, что B. breve, L. casei и галактоолигосахариды давали меньше осложнений в виде диареи и диареи, связанной с искусственной вентиляцией легких (ИВЛ), у 178 пациентов в критическом состоянии, находящихся на ИВЛ [52]. Профилактические пробиотики и синбиотики могут поддерживать микробиоту кишечника и снижать частоту диареи. При рефрактерной диарее трансплантация фекальной микробиоты (FMT) представляет собой сильную реконструкцию микробиоты кишечника [53], которая была рекомендована пациентам с множественными рецидивами инфекции C. difficile [54]. Также сообщалось о случае диареи, связанной с антибиотиками, среди пациентов с диареей более 5 л/сут, при которой микробиота кишечника была восстановлена, а симптомы устранены с помощью FMT [55]. При тяжелом нарушении микробиоты кишечника в ОИТ могут потребоваться более эффективные пробиотики/синбиотики.
5.3. Профилактическое действие пробиотиков и синбиотиков при критических заболеваниях
Рисунок 4. (а) Последовательные изменения в Bifidobacterium и Lactobacillus после поступления. Количество Bifidobacterium и Lactobacillus в группе синбиотиков было значительно увеличено по сравнению с таковым в группе несинбиотиков. (b) Последовательные изменения в ацетате и бутирате после поступления. Ацетат и бутират в группе синбиотиков были значительно увеличены по сравнению с таковыми в группе несинбиотиков.
Рисунок 5. Влияние синбиотиков на инфекционные осложнения. Совокупная частота энтерита и вентилятор-ассоциированной пневмонии (ВАП) была значительно ниже в группе синбиотиков, чем в группе несинбиотиков, по лог-ранговому тесту (p
5.4. Нарушение моторики кишечника и ограничения кишечной терапии
Панкреатит является одним из критических заболеваний брюшной полости, а нарушение моторики желудочно-кишечного тракта может вызвать непереносимость пищи и бактериальную транслокацию [72]. Olah et al. [73] сообщили, что частота инфекционных осложнений с Lactobacillus plantarum снизилась больше, чем у пациентов без L. plantarum (4,5 % против 30,4 %). Напротив, Besselink et al. [74] сообщили, что ишемия кишечника и уровень смертности у пациентов с шестью видами бактерий были значительно выше, чем у пациентов без этих бактерий (16 против 6%). Однако в этом исследовании частота инфекционных осложнений не показала значительной разницы, и бактериемия не была вызвана введенными бактериями. Кроме того, это исследование подверглось критике с нескольких точек зрения [75,76].
Обширный ожог может вызвать SIRS, сепсис и синдром полиорганной недостаточности. В случае необструктивной кишечной непроходимости при ожоге количество кишечной микробиоты, в основном Bifidobacterium, снижалось, а у пациентов с тяжелыми ожогами увеличивалось количество Pseudomonas и Candida [77]. Эти результаты показывают, что у тяжелобольных пациентов с нарушением моторики желудочно-кишечного тракта изменилась микробиота кишечника, что может привести к «недренированному абсцессу». Эти исследования также предполагают, что эффект и безопасность пробиотиков различаются в зависимости от вводимых бактерий и кишечной толерантности. Пробиотики и синбиотики могут не назначаться при тяжелом нарушении моторики кишечника. Необходимы дальнейшие исследования для определения подходящего терапевтического показания при тяжелом воспалении брюшной полости.
6. Резюме
Микробиота кишечника играет важную роль в поддержании иммунитета хозяина. Ухудшение микробиоты кишечника при критических заболеваниях может привести к синдрому системной воспалительной реакции и синдрому полиорганной дисфункции.
Лечение пробиотиками / синбиотиками может поддерживать нарушенную микробиоту кишечника и уменьшать инфекционные осложнения у тяжелобольных пациентов. Потребуются дальнейшие фундаментальные и клинические исследования для продвижения кишечной терапии для пациентов в критическом состоянии.
Дополнительная информация:
Литература
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
Микробиота женщины и исходы беременности
Полный текст
Аннотация
Микробная инвазия амниотической полости и последующее развитие инфекции являются одной из ведущих причин неблагоприятных исходов беременности. Внутриамниотическую инфекцию могут вызывать как патогенные, так и условно-патогенные микроорганизмы и вирусы, однако в подавляющем большинстве случаев возбудителями внутриамниотической инфекции являются представители нормальной микрофлоры различных биотопов женщины — влагалища, кишечника, ротовой полости и дыхательных путей. В работе обобщены современные представления о роли инфекционного фактора в развитии неблагоприятных исходов беременности, об источниках и о механизмах внутриамниотической инфекции.
Ключевые слова
Полный текст
Роль инфекции в неблагоприятных исходах беременности
Во время беременности плацента, плодные оболочки и цервикальная слизистая пробка защищают развивающийся плод от патогенных микроорганизмов. Микробная инвазия амниотической полости может привести к ряду неблагоприятных исходов беременности, включая самопроизвольный выкидыш, мертворождение и преждевременные роды. Самопроизвольный выкидыш — это самопроизвольное прерывание беременности в первом триместре беременности (ранний самопроизвольный выкидыш) или во втором триместре беременности (поздний самопроизвольный выкидыш). Под мертворождением понимают гибель плода в третьем триместре беременности. Преждевременными родами считают роды при сроке беременности 37 недель и меньше.
Вклад инфекционного фактора в развитие разных неблагоприятных исходов беременности различен. Накопленные к настоящему времени данные свидетельствуют, что роль инфекции в раннем самопроизвольном выкидыше и мертворождении относительно невелика — до 15 [1] и 10–25 [2] соответственно. В то же время, внутриамниотическая инфекция (или хориоамнионит), под которой понимают инфекцию хориона, амниона, амниотической жидкости, плаценты и любое их сочетание, является причиной примерно 40 % всех случаев преждевременных родов [3] и 60–70 % случаев позднего самопроизвольного выкидыша [1]. Важную роль инфекционного фактора в развитии позднего самопроизвольного выкидыша и преждевременных родов подчеркивает тот факт, что частота острого хориоамнионита составляет 94 % между 21-й и 24-й неделями беременности, 40 % между 29-й и 32-й неделями, 35 % между 25-й и 28-й неделями, 11 % между 33-й и 36-й неделями, 4 % между 37-й и 40-й неделями [4].
Спектр инфекционных агентов, способных вызывать внутриамниотическую инфекцию, исключительно широк. К их числу относятся как патогенные, так и условно-патогенные микроорганизмы и вирусы. Данный обзор литературы посвящен инфекциям, ассоциированным с нормальной (или эндогенной) микрофлорой различных биотопов женщины — влагалища, кишечника, ротовой полости и дыхательных путей.
Нормальная микрофлора нижних отделов репродуктивного тракта женщины в защите от инфекции
Ключевой функцией нормальной микрофлоры влагалища является защита репродуктивных органов женщины от инфекций. Первая линия защиты от возбудителей урогенитальных инфекций осуществляется путем сложного взаимодействия между компонентами мукозного врожденного иммунитета, формируемого слизистыми оболочками влагалища и цервикального канала, и нормальной микрофлорой влагалища.
Во влагалище здоровых женщин содержится огромное количество бактерий (в среднем 107 бактерий на 1 г выделений). Основным компонентом нормальной микрофлоры влагалища у большинства женщин репродуктивного возраста являются лактобациллы. Важнейшим механизмом антимикробной защиты является продукция лактобациллами молочной кислоты путем ферментации гликогена, накапливаемого в эпителиальных клетках под влиянием эстрогенов. Молочная кислота обеспечивает низкое значение рН влагалища и ограничивает тем самым размножение патогенных и потенциально патогенных микроорганизмов. Кроме молочной кислоты, лактобациллы влагалища синтезируют другие антимикробные вещества, такие как перекись водорода и бактериоцины — специфические белки, подавляющие жизнедеятельность других бактерий путем повреждения их цитоплазматических мембран. Еще одним способом, посредством которого нормальная микрофлора влагалища осуществляет антагонизм в отношении других бактерий, является конкуренция за пищевые субстраты и сайты адгезии к эпителию влагалища [5].
Результаты исследований последних лет показывают, что до трети здоровых женщин имеют «нелактобациллярный» тип физиологического микробиоценоза, представленный спектром анаэробных бактерий. Доминирующими бактериями во влагалище женщин с таким типом микробиоценоза являются представители бактериальных родов Gardnerella, Atopobium, Prevotella, Megasphaera, Dialister, Peptoniphilus, Sneathia, Eggerthella, Aerococcus, Finegoldia, Mobiluncus. Отмечено, что у всех женщин с данным вариантом микробиоценоза присутствуют (хотя часто в небольшом количестве) бактерии, способные продуцировать молочную кислоту [6, 7]. Частота встречаемости «нелактобациллярного» варианта нормальной микрофлоры существенно варьирует в зависимости от этнической/расовой принадлежности [6].
Микрофлора влагалища претерпевает значительные структурные изменения на протяжении жизни женщины, которые напрямую связаны с уровнем эстрогенов. Факторами, определяющими изменчивость микрофлоры влагалища, являются наступление или прекращение менархе, фаза менструального цикла, сексуальная активность женщины, тип микробиоценоза (свойства доминирующих бактерий). Отдельного внимания заслуживает вопрос об изменениях микрофлоры влагалища, связанных с беременностью. В целом микрофлора влагалища у здоровых беременных женщин стабильна на протяжении всей беременности и отличается меньшим разнообразием (с подавляющим доминированием Lactobacillus crispatus и L. iners), чем у здоровых небеременных женщин [8–10]. Факторами, способствующими стабильности микрофлоры влагалища при беременности, могут быть отсутствие циклических гормональных флуктуаций, менструальных кровотечений, а также снижение сексуальной активности [10].
Так же как и у небеременных женщин, у части беременных женщин нормальный микробиоценоз влагалища может состоять не из лактобацилл, а из спектра преимущественно анаэробных микроорганизмов, хотя среди беременных женщин такой тип микробиоценоза встречается реже. Однозначного ответа, связан ли «нелактобациллярный» тип физиологического микробиоценоза с повышенным риском осложнений беременности, в первую очередь преждевременных родов, на сегодняшний день нет, так как имеющиеся данные противоречивы [8, 9].
Источники и механизмы внутриамниотической инфекции
Пути микробной инвазии амниотической полости
Во время беременности оболочки плода являются механическим и иммунным барьером для микроорганизмов. Исходом микробной контаминации околоплодных вод не всегда является развитие клинически значимой воспалительной реакции. Так, частота выявления микроорганизмов в околоплодных водах у беременных, не имеющих клинических проявлений инфекционного поражения, может доходить до 30 % [11]. Неблагоприятные перинатальные исходы наблюдаются у пациенток, у которых реализуется инфекционный процесс в околоплодных водах [12–14].
Различают три основных пути проникновения инфекционных агентов в полость плодного пузыря:
Микроорганизмы могут оказывать прямое повреждающее действие на плодные оболочки, плаценту, плод, а также действовать опосредованно через систему цитокинов. Бактериальная инфекция является триггером преждевременного прерывания беременности через активацию цитокинового каскада: микробные агенты секретируют фосфолипазу, увеличивая продукцию простагландинов из арахидоновой кислоты в тканях матки, а бактериальные эндотоксины, такие как липополисахариды, действуя на макрофаги в плодных оболочках, стимулируют выработку простагландинов и запускают каскад провоспалительных цитокинов. При распространении возбудителей инфекции восходящим путем оболочки плода подвергаются литическому воздействию протеиназ, вырабатываемых бактериями, и преждевременно разрываются, вызывая отхождение амниотической жидкости [15–17]. Необходимо отметить, что на сегодняшний день до конца не ясно, является ли обширная инвазия плодных оболочек следствием или причиной внутриамниотической инфекции. В недавнем исследовании было показано, что микробная инвазия амниотической полости предшествует обширной инвазии плодных оболочек, а не следует за ней [18]. На основании полученных данных авторы предложили следующую модель микробной инвазии амниотической полости: сначала бактерии проникают в амниотическую полость через дискретный участок хориоамниотической мембраны, после чего происходит их пролиферация в амниотической полости и затем обширная инвазия плодных оболочек [18].
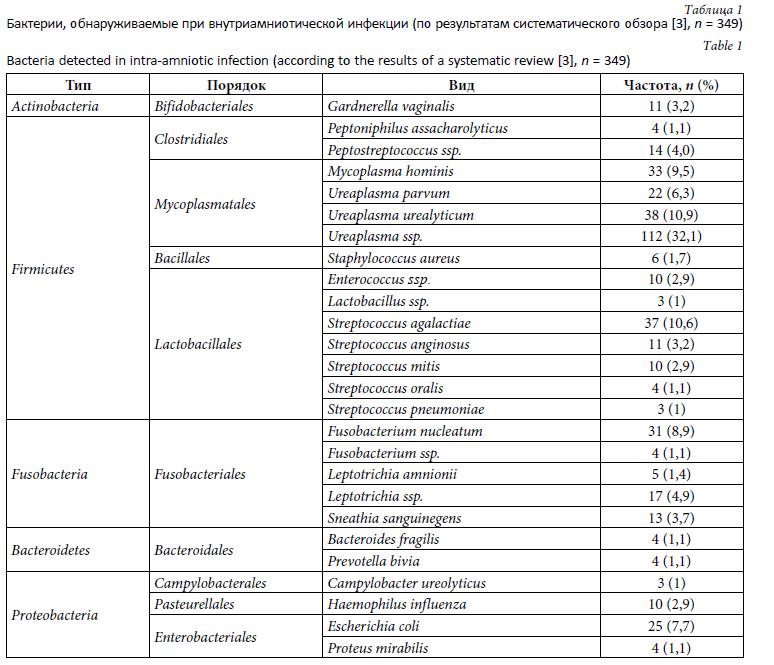
Бактерии, обнаруживаемые при внутриамниотической инфекции
Подавляющее большинство микроорганизмов, обнаруживаемых при внутриамниотической инфекции, принадлежит нормальной микробиоте женщины. Исключив экзогенно приобретаемые бактерии и принимая во внимание, что более триллиона микробных клеток населяют поверхность и полости тела, превышая число клеток тела человека по меньшей мере в 10 раз, можно утверждать, что тело женщины является богатым потенциальным источником оппортунистической микробной инвазии амниотической полости. Микроорганизмы, колонизирующие различные участки тела и способные получить доступ к восходящей миграции или гематогенному пути, могут внести вклад в разнообразие и численность бактерий в амниотической жидкости.
В недавнем систематическом обзоре было показано, что при внутриамниотической инфекции встречаются бактерии, принадлежащие 5 типам, 16 порядкам, 44 родам и 87 различным таксонам [3]. Наиболее широко представленным типом был тип Firmicutes, бактерии этого типа выявлялись у 343 из 349 женщин (98 %). Самым представительным порядком был порядок Mycoplasmatalesс частотой 59 % (205 женщин), а самым представительным родом — род Ureaplasma с частотой 49 % (172 женщины). При внутриамниотической инфекции с высокой частотой выявлялись виды бактерий, известные своим патогенным потенциалом, такие как U. urealyticum (11 %), Streptococcus agalactiae (11 %), Mycoplasma hominis (10 %) и Fusobacterium nucleatum (9 %). В таблице 1 представлены бактериальные таксоны, выявлявшиеся с частотой 1 % и выше.
Результаты исследований свидетельствуют, что большинство бактериальных видов, присутствующих с высокой частотой при внутриамниотической инфекции, принадлежат нормальной микрофлоре, главным образом, урогенитального тракта. Отмечено, что при использовании молекулярных методов число выявляемых бактериальных таксонов увеличивается в несколько раз по сравнению с культуральным методом [3]. Полимикробная инвазия амниотической полости имеет место приблизительно в 30 % случаев [12, 19].
Микробиота влагалища
Заболевания влагалища, вызываемые условно-патогенными микроорганизмами, такие как бактериальный вагиноз и аэробный вагинит, вносят существенный вклад в развитие инфекционных осложнений беременности. Бактериальный вагиноз характеризуется замещением лактобациллярной микрофлоры влагалища спектром других микроорганизмов, главным образом анаэробных: G. vaginalis, Atopobium vaginae, Prevotella spp., Mobiluncus spp., Megasphaera spp., Leptotrichia spp., Sneatia spp. и др. [20]. Существует убедительная доказательная база, что бактериальный вагиноз ассоциирован с ранним и поздним самопроизвольным выкидышем, преждевременными родами, преждевременным разрывом плодных оболочек, хориоамнионитом, послеродовым эндометритом [21–24].
Патофизиологические механизмы, определяющие неблагоприятное влияние бактериального вагиноза на течение и исход беременности, до сих пор полностью не ясны. В нескольких исследованиях было показано присутствие ассоциированных с бактериальным вагинозом бактерий в образцах эндометрия при плазмоклеточном эндометрите [25, 26]. Такое воспаление может нарушать физиологический иммуно-гормональный фон в ходе имплантации и раннего развития эмбриона и приводить к выкидышу (на ранних сроках беременности) или преждевременным родам (на поздних сроках беременности). Кроме того, микроорганизмы, населяющие нижние отделы генитального тракта при бактериальном вагинозе, могут восходящим путем проникать в полость матки и достигать децидуальной оболочки. Это может запускать целый ряд процессов, вовлеченных в индукцию преждевременных родов, включая увеличение продукции лейкоцитов, продукцию цитокинов, синтез простагландинов в амнионе, хорионе и миометрии, сокращения матки, расширение шейки матки, что, в свою очередь, способствует дальнейшему проникновению микроорганизмов в полость матки [17]. Далее, ассоциированные с бактериальным вагинозом бактерии могут вырабатывать литические ферменты, такие как сиалидазы и муциназы, которые могут ослаблять защитную цервикальную слизь и способствовать бактериальной инвазии верхних отделов генитального тракта [27]. Однако тот факт, что очень многие беременные женщины с бактериальным вагинозом благополучно вынашивают здорового ребенка, свидетельствует о том, что факторы хозяина способны контролировать эти процессы. Было показано, что генетическая предрасположенность к чрезмерным иммунным реакциям (детерминируемая полиморфизмами в гене TNF-α) в сочетании с бактериальным вагинозом ассоциирована с гораздо более высоким риском преждевременных родов, чем присутствие данного генотипа или наличие данного синдрома по отдельности [28]. Полагают, что в будущем идентификация и количественная оценка факторов иммунного ответа, возможно, будут применяться для выявления тех женщин с бактериальным вагинозом, у которых риск неблагоприятных исходов беременности повышен.
Аэробный, или неспецифический, вагинит — относительно недавно описанная нозологическая форма. Аэробный вагинит характеризуется как инфекционно-воспалительное заболевание влагалища, вызываемое условно-патогенными аэробными бактериями в основном кишечной группы — кишечной палочкой, а также стрептококками, стафилококками, энтерококками [29]. Сходство аэробного вагинита с бактериальным вагинозом заключается в том, что при обоих состояниях наблюдается уменьшение количества лактобацилл, приводящее к снижению концентрации молочной кислоты и, соответственно, повышению рН среды влагалища, и их замещение условно-патогенными микроорганизмами. Различия между этими заболеваниями существенны. Если для бактериального вагиноза характерны отсутствие воспаления и присутствие большого количества анаэробной микрофлоры, то аэробный вагинит в его типичном проявлении характеризуется повышенным воспалительным ответом и/или выраженными признаками атрофии эпителия влагалища и наличием умеренного количества комменсальной кишечной микрофлоры [29]. Чаще всего при аэробном вагините выявляются Streptococcus spp. (до 59 % случаев), Staphylocuccus aureus (до 42 %), коагулазаотрицательные стафилококки (до 37 %), Escherichia coli (до 23 %) [30].
Патогенез аэробного вагинита изучен недостаточно, и его предполагаемую роль в развитии осложнений беременности еще предстоит оценить. Полагают, что большинство случаев гнойно-септических заболеваний матери, плода и новорожденного связано с бактериями, типичными для аэробного вагинита, в то время как ассоциированные с бактериальным вагинозом бактерии чаще выявляются в амниотической полости у женщин с преждевременными родами и преждевременным разрывом плодных оболочек [31–33].
Необходимо отметить роль дрожжеподобных грибов рода Candida, также относящихся к условно-патогенным микроорганизмам, в развитии внутриамниотической инфекции. Показано, что у женщин, становившихся беременными на фоне применения внутриматочных контрацептивов, повышен риск внутриамниотической инфекции, обусловленной C. albicans [34]. Хотя связь между кандидозной инфекцией и использованием внутриматочных контрацептивов была впервые описана уже очень давно [35], только совсем недавно было показано, что кандиды формируют биопленки на внутриматочных контрацептивах, делая их своего рода резервуаром кандидозной инфекции в генитальном тракте [36].
Микробиота кишечника
Желудочно-кишечный тракт населен огромным спектром микроорганизмов, которые участвуют в метаболизме хозяина, защищают кишечник от инфекции и модулируют функции иммунной системы хозяина [37]. Полагают, что кишечная микрофлора также может служить источником внутриамниотической инфекции, так как представители кишечной микрофлоры обнаруживаются в амниотической жидкости женщин с преждевременным разрывом плодных оболочек [14]. Согласно данным систематического обзора G.L. Mendz et al. (2013), такие представители нормальной микрофлоры кишечника, как E. coli, S. agalactiae или Enterococcus spp., выявляются из амниотической жидкости у каждой пятой женщины с внутриамниотической инфекцией [3]. Считается, что в подавляющем большинстве случаев кишечные микроорганизмы колонизируют влагалище и затем достигают внутриматочную полость восходящим путем [38]. Гематогенный путь инвазии внутриматочной полости хорошо описан для возбудителя кишечных инфекций Listeria monocytogenes. Эти бактерии хорошо известны своей способностью преодолевать слизистые барьеры кишечника и гематогенным путем проникать в ткани плаценты [39]. Хотя листерии нельзя отнести к нормальной микрофлоре кишечника и, ввиду специфических особенностей данного микроорганизма, их свойства нельзя автоматически переносить на другие бактерии, теоретически гематогенный путь передачи для представителей нормальной микрофлоры кишечника тоже возможен [14].
Микробиота ротовой полости
Ротовая полость имеет свою характерную микробиоту, насчитывающую более 700 видов микроорганизмов [40]. Предположительно основной путь распространения микроорганизмов ротовой полости — гематогенный, особенно при периодонтите [41], однако полагают, что колонизация влагалища микробами из ротовой полости во время рецептивного орального секса также возможна [42].
Обнаружение бактерий ротовой полости в амниотической полости женщин с преждевременными родами согласуется с данными недавнего метаанализа, включившего более 12 тысяч женщин, результаты которого показали значительную ассоциацию преждевременных родов с периодонтитом у женщины [46]. Эти данные говорят в пользу того, что гематогенная диссеминация бактерий ротовой полости является одним из путей достижения амниотической полости.
Микрофлора дыхательных путей
Таким образом, опубликованные данные свидетельствуют о вовлеченности микрофлоры экстрагенитальной локализации в развитие внутриамниотической инфекции. Обнаружение одного и того же микроорганизма одновременно в типичном для него эпитопе и в амниотической полости говорит в пользу гематогенной микробной инвазии.
Заключение
Внутриамниотическая инфекция является одной из ведущих причин неблагоприятных исходов беременности. Подавляющее большинство микроорганизмов, обнаруживаемых при внутриамниотической инфекции, относится к нормальной микробиоте, главным образом, нижних отделов урогенитального тракта. Разработка ранних специфических маркеров микробной инвазии амниотической полости и развития внутриамниотической инфекции будет способствовать разработке стратегий предотвращения неблагоприятных исходов беременности.