Микрофлора кишечника что это такое
Функционирование здоровой микрофлоры ЖКТ
Кишечная микрофлора и ее функционирование

Дополнительный материал к разделу:
СОСТАВ И РАСПРЕДЕЛЕНИЕ МИКРООРГАНИЗМОВ В ЖЕЛУДОЧНО-КИШЕЧНОМ ТРАКТЕ
У здоровых лиц в кишечнике насчитывается более 500 видов микроорганизмов. Общая масса микрофлоры кишечника составляет от 1 до 3 кг. В разных отделах ЖКТ количество бактерий различно, большинство микроорганизмов локализованы в толстой кишке (около 10 10–12 КОЕ/мл, что составляет 35–50% ее содержимого). Состав кишечной микрофлоры достаточно индивидуален и формируется с первых дней жизни ребенка, приближаясь к показателям взрослого к концу 1-го — 2-му году жизни, претерпевая некоторые изменения в пожилом возрасте (табл. 1). У здоровых детей в толстой кишке обитают представители факультативно-анаэробных бактерий рода Streptococcus, Staphylococcus, Lactobacillus, Enterobacteriacae, Candida и более чем 80% биоценоза занимают анаэробные бактерии, чаще грамположительные: пропионобактерии, вейлонеллы, эубактерии, анаэробные лактобациллы, пептококки, пептострептококки, а также грамотрицательные бактероиды и фузобактерии.
Ниже, в таблице 1., представлен качественный и количественный состав основной микрофлоры толстой кишки у здорового человека в колониеобразующих единицах (КОЕ) в пересчете на 1 г кала (по ОСТ 91500.11.0004-2003 «Протокол ведения больных. Дисбактериоз кишечника»):
Таблица 1. Качественный и количественный состав основной микрофлоры толстого кишечника у здоровых людей (КОЕ/ г фекалий)
Кроме перечисленных в табл. 1, в толстой кишке человека в различном количестве присутствуют бактерии родов:
Распределение микроорганизмов по ходу желудочно-кишечного тракта имеет достаточно строгие закономерности и тесно коррелирует с состоянием пищеварительной системы (табл. 2).
Таблица 2. Средняя концентрация (распределение) микроорганизмов в различных отделах ЖКТ у здоровых взрослых [ 3 ]
См. дополнительно:
ФУНКЦИИ НОРМАЛЬНОЙ МИКРОФЛОРЫ
Вся совокупность микроорганизмов и макроорганизм составляют своеобразный симбиоз, где каждый извлекает выгоды для своего существования и оказывает влияние на партнера. Функции кишечной микрофлоры по отношению к макроорганизму реализуются как локально, так и на системном уровне, при этом различные виды бактерий вносят свой вклад в это влияние.
Микрофлора пищеварительного тракта выполняет следующие функции:
См. также:
Так, бифидобактерии за счет ферментации олиго- и полисахаридов продуцируют молочную кислоту и ацетат, которые обеспечивают бактерицидную среду, секретируют вещества-ингибиторы роста патогенных бактерий, что повышает резистентность организма ребенка к кишечным инфекциям. Модуляции иммунного ответа ребенка бифидобактериями также выражаются в снижении риска развития пищевой аллергии.
Лактобациллы уменьшают активность пероксидазы, оказывая антиоксидантный эффект, обладают противоопухолевой активностью, стимулируют продукцию иммуноглобулина А (IgA), подавляют рост патогенной микрофлоры и стимулируют рост лакто- и бифидофлоры, оказывают противовирусное действие.
Из представителей энтеробактерий наиболее важное значение имеет Escherichia coli M17, которая вырабатывает колицин В, за счет чего подавляет рост шигелл, сальмонелл, клебсиелл, серраций, энтеробактеров и оказывает незначительное влияние на рост стафилококков и грибов. Также кишечная палочка способствуют нормализации микрофлоры после антибактериальной терапии и воспалительных и инфекционных заболеваний.
Кишечные палочки, бифидо- и лактобактерии выполняют витаминообразующую функцию (участвуют в синтезе и всасывании витаминов К, группы В, фолиевой и никотиновой кислот). По способности синтезировать витамины кишечная палочка превосходит все остальные бактерии кишечной микрофлоры, синтезируя тиамин, рибофлавин, никотиновую и пантотеновую кислоты, пиридоксин, биотин, фолиевую кислоту, цианокобаламин и витамин К. Бифидобактерии синтезируют аскорбиновую кислоту, бифидо- и лактобактерии способствуют всасыванию кальция, витамина D, улучшают всасывание железа (благодаря созданию кислой среды).
Процесс пищеварения условно можно разделить на собственное (дистанционное, полостное, аутолитическое и мембранное), осуществляемое ферментами организма, и симбиозное пищеварение, происходящее при содействии микрофлоры. Микрофлора кишечника человека участвует в ферментации нерасщепленных ранее компонентов пищи, главным образом углеводов, таких, как крахмал, олиго- и полисахариды (в том числе и целлюлоза), а также белков и жиров.
Не всосавшиеся в тонкой кишке белки и углеводы в слепой кишке подвергаются более глубокому бактериальному расщеплению — преимущественно кишечной палочкой и анаэробами. Конечные продукты, образующиеся в результате процесса бактериальной ферментации, оказывают различное влияние на состояние здоровья человека. Например, бутират необходим для нормального существования и функционирования колоноцитов, является важным регулятором их пролиферации и дифференцировки, а также всасывания воды, натрия, хлора, кальция и магния. Вместе с другими летучими жирными кислотами он оказывает влияние на моторику толстой кишки, в одних случаях ускоряя ее, в других — замедляя. При расщеплении полисахаридов и гликопротеинов внеклеточными микробными гликозидазами образуются, помимо прочего, моносахариды (глюкоза, галактоза и т. д.), при окислении которых в окружающую среду выделяется в виде тепла не менее 60% их свободной энергии.
Среди важнейших системных функций микрофлоры — поставка субстратов глюконеогенеза, липогенеза, а также участие в метаболизме белков и рециркуляции желчных кислот, стероидов и других макромолекул. Превращение холестерина в не всасывающийся в толстой кишке копростанол и трансформация билирубина в стеркобилин и уробилин возможны только при участии бактерий, находящихся в кишечнике.
Протективная роль сапрофитной флоры реализуется как на местном, так и на системном уровнях. Создавая кислую среду, благодаря образованию органических кислот и снижению рН среды толстой кишки до 5,3–5,8, симбионтная микрофлора защищает человека от колонизации экзогенными патогенными микроорганизмами и подавляет рост уже имеющихся в кишечнике патогенных, гнилостных и газообразующих микроорганизмов. Механизм этого явления заключается в конкуренции микрофлоры за питательные вещества и участки связывания, а также в выработке нормальной микрофлорой определенных ингибирующих рост патогенов субстанций, обладающих бактерицидной и бактериостатической активностью, в том числе антибиотикоподобных. Низкомолекулярные метаболиты сахаролитической микрофлоры, в первую очередь летучие жирные кислоты, лактат и др., обладают заметным бактериостатическим эффектом. Они способны ингибировать рост сальмонелл, дизентерийных шигелл, многих грибов.
Также кишечная микрофлора усиливает местный кишечный иммунологический барьер. Известно, что у стерильных животных в lamina propria определяется очень малое количество лимфоцитов, кроме того, у этих животных наблюдается иммунодефицит. Восстановление нормальной микрофлоры быстро приводит к увеличению количества лимфоцитов в слизистой кишечника и исчезновению иммунодефицита. Сапрофитные бактерии в определенной степени обладают способностью модулировать уровень фагоцитарной активности, снижая его у людей, страдающих аллергией и, наоборот, повышая его у здоровых индивидуумов.
Таким образом, микрофлора ЖКТ не только формирует местный иммунитет, но и играет огромную роль в становлении и развитии иммунной системы ребенка, а также поддерживает ее активность у взрослого. Резидентная флора, особенно некоторые микроорганизмы, обладают достаточно высокими иммуногенными свойствами, что стимулирует развитие лимфоидного аппарата кишечника и местный иммунитет (в первую очередь за счет усиления продукции ключевого звена системы местного иммунитета — секреторного IgA), а также приводит к системному повышению тонуса иммунной системы, с активацией клеточного и гуморального звеньев иммунитета.
Системная стимуляция иммунитета — одна из важнейших функций микрофлоры. Известно, что у безмикробных лабораторных животных не только подавлен иммунитет, но и происходит инволюция иммунокомпетентных органов. Поэтому при нарушениях микроэкологии кишечника, дефиците бифидофлоры и лактобацилл, беспрепятственном бактериальном заселении тонкой и толстой кишки возникают условия для снижения не только местной защиты, но и резистентности организма в целом.
Несмотря на достаточную иммуногенность, сапрофитные микроорганизмы не вызывают реакций иммунной системы. Возможно, это происходит потому, что сапрофитная микрофлора является своего рода хранилищем микробных плазмидных и хромосомных генов, обмениваясь генетическим материалом с клетками хозяина. Реализуются внутриклеточные взаимодействия путем эндоцитоза, фагоцитоза и пр. При внутриклеточных взаимодействиях достигается эффект обмена клеточным материалом. В результате представители микрофлоры приобретают рецепторы и другие антигены, присущие хозяину. Это делает их «своими» для иммунной системы макроорганизма. Эпителиальные ткани в результате такого обмена приобретают бактериальные антигены.
Обсуждается вопрос о ключевом участии микрофлоры в обеспечении противовирусной защиты хозяина. Благодаря феномену молекулярной мимикрии и наличию рецепторов, приобретенных от эпителия хозяина, микрофлора становится способной к перехвату и выведению вирусов, обладающих соответствующими лигандами.
Таким образом, наряду с низким рН желудочного сока, двигательной и секреторной активностью тонкой кишки, микрофлора ЖКТ относится к неспецифическим факторам защиты организма.
Фолиевая кислота (витамин В9), поступая с продуктами питания, эффективно всасывается в тонкой кишке. Синтезирующийся в толстой кишке представителями нормальной кишечной микрофлоры фолат идет исключительно для ее собственных нужд и не утилизируется макроорганизмом. Тем не менее синтез фолата в толстой кишке может иметь большое значение для нормального состояния ДНК колоноцитов.
Кишечные микроорганизмы, синтезирующие витамин В12, обитают как в толстой, так и в тонкой кишке. Среди этих микроорганизмов наиболее активны в данном аспекте представители Pseudomonas и Klebsiella sp. Однако возможностей микрофлоры для полной компенсации гиповитаминоза В12 оказывается недостаточно.
Витамин К существует в нескольких разновидностях и необходим человеческому организму для синтеза различных кальцийсвязывающих белков. Источником витамина К1, филохинона, являются продукты растительного происхождения, а витамин К2, группа соединений менахинонов, синтезируется в тонкой кишке человека. Микробный синтез витамина К2 стимулируется при недостатке филохинона в диете и вполне способен его компенсировать. В то же время недостаточность витамина К2 при сниженной активности микрофлоры плохо корригируется диетическими мероприятиями. Таким образом, синтетические процессы в кишечнике являются приоритетными для обеспечения макроорганизма этим витамином. Витамин К синтезируется и в толстой кишке, но используется преимущественно для потребностей микрофлоры и колоноцитов.
Кишечная микрофлора принимает участие в детоксикации экзогенных и эндогенных субстратов и метаболитов (аминов, меркаптанов, фенолов, мутагенных стероидов и др.) и, с одной стороны, представляет собой массивный сорбент, выводя из организма токсические продукты с кишечным содержимым, а с другой — утилизирует их в реакциях метаболизма для своих нужд. Помимо этого, представители сапрофитной микрофлоры продуцируют на основе конъюгатов желчных кислот эстрагеноподобные субстанции, оказывающие влияние на дифференцировку и пролиферацию эпителиальных и некоторых других тканей путем изменения экспрессии генов или характера их действия.
Итак, взаимоотношения микро- и макроорганизма носят сложный характер, реализующийся на метаболическом, регуляторном, внутриклеточном и генетическом уровне. Однако нормальное функционирование микрофлоры возможно только при хорошем физиологическом состоянии организма и в первую очередь нормальном питании.
ПИТАНИЕ ДЛЯ МИКРОФЛОРЫ КИШЕЧНОГО ТРАКТА
Дополнительно см. также:
Питание микроорганизмов, населяющих кишечник, обеспечивается за счет нутриентов, поступающих из вышележащих отделов ЖКТ, которые не перевариваются собственными ферментативными системами и не всасываются в тонкой кишке. Эти вещества необходимы для обеспечения энергетических и пластических потребностей микроорганизмов. Способность использовать нутриенты для своей жизнедеятельности зависит от ферментативных систем различных бактерий.
В зависимости от этого условно выделяют бактерии с преимущественно сахаролитической активностью, основным энергетическим субстратом которых являются углеводы (характерно в основном для сапрофитной флоры), с преимущественной протеолитической активностью, использующих белки для энергетических целей (характерно для большинства представителей патогенной и условно-патогенной флоры), и смешанной активностью. Соответственно, преобладание в пище тех или иных нутриентов, нарушение их переваривания будет стимулировать рост различных микроорганизмов.
Ранее эти компоненты пищи называли «балластными», предполагая, что они не имеют какого-либо существенного значения для макроорганизма, однако по мере изучения микробного метаболизма стало очевидно их значение не только для роста кишечной микрофлоры, но для здоровья человека в целом.
Согласно современному определению, пребиотиками называют частично или полностью не перевариваемые компоненты пищи, которые избирательно стимулируют рост и/или метаболизм одной или нескольких групп микроорганизмов, обитающих в толстой кишке, обеспечивая нормальный состав кишечного микробиоценоза.
Свои энергетические потребности микроорганизмы толстой кишки обеспечивают за счет анаэробного субстратного фосфорилирования (рис. 1), ключевым метаболитом которого является пировиноградная кислота (ПВК). ПВК образуется из глюкозы в процессе гликолиза. Далее, в результате восстановления ПВК, образуется от одной до четырех молекул аденозинтрифосфата (АТФ). Последний этап приведенных выше процессов обозначается как брожение, которое может идти различными путями с образованием различных метаболитов.
В результате микробного метаболизма в толстой кишке образуются молочная кислота, короткоцепочечные жирные кислоты (С2 — уксусная; С3 — пропионовая; С4 — масляная/изомасляная; С5 — валериановая/изовалериановая; С6 — капроновая/изокапроновая), углекислый газ, водород, вода. Углекислый газ в большой степени преобразуется в ацетат, водород всасывается и выводится через легкие, а органические кислоты (в первую очередь жирные короткоцепочечные) утилизируются макроорганизмом. Нормальная микрофлора толстой кишки, перерабатывая не переваренные в тонкой кишке углеводы, производит короткоцепочечные жирные кислоты с минимальным количеством их изоформ. В то же время при нарушении микробиоценоза и увеличении доли протеолитической микрофлоры указанные жирные кислоты начинают синтезироваться из белков преимущественно в виде изоформ, что отрицательно сказывается на состоянии толстой кишки, с одной стороны, и может быть диагностическим маркером — с другой.
Помимо этого, различные представители сапрофитной флоры имеют свои потребности в определенных нутриентах, объясняющиеся особенностями их метаболизма. Так, бифидобактерии расщепляют моно-, ди-, олиго- и полисахариды, используя их как энергетический и пластический субстрат. При этом они могут ферментировать белки, в том числе и для энергетических целей; не требовательны к поступлению с пищей большинства витаминов, но нуждаются в пантотенатах.
Лактобактерии также используют различные углеводы для энергетических и пластических целей, однако плохо расщепляют белки и жиры, поэтому нуждаются в поступлении извне аминокислот, жирных кислот, а также витаминов.
Энтеробактерии расщепляют углеводы с образованием углекислого газа, водорода и органических кислот. При этом существуют лактозонегативные и лактозопозитивные штаммы. Также они могут утилизировать белки и жиры, поэтому мало нуждаются во внешнем поступлении аминокислот, жирных кислот и большинства витаминов.
Очевидно, что питание сапрофитной микрофлоры и ее нормальное функционирование принципиально зависит от поступления к ней не переваренных углеводов (ди-, олиго- и полисахаридов) для энергетических целей, а также белков, аминокислот, пуринов и пиримидинов, жиров, углеводов, витаминов и минералов — для пластического обмена. Залогом поступления к бактериям необходимых нутриентов является рациональное питание макроорганизма и нормальное течение пищеварительных процессов.
Хотя моносахариды могут легко утилизироваться микроорганизмами толстой кишки, к пребиотикам их не относят.
Лактоза (молочный сахар) представляет собой дисахарид, состоящий из галактозы и глюкозы. В норме лактоза расщепляется лактазой тонкой кишки до мономеров, которые практически полностью всасываются в тонкой кишке. Лишь незначительное количество нерасщепленной лактозы у детей первых месяцев жизни попадает в толстую кишку, где утилизируется микрофлорой, обеспечивая ее становление. В то же время дефицит лактазы приводит к избытку лактозы в толстой кишке и значительному нарушению состава кишечной микрофлоры и осмотической диарее.
Лактулоза — дисахарид, состоящий из галактозы и фруктозы, в молоке (женском или коровьем) отсутствует, однако в небольших количествах может образовываться при нагревании молока до температуры кипения. Лактулоза не переваривается ферментами ЖКТ, ферментируется лакто- и бифидобактериями и служит им субстратом для энергетического и пластического обмена, за счет чего способствует их росту и нормализации состава микрофлоры, увеличению объема биомассы в содержимом кишечника, что определяет ее слабительный эффект. Помимо этого, показана антикандидозная активность лактулозы и ее угнетающий эффект на сальмонелл. Полученная синтетическим путем лактулоза (дюфалак) широко используется как эффективное слабительное средство, обладающее пребиотическими свойствами. Как пребиотик детям дюфалак назначается в низких дозах, не оказывающих слабительного эффекта (по 1,5–2,5 мл 2 раза в день в течение 3–6 нед).
Олигосахариды представляют собой линейные полимеры глюкозы и других моносахаров с общей длиной цепи не более 10. По химической структуре выделяют галакто-, фрукто-, фукозил-олигосахариды и др. Концентрация олигосахаридов в женском молоке относительно невелика, не более 12–14 г/л, однако их пребиотический эффект весьма значителен. Именно олигосахариды сегодня рассматриваются как основные пребиотики женского молока, обеспечивающие как становление нормальной микрофлоры кишечника ребенка, так и ее поддержание в дальнейшем. Важным является то обстоятельство, что олигосахариды присутствуют в значимых концентрациях только в женском молоке и отсутствуют, в частности, в коровьем. Следовательно, в состав адаптированных молочных смесей для искусственного вскармливания здоровых детей должны добавляться пребиотики (галакто- и фруктосахариды).
Полисахариды представляют собой длинноцепочечные углеводы в основном растительного происхождения. Инулин, содержащий фруктозу, в больших количествах присутствует в артишоках, клубнях и корнях георгинов и одуванчиков; утилизируется бифидо- и лактобактериями, способствует их росту. Помимо этого, инулин повышает всасывание кальция и влияет на метаболизм липидов, снижая риск развития атеросклероза.
Дополнительно см. также:
В средних количествах (1–1,9 г/100 г продукта) пищевые волокна содержатся в моркови, сладком перце, петрушке (в корне и зелени), редьке, репе, тыкве, дыне, черносливе, цитрусовых, бруснике, фасоли, гречневой, перловой крупе, «Геркулесе», ржаном хлебе.
Высокое содержание (2–3 г/100 г продукта) пищевых волокон характерно для чеснока, клюквы, красной и черной смородины, черноплодной рябины, ежевики, овсяной крупы, хлеба из белково-отрубной муки.
Наибольшее же их количество (более 3 г/100 г) содержится в укропе, кураге, клубнике, малине, чае (4,5 г/100 г), овсяной муке (7,7 г/100 г), пшеничных отрубях (8,2 г/100 г), сушеном шиповнике (10 г/100 г), жареном кофе в зернах (12,8 г/100 г), овсяных отрубях (14 г/100 г). Пищевые волокна отсутствуют в рафинированных продуктах.
Несмотря на очевидную значимость пребиотиков для питания микрофлоры, благополучия ЖКТ и всего организма в целом, в современных условиях отмечается дефицит пребиотиков в питании во всех возрастных группах. В частности, взрослый человек должен съедать в сутки примерно 20–35 г пищевых волокон, тогда как в реальных условиях европеец потребляет не более 13 г в сутки. Уменьшение доли естественного вскармливания у детей первого года жизни приводит к недостатку пребиотиков, содержащихся в женском молоке.
Таким образом, пребиотики обеспечивают благополучие микрофлоры толстой кишки, здоровье толстой кишки и являются необходимым фактором здоровья человека в связи с их существенными метаболическими эффектами. Преодоление дефицита пребиотиков в современных условиях связано с обеспечением рационального питания лиц всех возрастных категорий, начиная от новорожденных и кончая людьми преклонного возраста.
Литература
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
Как грамотно восстановить микрофлору кишечника
Кишечник человека содержит миллионы бактерий. Но не все из них являются полезными. В кишечнике иногда обитают вредоносные микроорганизмы, вызывающие различные заболевания. Что вызывает рост вредных бактерий, и как же восстановить нормальную микрофлору, поговорим далее.
Важность восстановления микрофлоры
Нормальная кишечная микрофлора – это баланс полезных и вредных бактерий, населяющих кишечник человека. Если преобладают вредные, а полезные находятся в меньшинстве, такое состояние называется дисбалансом микрофлоры и требует коррекции. Этим занимаются врачи-гастроэнтерологи.
Они рекомендуют сдать анализ кала на дисбактериоз и бактериальный посев при заметных нарушениях в работе кишечника (вздутие, понос, тошнота, запор, боли и т.д.).
По результатам анализов назначается соответствующее лечение, после которого микрофлора нормализуются, самочувствие человека улучшается. Нормальная микрофлора кишечника важна для выработки необходимых витаминов, укрепления иммунитета и защиты от различных болезней.
Различные факторы могут ухудшать состояние микрофлоры кишечника, это:
прием антибиотиков и НПВС;
увлечение западной диетой (с наличием фастфудов);
недостаточность клетчатки в рационе;
прием обезболивающих средств;
лечение ингибиторами протонного насоса;
применение блокаторов Н2- гистаминовых рецепторов.
Некоторые врачи считают, что среда кишечника не должна быть стерильной. Но вредные бактерии должны составлять не более 15 процентов всей микрофлоры. Только тогда дисбаланс сохранится.
Микрофлора может меняться в зависимости от возраста, настроения, самочувствия человека, климата, сезона.
Нарушение микрофлоры может вызывать следующие заболевания:
Что такое дисбактериоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Людевиг А. А., гастроэнтеролога со стажем в 8 лет.
Определение болезни. Причины заболевания
От редакции: диагноз «дисбактериоз» не включён в международную классификацию болезней (МКБ-10), его используют врачи только в России и странах СНГ. Дисбактериоз сопутствует другим патологиям, но было бы неверно однозначно утверждать, что эти патологии вызывает именно нарушение баланса микрофлоры. Изучение взаимосвязи между деятельностью микробиома и возникновением различных заболеваний — одно из перспективных направлений в медицинских исследованиях.
Что такое микрофлора кишечника и для чего она нужна
Организм человека населяют свыше триллиона бактерий. В их микробиоме в сто раз больше генов, чем в нашем собственном геноме. Они живут на коже, слизистых, в пищеварительном тракте.
Кишечное сообщество, которое мы приютили в своём организме, обладает метаболической активностью, как у целого органа. Оно помогает нам выжить, поэтому мы в корне зависим от наших колонизаторов, как и они от нас.
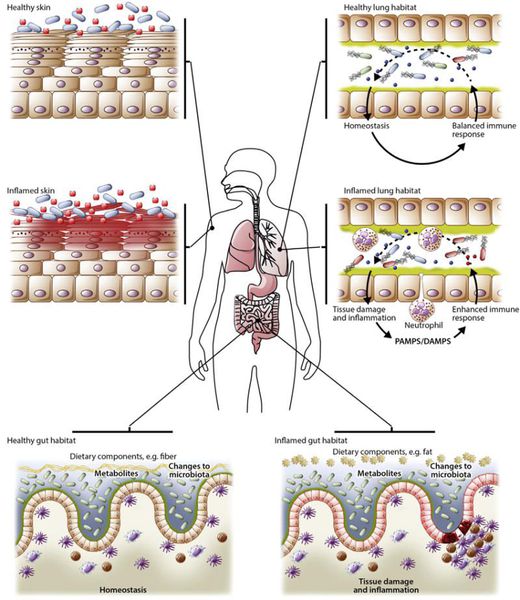
В норме кишечник обеспечивает среду для роста микроорганизмов, а флора поддерживает «равновесие» в организме хозяина:
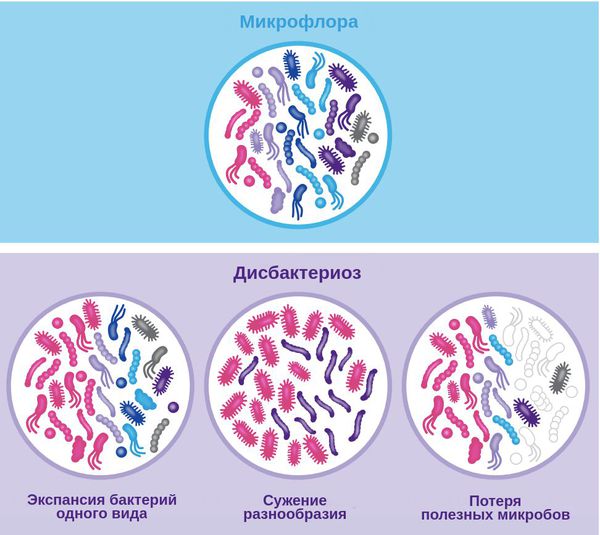
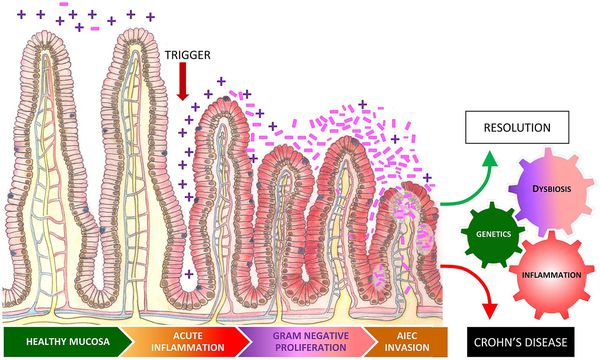
Дисбактериоз, или дисбиоз — это синдром, при котором нарушается соотношение между представителями микрофлоры. Он не является болезнью, но лежит в основе множества заболеваний — кишечных, общевоспалительных, аутоиммунных и нейропсихических.
Соотношение различных видов микроорганизмов нарушается по многим причинам:
Симптомы дисбактериоза
Когда защитная функция слизистой оболочки кишечника нарушается, иммунная система перестаёт адекватно реагировать на кишечную микрофлору. В связи с этим возникают разнообразные симптомы:
Когда под влиянием дисбиоза начинают развиваться различные болезни, появляются другие симптомы:
Патогенез дисбактериоза
Колонизация кишечника бактериями начинается при прохождении младенца через родовой канал. В этот момент он получает микробиоту своей матери — лактобациллы, Prevotella и другие. При кесаревом сечении микробный состав изменяется. Он напоминает кожу матери: появляются стафилоккоки, коринебактерии и пропионобактерии.
Во время грудного вскармливания увеличивается количество бифидобактерий. Они необходимы для использования олигосахаридов материнского молока. При недостаточном питании формирование этих бактерий нарушается, что приводит к стойкой незрелости микробиоты и риску развития дисбактериоза.
В зависимости от типа дисбиоза и особенностей организма могут включаться различные патологические пути.
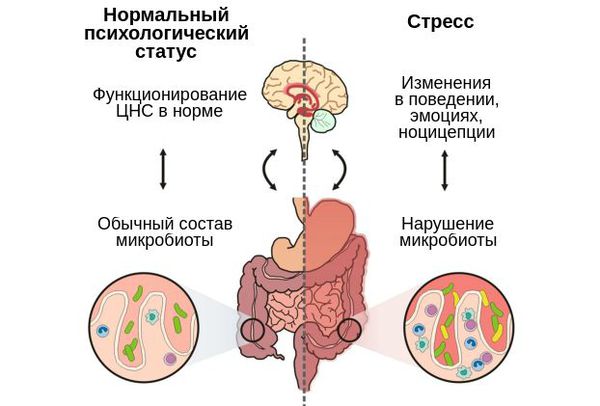
Путь «Дисбактериоз — кишечник — мозг»
Микробиота кишечника влияет не только на физическое, но и на психологическое состояние человека. Её связь с мозгом осуществляется через блуждающий нерв (вагус) и ключевые центральные медиаторы :
Путь «Микробиота — воспаление — инсулинорезистентность»
Путь «Дисбактериоз — ожирение — печень»
О количестве съеденного организм узнаёт по уровню всё тех же короткоцепочечных жирных кислот, вырабатываемых флорой. При низком потреблении клетчатки — овощей и отрубей — этих жирных кислот вырабатывается мало. В ответ на это кишечник замедляет эвакуацию, чтобы запасти побольше энергии. В итоге запускается адипогенез — отложение жира.
Путь «Дисбактериоз — аутоиммунитет»
Изменённая композиция микробиоты воздействует на кишечную иммунную систему. Иммунитет, активированный дисбактериозом кишечника, запускает каскад воспалительных реакций, что приводит к поражению суставов, кожи, почек, кишечника и т. д. Если реакция защитных сил чрезмерна, развиваются аутоиммунные заболевания.
Хронический воспалительный ответ, который вызывает дисбиоз, также может поспособствовать развитию ревматических заболеваний.
Путь «Дисбактериоз — аллергия»
Полезные бактерии поддерживают баланс иммунного ответа в организме.
Они стимулируют подавление IgE и лимфоцитов Th1 и Th2, которые сдерживают паразитарную инфекцию. Если популяция полезных микроорганизмов не развивается, это может привести к аллергическим ответам.
В итоге, если слишком тщательно оберегать ребёнка от столкновения с инфекциями, у него резко повышается риск развития аллергических заболеваний.
Классификация и стадии развития дисбактериоза
Из-за разнообразия агентов микрофлоры и проявлений дисбиоза, классификация нарушения микрофлоры весьма условна.
Традиционно выделяют три степени дисбиоза:
Кроме изменений микрофлоры важно знать, в микробиоме какого органа произошло нарушение. В связи с этим различают кишечный и внекишечный дисбактериоз. К внекишечным формам относятся:
По течению дисбактериоз кишечника условно подразделяют на три стадии:
В зависимости от того, в каком отделе кишечника возникло нарушение, выделяют:
Осложнения дисбактериоза
Симптомы дисбактериоза кишечника с трудом можно отличить от симптомов его осложнений. Всё потому, что дисбиоз — синдром, который вносит существенный вклад в развитие многих болезней.
Осложнения можно разделить на несколько групп:
Нейропсихические болезни
Связь шизофрении, аутистических расстройств и болезни Паркинсона с дисбиозом доказана. Но о том, являются ли эта связь основной или сопутствующей, до сих пор ведутся споры.
Аутоиммунные патологии
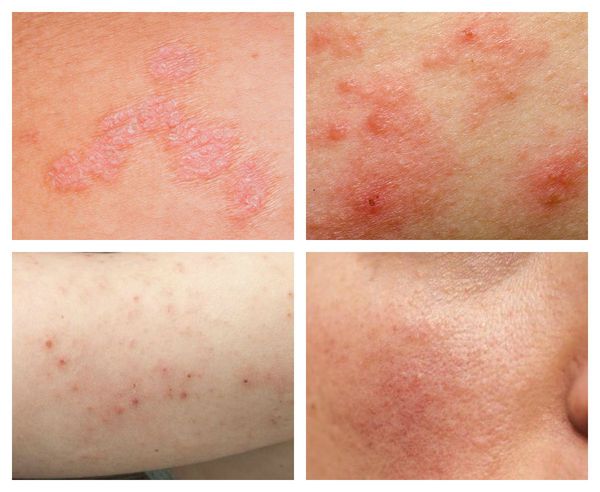
Аллергические заболевания
Бронхиальная астма связана с увеличением респираторной микрофлоры — гемофильной палочки, стрептококков, бактерий Moraxella — и снижением кишечного микробиома — бифидобактерий, бактерий Akkermansia, Faecalibacterium, Morganella, Lactobacillus. Ослабить аллергическую реакцию может вдыхание «сельскохозяйственной пыли», которая насыщена бактериями и их компонентами.
Аллергия на еду появляется при чрезмерном разнообразии микрофлоры. Избыточное микробное обогащение кишечника у 3-месячных детей увеличивает риск развития гиперчувствительности к пище к годовалому возрасту. При обогащении кишечника микробами в 12 месяцев этого уже не происходит.
Когда количество бактерий Ruminococcaceae и Lachnospiraceae повышается, у детей развивается аллергия на молоко. Если же флора обогащена бактериями Firmicutes, включая Clostridia, то аллергия может разрешиться к школьному возрасту.
Аллергии на арахис или древесные орехи возникает при уменьшенном микробном разнообразии и увеличении числа бактерий Bacteroidetes. Выраженность симптомов аллергии и диарея могут ослабнуть при наличии или пероральном введении 17 штаммов Clostridia.
Системные воспаления
Микробиота в данном случае становится и причиной, и мишенью нарушений моторики кишечника, висцеральной гипер чувствительности и нейроиммунных сигналов. Происходит это из-за нарушения слизистого барьера, активации рецепторов, к которым крепятся бактерии, а также дисфункции оси гипоталамус-гипофиз-надпочечник (ось ГГН).
Почему нарушается моторика кишечника? Микробиота модулирует моторную функцию кишечника. Её состав может измениться через толл- и нод-рецепторы. В результате повышается проницаемость кишечной стенки, и метаболиты бактерий получают доступ к подслизистой оболочке. Это изменяет экспрессию генов, которые участвуют в работе гладких мышц и нейротрансмиссии. Нормальная кишечная палочка усиливает сокращение толстой кишки, а патогенные штаммы E. coli нарушают сократимость мышечных клеток и угнетают моторику. Воздействие Lactobacillus rhamnosus значительно ухудшает ацетилхолин-стимулируемое сокращение.
Так как непереносимость глютена во взрослой жизни после многих лет употребления злаков встречается всё чаще, дополнительным фактором формирования целиакии становится воздействие окружающей среды.
Колоректальный рак — рак прямой кишки — также связан с нарушением микрофлоры. Запущенный дисбактериоз запускает хроническое воспаление. Из-за этого накапливаются продуцируемые хозяином антибактериальные пептиды, секреторные IgA, муцины, цитокины или нейромедиаторы. Также в организме скапливаются остатки повреждённых клеток и много активных форм кислорода и азота. При ошибках копирования во время деления кишечных клеток (дисплазии) эти вещества способствуют злокачественному перерождению.
Развитие рака происходит по модели «водитель — пассажир»:
Другие осложнения дисбактериоза
Диагностика дисбактериоза
Диагностика дисбактериоза проводится:
Исследователи чаще используют генотипирование микробиоты методами ПЦР Real-time (в режиме реального времени), исследуя 16S pРНК бактерий. В клинической практике врач проводит посевы микрофлоры, реже ПЦР и микроскопию.
Молекулярная идентификация — это определение последовательностей ДНК или РНК представителей микрофлоры. Проводится не для всех видов бактерий и вирусов, но их число становится всё больше. Бывают одноцелевые (видовые) и мультиплексные (таксонные) анализы.
Для увеличения количества копий ДНК и улучшения качества идентификации используют амплификацию — многократный повтор исследования. Она позволяет обнаружить даже незначительное количество микроорганизмов.
Существует несколько вариантов амплификации:
Чаще всего разнообразие микрофлоры изучается с помощью метода ПЦР. Ген 16S рРНК является идеальной мишенью для классификации бактерий из-за его девяти областей, которые помогают различить виды с помощью отдельных нуклеотидных полиморфизмов.
Хотя большинство образцов материала высевают на среду общего назначения (например, кровяной или шоколадный агар), некоторые болезнетворные микроорганизмы требуют определённых питательных веществ, ингибиторов или других специальных условий. Если есть подозрение на наличие особых микроорганизмов, если пациент принимал антибактериальные препараты, а также при некоторых особых случаях (например, при наличии ВИЧ-инфекци), нужно об этом сообщить в лабораторию.
Микроскопия охватывает не все микроорганизмы, зато проста и помогает в предварительном выборе антибиотиков при подозрении на инфекцию, пока ожидаются результаты окончательной идентификации.
Научные открытия в области диагностики
Недавние достижения в технологиях молекулярной биологии — омикс-технологиях — позволили контролировать концентрации различных биологических молекул. Благодаря этому теперь можно определить их вариации микроорганизмов в различных биологических состояниях в масштабе генома.
Несколько популярных «омических» платформ включают:
Лечение дисбактериоза
Диета
Рацион питания оказывает сильнейшее влияние на микробиоту кишечника. Достичь здорового статуса микрофлоры можно при низком потреблении животных жиров и простых углеводов, включении в рацион овощей и пищи с высоким содержанием клетчатки, а также при разнообразии потребляемых продуктов.
Диета при нарушении микробиома должна быть максимально полной: чем шире рацион, тем богаче микробное разнообразие. При наличии симптомов метеоризма и неустойчивого стула следует избегать сырых овощей (лучше есть их в виде рагу) и фруктов натощак.
Если есть пищевые непереносимости, приводящие к дисбиозу, то придётся исключить:
Кишечник и флора не любят зажаристую мясную корочку, поэтому тушение продуктов всегда лучше, чем жарка.
Пробиотики
Однозначного мнения о пользе приёма пробиотиков для лечения дисбактериоза пока нет. В исследованиях отмечалось такие положительные эффекты:
О снижении инсулинорезистентности данные неоднородны.
В западных странах терапия пробиотиками является дополнением к патогенетическому лечению — блокировки механизмов развития болезни. Решение о её назначении остаётся за врачом.
В России лакто-бифидопробиотики в дозах от 10 9 бактерий в капсуле рекомендованы при болезнях кишечника и как дополнительная терапия аутоиммунных и аллергических заболеваний. Тем не менее, остаётся вопрос длительности применения пробиотиков, так как изолированные заселяемые бактерии (в отличие от фекалотрансплантации) не приживаются, но помогают вытеснить патобионтов и дают возможность угнетённой нормофлоре самостоятельно восстановиться.
Важно, что для лечения различных патологий нужны различные штаммы бактерий :
Пребиотики
Эти питательные вещества выступают в качестве «удобрений» для полезных видов бактерий кишечника. К пребиотикам относятся неперевариваемые олигосахариды, инулин, масляная кислота, многоатомные спирты, аминокислоты и пептиды, лактулоза и пищевые волокна.
Метабиотики (постбиотики)
Они являются структурными компонентами пробиотиков и их метаболитов. Препараты этой группы недостаточно изучены, хотя различные продукты распада бактерий содержатся в кисломолочных и квашеных продуктах питания. В аптеке можно встретить такие метабиотики, как » Хилак форте » и » Бактистатин «, однако их эффективность не доказана ни в одном крупном исследовании. Поэтому лечение метабиотиками остаётся пока только на уровне концепции.
Антибиотики
Фекалотрансплантация
Бактериофаги
Бактериофаги (вирусы, избирательно поражающие бактериальные клетки) эффективны для борьбы с инфекцией — дисбактериозом 2 степени. Препарат подбирают по результатам посевов кала с чувствительностью к фагам. Однако этот метод применяется крайне редко из-за высокой стоимости препаратов и сложности их использования. Выпивать «бульон» с фагами нужно за час до еды 3 раза в день, предварительно выпивая большое количество воды, чтобы разбавить желудочную кислоту, в которой бактериофаги разрушаются. Сейчас этот метод лечения чаще используют в педиатрии, когда нет возможности дать антибиотик.
Иммуномодуляторы
Использование иммуномодуляторов для лечения дисбактериоза кишечника обсуждается, однако убедительных данных пока нет. Хорошо зарекомендовали себя только витамин Д и Омега-3, дефицит которых однозначно негативно сказывается на взаимодействии кишечной стенки с микробиомом.
Могут ли помочь народные средства
Суть народности метода в его популярности среди людей без наличия доказательной базы. Когда какой-то метод лечения проходит клинические испытания, он становится лекарством традиционной практики. Из фитотерапии положительно воздействуют на слизистую пищеварительного тракта и флору настои календулы, ромашки, шалфея и солодки.
Прогноз. Профилактика
Прогноз при дисбактериозе благоприятный. Восстановление нормальной флоры — процесс не быстрый, но достижимый.
Начинать профилактику дисбактериоза у детей необходимо с нормализации вагинальной и кишечной микрофлоры будущих мам. Роды лучше проводить естественным способом.
Следующий шаг на пути правильного формирования микрофлоры кишечного — грудное вскармливание, в ходе которого в организме появляются бифидобактерии. Слишком раннее введение глютенового прикорма поможет избежать возможного развития местного воспаления и целиакии.
В дальнейшей жизни важнейшее значение в профилактике дисбактериоза имеет образ питания, разнообразие рациона и режим приёма пищи. Диета должна быть обогащена кисломолочными продуктами, овощами, фруктами и отрубями. Преобладание растительных масел над животными жирами способствует балансу жирных кислот и противовоспалительной активности в кишечнике.
На фоне погрешности в диете, стресса и после перенесённых инфекций могут появиться первые симптомы кишечного дискомфорта — вздутие, нарушение стула, нарастание висцеральной чувствительности.
Отказ от вредных привычек (курения, злоупотребления алкоголем), минимизация консервантов, потребляемых с пищей, а также амортизация стресса помогут избежать запуска воспалительных процессов и нарушения микрофлоры, связанного с иммунным ответом.
В современном мире инфекции распространяются с огромной скоростью, поэтому отказ от антибиотиков невозможен. Важно применять их разумно, только по назначению врача и с одновременным приёмом пробиотиков.
Регулярное мытьё рук, фруктов и овощей, отказ от косметических средств с антимикробной активностью защищают от инфекций и сохраняют естественную нормофлору.
С возрастом разнообразие микробиоты естественным образом снижается. Это повышает склонность к запорам, ослабляет иммунную защиту и вызывает общую слабость. В таких ситуациях профилактикой дальнейшего развития дисбиоза будет своевременный приём курсов про- и пребиотиков или их постоянное поддерживающее применение.