Микрофлора кишечника это простыми словами что такое
Роль микробиоты кишечника в поддержании здоровья
Микрофлора представляет собой метаболически активную и сложную экосистему, состоящую из сотен тысяч микроорганизмов — бактерий, вирусов и некоторых эукариот. Подобно невидимому чулку, биоплёнка покрывает все слизистые нашего организма и кожу. Микробиота объединяет более чем 10 14 (сто биллионов) клеток микроорганизмов, что в 10 раз превышает число клеток самого организма. Микробиота находится в содружественных отношениях с организмом человека: организм хозяина предоставляет среду обитания и питательные вещества, микроорганизмы защищают организм от патогенных возбудителей, способствуют поддержанию нормальных иммунологических, метаболических и моторных функций. Выделяют несколько важных биотопов, которые отличаются плотностью распределения микроорганизмов и составом: кожные покровы, слизистые оболочки ЖКТ, дыхательных путей, урогенитального тракта и проч. Самой многочисленной считается микробиота кишечника, на её долю приходится 60% микроорганизмов, колонизирующих организм человека.
Микрофлора кишечника состоит из группы микроорганизмов, представленных более чем 1000 видами, 99% из которых приходится на 30–40 главных видов. В научных кругах кишечную микрофлору называют также дополнительным органом.
Состояние микробиоты кишечника определяет качество и продолжительность жизни. У каждого человека есть свой индивидуальный характер распределения и состава микробиоты. Частично он определяется генотипом хозяина и первоначальной колонизацией, которая происходит сразу после рождения. Различные факторы, такие как тип родов, кормление грудью, образ жизни, диетарные предпочтения, гигиенические условия и условия окружающей среды, использование антибиотиков и вакцинация, могут определять окончательные изменения в структуре микробиоты.
При изменении состава или функции микробиоты развивается дисбиоз. Дисбиотические состояния изменяют моторику кишечника и его проницаемость, а также искажают иммунный ответ, тем самым создавая предпосылки для развития провоспалительного состояния. Такие изменения, особенно в отношении иммунных и метаболических функций хозяина, могут вызывать или способствовать возникновению ряда заболеваний, например, сахарного диабета, ожирения, неврологических и аутоиммунных заболеваний. Недавние исследования показали, что микробиота участвует в этиопатогенезе многих гастроэнтерологических заболеваний, таких как синдром раздраженного кишечника, воспалительные заболевания кишечника, целиакия, неалкогольный стеатогепатит и новообразования желудочно-кишечного тракта.
Кишечная микрофлора и иммунитет
Кишечная микробиота имеет решающее значение для развития лимфоидных тканей, а также для поддержания и регуляции кишечного иммунитета.
В кишечнике происходит сенсибилизация иммуноцитов, которые затем заселяют другие слизистые оболочки и циркулируют между различными органами. Этот механизм обеспечивает формирование клонов лимфоцитов и образование специфических антител в участках слизистой оболочки, отдалённых от очага первичной сенсибилизации.
Иммунокомпетентные ткани пищеварительного тракта объединены в лимфоидную ткань. Лимфоидная ткань представлена лимфоцитами, расположенными между эпителиальными клетками кишечника, лимфоцитами собственного слоя, пейеровыми бляшками (скопления лимфоидной ткани в тонкой кишке) и лимфоидными фолликулами.
Попавшие в просвет кишечника или на слизистые оболочки антигены распознаются иммуноглобулинами памяти (IgG), после чего информация передаётся в иммунокомпетентные клетки слизистой оболочки, где из сенсибилизированных лимфоцитов клонируются плазматические клетки, ответственные за синтез IgА и IgМ. В результате защитной деятельности этих иммуноглобулинов включаются механизмы иммунореактивности или иммунотолерантности. Благодаря индукции иммунологической толерантности в кишечнике не возникают нежелательные воспалительные реакции против кишечной микробиоты и пищевых белков.
Кишечная микробиота и обмен веществ
Кишечная микробиота вносит непосредственный вклад в метаболизм питательных веществ и витаминов, необходимых для жизнедеятельности организма хозяина, при этом извлекая энергию из пищи. Эта энергия образуется путём реакции сбраживания не усваиваемых углеводов (клетчатки), в результате реакции образуются короткоцепочечные жирные кислоты, водород и углекислый газ.
Короткоцепочные жирные кислоты обеспечивают работу колоноцитов.
Короткоцепочные жирные кислоты считаются тонкими регуляторами иммунитета, энергетического обмена и метаболизма жировой ткани. Например, короткоцепочные жирные кислоты участвуют во взаимодействии бактерий и иммунитета, подавляя сигналы, которые могут привести к развитию аутоиммунных реакций. Пропионовая и масляная жирная кислота положительно влияют на метаболизм глюкозы. Наконец, короткоцепочные жирные кислоты обеспечивают подкисление просвета толстой кишки, предотвращая рост бактериальных патогенов.
Кишечная микробиота принимает непосредственное участие в метаболизме желчных кислот, источником которых является холестерин. В печени из холестерина синтезируются первичные желчные кислоты — холевая и хенодезоксихолевая, которые поступают в кишечник. Бактероиды и лактобациллы далее превращают первичные желчные кислоты во вторичные желчные кислоты — дезоксихолевую и литохолевую. Изменение нормального баланса кишечных бактерий приводит к неадекватному синтезу желчных кислот.
Микробиота и нервная система
Ещё более удивительные данные о взаимосвязи кишечной микробиоты и нервной системы. Микробиота кишечника тесно общается с центральной нервной системой. Микробиота кишечника производит такие нейроактивные молекулы, как ацетилхолин и серотонин, дофамин, которые являются главными медиаторами сигналов в ЦНС, а также регулируют работу мозга через активацию иммунных сигнальных путей. Дополнительно, блуждающий нерв активно участвует в двунаправленных взаимодействиях между кишечной микробиотой и мозгом для поддержания гомеостаза как в головном мозге, так и в кишечнике.
Недавние исследования показали, что микробиом влияет на свойства и функцию микроглии. Микроглия защищает мозг от различных патологических состояний через активацию иммунного ответа, фагоцитоза и продукцию цитокинов. Кроме того, микроглия ответственна за формирование нейронных цепей, которые участвуют в развитии мозга. Различные дисбиотические состояния, в том числе вызванные приёмом антибиотиков приводят к угнетению созревания клеток микроглии. Незрелая микроглия приводит к нарушению иммунной активации.
Астроциты — самая многочисленная клеточная популяция в ЦНС, и они почти в пять раз превосходят численность нейронов. Подобно микроглии, астроциты выполняют несколько важных функций по поддержанию целостности ЦНС, включая контроль кровообращения в головном мозге, поддержание стабильности гематоэнцефалического барьера. Астроциты регулируют баланса ионов и оказывают влияние на передачу сигналов между нейронами. Чрезмерная активация астроцитов является пусковым механизмом в развитии дисфункции ЦНС и неврологических расстройств. Чрезмерная активация происходит под действием метаболитов микрофлоры.
Целостность гематоэнцефалического барьера регулируется также метаболитами микробиоты, которые опосредуют передачу большего количества микробных сигналов между осью кишечник-мозг.
Дисбиоз микробных видов в кишечнике может вызывать атипичные иммунные сигналы, дисбаланс в гомеостазе организме-хозяина и привести к прогрессированию заболеваний ЦНС. Например, рассматривается роль микробиоты в патогенезе рассеянного склероза-заболевания, характеризующимся демиелинизацией аксонов нервных клеток. При болезни Паркинсона, которая проявляется моторными симптомами, включая тремор, мышечную ригидность, медлительность движений и аномалию походки наблюдается накопление α-синуклеина в нейронах. Избыточное отложение α-синуклеина в нервной системе инициируется кишечной микрофлорой до того, как возникают симптомы поражения ЦНС, что связано с некоторыми специфическими пищеварительными симптомами (запоры и нарушение двигательной функции толстой кишки). Бактериальный состав кишечника влияет на болезнь Паркинсона: тяжесть симптомов, в том числе постуральная нестабильность и нарушение походки, связана с изменениями численности некоторых видов Enterobacteriaceae, уменьшение количества Lachnospiraceae приводит к более серьёзному ухудшению моторных и немоторных симптомов у пациентов с болезнью Паркинсона. Болезнь Альцгеймера — ещё одно нейродегенеративное заболевание, которое приводит к серьёзным нарушениям функции ЦНС — обучению, памяти и поведенческим реакциям. Болезнь Альцгеймера характеризуется отложением пептида амилоид-β (Aβ) снаружи и вокруг нейронов, вместе с накоплением белка тау внутри корковых нейронов. Перегрузка амилоидом и агрегация тау нарушают синаптическую передачу. Изменение состава и разнообразия микробиоты вносит определённый вклад в патогенез болезни Альцгеймера. Активированная микроглия способствует развитию заболевания, увеличивая отложение амилоида.
Ожирение и состав микробиоты
При ожирении и сахарном диабете наблюдаются изменения в составе микробиоты кишечника, в частности, снижение популяционного уровня сахаролитических бактероидов, влияющих на интенсивность метаболических процессов, а также увеличение доли бактерий класса Firmicutes (Esherichia coli, Clostridium coccoides, Clostridium leptum). Снижение содержания сахаролитических бактерий уменьшает выработку коротко-цепочных жирных кислот, обеспечивающих трофику и деление эпителия кишечника, его созревание, оказывающих антимикробное действие и регуляторное действие в отношении ионов и липидов.
Дополнительно при ожирении отмечается хроническое системное воспаление, сопровождающееся секрецией провоспалительных цитокинов (интерлейкины — ИЛ, С-реактивный белок, α-фактор некроза опухоли — α-ФНО и др.) в висцеральной жировой ткани. Нарушения в составе кишечной микрофлоры приводят к усилению эффекта системного воспаления за счёт увеличения концентрации бактериальных липополисахаридов, стимулирующих выработку провоспалительных компонентов.
Диагностика состояния кишечной микробиоты
Существует два метода определения микробиоты — стандартный анализ на дисбактериоз и оценка состава микробиоты методом масс-спектрометрии по крови (ГХ-МС). В основе методики масс-спектрометрии лежит определение присутствия микроорганизмов по их клеточным компонентам (высшие жирные кислоты, альдегиды, спирты и стерины). Методика разработана профессором Осиповым Г.А. Метод ГХ-МС позволяет одновременно измерять более сотни микробных маркёров непосредственно в образце, позволяющих сделать заключение о некультивируемых и труднокультивируемых патологических возбудителях. Метод универсален также в отношении грибов и вирусов.
Не все йогурты одинаковые — полезные статьи Активиа
Микробиота кишечника: что это такое и в чём её роль в организме человека
В нашем организме около 30 триллионов клеток и почти столько же бактерий.
Что такое микробиота?
По нашему телу микроорганизмы распределены неравномерно, и в местах обитания бактерий – нишах – формируется свое особенное микробное сообщество: на коже, в полости рта, дыхательных путях и кишечнике.
***Разная микробиота: собственные наборы бактерий для кожи, полости рта, лёгких, влагалища, кишечника.
Человек не приходит в этот мир с уже сформировавшейся микробиотой — она развивается и до, и после рождения.
Примерно к трем годам у ребенка полностью формируется микробиота [2]. В течение всей жизни она будет меняться незначительно [3], а в пожилом возрасте ее состав станет менее разнообразным из-за процессов старения и влияния привычной пищи [4].
Микробиом, микробиота, микрофлора — в чем разница?
Термины «микробиом» и «микробиота» часто используются как синонимы, но различия между ними все-таки есть.
Микробиота — это совокупность микроорганизмов определенной экосистемы (наше тело — тоже своего рода макроэкосистема для различных микроорганизмов). Ее составляют не только бактерии — она включает еще и дрожжи, вирусы, археи и другие виды микроорганизмов.
Микробиом — это совокупность генов микробиоты, ее коллективный геном.
Кто населяет наш кишечник?
Условно-патогенные (оппортунистические) бактерии для здорового человека обычно безвредны. Но они резко размножаются при негативном воздействии на организм. Если человек получил травму, произошел сбой в иммунной системе или нарушился баланс в составе микробиоты, нейтральные микробы могут стать патогенными. Например, из-за стресса на фоне приема антибиотиков растет число оппортунистических бактерий [8,9].
Функции кишечной микробиоты
Работа, которую выполняют бактерии кишечника, трудна и незаметна — по крайней мере, на первый взгляд. Однако именно микробиота нужна для выполнения нескольких важных функций организма [10]:
• Поддержка иммунитета. Микробиота нужна для эффективной работы иммунной системы: бактерии кишечника выступают в роли своеобразного «тренажера». А главное, обитатели микробиома постоянно конкурируют между собой, занимая свободное пространство, и места для патогенных микробов уже не остается.
• Синтез витаминов (К, группы В и других), которые всасываются в кишечнике вместе с пищей.
Этим перечнем функции микробиоты не исчерпываются. Исследования показывают [11], что бактерии в ее составе влияют на настроение, на работу нейромедиаторов и на уровень главного гормона стресса — кортизола.
Все эти функции — пищеварение, помощь иммунной системе, синтез витаминов — выполняют далеко не все бактерии. Микробиота — это целая экосистема, где каждая часть микроорганизмов отвечает за свою задачу. Фактически, это орган в органе со своими особенностями и функциями. Мы получаем его при рождении и растем вместе с ним, формируя свой собственный, уникальный профиль микробиома.
Что может влиять на микробиоту
Что же влияет на микробиоту?
Как улучшить микробиом кишечника
Вопросы и ответы о микробиоте
Различается ли микробиота толстого и тонкого кишечника?
Да, различается — и по составу (количественному и качественному), и по функциям. Микробиота тонкого кишечника отвечает за защиту слизистой оболочки, принимает активное участие в усвоении питательных веществ, участвует в иммунной защите нашего организма.
Микробиом толстого кишечника — это настоящий центральный реактор всего ЖКТ. От него зависит наше самочувствие. К тому же, в толстом кишечнике микробиоты в разы больше, чем в тонком. Поэтому мы чаще говорим о микробиоте толстого кишечника.
Как узнать состояние своей микробиоты?
Если исследование нужно для лечения, назначить его и интерпретировать полученные результаты должен только лечащий врач.
Связаны ли микробиоты разных органов?
Тем не менее, микробиоты могут влиять друг на друга. Например, продолжительный прием определенных лекарств может привести к тому, что микробы желудка будут попадать в кишечник и там размножаться, приводя к дисбиозу.
Что такое «пересадка микробиоты»?
Это еще один способ восстановить баланс микроорганизмов, когда бактерии доставляются не стандартным способом, через весь ЖКТ, а сразу в нужную часть кишечника. Так микробы оказываются на нужном месте быстрее, но пересадка весьма трудоемка, и используют ее редко, только при очень тяжелых заболеваниях. Чаще всего достаточно классических методов лечения.
Препараты для восстановления микрофлоры кишечника
Относится к группе пребиотиков. Содержит в себе ЛАКТУЛОЗУ (дисахарид, созданный искусственным путем. В процессе разложения лактулозы снижается кислотность содержимого кишечника, повышается давление в просвете кишки и усиливается ее перистальтика. Поэтому при нарушении микрофлоры с нарушением стула (запором), наблюдается значительное улучшение состояния при приеме Дюфалака. Большинство патогенных бактерий живут в слабощелочной или нейтральной среде. Препарат угнетает рост патогенной микрофлоры, за счёт создания кислой среды в кишечнике, а так как лактулоза служит питательным субстратом для бактерий кишечника, нормализуется состав микрофлоры.
Как принимать: Дюфалак выпускается в виде сиропа со сливовым вкусом. Можно принимать как в разбавленном виде, так и неразбавленном. Всю дозу необходимо сразу проглотить.Пребиотическая доза препарата и длительность приема подбираются индивидуально, учитывая частоту стула у пациента, у взрослых 5–10 мл, у детей 2,5–5 мл 1 раз в сутки.
Бифиформ.
Относится к многокомпонентным пробиотикам. Содержит в себе Бифидобактерии и Энтерококки. А сама капсула препарата является одновременно и защитой от расщепления в желудке и питательным субстратом для данных штаммов бактерий. Важно, что препарат, в отличии от многих других препаратов для восстановления микрофлоры не содержит лактозы. Поэтому он актуален для людей с ее непереносимостью. Препарат не только помогает заселить кишечник полезными бактериями, но и стимулирует развитие местного иммунитета. Как принимать: для восстановления и поддержания микрофлоры рекомендуется принимать по 1 капсуле 2-3 раза в день курсом от 2 до 3 недель. Не зависит от приема пищи, что тоже является дополнительным плюсом при применении.
Флорин Форте.
Поликомпонентный пробиотик, который содержит в себе 2 типа штаммов: Бифидобактерии и Лактобактерии. Это единственный в своем роде поликомпонентный пробиотик, в котором микроколонии бактерий сорбированы по специальной технологии на частицы активированного угля. Данная технология позволяет препарату доставить бактерии в кишечник в неизменном виде, а компоненты угля помогают им прикрепиться к кишечной стенке. Штаммы бактерий не являются генно-модифицированными. Выявлена высокая эффективность препарата при нарушениях стула (диареи). При данном симптоме средство действует наиболее эффективно, по сравнению с другими препаратами-пробиотиками по данным последних исследований. Большим достоинством вещества является его безопасность. Его можно давать детям с первых дней жизни (и даже недоношенным детям), а также беременным и кормящим женщинам. Как принимать:Флорин-Форте представлен в форме порошка. Прием желательно производить во время еды, но строгой зависимости нет. Препарат смешивают с жидкой пищей (в идеале с кисломолочным продуктом) или водой. Новорожденным и детям грудного возраста препарат смешивают с грудным молоком. Дозировка зависит от возраста. Взрослым пациентам назначается по 2 пакета 3 раза в сутки, детям по 1 пакету 2-4 раза в сутки. Препарат содержит лактозу.
Линекс.
Является одним из самых известных в группе поликомпонентным пробиотиком. В составе Линекса целых три непатогенные бактерии — Лактобактерии, Бифидобактерии и Молочный Стрептококк. Особо эффективна эта комбинация при нарушении микрофлоры, связанной с приемом антибиотиков, а Энтерококк позволяет нормализовать микрофлору в верхних отделах кишечника, что можно встретить не у все пробиотических препаратов. По данным исследований, именно при диарее, вследствие приема антибиотиков, Линекс показал хорошие результаты. Также препарат положительно влияет на иммунитет, т.к. участвует в синтезе аскорбиновой кислоты и образует вещества с антибактериальными свойствами, что может помочь при легких формах кишечных инфекций. Большим плюсом Линекса является устойчивость микроорганизмов, входящих в состав препарата к антибиотикам. Именно поэтому препарат можно принимать параллельно с терапией антибактериальными препаратами. Как принимать: его можно принимать детям, пожилым людям, беременным и кормящим женщинам. Дозировка зависит от формы выпуска. Для взрослых более удобен прием в форме капсул (рекомендованная доза — по 2 капсулы 3 раза в день). Для детей существуют саше с порошком или капли, которые можно добавлять в молоко, сок и другие негорячие напитки. Запивать капсулы также не рекомендуется горячими напитками или алкоголем. Если при приеме препарата наблюдается повышение температуры или ухудшение общего состояния требуется дополнительное наблюдение врача.
Пробифор.
Пробиотик, содержащий один штамм бактерий — Бифидобактерии. Также в составе — активированный уголь. Препарат, используемый не только для поддержания и восстановления микрофлоры, но и для лечения кишечных инфекций неизвестной этиологии, диареи и интоксикации. Содержит лактозу, поэтому противопоказан при ее непереносимости. Является достаточно активным препаратом, которые показывает высокую эффективность в лечении кишечных заболеваний. Как принимать: Пробифор принимают внутрь во время приема пищи, при необходимости — независимо от приема пищи. Выпускается в форме капсул и порошка. Капсулы можно принимать только детям от 5 лет и взрослым, порошок всем возрастным группам.
Бифидумбактерин.
Однокомпонентный пробиотик, содержащий штамм Бифидобактерий. Имеет много лекарственных форм (капсулы, суспензия, суппозитории, порошок). У данного препарата очень мягкое воздействие на микрофлору, поэтому четкой схемы приема нет. Можно применять как детям, так и беременным женщинам. Одним из плюсов препарата является его ценовая доступность.
Лактобактерин плюс.
Пробиотик, содержащий один штамм бактерий — Лактобактерии. Помимо нормализации микрофлоры, имеет свойство повышения иммунной защиты организма. При аллергических проявлениях также оказывает высокую эффективность. Форма выпуска: жидкий концентрат. Такая форма более удобна чем порошковая, так как нет необходимости разведения. Рекомендуется сочетать препарат с приемом витаминов, так как это усиливает его действие. Ввиду высокой устойчивости к антибактериальным препаратам, также допускается совместный прием при антибактериальной терапии. Как принимать: важно, что Лактобактерин разрешен для приема детям с первых дней жизни. Принимать его нужно не позднее чем за 30 минут до еды, предварительно встряхнув флакон, запивая небольшим количеством воды. Дозировка зависит от возраста, у детей до 12 лет это 1-3 мл в день, у взрослых – 3-5 мл. Также Лактобактерин назначается для поддержания микрофлоры уже после лечения курсами на 1-1,5 месяца.
Полисорб.
Данный препарат не входит в группу про- и пребиотиков. Но он отлично справляется с подготовкой организма к приему препаратов для восстановления кишечной микрофлоры, особенно после приема курсов антибиотиков. Это мощный энтеросорбент. Он обладает всеми важными качествами данной группы препаратов (не обладает токсическими свойствами, не травмирует слизистые оболочки, хорошо удаляется из кишечника, имеет хорошие связывающие свойства, не вызывает нарушения микрофлоры и имеет удобную лекарственную форму). Основное предназначение данного препарата — выведение токсинов из организма. Он очень эффективен при аллергических проявлениях нарушения микрофлоры. Улучшает состояние кожи. Также связывает избыток холестерина и других вредных жирных кислот, нейтрализуя их. Как принимать: выпускается в виде порошка, который обязательно нужно растворить в ¼-1/2 стакане воды. Доза препарата зависит от массы тела пациента. Полисорб проходит через желудочно-кишечный тракт и выводится в полностью неизменном состоянии.
Все эти препараты направлены на улучшения состояния нормальной микрофлоры кишечника. При постоянном приеме и соблюдении инструкций, пациент начинает отмечать улучшение уже после 5-7 дней приема. При выборе пробиотика или пребиотика, необходимо учитывать индивидуальную непереносимость некоторых компонентов препарата, возраст и степень выраженности нарушения микрофлоры кишечника. Во всех случаях рекомендуется проконсультироваться с лечащим врачом. При правильном выборе и приеме препаратов, а также сбалансированном питании и ведении здорового образа жизни ваш кишечник скажет вам спасибо!
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ, НЕОБХОДИМО ОЗНАКОМИТЬСЯ С ИНСТРУКЦИЕЙ ИЛИ ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ.
Микробиом кишечника: мир внутри нас
В реальном мире достаточно поводов для благоговейного изумления. Природа куда более изобретательна в отношении чудес, чем мы с вами. Карл Саган.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Микробиом человеческого кишечника представляет собой уникальную совокупность микроорганизмов. Его незримое присутствие опосредует целый ряд важных процессов: от метаболических и иммунных до когнитивных, а отклонение его состава от нормы приводит к развитию разнообразных патологических состояний: аллергических и аутоиммунных заболеваний, сахарного диабета, ожирения и др. Качественный и количественный состав микробиома, от которого во многом зависит будущее здоровье человека, определяется во младенчестве. Процессам его формирования и будет посвящена эта статья.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Александр Коваленко.
Микробиом распределен в нашем организме неравномерно, по его топографии и видовому составу принято различать микробиом кожи, полости рта, дыхательных путей, урогенитального тракта и кишечника. Наиболее крупным микробиомом нашего тела является, несомненно, кишечный. Он может состоять из сотен видов различных микроорганизмов, но у взрослого человека преобладают бактерии двух типов: Firmicutes и Bacteroidetes [3]. Кишечный микробиом изучен лучше других бактериальных сообществ человека, и многолетние исследования, о которых будет рассказано ниже, показали, что именно он в большей степени влияет на здоровье своего носителя. Давайте же совершим путешествие в прошлое и разберем, как формируется микробиом нашего кишечника.
Микробиом: начало
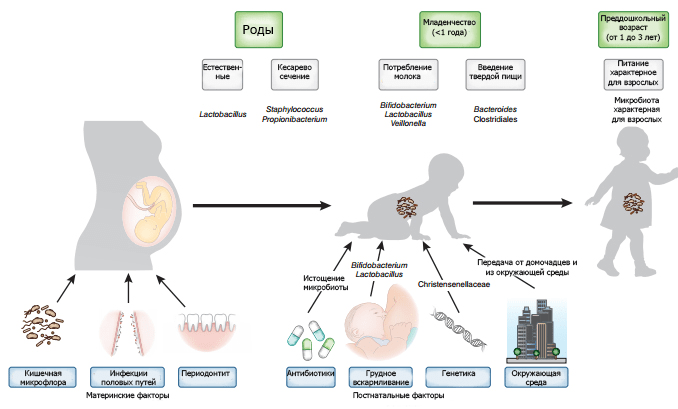
Еще до недавнего времени считалось, что плод в утробе матери полностью огражден от контакта с миром микроорганизмов, то есть человек рождается полностью стерильным, а его заселение бактериями происходит позже. Но появились данные о том, что первые колонизаторы осваивают организм человека еще до его рождения. В ряде исследований было выявлено, что в плаценте, околоплодных водах, пуповинной крови и первичном кале — меконии — присутствуют бактерии родов Enterococcus, Escherichia, Leuconostoc, Lactococcus и Streptococcus, а у недоношенных младенцев — следы Enterobacter, Enterococcus (в меньшей степени, чем у доношенных), Lactobacillus, Photorhabdus и Tannerella [4–14]. Также в одной из работ были получены доказательства внутриутробной бактериальной транслокации — проникновения бактерий из кишечника матери к плоду [13]. Исследователи предполагают, что это происходит посредством кровотока: механизмом, сходным с «энтеромаммарной осью», о которой поговорим чуть позже. Эту гипотезу поддерживают данные другого эксперимента, в котором беременные мыши перорально получали меченых Enterococcus faecium, после чего эти бактерии «заявляли о себе» в плаценте и даже меконии еще не рожденных мышат [13].
Но всё же по-настоящему серьезный контакт с миром микроорганизмов происходит после рождения, и во многом от того, как пройдет эта встреча, зависит будущее здоровье человека. Колонизация кишечника у здоровых детей укладывается в четыре последовательные временны́е фазы. Первая длится от момента рождения до двух недель. Микробная популяция в этот период представлена в основном стрептококками и кишечной палочкой. В зависимости от вида вскармливания — грудного или искусственного — через некоторое время присоединяются бифидо- или лактобактерии соответственно. В небольших количествах обнаруживаются и представители родов Clostridium и Bacteroides. Через две недели начинается вторая фаза, которая продолжается до введения в рацион прикорма. В это время увеличивается численность представителей рода Bacteroides. С момента введения прикорма начинается третья фаза, длящаяся до завершения грудного вскармливания. В эту фазу окончательно формируется микробиом ребенка: постепенно, по мере увеличения в рационе доли твердой пищи и снижения доли грудного молока, растет количество бактероидов и анаэробных грамположительных кокков (пептококков и пептострептококков). Окончание грудного вскармливания знаменует переход к четвертой фазе. Она характеризуется относительной стабильностью микробного состава, который сохраняется в течение всей жизни индивида [15].
А теперь рассмотрим подробнее, как протекают процессы колонизации и становления иммунного ответа во время и после рождения.
Родоразрешение
Как оказалось, даже характер родоразрешения (ребенок может появиться на свет естественным путем, а может и оперативным, с помощью кесарева сечения) влияет на состав микробиома младенца.
Первое, с чем сталкивается ребенок, — микробный мир родовых путей его матери. У небеременных женщин идентифицировано шесть видов лактобактерий, исходя из соотношения которых выделяют по крайней мере пять качественно различных типов микробиома влагалища [16]. В четырех из них — характерных, как правило, для представительниц европейских и азиатских народов — преобладают следующие представители рода Lactobacillus:
IV тип микробиома часто встречается у чернокожих и латиноамериканских женщин и характеризуется низким уровнем Lactobacillus spp. и большим числом анаэробных бактерий.
Интересно, что женщины, имеющие IV тип микробиома влагалища, более склонны к развитию специфических и неспецифических воспалительных гинекологических заболеваний. Этот феномен связан со снижением количества Lactobacillus spp., которые в норме создают неблагоприятную для патогенов кислую среду. Также было установлено, что у этих женщин больше шансов заразиться ВИЧ, ведь воспалительные процессы увеличивают на поверхности слизистых оболочек численность CD4-содержащих лимфоцитов — основных мишеней вируса [17].
При беременности из-за изменения pH влагалища бактериальное разнообразие уменьшается, но повышается стабильность состава микробиоты. Как правило, в этот период в микробиоме преобладают Lactobacillus crispatus и Lactobacillus iners. Количественное превосходство этих видов подчеркивает их важность для поддержания здоровой среды родовых путей. У европейских и азиатских женщин во время беременности могут происходить сдвиги между типами микробиомов, но, как правило, они редко переходят к IV типу [18]. Таким образом, в зависимости от особенностей микробиоты влагалища матери ребенок начинает свою жизнь со «знакомства» с определенным видовым набором микроорганизмов, что подчеркивает важность исследований микробиомов различных групп населения.
Но во что же выливается это знакомство? Почему вообще заселение микробами так важно для ребенка? Дело в том, что бактерии за счет симбиотических взаимоотношений с эпителиальными и иммунными структурами кишечника фактически активируют иммунную систему хозяина (рис. 1) [21].
Покидая родовые пути естественным образом, доношенный новорожденный в небольших количествах заглатывает представителей вагинальной и кишечной микробиоты матери. В основном это бактерии родов Prevotella, Sneathia и Lactobacillus [15]. Если же родоразрешение происходит путем кесарева сечения, одними из первых колонизируют организм новорожденного представители кожных микробиомов матери и медицинского персонала, в основном — бактерии родов Propionibacterium, Corynebacterium и Streptococcus [19], [20]. У таких младенцев отмечают замедление заселения кишечника филой Bacteroidetes и низкое бактериальное разнообразие в течение первых двух лет жизни [22]. Однако с четырех месяцев различия в бактериальном разнообразии с естественно рожденными детьми начинают стираться, и к 12 месяцам практически исчезают [19].
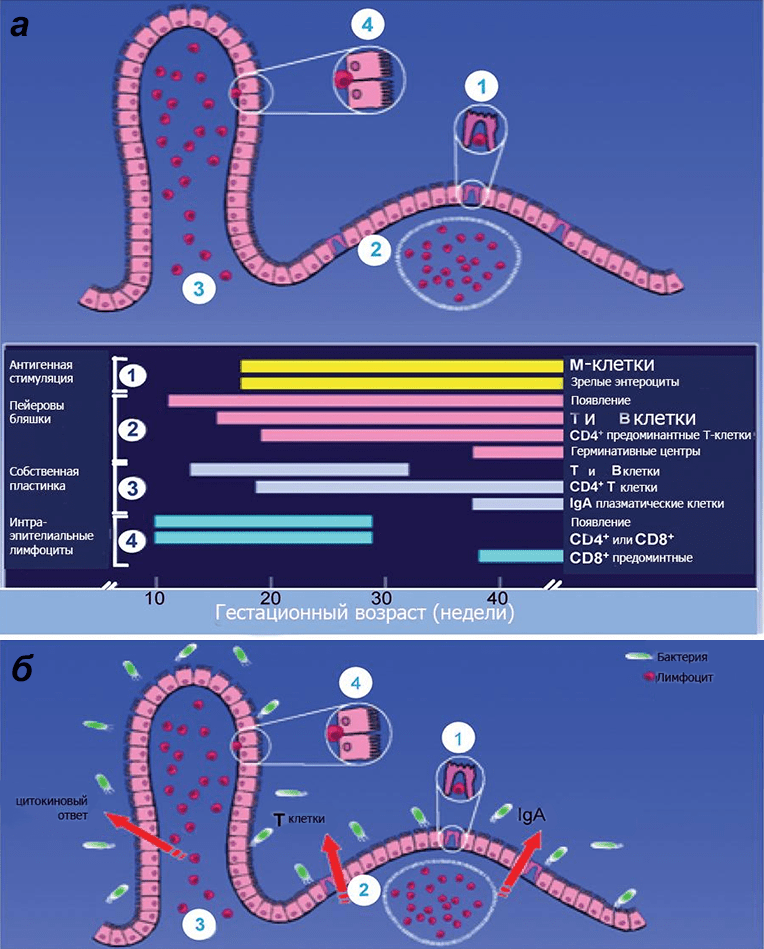
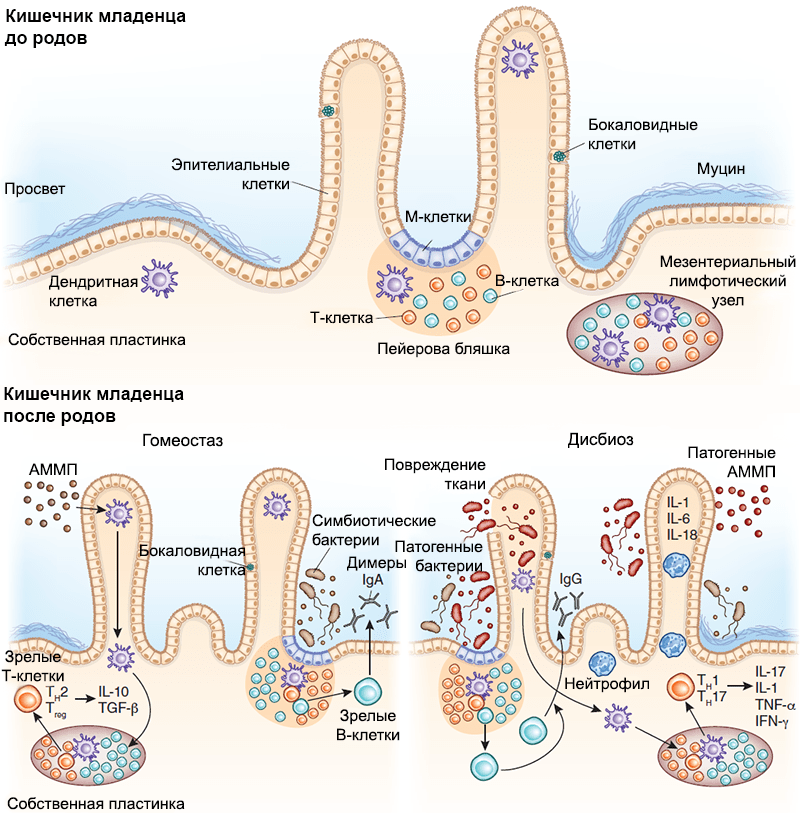
Рисунок 1. Схема иммунной защиты слизистой оболочки кишечника плода в зависимости от гестационного возраста. а — У младенца, рожденного в срок, все компоненты иммунной защиты слизистой оболочки являются зрелыми. б — Однако чтобы иммунная система приобрела работоспособность, должна произойти ее стимуляция первичными колонизаторами. Иммунная защита кишечника включает в себя: специализированный эпителий, или М-клетки (1), пейеровы бляшки (2), интерстициальные (3) и интраэпителиальные (4) лимфоциты, опосредующие развитие иммунных реакций. Среди лимфоидных образований кишечника выделяют одиночные лимфатические узлы (расположены преимущественно в дистальных отделах кишечника) и пейеровы бляшки (расположены в основном в подвздошной кишке). Последние образованы сгруппированными лимфатическими фолликулами, выпячивающими эпителий в просвет кишки в виде купола, и межузелковыми скоплениями лимфоидной ткани. Эпителий слизистой оболочки в области бляшки содержит до 10% специфических микроскладчатых (М-) клеток, обеспечивающих трансэпителиальный транспорт, механизм которого — трансцитоз: благодаря тонкому гликокаликсу они активно поглощают апикальной поверхностью макромолекулы (в том числе антигены) из просвета кишки, в составе эндосом перемещают их через свою цитоплазму и посредством экзоцитоза передают иммунокомпетентным клеткам пейеровых бляшек. Для ускорения процесса М-клетки снизу образуют «карманы», заполняющиеся «иммунным винегретом» из В-клеток, плазмоцитов, Т-клеток, макрофагов и антигенпрезентирующих дендритных клеток.
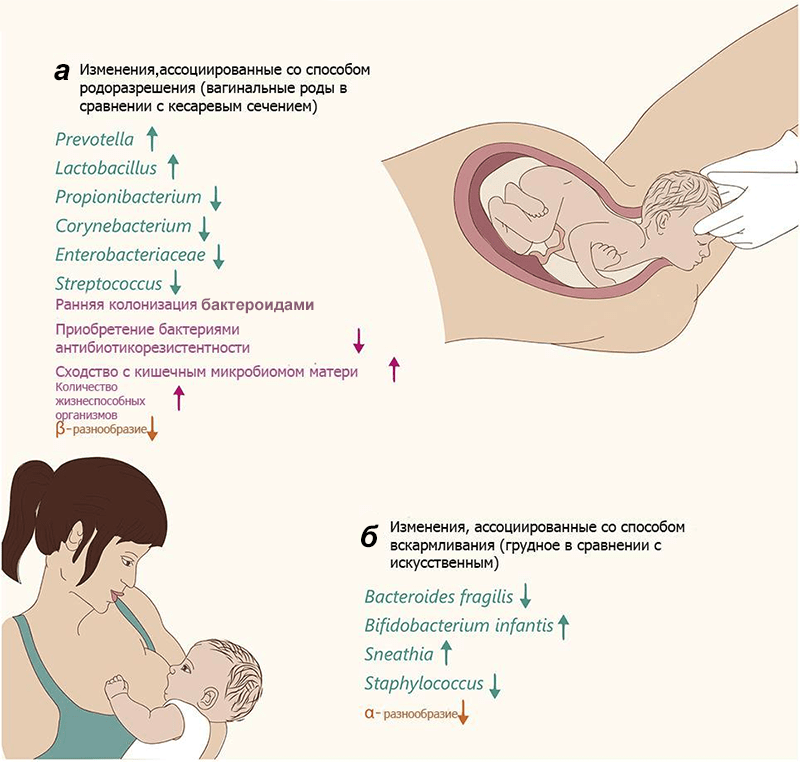
Тем не менее очевидно, что характер родоразрешения влияет на микробиом новорожденного (рис. 2). Правда, пока неясно, сказываются ли эти различия на здоровье взрослого индивида: хотя некоторые эпидемиологические исследования демонстрируют связь между кесаревым сечением и различными заболеваниями (табл. 1), причина их развития окончательно не выяснена.
Рисунок 2. Изменения микробиома у новорожденных. Цвет текста и стрелки обозначают изменения специфических разновидностей (зеленый), общие изменения (розовый) и разнообразие сообщества (оранжевый). а — Изменения у младенцев, родившихся естественным путем, относительно извлеченных хирургически. б — Изменения у младенцев, находящихся на грудном вскармливании, относительно «искусственников». α-разнообразие — видовое разнообразие внутри исследуемого сообщества, β-разнообразие — видовое разнообразие между сообществами данной области (по Р. Уиттекеру).
Грудное вскармливание
Не менее важным фактором в формировании микробиома новорожденного является характер питания. Грудное молоко — оптимально сбалансированная пища для младенца, обеспечивающая его нормальное развитие [23]. Как известно, в первые дни жизни именно оно защищает ребенка от инфекционных болезней и способствует снижению смертности от них [24] за счет содержания множества иммунных факторов: Т- и В-лимфоцитов, плазматических клеток, иммуноглобулинов (в первую очередь IgА) и антимикробных ферментов (лизоцима и лактоферрина). Установлено, что грудное вскармливание в какой-то мере предотвращает развитие таких хронических заболеваний, как сахарный диабет [25] и ожирение [26]. И, несомненно, грудное молоко способствует формированию «здорового» микробиома. Первые данные об обнаружении бактерий в женском молоке были получены в 1950 году, но исследователей тех лет интересовали лишь патогенные микроорганизмы [27]. И хотя уже в 70-х годах в грудном молоке были найдены первые бактерии-симбионты, ученым не удалось их идентифицировать [27]. Лишь в 2003 году, когда в молоке, на коже груди и ареолах сосков восьми кормящих матерей и в ротовой полости и фекалиях их детей были обнаружены родственные лактобациллы, ученые предположили, что эти бактерии не занесены случайно извне, а имеют эндогенное происхождение [28].
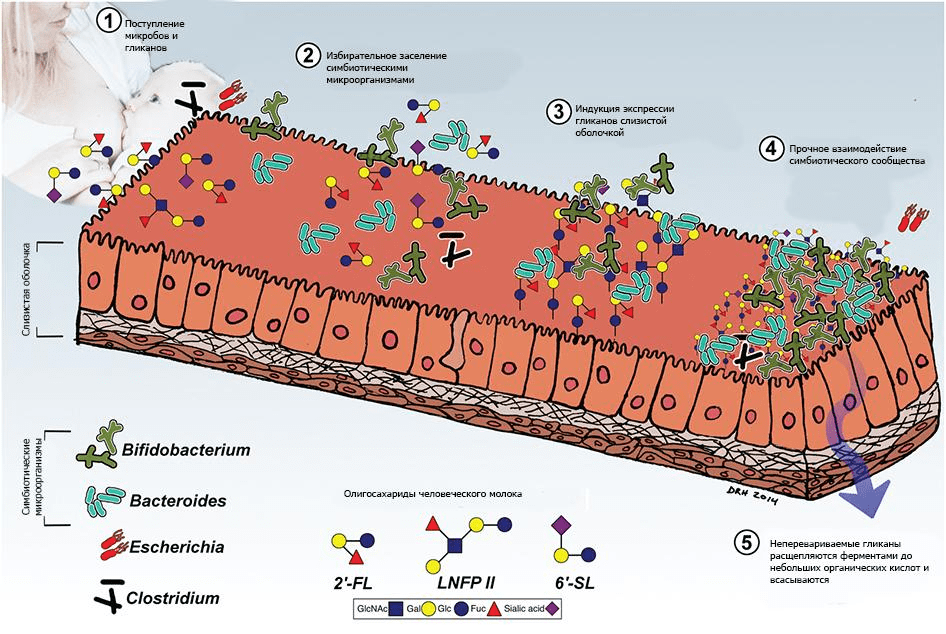
Независимо от того, материнское или донорское грудное молоко используется для вскармливания, у каждого младенца формируется свой особый микробиом. Заслуга в этом принадлежит олигосахаридам молока человека (ОМЧ) [29], [30]. В составе женского молока около 8% отведено перевариваемым ОМЧ — пребиотикам, поддерживающим рост Bifidobacterium longum subsp. infantis [31]. При этом профиль ОМЧ у каждой женщины уникален, что обеспечивает, в свою очередь, индивидуальность младенческого микробиома (рис. 3) [32].
Рисунок 3. Взаимодействие гликанов человеческого молока и микробиоты. Взаимодействие новорожденного с материнскими и содержащимися в окружающей среде микроорганизмами опосредовано потреблением молозива и содержащихся в нём гликанов (олигосахаридов молока человека, ОМЧ). ОМЧ обладают пребиотической, антиадгезионной и противовоспалительной активностью, облегчают экспансию симбионтов — в особенности Bacteroides и Bifidobacterium — и ингибируют рост и адгезию оппортунистических и облигатных патогенов.
Другим опосредующим формирование микробиома фактором является так называемая энтеромаммарная ось — система, которая обеспечивает транспорт бактерий из кишечника (будущей) матери в молочные железы. Ее первичным звеном служат дендритные клетки кишечника, которые захватывают бактерий и транспортируют их в местные лимфоидные фолликулы [1]. Там осуществляется выработка специфического иммуноглобулина А. Эти дендритные клетки и секретирующие иммуноглобулин лимфоциты циркулируют в крови, но могут избирательно возвращаться в кишечник за счет взаимодействия между β7-интегринами и выделяемыми эндотелиоцитами молекулами адгезии (адрессинами, MAdCAM-1). Клетки эндотелия молочных желез синтезируют молекулы MAdCAM-1 во время беременности, обеспечивая избирательное поступление в железу «запрограммированных» дендритных клеток, содержащих кишечные бактерии [33]. Помимо бактерий, в молозиве и молоке матери содержатся Т-клетки, производящие β7-интегрины, и плазматические клетки, вырабатывающие специфический IgА [34]. Также в молоке находятся цитокины, состав которых зависит от иммунологического опыта матери, приобретенного в течение жизни.
Существует теория, предполагающая передачу микроорганизмов из полости рта младенца в молочную железу матери с последующей выработкой в ее организме специфических антител и их поступлением в ЖКТ ребенка [34]. Предположение подтверждается тем фактом, что в ротовой полости новорожденного и в грудном молоке обнаруживаются идентичные бактерии родов Gemella, Veillonella, Staphylococcus и Streptococcus [35], [36]. Хотя есть данные, что они присутствуют в молозиве еще до начала грудного вскармливания (даже после тщательной гигиенической обработки железы образцы сцеженного молока содержат бактерии кожного и кишечного микробиома матери [37]), это всё же не отменяет возможность реализации механизма обратного заноса.
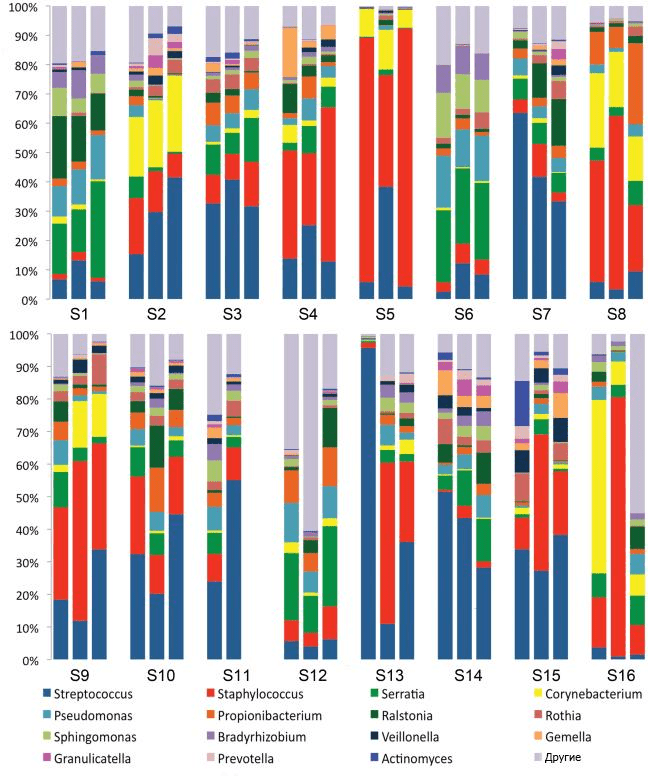
В 2011 году ученые из США обнаружили девять таксономических единиц бактерий в образцах молока от 16 женщин. Установив тем самым, что микробный состав молока чрезвычайно разнообразен, они предложили концепцию «ядра микробиома женского молока» (рис. 4) [35]. В дальнейшем стало ясно, что микробиом изменяется в течение всего периода лактации. Так, в молозиве преобладают бактерии родов Weissella, Leuconostoc, Staphylococcus, Streptococcus и Lactococcus, а в молоке, вырабатываемом в первые шесть месяцев после родов, видимо, из-за частого контакта с обитателями полости рта младенца происходит «перекос» в сторону Veillonella, Leptotrichia и Prevotella — что опять же подтверждает теорию обратного заноса [37].
Рисунок 4. Девять бактериальных таксономических единиц, обнаруженных в образцах молока от 16 женщин в 2011 году. Наблюдаемые сообщества оказались достаточно сложными, и при относительном постоянстве состава у одной группы испытуемых у другой с течением времени отмечались изменения.
Здоровье матери также играет важную роль в формировании микробного состава молока. В первый месяц лактации в молоке страдающих ожирением женщин преобладают Lactobacillus, однако через полгода их сменяют представители рода Staphylococcus [37], которые, как показывают исследования, начинают преобладать и в кишечнике тучных младенцев, в связи с чем ученые предположили существование связи между особенностями микробиома женского молока и паратрофией у детей.
Паратрофия
Паратрофия — один из любимых в нашей стране педиатрических «диагнозов». Да, такое состояние есть, но диагноза такого в МКБ-10 нет. По идее, с лингвистической точки зрения, термин «паратрофия» (плавающий исключительно в рунете, ну и в российских медкартах тоже) мог бы описывать любые расстройства питания (для них в МКБ-10 выделена категория E40—E68, nutritional diseases), но традиционно паратрофией у нас называют единственное патологическое состояние из группы расстройств питания — которое в МКБ-10 можно притянуть к рубрике «ожирение и другие виды избыточности питания» (Е65-68). До года, а то и до полутора лет, особенно если ребенок находится исключительно на грудном вскармливании, диагнозу «ожирение» предпочитают именно «паратрофию». К детям старше двух лет применим только диагноз «избыточная масса тела/ожирение». «Диагноз» паратрофия по сути просто констатирует факт тучности младенца.
Паратрофик отличается повышенным индексом массы тела (ИМТ), избыточными, а кое-где и нормальными, параметрами (излишнее накопление жира особенно заметно на животе и бедрах, характерна «шарпееподобная складчатость»), нередко имеет признаки нарушения трофики тканей (кожа может быть пастозной и бледной, мышцы дряблыми).
На вопросы, касающиеся лечения и рисков такого состояния, пока нельзя ответить однозначно. Основная масса врачей считает, что всё нормализуется после того, как ребенок научится ходить, то есть существенно повысит расход энергии. Но это при условии, что паратрофия возникла именно на грудном вскармливании, а не из-за неадекватных и обильных прикормов. (Кстати, паратрофию еще называли «мучной болезнью», поскольку изначально наблюдали у детей, переведенных на однообразное питание углеводными продуктами.) Единственным заслуживающим внимание следствием паратрофии большинство педиатров считает временную задержку моторного развития: ясно, что тучным детям сложнее переворачиваться, ползать, вставать и т.д. Однако некоторые врачи всё же рекомендуют снизить количество потребляемого молока и добавить овощной прикорм. Беда в том, что пока нет достаточных научных оснований для утверждения, что между паратрофией и детским, а затем и взрослым ожирением связи нет. Да хотя бы и то, что у паратрофика есть проблемы с моторикой, теоретически может заложить основу для развития ожирения. Так или иначе — и в этом солидарны как «оптимисты», так и «перестраховщики» из медсообщества, — такой «диагноз» уж точно не повод для родительской паники.
Постепенное отнятие младенца от груди и переход на твердую пищу также играют важную роль в формировании бактериального разнообразия. После завершения грудного вскармливания в микробиоме детского кишечника появляются характерные для взрослого бактерии — представители типов Bacteroidetes, Firmicutes и класса Clostridia: Clostridium, Ruminococcus, Faecalibacterium, Roseburia, и Anaerostipes [19], [38].
Иммунитет
Недавние исследования подтвердили важную роль кишечной микрофлоры в развитии иммунной защиты. В Nature Reviews Immunology был опубликован обзор, подчеркнувший важный вклад бактерий-комменсалов в функционирование эпителиального барьера кишечника (рис. 5).
Рисунок 5. Эпителиальный барьер кишечника. Простой цилиндрический эпителий обладает механизмами физической и биохимической адаптации к микробной колонизации, поддерживающими целостность барьера. К ним относятся: богатые актином микроворсинки; плотные контакты эпителиальных клеток (а); муцины, которые формируют «сито» для просеивания молекул — гликокаликс; продукция различных антимикробных пептидов. М-клетки, покрывающие пейеровы бляшки и одиночные лимфоидные фолликулы, обеспечивают транслокацию молекул из просвета кишки под эпителий, к антигенпредставляющим клеткам. Дендриты специализированных дендритных клеток (ДК) могут проникать в просвет кишечника через плотные контакты (б).
Ученые предположили, что бактерии кишечника не только стимулируют его лимфоидные элементы, но и оказывают влияние на кишечный слизистый барьер, стимулируя образование микроворсинок [39], [40] и плотных контактов [41].
Рисунок 6. Взаимодействие между иммунной системой кишечника и микробиомом младенца. Развитие вторичных лимфоидных структур, в том числе пейеровых бляшек и одиночных лимфоузлов, происходит внутриутробно, задолго до начала бактериальной колонизации. С ее началом настраиваются механизмы взаимодействия иммунной системы хозяина и бактерий-симбионтов. М-клетки путем трансцитоза передают бактериальные антигены дендритным клеткам, те их презентируют, опосредуя Т-зависимое созревание В-лимфоцитов и способствуя секреции плазматическими клетками IgA, который играет важную роль в защите от патогенов. Бактерии могут транслоцироваться также через дендритные клетки и презентироваться Т-клеткам лимфоузла, индуцируя их дифференцировку. Нижняя левая панель — АММП — ассоциированный с микроорганизмами молекулярный паттерн. В условиях гомеостаза АММП, ассоциированные с бактериями-симбионтами, стимулируют продукцию регуляторных цитокинов (IL-25, IL-33, тимусного стромального лимфопоэтина и трансформирующего фактора роста, TGF-β). Трансдукция сигнала на дендритные клетки стимулирует развитие регуляторных Т-клеток и способствует секреции IL-10. Нижняя правая панель — В состоянии дисбиоза снижение количества бактерий-симбионтов приводит к размножению патогенов. Патогенные АММП индуцируют секрецию провоспалительных цитокинов (IL-1, IL-6 и IL-18), способствуя размножению эффекторных Т-клеток. Эти Т-клетки дифференцируются в CD4 + Th1 и Th17 и секретируют IL-17, фактор некроза опухоли (TNF-α) и интерферон-γ (IFN-γ), которые привлекают в очаг воспаления нейтрофилы, защищая организм хозяина от патогенов.
Исследуя влияние бактерий на защитные механизмы кишечника (рис. 6), ученые искусственно колонизировали бактерией Bacteroides thetaiotaomicron кишечники безмикробных мышей. Затем РНК кишечного эпителия анализировали на предмет изменения экспрессии генов [42]. Была отмечена обширная активация генов эпителиоцитов, которые регулировали функцию эпителиального барьера и способствовали повышению продукции рецептора к IgА. Это исследование прекрасно отражает влияние бактериальной колонизации на кишечник новорожденного, ведь он в данном контексте такой же, практически безбактериальный, организм.
Всё новые работы подчеркивают важную роль бактериальной колонизации в формировании и поддержании здоровья млекопитающих. В недавнем эксперименте, посвященном изучению функций Toll-подобных рецепторов, нокаутировали ген важного компонента врожденного иммунитета — рецептора TLR5, расположенного на базолатеральной поверхности энтероцитов мышей. Это повлекло за собой следующее: мыши начали регулярно объедаться и в конце концов развили метаболический синдром, сопровождавшийся изменением состава кишечной микробиоты. Возникло предположение, что микробиом может служить индикатором развития многих заболеваний. Но ученые пошли дальше и пересадили «патологическую» микробиоту из TLR5-дефицитных особей безмикробным мышам с нормальным рецептором, и у тех тоже проявились признаки метаболического синдрома. То есть микробиом, возможно, может служить не только индикатором системных проблем, но и непосредственно участвовать в их возникновении. Интересно, что ограничение питания TLR5-дефицитных мышей предотвращало развитие ожирения, но не резистентности к инсулину [43].
Вообще, связь колонизации бактериями-симбионтами с развитием как приобретенного, так и врожденного иммунитета, демонстрировали неоднократно. Было установлено, что взаимодействие рецепторов энтероцитов и иммунных клеток кишечника с антигенами микроорганизмов вызывает естественную, самоограничивающуюся воспалительную реакцию. Таким способом механизмы врожденного иммунного ответа позволяют предотвратить проникновение патогенов через эпителиальный барьер кишечника, при этом отличая их от безвредных симбионтов (рис. 6) [44], [45]. Когда ребенок покидает утробу матери, происходит контакт с огромным количеством бактерий. И для того чтобы избежать непрерывной воспалительной реакции в ответ на колонизацию кишечника, снижается экспрессия упомянутых рецепторов, в частности TLR2 и TLR4 [46]. К сожалению, у детей, появившихся на свет раньше срока, описанные механизмы еще незрелые, что часто приводит к развитию некротического энтероколита [47].
Дополнительно о связях микробиома с иммунитетом, питанием, болезнями и препаратами для их лечения можно прочитать на «биомолекуле»: «Зоопарк в моем животе» [50].
И другие.
Помимо генетических факторов, характера родоразрешения и вскармливания, на формирование микробиома и иммунитета у новорожденного в той или иной мере оказывают влияние особенности питания, опыт приема антибиотиков и факторы окружающей среды (рис. 7).
Рисунок 7. Факторы, обеспечивающие формирование микробиома младенца. Инфекции половых путей женщины могут привести к бактериальному загрязнению матки. Микрофлора кишечника и ротовой полости может транспортироваться с кровью к плоду. Характер родоразрешения формирует первичную микрофлору. Генетика и постнатальные факторы, такие как режим питания, использование антибиотиков и воздействие окружающей среды оказывают дополнительное влияние на микробиом.
Антибиотики — одни из наиболее часто выписываемых детям препаратов. Назначение их матери в послеродовом периоде или же новорожденному может нарушить хрупкие процессы, которые лежат в основе формирования микробиома, и стать причиной ряда заболеваний (табл. 1). Исследования последних лет регулярно подчеркивают важность понимания процессов, ведущих к неонатальному дисбиозу и развитию в дальнейшем таких патологий, как диабет II типа, воспалительные заболевания кишечника или аллергическая реакция на компоненты молока [51–56]. Изменения в микробиоме, провоцируемые антибиотиками, зависят от способа введения, мишени, типа и дозировки препарата. Всё это пока плохо изучено у младенцев, что затрудняет понимание влияния антибиотикотерапии на формирование нормальной микрофлоры.
Таблица 1. Основные факторы, служащие связующим звеном между дисбалансом микробиома в раннем возрасте и склонностью к последующему развитию заболеваний.Таблица из [71].| Фактор, вызывающий дисбаланс | Характеристика когорты | Исходы |
|---|---|---|
| Кесарево сечение | 1,9 млн датских детей в возрасте 0–15 лет | Астма, системные заболевания соединительной ткани, ювенильный ревматоидный артрит, воспалительные заболевания кишечника, иммунодефициты и лейкозы |
| 1255 трехлетних детей из США | Ожирение, высокий ИМТ | |
| 2803 норвежских ребенка 0–3 лет | Аллергическая реакция на куриные яйца, рыбу или орехи | |
| Антибиотикотерапия | 1401 ребенок 0–6 месяцев из США | Астма и аллергия |
| 5780 британских детей 0–2 лет | Астма и экзема | |
| 12 062 финских ребенка 0–2 лет | Избыточный вес и ожирение | |
| 162820 детей 2–18 лет из США | Избыточный вес | |
| 9 млн британских детей | Воспалительные заболевания кишечника | |
| Пробиотики | 215 испанских детей 0–6 месяцев | Снижение частоты инфекций ЖКТ и верхних дыхательных путей |
| Европейское общество специалистов в области детской гастроэнтерологии, гепатологии и питания, комиссия по вопросам питания | Снижение частоты неспецифических желудочно-кишечных инфекций | |
| Пищевые добавки | 139 африканских детей 6–14 лет | С большей частотой — воспалительные заболевания кишечника, с меньшей — колики |
| Гигиена | 184 ребенка 0–3 лет (исследование чистоты пустышек) | Чистота пустышек снижала риск развития астмы, аллергии и сенсибилизации |
| Домашние животные | 3143 финских ребенка 0–1 года | Снижение риска развития диабета I типа |
Отдельно стоит сказать о пробиотиках и пребиотиках, которыми повсеместно обогащены смеси для искусственного вскармливания, несмотря на недоказанность их эффективности [57]. Пробиотики представляют собой живые микроорганизмы, которые, предположительно, должны участвовать в формировании микробиома, а пребиотики — это вещества, которые способствуют росту полезных микроорганизмов. Использование пробиотиков в педиатрической практике — до сих пор спорный момент, хотя их влияние на различные детские заболевания изучалось достаточно широко. Так, некоторые мета-анализы обнаружили их эффективность в терапии атопического дерматита, в то время как другие не выявили существенного влияния на детей младше 12 месяцев [58–61]. Была проведена оценка воздействия самых популярных пробиотических добавок в детском питании (Lactobacillus и Bifidobacterium spp., L. reuteri) на колики у младенцев. После трех недель их применения в кишечнике новорожденных увеличивалось количество лактобацилл и уменьшалось содержание кишечной палочки [62]. Однако на сегодняшний день большинство исследований показывает, что пре- или пробиотики значительно не влияют на качественный и количественный состав микробиома кишечника.
Окружающая среда не стерильна, и предметы быта, с которыми сталкивается новорожденный, тоже служат источниками микроорганизмов, участвующих в формировании микробиома. К примеру, вероятность обмена бактериями посредством предметов быта и воздуха в помещении увеличивается соразмерно количеству людей, проживающих в доме. Исследование 60 семей из США выявило, что члены одной семьи (домовладения) имеют более схожие микробиомы, чем члены разных семей [63]. Особенно показательно максимальное сходство микробиоты кожи у супругов, а также обмен поверхностными бактериальными сообществами между хозяевами и их собаками. Частый контакт с компонентами домашней пыли и большая семья в первые два месяца жизни могут привести к изменениям в микробиоме, ассоциированным с возникновением аллергии. Они заключаются в увеличении у младенцев количества бифидобактерий (за исключением B. adolescentis) и снижении численности Lactobacillus spp., Bifidobacterium adolescentis и Clostridium difficile [64].
Вероятно, частый контакт с животными, а соответственно, и с их микробиотой, на первом году жизни оказывает защитное действие, повышая иммунную толерантность. Например, взаимодействие с домашними животными с раннего возраста снижает риск развития аллергических состояний и астмы, но механизмы этого явления пока в полной мере не выявлены [65]. Ну и после всего сказанного, конечно, не станет сюрпризом вывод ученых о том, что бактериальное разнообразие гораздо выше у сельских детей, чем у городских [66]. В заключение стόит отметить, что ряд бактериальных штаммов обнаруживается одновременно у матерей и их взрослых дочерей, из чего следует, что одни бактерии временно «арендуют» жилплощадь, а другие получают в макроорганизме пожизненную «прописку».
Коррекция
В недавно проведенных исследованиях изучались терапевтические вмешательства, которые могли бы изменять микробом и профилактировать микробный дисбаланс еще в раннем детстве.
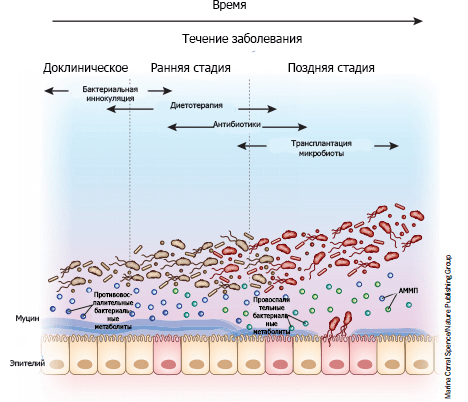
Подходы к модификации микробиома, как правило, подразделяются на три основные группы: очищение от микроорганизмов, их модуляция и замена, восстановление микробиоты. К примеру, антибиотики из-за их способности эффективно очищать кишечник от бактерий часто используют для лечения состояний, вызванных неспецифической патогенной микробиотой (рис. 8).
Рисунок 8. «Микробная терапия» в зависимости от стадии заболевания. На доклинических стадиях болезнь еще не проявляется в полной мере: ее симптомы (если вообще они есть) минимальны и неспецифичны, но тонкие биологические изменения уже происходят. Использование культур определенных бактериальных сообществ на ранних стадиях болезни может с максимальной эффективностью предотвратить дисбиоз и развитие патологии. По мере прогрессирования заболевания происходит обогащение микробиома патогенами (изображены красным), продуцирующими провоспалительные метаболиты и тем самым активирующими воспалительные пути (рис. 6). Слизистый слой, защищенный эпителием, истончается по мере накопления патогенов, утяжеляя течение заболевания. Диетотерапия и антибиотики на этом этапе могут использоваться в качестве радикальной меры, изменяющей количественный и качественный состав бактерий. На поздних стадиях продолжающееся истончение слизистого слоя позволяет бактериям прорваться через эпителиальный барьер. Тогда агрессивная антибиотикотерапия в сочетании с трансплантацией микробиоты может помочь восстановить микробный баланс. АММП — ассоциированный с микроорганизмами молекулярный паттерн.
Однако у детей раннего возраста длительное применение антибиотиков чревато значительным риском осложнений. Состав микробиоты можно изменить и посредством диетотерапии, употребляя продукты, которые способствуют росту «полезных» микроорганизмов. Одним из примеров подобной диеты является особое энтеральное питание, применяемое для симптоматической терапии болезни Крона у детей. Оно представляет собой специфическую смесь всех необходимых микро- и макронутриентов и потому в течение длительного времени может служить единственным источником питательных веществ. Оно подается исключительно в жидком виде — перорально либо через зонд — и способствует достижению клинической ремиссии за счет создания своеобразного «режима покоя»: снижения функциональной нагрузки на воспаленный кишечник и уменьшения его травматизации [67].
Исследования в области дефицита питания продемонстрировали, что на сегодняшний день невозможно, используя только диетотерапию, существенно повлиять на состав кишечного микробиома, хотя изучение влияния характера питания на него продолжается.
Учитывая то, какое значительное воздействие на здоровье оказывает микробиота в раннем детстве, весьма актуальными выглядят методы, направленные на своевременное, профилактическое, восстановление микробного баланса. Недавно удалось показать, что микробиом новорожденных, появившихся на свет посредством кесарева сечения, можно восстановить до состояния, схожего с младенцами, родившимися естественным путем. Обтирание таких детей тампонами, которые были введены за час до кесарева сечения во влагалище матери, приводило к значительному обогащению их микробиома представителями Lactobacillus и Bacteroides. Правда, пока не выяснены возможные последствия такой процедуры для здоровья [68].
Микробиом кишечника можно рассматривать как целый отдельный орган нашего тела. Мы приобретаем его при рождении, и то, каким он будет, зависит от множества факторов. Но одно можно сказать наверняка: он будет непохожим ни на какой другой микробиом. Это практически такой же уникальный признак, как папиллярные линии и сосудистый рисунок сетчатки глаза. И подобно тому, как отпечатки пальцев могут рассказать следователям криминальную биографию преступника, микробиом кишечника может предъявить ученым вехи онтогенеза своего хозяина. И как нельзя лучше процесс бактериальной колонизации и его значимость для организма отражает знаменитая пословица: «Что посеешь, то и пожнешь». Берегите свой микробиом и будьте здоровы!