Микроскопический полиангиит что это такое
Микроскопический полиангиит
Статья проверена врачом-ревматологом Филатовой Е.Е., носит общий информационный характер, не заменяет консультацию специалиста.
Для рекомендаций по диагностике и лечению необходима консультация врача.
В Клиническом госпитале на Яузе проводится экспертная диагностика и высокотехнологичное лечение микроскопического полиангиита. Диагностический комплекс включает: лабораторное обследование (в т.ч. иммунологический анализ крови), УЗИ внутренних органов и систем, биопсию тканей в зоне поражения и их гистологическое исследование. Индивидуальная схема лечения включает фармакотерапию и методы экстракорпоральной гемокоррекции.
О развитии микроскопического полиангиита
Микроскопическим полиангиитом (МП) называют заболевание аутоиммунной природы, в основе которого лежит образование аутоантител к клеточным элементам (цитоплазме) собственных нейтрофилов. Это, в свою очередь, приводит к воспалению мелких сосудов (ангииту) и развитию некроза окружающих тканей.
Причина данного заболевания не установлена, однако ученые склоняются к мультифакторной теории возникновения недуга. Отсутствие своевременной адекватной терапии практически со 100% вероятностью приводит к некротическим изменениям в почечной ткани. Развивается гломерулонефрит с быстро прогрессирующей почечной недостаточностью, трудно поддающейся лечению. Когда в процесс вовлечены сосуды бронхолегочной системы, возможно кровохарканье и легочное кровотечение.
Симптомы
На начальном этапе болезни специфические признаки отсутствуют. Пациентов могут беспокоить незначительное недомогание, лихорадка, снижение массы тела, миалгия и артралгия.
Симптомы развернутой клинической картины напрямую зависят от органа, который наиболее поражен недугом:
Дыхательная система страдает в более, чем 50% случаев. У пациентов диагностируют некротический ринит, воспалительные процессы в легких, кровохарканье. Наиболее грозное осложнение в подобной ситуации — легочное кровотечение.
Почки. Микроскопический полиангит поражает почки у 100% больных. Это способствует возникновению гломерулонефрита с прогрессирующей почечной недостаточностью. Оптимальным методом терапии в таком случае считается гемодиализ и последующая трансплантация почки.
Опорно-двигательный аппарат. Не менее половины пациентов отмечают поражение суставов, которое сопровождается нарушением двигательной функции и болями.
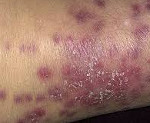
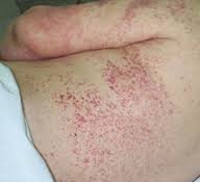
Кожа. Для МП характерны кожные проявления: обширные или точечные геморрагические высыпания с элементами некроза, на месте которых образуются язвы.
Нервная система. Больного беспокоят симптомы полинейропатии — локальные изменения кожной чувствительности, «мурашки», покалывания, двигательные нарушения, зябкость, потливость рук,.
Нарушения зрения, эписклерит или кератоконъюнктивит встречаются у 25% пациентов.
Диагностика микроскопического полиангиита в Клиническом госпитале на Яузе
Лабораторные исследования
Инструментальное обследование
С уверенностью можно говорить о микроскопическом полиангиите, если у пациента присутствуют следующие симптомы:
Лечение
В Клиническом госпитале на Яузе схема лечения микроскопического полиангиита разрабатывается индивидуально для каждого пациента с учётом результатов обследования и общего состояния больного. Основным средствами для лечения МП считаются цитостатики и глюкокортикоидные гормоны.
В особо тяжелых случаях может быть рекомендован гемодиализ и трансплантация почки.
Улучшить состояние пациента, снизить активность патологического процесса, нашим специалистам помогают методы экстракорпоральной гемокоррекции.
Экстракорпоральная гемокоррекция при микроскопическом полиангиите
Применение ЭГ при микроскопическом полиангиите преследует следующие цели:
В Клиническом госпитале на Яузе используются следующие методы ЭГ:
Показаниями к проведению экстракорпоральной гемокоррекции служат поражение почек и дыхательной системы при МА, нарастание признаков почечной недостаточности, отрицательная динамика лабораторных показателей, некроз кожи в зоне высыпаний, появление кровохарканья.
При подозрении на микроскопический полиангиит запишитесь на прием к ревматологу Клинического госпиталя на Яузе, чтобы взять заболевание под контроль и снизить риск грозных осложнений.
Цены на услуги Вы можете посмотреть в прайсе или уточнить по телефону, указанному на сайте.
Микроскопический полиангиит
Данное заболевание дифференцируется на несколько видов:
Также подразделяют микроскопический полиангиит еще по месту локализации.
Причины
Абсолютно точную основную причину возникновения данного заболевания, ученым пока не удалось определить. Поэтому научные исследования проводят и на сегодняшний день. Активнее всего научные исследования затрагивают области иммунитета и его разрушения, и влияние вирусов на протекание микроскопического полиангиита.
Точно установлено, что процесс появления микроскопического полиангиита связан с формированием антител к цитоплазме нейтрофилов (ANCA). Это провоцирует нарушение целостности эндотелия сосудов.
На активном этапе развития патологических отклонений антинейтрофильные цитоплазматические антитела в организме обнаруживаются у всех заболевших.
Симптомы
Признаки, которые могут свидетельствовать о наличии микроскопического полиангиита:
Наиболее опасные симптомы, которые в состоянии привести к значительному ухудшению состояния, – кровохарканье, высокий уровень креатинина, высокая протеинурия, олигурия.
Скорому летальному исходу способствуют острая дыхательная и почечная недостаточность, легочное кровотечение, инфекционные осложнения.
Диагностика
Нетипичным иммунологическим маркером, который говорит о развитии болезни, считается наличие в кровяной сыворотке антител к цитоплазме нейтрофилов. Для выявления степени развития проблемы проводятся такие исследования:
Лечение
Для осуществления лечебной терапии необходимо записаться на прием к врачу-ревматологу.
Лечение заключается в купировании симптомов, резких ухудшений и максимальном улучшении состояния пациента. Такая линия оздоровления влечет за собой постоянное наблюдение лечащего врача и пожизненную терапию иммуносупрессивными глюкокортикоидами и циклофосфамидом.
Иногда применяется пульс-терапия, при которой назначаются высокие дозы глюкокортикостероидных препаратов на короткий срок. Чаще всего в данном случае используется метилпреднизолон в сочетании с плазмаферезом.
В сложных ситуациях действенным методом считается экстракорпоральная гемокоррекция (каскадная фильтрация плазмы, криоаферез, лимфоцитаферез).
В случае наступлении полной ремиссии лечение все равно не прекращается, выполняется поддерживающая терапия.
Профилактика
Профилактических мероприятий, которые послужили бы предупреждением возникновению болезненного состояния, на данный момент не разработано.
Микроскопический полиангиит
Общие сведения
Микроскопический полиангиит (микроскопический полиартериит) – заболевание из группы системных васкулитов, характеризующееся поражением сосудов мелкого калибра с явлениями некротизирующего гломерулонефрита и легочного капиллярита. В связи с особенностями морфологических, клинических и иммунологических нарушений в 1948 г. микроскопический полиангиит был выделен в отдельную нозологию. Распространенность микроскопического полиангиита составляет 0,36 случаев на 100 тыс. населения. В ревматологии заболевание регистрируется в 10 раз чаще, чем узелковый периартериит и в 2 раза чаще, чем гранулематоз Вегенера. Микроскопический полиангиит практически с одинаковой частотой диагностируется у мужчин и женщин; чаще развивается у лиц старше 50-60 лет.
Причины
Этиология микроскопического полиангиита неизвестна. В настоящее время ведется изучение иммуногенетических аспектов патологии, исследуется пусковая роль вирусной инфекции в развитии заболевания. Вместе с тем, достоверно известно, что основной механизм патогенеза некротизирующего васкулита связан с образованием антител к цитоплазме нейтрофилов (ANCA), вызывающих повреждение эндотелия сосудов. Аутоантитела обладают специфичностью в отношении миелопероксидазы (p-ANCA) и сериновой протеиназы (c-ANCA), реже – других ферментов нейтрофилов. В активную стадию заболевания антинейтрофильные цитоплазматические антитела выявляются у всех пациентов.
Патоморфологические изменения при микроскопическом полиангиите представлены некротизирующим васкулитом мелких сосудов (артериол, венул, капилляров) без явлений гранулематозного воспаления. Наиболее характерно поражение сосудов почек (некротизируюший гломерулонефрит), легких (геморрагический альвеолит, капиллярит) и кожи (лейкоцитокластический венулит). Изредка поражаются артерии среднего и крупного калибра.
Симптомы микроскопического полиангиита
Дебют микроскопического полиангиита характеризуется появлением неспецифических гриппоподобных симптомов: субфебрильной температуры тела, мигрирующих миалгий и артралгий, общей слабости, недомогания, ночной потливости. Примерно у трети больных развивается поражение верхних дыхательных путей (язвенно-некротический или атрофический ринит, синусит, средний отит) и зрительной системы (конъюнктивит, кератит, эписклерит, увеит). Эти изменения обратимы и подвергаются обратному развитию на фоне терапии иммунодепрессантами.
Возможно возникновение стойких артритов мелких и крупных суставов, синовитов пястно-фаланговых и межфаланговых суставов, периферической полинейропатии. Обычно уже в начальной стадии микроскопического полиангиита обнаруживается поражение кожи в виде сосудистой пурпуры, эритемы, ливедо, узелковых или буллезных высыпаний, реже – язвенных изменений и асептических некрозов мягких тканей.
Ведущими проявлениями, определяющими течение и прогноз микроскопического полиангиита, служат легочный и почечный синдромы. Геморрагический альвеолит развивается более чем у половины пациентов. Клинические проявления легочного синдрома включают кашель, прогрессирующую одышку, боль в грудной клетке, нарастающую дыхательную недостаточность. Типично развитие кровохарканья, а иногда – профузного легочного кровотечения, которое является ведущей причиной смерти пациентов с микроскопическим полиангиитом.
Поражение почек по типу некротического гломерулонефрита обнаруживается практически во всех случаях заболевания. Патологический симптомокомплекс характеризуется стойкой протеинурией, гематурией, нефротическим синдромом, мягкой или умеренной артериальной гипертензией. Течение гломерулонефрита при микроскопическом полиангиите быстропрогрессирующее, злокачественное, рано приводящее к развитию острой почечной недостаточности. К нечасто встречающимся висцеральным проявлениям микроскопического полиангиита относятся бронхообструктивный синдром, ишемический энтероколит, протекающий с болями в животе и кишечным кровотечением.
Различают несколько вариантов клинического течения микроскопического полиангиита:
Диагностика
В начальной фазе микроскопического полиангиита пациенты довольно часто обследуются у узких специалистов: отоларинголога, офтальмолога, дерматолога, пульмонолога, фтизиатра, нефролога и др. Однако после исключения изолированных синдромов, диагностикой и лечением заболевания занимается ревматолог.
Специфическим иммунологическим маркером микроскопического полиангиита служит обнаружение в сыворотке крови антител к цитоплазме нейтрофилов. С целью оценки степени активности патологического процесса исследуется общий анализ мочи и крови, фибриноген, С-реактивный белок, электролиты, креатинин, железо сыворотки крови. В рамках морфологической верификации патологии может потребоваться проведение биопсии кожи, слизистой оболочки верхних дыхательных путей, легкого, почки. Рентгенография и КТ легких выявляют двустороннюю очаговую инфильтрацию, при длительном течении микроскопического полиангиита – легочный фиброз. Широко используется ультразвуковая и радиоизотопная диагностика (УЗИ почек, сцинтиграфия легких и др.).
Лечение микроскопического полиангиита
Лечение микроскопического полиангиита преследует цели купирования обострений, достижения и поддержания ремиссии. В острой стадии лечение проводится в стационаре. На этом этапе назначается иммуносупрессивная терапия глюкокортикоидами и циклофосфамидом. Возможен вариант проведения пульс-терапии метилпреднизолоном в сочетании с плазмаферезом. В комплексном лечении быстропрогрессирующих, тяжелых форм микроскопического полиангиита используются и другие методы экстракорпоральной гемокоррекции (криоаферез, каскадная фильтрация плазмы, лимфоцитаферез).
Поддерживающая иммуносупрессивная терапия продолжается даже после достижения полной клинико-лабораторной ремиссии. При нарастании почечной недостаточности проводится гемодиализ; в терминальной стадии ХПН решается вопрос о возможности трансплантации почки.
Прогноз и профилактика
Заболевание имеет относительно неблагоприятный прогноз. На фоне лекарственной терапии 5-летняя выживаемость составляет 65%. Плохими прогностическими факторами в отношении общей выживаемости служат кровохарканье, высокий уровень креатинина крови, олигурия, высокая протеинурия, пожилой возраст. Основными причинами смерти выступают легочное кровотечение, острая дыхательная или почечная недостаточность, инфекционные осложнения. Пациенты с микроскопическим полиангиитом нуждаются в длительной терапии иммунодепрессантами и пожизненном наблюдении ревматолога. Профилактика заболевания не разработана.
Варианты течения и исходы микроскопического полиангиита
Изучить частоту и тяжесть клинических проявлений и исходы заболевания у пациентов с микроскопическим полиангиитом (МПА).
Материалы и методы
Проведен ретроспективный анализ пациентов с микроскопическим полиангиитом (МПА), которые наблюдались в клинике им. Е.М. Тареева с 2002 по 2018 г. Диагноз устанавливали в соответствии с номенклатурой, принятой на конференции в Чапел-Хилле в 2012 г., с использованием алгоритма Европейского агентства по лекарствам (ЕМА).
В исследование были включены 102 пациента с МПА, медиана наблюдения составила 28,5 (1; 231) мес. Самыми частыми клиническими проявлениями были поражение почек (93,1%) и легких (78,4%), в том числе диффузное альвеолярное кровотечение (ДАК) (30,4%). В 53% случаев поражение почек протекало по типу быстропрогрессирующего гломерулонефрита (БПГН). Общая 1-летняя выживаемость составила 95,9%, 5-летняя – 91,5%. Риск летального исхода за период наблюдения был достоверно выше у пациентов с диффузным альвеолярным кровотечением (отношение шансов [ОШ] 14,3; 95% доверительный интервал [ДИ] 1,7-119,0, р=0,014). Группа пациентов с ДАК по сравнению с пациентами без ДАК характеризовалась достоверно более высоким риском развития БПГН (ОШ 2,54, 95% ДИ 1,09-6,16) и инфекционных осложнений (ОШ 3,37, 95% ДИ 1,34-8,53). Почечные исходы заболевания были достоверно хуже у пациентов с БПГН – за время наблюдения в этой группе достоверно чаще отмечали прогрессирование хронической болезни почек до поздних стадий, включая терминальную (ОШ 1,85, 95% ДИ 1,40-28,84; р=0,002). У 14 (13,7%) пациентов за время наблюдения прогрессирующее снижение функции почек привело к развитию терминальной почечной недостаточности.
Наше исследование продемонстрировало высокую выживаемость пациентов с МПА. Поражение почек и легких определяют прогноз заболевания. Развитие ДАК было фактором риска летального исхода, в то время как развитие БПГН определяло почечную выживаемость.
Микроскопический полиангиит (МПА) – некротизирующий АНЦА-ассоциированный васкулит с преимущественным поражением мелких и средних сосудов почек и легких, проявляющийся гломерулонефритом и легочным капилляритом и несколько реже – вовлечением других органов и систем [1]. У 95% больных МПА выявляют антитела к цитоплазме нейтрофилов (АНЦА), при этом антитела к миелопероксидазе встречаются чаще, чем антитела к протеиназе-3 [2]. В отличие от других АНЦА-ассоциированных васкулитов (гранулематоза с полиангиитом и эозинофильного гранулематоза с полиангиитом), МПА характеризуется более высокими частотой развития терминальной хронической почечной недостаточности (ХПН) и смертностью, но более низким риском развития обострений 4. МПА часто осложняется развитием хронической болезни почек (ХБП), в том числе терминальной ХПН [4]. По сравнению с хорошо изученными почечными проявлениями васкулита, особенности поражения других органов, в том числе легких, охарактеризованы недостаточно.
Целью исследования было изучение частоты и тяжести клинических проявлений и исходов заболевания у пациентов с МПА.
Материал и методы
В исследование включали пациентов с МПА, обследованных в клинике им. Е.М. Тареева в 2002-2018 гг. Диагноз устанавливали в соответствии с критериями Европейского агентства по лекарствам (ЕМА) и номенклатурой, принятой на конференции в Чапел-Хилле в 2012 г. [1,6]. Типирование и количественное определение АНЦА проводили методом иммуноферментного анализа (ИФА) [8]. Активность заболевания оценивали с помощью Бирмингемского индекса активности васкулита (Birmingham Vasculitis Activity Score, BVAS, версия 3.0), а накопление необратимых повреждений органов – с помощью индекса повреждения при васкулите (Vasculitis Damage Index, VDI) [9,10]. Ремиссию заболевания констатировали при значении BVAS, равном 0, если доза глюкокортикостероидов не превышала 10 мг/сут в пересчете на преднизолон.
Расчет скорости клубочковой фильтрации (СКФ) по формуле CKD-EPI и определение стадии ХБП, а также диагностику острого повреждения почек (ОПП) проводили в соответствии с рекомендациями KDIGO (2012 г.) и Научного общества нефрологов России [11,12]. Клини чес ким эквивалентом диффузного альвеолярного кровотечения (ДАК) считали сочетание нарастающей дыхательной недостаточности, кровохарканья, снижения уровня гемо глобина по крайней мере на 30 г/л от исходного, двусторонние участки “матового стекла” или инфильтративные изменения при мультиспиральной компьютерной томографии (МСКТ) органов грудной клетки.
Статистический анализ полученных данных проводился с использованием программы SPSS 23.0. Нормальность распределения тестировали при помощи критерия Шапи ро-Уилка. Количественные показатели с нормальным распределением представлены в виде среднего арифметического и стандартного отклонения (М±m), с распределением, отличавшимся от нормального, – в виде медианы и межквартильного размаха. Качественные показатели приведены в виде абсолютных частот и доли в процентах. Оценку значимости различий в группах для количественных переменных проводили при помощи критерия Манна-Уитни (при отклонении распределения от нормального), для переменных с номинальным типом распределения – при помощи точного критерия Фишера. Выживаемость анализировали с использованием методом Каплана-Майера, для оценки достоверности различий выживаемости между группами использовали логарифмический ранговый критерий. Влияние факторов риска на выживаемость анализировали при помощи регрессии Кокса. Значимыми считали различия при p
Результаты
В исследование были включены 102 пациента с МПА, среди которых преобладали женщины (67,4%). У 97 (95,1%) больных определялись АНЦА (табл. 1). Анти тела к миелопероксидазе встречались примерно в два раза чаще антител к протеиназе-3. Частота поражения органов не зависела от типа АНЦА, за исключением поражения органа зрения, которое ассоциировалось с антителами к протеиназе-3. У 36 (35,3%) пациентов диагноз был подтвержден при гистологическом исследовании, в том числе биоптата почки у 18 (23,5%), кожи у 5 (4,9%), слизистой оболочки верхних дыхательных путей у 4 (3,9%), легкого у 4 (3,9%). Медиана длительности динамического наблюдения составила 28,5 (1; 231) мес.
| Показатели | Значения |
|---|---|
| Примечание: МПО – миелопероксидаза, ПР3 – протеиназа 3, ДАК – диффузное альвеолярное кровотечение, БПГН – быстропрогрессирующий гломерулонефрит, ОПП – острое почечное повреждение, тХПН – терминальная хроническая почечная недостаточность | |
| Показатели | Значения |
| Возраст на момент установления диагноза, лет | 51,2(16;83) |
| Женщины, n | 69 |
| Длительность наблюдения, мес | 28,5 (1; 231) |
| BVAS в дебюте | 17 (3;35) |
| VDI в конце наблюдения | 3 (0;10) |
| АНЦА, n (%) | |
| Антитела к МПО | 64 (62,7) |
| Антитела к ПР3 | 28 (27,5) |
| АНЦА не типированы | 5 (4,9) |
| АНЦА-негативные | 5 (4,9) |
| Легкие, n (%) | 80 (78,4) |
| ДАК | 31 (30,4) |
| Фиброзные изменения (в исходе) | 55 (53,9) |
| “Сотовое легкое” | 5 (4,9) |
| Инфильтраты | 50 (49,9) |
| Плеврит | 14 (13,7) |
| BVAS легочный в дебюте | 4 (0;6) |
| VDI легочный к концу наблюдения | 1 (0;4) |
| Почки, n (%) | 95 (93,1) |
| Гематурия | 82 (80,4) |
| Протеинурия | 80 (78,8) |
| Нефротический синдром | 11 (10,8) |
| Артериальная гипертония | 32 (31,3) |
| БПГН | 53 (52,0) |
| ОПП в анамнезе | 24 (23,5) |
| тХПН | 14 (13,7) |
| BVAS почечный в дебюте | 10 (0;12) |
| VDI почечный к концу наблюдения | 1 (0;3) |
| Общие симптомы, n (%) | 62 (60,8) |
| Поражение мышц, n (%) | 7 (6,9) |
| Кожа, n (%) | 43 (42,2) |
| Суставы (артрит), n (%) | 53 (52) |
| Периферическая нервная система, n (%) | 24 (23,5) |
| Сенсорная полинейропати | 18 (17,6) |
| Множественный мононеврит | 6 (5,9) |
| Центральная нервная система, n (%) | 5 (4,9) |
| Желудочно-кишечный тракт, n (%) | 6 (5,9) |
| Орган зрения, n (%) | 6 (5,9) |
| Верхние дыхательные пути, n (%) | 14 (13,7) |
| Без вовлечения почек и легких, n (%) | 2 (1,9) |
| Частота обострений, n (%) | |
| За 1-й год | 18 (17,6) |
| Почечное обострение за 1-й год | 11 (10,8) |
| За 5 лет | 32 (31,4) |
| Почечное обострение за 5 лет | 18 (17,6) |
Поражение почек. Практически у всех больных наблюдалось поражение почек, которое проявлялось гематурией и/или протеинурией (табл. 1). Последняя обычно не достигала нефротического уровня. Более чем у половины пациентов поражение почек сопровождалось развитием быстропрогрессирующей почечной недостаточности, сочетание которой с мочевым синдромом и артериальной гипертонией мы расценивали как клинический эквивалент быстропрогрессирующего гломерулонефрита (БПГН). У 24 (23,5%) пациентов за время наблюдения было зарегистрировано развитие острого почечного повреждения (ОПП).
У 18 (17,6%) пациентов с поражением почек была проведена нефробиопсия. Характерная для АНЦА-ассоциированного гломерулонефрита морфологическая картина экстракапиллярного (“с полулуниями”) гломерулонефрита 3 типа (малоиммунного) была описана в 7 (38,8%) из 18 случаев. У 6 (33,3%) пациентов выявлен фокальный склерозирующий гломерулонефрит с полулуниями, у 2 (11,1%) – мезангиокапиллярный гломерулонефрит, у 2 (11,1%) – мембранозно-пролиферативный, у 1 (5,5%) – тотальный нефросклероз.
Группа пациентов с быстропрогрессирующей по чечной недостаточностью (n=53) по сравнению с пациентами без быстропрогрессирующей почечной недостаточности (n=42) характеризовалась более высокой частотой других жизнеугрожающих проявлений МПА, таких как диффузное альвеолярное кровотечение (p=0,047) и поражение желудочно-кишечного тракта (p=0,034), а также гематурии (р=0,04), протеинурии (р=0,02), увеличения сывороточного уровня креатинина >500 мкмоль/л (р=0,0001), артериальной гипертонии (р=0,004) и ОПП (р=0,0001).
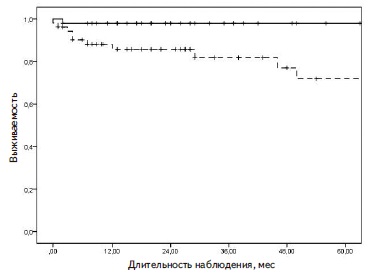
У 14 (13,7%) из 102 пациентов прогрессирующее снижение функции почек за время наблюдения привело к развитию терминальной ХПН, в том числе более чем в половине случаев в течение первого года после начала заболевания. Медиана срока развития терминальной ХПН составила 11,6 (7; 39) мес. Почечные исходы заболевания были достоверно хуже у пациентов с клинической картиной БПГН – за время наблюдения в этой группе достоверно чаще отмечали прогрессирование ХБП до терминальной стадии (отношение шансов [ОШ] 6,36 95% доверительный интервал [ДИ] 1,4028,84; р=0,002) (рис. 1).
Поражение легких было выявлено у 80 (78,4%) пациентов. Интерстициальные изменения оказались наиболее частыми рентгенологическими признаками поражения легких в дебюте заболевания (табл. 2). Данный рентгенологический паттерн встречался у 64 (66,7%) больных, в том числе у 31 (31,3%) – в рамках диффузного альвеолярного кровотечения. У 22 (21,6%) пациентов обнаружены изолированные участки “матового стекла”, что было расценено как проявления альвеолита. У 11 (10,8%) пациентов поражение легких было представлено интерстициальной пневмонией согласно классификации Американского торакального общества и Европейского респираторного общества (ATS/ERS) 2013 г. У 5 пациентов имелись признаки неспецифической интерстициальной пневмонии (симметричное диффузное распределение или преобладание изменений в нижних отделах легких; преобладание затемнений по типу “матового стекла” и зон консолидации над ретикулярными изменениями; относительная сохранность субплевральных зон; отсутствие участков “сотового легкого”), у 3 – обычной интерстициальной пневмонии (преобладание изменений в базальных и субплевральных отделах; часто неоднородное рас пределение; зоны “сотового легкого”; ретикулярные изменения с периферическими тракционными бронхоэктазами и бронхиолоэктазами), у 3 – сочетание эмфиземы и легочного фиброза. Среди пациентов с интерстициальной пневмонией у 5 (4,9%) заболевание дебютировало с развития легочного фиброза, который предшествовал формированию развернутой клинической картины системного васкулита на 36 (8; 72) мес. Еще у 6 пациентов рентгенологические признаки интерстициальной пневмонии совпали по времени с дебютом МПА.
У 50 (49,0%) пациентов имело место инфильтративное поражение легких, причем в 26 случаях данный рентгенологический паттерн встречался изолированно, в остальных 24 – сочетался с “матовым стеклом” в рамках диффузного альвеолярного кровотечения (табл. 2).
| Исходно (n=80) | В конце наблюдения (n=65) | |
|---|---|---|
| Интерстициальные изменения | 64 (80,0) | 20(30,7) |
| “Матовое стекло” | 44 (55,0) | 17 (26,1) |
| Инфильтраты | 50 (62,5) | 0 (0,0) |
| Консолидация | 5 (6,2) | 8 (12,3) |
| Бронхоэктазы | 4 (5,0) | 19 (29,2) |
| Бронхиолит | 3 (3,7) | 5 (7,6) |
| Поражение плевры | 13 (16,2) | 5 (7,6) |
| Плеврит | 14 (17,5) | 0 (0,0) |
| Утолщение плевры | 3 (3,75) | 5 (7,6) |
| Легочный фиброз | 16 (20,0) | 55 (84,6) |
| “Сотовое легкое” | 0 (0,0) | 5 (7,6) |
| Ателектаз | 3 (3,8) | 9 (13,8) |
| Эмфизема | 0 (0,0) | 14 (21,5) |
| Легочная гипертензия | 0 (0,0) | 9 (13,8) |
В конце периода наблюдения у 55 (53,9%) пациентов выявлены фиброзные изменения. У большинства больных имел место очаговый или пластинчатый фиброз, у 5 пациентов отмечалось развитие “сотового легкого” (табл. 2). Фиброзные изменения в исходе поражения легких достоверно чаще развивались у пациентов, у которых в дебюте болезни определялись интерстициальные изменения (р=0,002), “матовое стекло” (р=0,036) или зоны консолидации (р=0,043). В конце периода наблюдения бронхоэктазы (р=0,002) и ателектазы (р=0,024) достоверно чаще встречались у пациентов с легочным фиброзом.
Диффузное альвеолярное кровотечение было диагностирован почти у трети пациентов (30,4%), при этом у половины из них – в дебюте заболевания. Развитие диффузного альвеолярного кровотечения ассоциировалось с более высоким риском БПГН (ОШ 2,54, 95% ДИ 1,09-6,16), инфекционных осложнений (ОШ 3,37, 95% ДИ 1,34-8,53) и гипогаммаглобулинемии (ОШ 12,50, 95% ДИ 1,29-121,97) за время наблюдения.
Поражение других органов и систем. У 53 (51,9%) пациентов имел место неэрозивный артрит с поражением преимущественно мелких суставов кистей, при этом у 30 среди них развитие артрита предшествовало системным проявлениям васкулита. Поражение периферической нервной системы, подтвержденное с помощью электронейромиографии, отмечалось примерно у четверти пациентов. Изолированная сенсорная нейропатия (дистальная симметричная) встречалась в 3 раза чаще сенсомоторной нейропатии (17,6% и 5,9% случаев, соответственно).
Поражение верхних дыхательных путей (преимущественно придаточных пазух носа) отмечено у 14 (13,7%) пациентов, а наиболее частым его клиническим проявлением было затруднение носового дыхания и образование геморрагических корочек. В 4 случаях проведена биопсия слизистой оболочки носа, выявившая картину язвенно-некротического ринита без развития гранулематозной реакции. При мультиспиральной компьютерной томографии придаточных пазух носа, проведенной всем пациентам с поражением верхних дыхательных путей, данных за деструктивное поражение, характерное для гранулематоза с полиангиитом, также получено не было.
Проведенный статистический анализ не выявил ассоциации между поражения слизистой оболочки и придаточных пазух носа и типом АНЦА.
У 6 (5,8%) пациентов наблюдалось поражение органа зрения, в том числе эписклерит у 4 и увеит у 2.
Лечение. В качестве индукционной терапии все пациенты получали глюкокортикостероиды внутрь в сочетании циклофосфамидом (71,6%) или реже ритуксимабом (16,7%). У 13 (12,8%) пациентов начальная индукционная терапия глюкокортикостероидами и циклофосфамидом оказалась неэффективной, что привело к прогрессированию заболевания с развитием летального исхода у 5 больных, в остальных 8 случаях потребовалось назначение ритуксимаба. У 12 пациентов для индукционной терапии применяли только глюкокортикостероиды, что было связано с невысокой активностью васкулита, возрастом пациента и/или высоким риском инфекционных осложнений, в том числе у пациентов на диализе. Для поддержания ремиссии применяли азатиоприн у 41 (40,2%) пациента, циклофосфамид у 26 (25,5%), ритуксимаб у 18 (17,6%), микофенолата мофетил у 8 (7,8%). Медиана кумулятивной дозы циклофосфамида за время наблюдения составила 9 г (1; 200). К концу наблюдения у 67 (64,7%) пациентов констатирована ремиссия заболевания, у 35 (35,3%) – имелись признаки активности васкулита.
За время лечения у 28 (27,5%) пациентов отмечено развитие инфекционных осложнений (наиболее часто встречались бронхо-легочные инфекции), у 5 (4,9%) – гипогаммаглобулинемии (IgG Выживаемость. За период наблюдения умерли 7 (6,9%) пациентов, в том числе 4 – в течение первого года болезни. Время наступления летального исхода с момента установления диагноза составило 11,2 (0;25) месяцев. При оценке методом Каплана-Майера общая 1-летняя выживаемость равнялась 95,9%, 5-летняя выживаемость – 91,5%, а частота летальных исходов – 1,7 на 100 пациенто-лет. У 6 из 7 умерших пациентов определялись антитела к миелопероксидазе, однако их наличие не сопровождалось достоверным увеличением риска смерти (ОШ 0,40, 95% ДИ 0,32-1,41).
В структуре причин летального исхода преобладало фульминантное течение васкулита с вовлечением легких (у 5 пациентов). Один пациент умер от инфекционных осложнений и один – в результате декомпенсации сопутствующей сердечно-сосудистой патологии. Выжи ваемость в группе пациентов с диффузным альвеолярным кровотечением была ниже, чем у пациентов без геморрагического альвеолита (рис. 2). Развитие диффузного альвеолярного кровотечения ассоциировалось с достоверным увеличением риска летального исхода (ОШ 14,30; 95% ДИ 1,70-119,00, р=0,014).
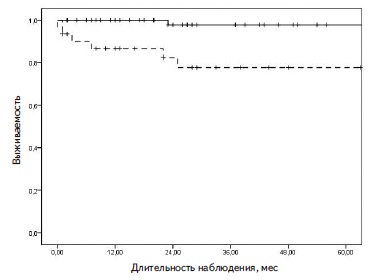
Рецидивы заболевания. За первый год наблюдения развитие рецидивов заболевания отмечено у 18 (17,6%) пациентов, в том числе у 11 (10,8%) – с вовлечением почек, в течение 5 лет – у 32 (31,4%) и 18 (17,6%), соответственно. При оценке методом Каплана-Майера общая 1-летняя безрецидивная выживаемость равнялась 83,3%, 5-летняя – 66,8%. Медиана срока развития первого рецидива заболевания составила 13,5 мес (2;72), а частота рецидивов – 14,0 на 100 пациенто-лет. У пациентов, у которых определялись антитела к миелопероксидазе, безрецидивная выживаемость была выше, чем у пациентов с антителами к протеиназе-3 (100% и 96,0% в течение 1 года, 78,0% и 53,3% в течение 5 лет, соответственно), однако различия не достигли статистической значитмости.
Обсуждение
Частота поражения различных органов и систем у обследованных нами пациентов с МПА была сопоставимой с таковой в опубликованных ранее исследованиях 13. В частности, чаще всего (93,1%) встречалось поражение почек, что соответствует данным других авторов [13,15-18]. Более чем у половины больных мы наблюдали быстропрогрессирующее тече ние АНЦА-ассоциированного гломерулонефрита, которое ассоциировалось с достоверным ухудшением почечной выживаемости. Кроме того, у части больных отмечалось сочетание БПГН с другими жизнеугро жающими проявлениями заболевания, такими как диффузное альвеолярное кровотечение (с развитием классической картины почечно-легочного синдрома) и тяжелое поражение желудочно-кишечного тракта. Сход ные данные приводятся другими авторами [16,18,19].
Поражение легких было вторым по частоте клиническим проявлением МПА у обследованных больных (78,4%), что также согласуется с данными других исследований [20,21]. В дебюте заболевания преобладало поражение легочного интерстиция, которое отмечалось в рамках диффузного альвеолярного кровотечения, альвеолита или интерстициальной пневмонии. Наравне с интерстициальными изменениями достаточно часто (62,5%) встречались инфильтративные изменения легких, которые также имели место при диффузном альвеолярном кровотечении. Развитие последнего яв ля ется жизнеугрожающим проявлением МПА. Данный вариант поражения легких встречался у трети обследованных. Регрессионный анализ показал, что развитие диффузного альвеолярного кровотечения является значимым фактором риска летального исхода. Данная взаимосвязь также подтверждается другими крупными исследованиями. Например, в исследовании K. Hira yama и соавт. развитие диффузного альвеолярного кровотечения наблюдали у 177 пациентов с МПА, а смертность в этой группе достигла 44% [21]. R. CartinCeba и соавт. показали, что наиболее важным предиктором развития тяжелой дыхательной недостаточности у пациентов с диффузным альвеолярным кровотечением является степень гипоксемии в дебюте легочного поражения [22]. Кроме того, развитие этого варианта течения легочного процесса ассоциировалось с инфекционными осложнениями и гипогамма глобулинемией при дальнейшем наблюдении, что, вероятно, отражает применение агрессивной иммуносупрессивной терапии у таких пациентов 25.
К концу периода наблюдения у 55 (53,9%) больных были выявлены фиброзные изменения в легких различной степени выраженности. Развитие бронхоэктазов и бронхиолита достоверно чаще наблюдалось у пациентов с легочным фиброзом. Интерстициальные изменения имели место у 20 (19,6%) пациентов, причем у 11 из них в рамках интерстициальной пневмонии.
В 1990 году А. Nada и соавт. впервые описали два случая легочного фиброза у пациентов с антителами к миелопероксидазе, у которых отсуствовали клиническая картина системного васкулита [27]. С тех пор было проведено несколько исследований, авторы которых расценили данный вариант поражения легких в качестве клинического проявления MПA 29. Интер сти циальный легочный фиброз может как предшествовать развитию других симптомов васкулита, так и развиваться одновременно с ними, либо присоединяться на более позднем этапе заболевания. Все эти сценарии развития легочного фиброза мы наблюдали и в нашем исследовании. Так, у 5 (4,9%) пациентов картина интерстциального поражения была выявлена до формирования развернутой картины МПА, а у 6 (5,9%) пациентов совпала с дебютом заболевания. Поражение легких у данных пациентов мы классифицировали в соответствии с рекомендациями Американского торакального общества и Европейского респираторного общества [31]. Чаще всего выявленные рентгенологические паттерны соответствовали картине неспецифической интерстициальной пневмонии, также встречались признаки обычной интерстициальной пневмонии и сочетания легочного фиброза и эмфиземы, что описано и другими исследователями [29,30,32]. Развитие интерстициальной пневмонии ассоциировалось с достоверным ухудшением прогноза вследствие прогрессирования дыхательной недостаточностью и присоединения вторичной инфекции [33,34].
В ранних исследованиях 1- и 5 летняя выживаемость у пациентов с МПА составляла всего 80,0-82,7% и 45,155,0%, соответственно [20,21]. В нашем исследовании выживаемость была значительно выше (95,9% и 91,5%, соответственно), что отражало проведение адекватной иммуносупрессивной терапии, а также меньшую частоту развития терминальной ХПН. Наши данные согласуются с результатами других недавно выполненных исследований, в которых 1- и 5-летняя выживаемость достигала 88-98% и 73-90%, соответственно [3,15,16, 35]. При этом тяжелое поражение почек и легких остается значимым фактором неблагоприятного прогноза.
Одной из наиболее актуальных проблем при МПА и АНЦА-ассоциированных васкулитах в целом остается высокая частота рецидивов заболевания. Мы наблюдали развитие обострения заболевания в течение 13,5 мес (медиана) у трети пациентов. В исследованиях L. Guille vin и соавт. и C. Agard и соавт. частота (28-39%) и средние сроки (15-43 мес) развития рецидивов были сходными [36,37]. Мы не выявили достоверных различий частоты развития рецидивов МПА в зависимости от типа АНЦА, что также отражено в исследовании Y. Oh и соавт. [38].
Заключение
Прогноз МПА определяет, в первую очередь, поражение легких и почек, которое нередко протекает в фульминантной форме. В то же время накапливающиеся данные предполагают постепенную смену парадигмы, в рамках которой МПА рассматривают преимущественно как вариант почечно-легочного синдрома, характеризующегося исключительно развитием БПГН и диффузного альвеолярного кровотечения. Так, поражение легких при МПА может длительно протекать по типу интерстициального фиброза с постепенным формированием необратимых изменений легочной ткани, а вовлечение почек не ограничивается развитием быстропрогрессирующей почечной недостаточности и может быть “стертым”. По-прежнему остается актуальной проблема рецидивов заболевания и профилактики нежелательных явлений длительной иммуносупрессивной терапии.