Миксоматозная дегенерация митрального клапана что это такое
Что такое миксома сердца? Причины возникновения, диагностику и методы лечения разберем в статье доктора Заподовников С. К., терапевта со стажем в 16 лет.
Определение болезни. Причины заболевания
Миксома сердца (Cardiac myxoma) — это наиболее распространённая первичная доброкачественная опухоль сердца. Заболевание может проявляться головокружением, спонтанной ночной одышкой и кровохарканием.
Опухоль может перекрыть кровоток, приведя к гибели пациента, поэтому при появлении симптомов нужно немедленно обратиться к врачу.
Помимо миксомы сердца, существует одонтогенная миксома — редкая доброкачественная опухоль челюстей. В данной статье рассматривается только миксома сердца.
Причины появления миксомы
Точные причины заболевания неизвестны. Менее 5 % миксом развиваются на фоне синдрома Карни (миксомный комплекс, Карни-комплекс). Это редкий аутосомно-доминантный синдром, т. е. он может проявиться у ребёнка, если у одного из родителя есть мутантный ген. В большинстве случаев возникает из-за мутаций в гене PRKAR1A — супрессоре протеинкиназы типа А, которая участвует во множестве реакций внутри клетки.
Помимо сердечной миксомы, на фоне синдрома Карни могут развиться:
Эпидемиология
Симптомы миксомы сердца
Правильно поставить диагноз «сердечная миксома» непросто. Однако вовремя проведённое УЗИ сердца, в том числе при диспансеризации, поможет выявить опухоль до появления жалоб. Симптомы миксомы зависят от многих факторов:
Некоторые особенности течения миксомы:
В зависимости от причин недомогания симптомы можно разбить на три группы:
1. Внутрисердечная обструкция (закрытие атриовентрикулярных отверстий). Может сопровождаться головокружением, одышкой в лежачем положении, спонтанной ночной одышкой, кашлем, кровохарканьем, отёком лёгких, сердечной недостаточностью и внезапной смертью. Когда пациент сидит или лежит, миксома попадает в отверстие митрального клапана и блокирует ток крови. В результате из сердца перекачивается меньше крови и артериальное давление временно падает. В положении лёжа миксома отодвигается от клапана и давление приходит в норму.
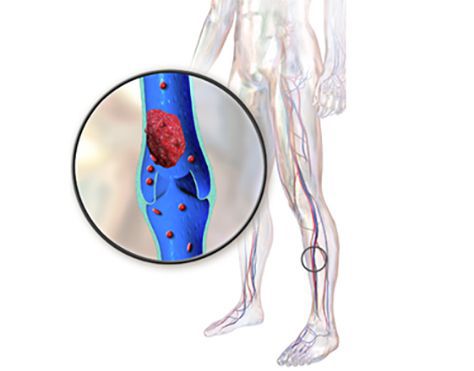
2. Эмболия при левостороннем расположении миксомы. Эмболия — закупорка сосудов различными частицами (эмболами), из-за которой нарушается кровоснабжение ткани или органа.
При миксоме чаще всего перекрываются сосуды центральной нервной системы и артерии сетчатки. Если пациент кратковременно теряет сознание, то это может указывать на эмболию мозговых артерий. Из-за неё может развиться внутричерепная аневризма — редкое, но серьёзное осложнение.
Эмболия периферических артерий может быть одним из первых признаков миксомы. Она проявляется болью в поражённой конечности, нарушением активных движений в её суставах и изменением цвета кожи.
Патогенез миксомы сердца
Патогенез сердечной миксомы изучен недостаточно. Предположительно, она развивается из эмбрионального эндотелия пристеночного эндокарда. Выраженность и характер нарушений зависят от размера и расположения опухоли.
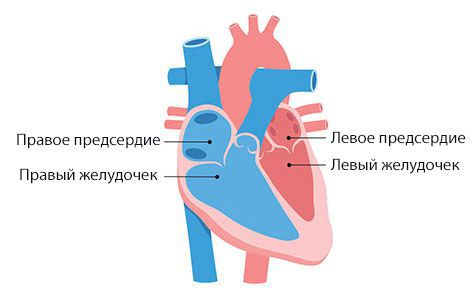
Миксома левого предсердия сужает митральное отверстие и вызывает непроходимость лёгочных вен, из-за чего развивается лёгочная венозная и артериальная гипертензия, а также вторичная правожелудочковая сердечная недостаточность.
Миксома может выпячиваться в левый желудочек, тогда при его сокращении (в раннюю систолу) опухоль движется от желудочка к предсердию. В результате в предсердии сильно повышается давление.
При расслаблении левого желудочка (ранняя диастола) опухоль выпячивается в полость желудочка, из-за чего резко снижается давление внутри предсердия. Если опухоль не выпячивается, то она препятствует току крови через атриовентрикулярное отверстие. Движение крови замедляется, что схоже с трикуспидальным или митральным стенозами.
Миксома правого предсердия уменьшает правое атриовентрикулярное отверстие и затрудняет отток крови из полых вен, из-за чего развивается системная венозная гипертензия.
Миксома левого желудочка приводит к сужению (стенозу) выносящего тракта левого желудочка. Течение болезни напоминает обструктивную кардиомиопатию: сильно увеличен левый желудочек и нарушен отток крови из него.
Согласно концепции американских исследователей, некоторые проявления миксомы не связаны с её действием напрямую. К таким проявлениям учёные отнесли лихорадку, васкулит, гематологические изменения и конституциональные симптомы. Предположительно, они возникают из-за выработки опухолью цитокинов: интерлейкинов, факторов роста эндотелия сосудов, основного фактора роста фибробластов и моноцитарного хемотаксического белка-1. Цитокины участвуют в росте опухоли, рецидивах и появлении отдалённых метастазов.
Классификация и стадии развития миксомы сердца
Можно выделить три вида миксом:
Осложнения миксомы сердца
К другим осложнениям миксомы можно отнести:
Острый инфаркт миокарда
Инфаркт миокарда, вызванный миксомой, отличается от атеросклеротического инфаркта тремя признаками:
Инсульт
Симптомы инсульта при миксоме не отличаются от классических и могут включать: расстройство речи, потерю мышечной силы, паралич конечностей с одной стороны тела, двоение в глазах, головокружение и потерю сознания.
Инфицированная миксома
Дисфагия
Диагностика миксомы сердца
При подозрении на сердечную миксому проводятся:
2. Лабораторная диагностика. Общий анализ крови может показать лейкоцитоз, анемию, тромбоцитопению, повышенные уровни СОЭ и С-реактивного белка.
3. Электрокардиография. У 20–40 % больных изменения неспецифичны и могут включать фибрилляцию или трепетание предсердий, блокаду левой ножки пучка Гиса и гипертрофию предсердий, реже желудочков. Чем сильнее стеноз, вызванный опухолью, тем более выражены эти изменения.
4. Эхокардиография (трансторакальная и чреспищеводная) — очень информативный метод, который помогает подтвердить диагноз, оценить состояние опухоли и подобрать оптимальную тактику лечения. Плотная гладкая капсула миксомы позволяет получить чёткие контуры отражённого эхо-сигнала, тогда как у опухолевых масс без оболочки контур смазанный. При двухмерной эхокардиографии миксома выглядит как светлое образование на тёмном фоне, при этом видно её движение.
5. Рентгенография органов грудной клетки позволяет выявить увеличенные размеры сердца и признаки лёгочной гипертензии.
6. Ангиокардиография вытеснена более точными методиками, при подозрении на миксому сейчас практически не используется. Кроме того, процедура повышает риск эмболизации.
7. Магнитно-резонансная и мультиспиральная компьютерная томография (МРТ и МСКТ) сердца позволяют определить края опухоли и исключить опухолевую инфильтрацию. Проводится, если не получилось поставить чёткий диагноз с помощью эхокардиографии.
8. Радионуклидная вентрикулография (РНВГ) также проводится в тех случаях, когда трудно поставить точный диагноз методом эхокардиографии. Позволяет с высокой точностью оценить систолическую и диастолическую функции обоих желудочков. В последние годы, благодаря совершенствованию ультразвуковой диагностики, РНВГ стала менее актуальной.
Дифференциальная диагностика
Миксому следует отличать от следующих заболеваний:
Злокачественные опухоли сердца, как правило, не имеют ножки и чаще прорастают в миокард. Но на эхокардиографии они могут напоминать миксому, бывает сложно поставить правильный диагноз. Поэтому часто требуется провести биопсию, при которой кусочек опухоли отщипывают и отправляют в лабораторию на исследование.
Лечение миксомы сердца
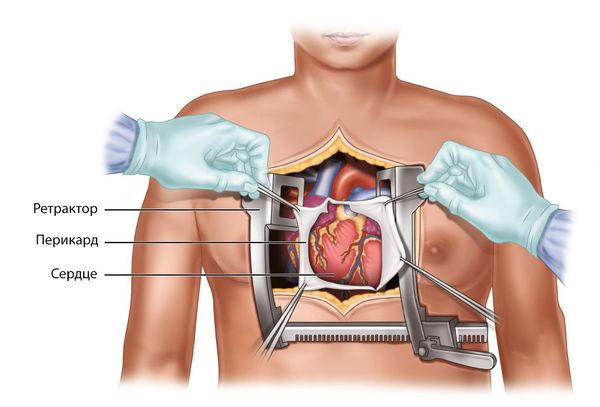
Удаление опухоли — это единственный метод лечения сердечной миксомы. Операцию следует провести как можно скорее, в большинстве случаев состояние пациентов после неё значительно улучшается.
Миксомы удаляют методом срединной стернотомии, т. е. с рассечением грудины. Проводится при пониженной температуре тела и остановке сердца с подключённым аппаратом искусственного кровообращения.
Очень важно, чтобы во время операции фрагменты опухоли не смещались. Врачу необходимо убедиться, что опухолевых очагов и их фрагментов нет в другом предсердии и желудочках.
Полная резекция включает удаление корня ножки, с помощью которой опухоль прикрепляется к стенке сердца. Иногда приходится удалять опухоль вместе с межпредсердной перегородкой. Это создаёт дефект, который можно закрыть специальным пластырем, например дарконовым.
Если опухоль связана с клапаном, то после удаления миксомы его восстанавливают методом аннулопластики — с помощью жёсткого либо эластичного опорного кольца. Если это невозможно, то клапан заменяют протезом.
Трансплантация сердца применяется в очень редких случаях: когда нельзя удалить опухоль и сохранить при этом функции сердца. Из-за риска отторжения в течение года регулярно проводится биопсия, затем достаточно проходить её раз в год.
Прогноз. Профилактика
Если миксому не удалить, то средняя продолжительность жизни пациентов редко превышает два года с момента появления симптомов.
Для ранней диагностики повторных случаев проводится эхокардиография. В первые полгода её нужно проходить раз в три месяца. При выявлении синдрома Карни важно обследовать близких родственников, чтобы своевременно выявить семейные миксомы.
Эхокардиография митрального клапана (часть 3)
Кальцификация кольца митрального клапана на эхокардиографии
Митральная регургитация на ЭхоКГ
Митральная регургитация возникает в результате аномалий, влияющих на различные компоненты митрального клапана: створки, фиброзное кольцо, хорды или сосочковые мышцы. Причины митральной регургитации многочисленны по сравнению с митральным стенозом. Заболевание миокарда, особенно поражающее базальную часть левого желудочка, приводит к митральной регургитации. Менее распространенными причинами митральной регургитации являются пролапс митрального клапана, миксоматозная дегенерация, эндокардит, неишемическая дилатационная кардиомиопатия и другие инфильтративные заболевания и фиброз.
Общие причины митральной регургитации:
Ишемическая митральная регургитация. Наиболее частой причиной митральной регургитации является ишемическая болезнь сердца, и наиболее частым компонентом аппарата митрального клапана, который подвержен ишемической дисфункции, является заднемедиальная папиллярная мышца, которая также предрасположена к инфаркту. Уязвимость заднемедиальной сосочковой мышцы к ишемической дисфункции обусловлена тем, что она снабжается энергией одной ветвью задней нисходящей артерии и имеет только несколько коллатералей. Напротив, переднебоковая сосочковая мышца получает кровоснабжение от ветвей как левой передней нисходящей артерии, так и огибающей артерии; поэтому она менее подвержен ишемии. Ишемические нарушения функции левого желудочка способствуют развитию митральной регургитации за счет ряда механизмов:
При ишемической митральной регургитации наблюдаются четыре клинических проявления:
Острый инфаркт миокарда: митральная регургитация часто встречается при остром инфаркте миокарда, а значительная регургитация осложняет до 15% случаев. Хотя в большинстве случаев такие случаи на эхокардиографии возникают в контексте острого инфаркта миокарда, в некоторых случаях может наблюдаться острое развитие митральной регургитации. Большинство пациентов с инфарктом миокарда, осложненным митральной регургитацией, имеют заболевание правой и огибающей коронарных артерий, которое вызывает дисфункцию нижней стенки. Таким образом, митральная регургитация на ЭхоКГ связана не с размером инфаркта, а со степенью ишемической дисфункции и вовлечением заднемедиальной папиллярной мышцы. В результате плохая поддержка задней створки, называемая привязкой, вызывает недостаточное закрытие створки и несостоятельность клапана. Тяжелая митральная регургитация, развивающаяся после инфаркта, имеет плохой прогноз: смертность возрастает до 25% через 30 дней и более 50% через 1 год. Влияние реперфузии миокарда на митральную регургитацию остается спорным.
Разрыв папиллярной мышцы на эхокардиографии: хотя и является редким осложнением инфаркта миокарда, полный разрыв папиллярной мышцы вызывает тяжелую митральную регургитацию и кардиогенный шок, который обычно заканчивается летальным исходом, 70% в течение 24 часов без экстренного хирургического вмешательства. Хирургическое лечение сосочковой мышцы в большинстве случаев невозможно из-за большой площади некротической ткани; поэтому замена клапана необходима, и на ее риск влияют другие факторы, включая тяжелую дисфункцию левого желудочка, которая обычно существует. Разрыв папиллярной мышцы происходит через 2–5 дней после начала инфаркта. Неполный разрыв, обычно только одной головки сосочковой мышцы, происходит через 4–5 дней после инфаркта с постепенным ухудшением митральной регургитации. Это усиливает ранее существовавшую дисфункцию левого желудочка.
Ишемическая митральная регургитация в нормальном левом желудочке на эхокардиографии: пациенты с длительной ишемической дисфункцией миокарда могут иметь обратимую ишемию при физической нагрузке. Если это влияет на заднюю стенку левого желудочка, это приводит к дальнейшему ухудшению функции задней стенки и, как следствие, функции задней створки и развитию митральной регургитации. Одышка при физической нагрузке у этих пациентов не всегда должна быть вызвана повышенным конечным диастолическим давлением, а внезапным повышением давления в левом предсердии из-за развития митральной регургитации при физической нагрузке, особенно у пациентов с расширенным левым предсердием и пациентов с плохой податливостью предсердий.
Стресс-эхокардиография идеальна для демонстрации ишемической желудочковой дисфункции и развития митральной регургитации и повышения давления в левом предсердии, отсюда положительная роль антиангинальной терапии и снижения постнагрузки. Пациентам, у которых развивается значительная митральная регургитация при стрессе и которые приняты на операцию по аортокоронарному шунтированию, следует провести восстановление митрального клапана, пластику кольца одновременно с хирургической реваскуляризацией, чтобы избежать потенциальных стойких симптомов, несмотря на успешную операцию.
Ишемическая митральная регургитация при желудочковой дисфункции на эхокардиографии: Митральная регургитация очень часто встречается у пациентов с длительной ишемической дисфункцией левого желудочка и у пациентов с терминальной стадией желудочковой недостаточностью. Поскольку у этих пациентов створки клапана морфологически нормальные, митральная регургитация описывается как «функциональная». Трехмерная эхокардиографическая оценка митрального клапана доказывает, что сам клапан не совсем нормальный, с давними прогрессирующими изменениями межстворчатых отношений и подклапанного аппарата. Снижение желудочкового давления может улучшить геометрию левого желудочка, а снижение артериального давления может уменьшить тяжесть митральной регургитации.
Миксоматозная дегенерация митрального клапана на эхокардиографии
Это наиболее частая причина изолированной митральной регургитации на эхокардиографии. Ее также называют дегенеративным заболеванием митрального клапана пожилого возраста или синдром выбухающего митрального клапана (синдром провисающего клапана, синдром волнообразной митральной створки, «парусящий клапан», «баллонная деформация митрального клапана»). Заболевание включает прогрессирующую миксоматозную дегенерацию створок митрального клапана и может варьироваться от растянутой «нормальной» створки до полностью утолщенной миксоматозной створки с выбуханием в систолу. К этому объекту применялись термины пролапс, гибкий, избыточный, миксоматозный клапан и молотящая створка.
Классические створки клапана при пролапсе на эхокардиографии утолщены, открываются в противофазе и увеличиваются в площади, а в систолу выпадают в левое предсердие. Этот процесс может повлиять на любую из двух створок, чаще всего на среднюю треть задней створки. Хорды могут стать удлиненными, истонченными и извилистыми, что предрасполагает к разрыву и острому пролапсу митрального клапана. У пожилых людей миксоматозная митральная дегенерация обычно протекает бессимптомно. Эхокардиографически средне-позднее систолическое искривление створок> 2–3 мм кзади до точки закрытия митрального клапана рассматривается как явная демонстрация пролапса створок. В частности, при поражении двух кончиков створок миксоматоз бывает трудно отличить от вегетаций, вызванных эндокардитом. Диагноз митрального пролапса следует ставить с левой парастернальной позиции, так как комбинация изменения формы кольца митрального клапана в систоле и закрытия клапана может показаться проявлением пролапса с других точек зрения. При синдроме Марфана миксоматозная дегенерация обычно затрагивает кончики створок, особенно переднюю створку. Это не всегда приводит к значительной митральной регургитации, но может оставаться статическим и бессимптомным в течение многих лет. Потеря систолической коаптации и выпадение одной из двух створок в левое предсердие является высокочувствительным и специфическим признаком систолической дисфункции створки независимо от его этиологии. Чреспищеводная эхокардиография обычно обеспечивает более четкое изображение створок и степень потери коаптации. Степень митральной регургитации с чистым пролапсом створки может быть незначительной на эхокардиографии, и клиническое обследование выявляет среднесистолический щелчок или поздний систолический шум. Пролапс митрального клапана может предрасполагать к инфекционному эндокардиту, поэтому пациентам из группы высокого риска могут быть рекомендованы профилактический прием антибиотиков в зависимости от ситуации. Простой митральный пролапс может прогрессировать до тяжелой митральной регургитации, требующей хирургического вмешательства.
Врожденная митральная регургитация на эхокардиографии
Наиболее распространенная форма так называемой врожденной митральной регургитации на эхокардиографии — это форма, которая обнаруживается в сочетании с первичным дефектом межпредсердной перегородки или другой формой дефекта атриовентрикулярной перегородки. В целом системный атриовентрикулярный клапан в этой группе аномалий лучше описывать как левый атриовентрикулярный клапан, а не как митральный клапан. Другой важной причиной врожденной митральной регургитации является так называемая изолированное расщепление (расщелина) передней створки митрального клапана. По сути, клапан имеет три створки. Важность этого диагноза заключается в том, что почти в каждом случае можно выполнить хирургическое вмешательство, наложив заплатку на переднюю створку митрального клапана, что позволяет избежать необходимости замены митрального клапана.
Инфекционный эндокардит на митральном клапане и ЭхоКГ
Это основная причина симптоматической митральной регургитации на ЭхоКГ. Вегетации развиваются на клапане и варьируются от небольших клубеньков по линии прикрепления до крупных рыхлых масс до 10 мм в диаметре и даже более, особенно при грибковой инфекции. Поражения передней (аортальной) створки митрального клапана могут возникать в связи с эндокардитом аортального клапана, обычно с поражением правой коронарной створки. Инфекция митрального клапана также может вызвать разрыв и перфорацию створки и, следовательно, возникновение струи в нетипичном месте. Эти поражения на эхокардиографии варьируются от локализованных аневризм до полной перфорации створок, приводящей к тяжелой митральной регургитации, требующей замены клапана. Эндокардит может поражать нормальные клапаны, особенно у пожилых людей, но чаще всего клапаны с незначительными врожденными аномалиями или пролапс митрального клапана.
Патофизиология митральной регургитации
Объем регургитации при митральной регургитации рассчитывается как поток регургитации через область регургитации. Скорость потока через отверстие связана с разницей систолического давления между желудочками и предсердиями. Высокое систолическое давление в левом желудочке, например системная гипертензия, увеличивает объем митральной регургитации, а низкое давление в левом желудочке снижает его.
Давление в левом предсердии при острой митральной регургитации повышается с V-зубцом в поздней систоле из-за увеличения объема и скорости поступления крови в левое предсердие. Однако отсутствие V-зубца на записи давления в левом предсердии или давления легочного клина не исключает диагноза тяжелой митральной регургитации. При тяжелой митральной регургитации увеличенный ретроградный ударный объем в левое предсердие вызывает увеличение прямого потока через митральный клапан в левый желудочек в последующем цикле, что увеличивает активность желудочков и скорость увеличения размера полости.
Митральная регургитация часто является динамическим поражением, и размер отверстия для регургитации и объем регургитации могут изменяться в зависимости от градиента давления на клапане и изменений объема и геометрии левого желудочка. Сама эффективная площадь регургитирующего отверстия может увеличиваться при значительно аномальной геометрии желудочков. Таким образом, успешное уменьшение объема левого желудочка с помощью оптимальной медикаментозной терапии или кардиостимуляции и улучшение его систолической функции может способствовать снижению тяжести митральной регургитации и открытию порочного круга. Изолированная митральная регургитация связана с большим увеличением выброса левого желудочка на эхокардиографии. Общий ударный объем может быть увеличен в 3–4 раза по сравнению с нормальным. Во время открытия аортального клапана более четверти ударного объема уже могло попасть в левое предсердие. Это приводит к V-зубцу, который может достигать 50–60 мм рт.ст.
Этот объем крови повторно поступает в желудочек в раннюю диастолу, таким образом сокращая время изоволюмической релаксации и увеличивая скорость раннего диастолического наполнения, что приводит к третьему тону сердца. Когда митральная регургитация очень тяжелая, давление в левом желудочке и левом предсердии может уравняться в середине выброса или даже раньше. Это происходит особенно при разрыве сосочковой мышцы. Вначале конечный диастолический объем левого желудочка на эхокардиографии существенно не увеличивается, тогда как конечный систолический объем значительно снижается. Это приводит к значительному падению прямого сердечного выброса, которое может поддерживаться только синусовой тахикардией.
Синдром соединительнотканной дисплазии сердца у детей
В последние годы отмечается увеличение числа врожденных пороков развития и наследственных заболеваний, а также нарастание распространенности различных вариантов соединительнотканной дисплазии из-за ухудшения экологической обстановки.
В последние годы отмечается увеличение числа врожденных пороков развития и наследственных заболеваний, а также нарастание распространенности различных вариантов соединительнотканной дисплазии из-за ухудшения экологической обстановки. По современным представлениям синдром соединительнотканной дисплазии определяют как самостоятельный синдром полигенно-мультифакториальной природы, проявляющийся внешними фенотипическими признаками в сочетании с диспластическими изменениями соединительной ткани и клинически значимой дисфункцией одного или нескольких внутренних органов (В. А. Гаврилова, 2002).
Высокая частота синдрома ДСТС при различных заболеваниях свидетельствует о системности поражения, что связано с «вездесущностью» соединительной ткани, составляющей строму всех органов и тканей.
Диспластическое сердце — сочетание конституциональных, топографических, анатомических и функциональных особенностей сердца у человека с дисплазией соединительной ткани (ДСТ). В западной литературе используется термин «миксоидная болезнь сердца» (Morales A. B., Romanelli B. E. A., 1992), однако эта формулировка используется преимущественно зарубежными авторами.
Частота диспластического сердца составляет 86% среди лиц с первичной недифференцированной ДСТ (Г. Н. Верещагина, 2008).
По современным представлениям к синдрому ДСТС относят пролапсы клапанов сердца, аневризмы межпредсердной перегородки и синусов Вальсальвы, эктопически крепящиеся хорды митрального клапана и многие другие.
В основе патологии лежит неполноценность внеклеточного матрикса, его коллагеновых структур.
Диспластическое сердце формируют:
I. Конституциональные особенности — «капельное», «висячее» сердце, поворот его вокруг сагиттальной и продольной оси.
II. Костно-вертебральные дисплазии и деформации со сдавлением, ротацией, смещением сердца и перекрутом крупных сосудов: по данным Урмонаса В. К. и др. (1983). Деформации грудной клетки и позвоночника приводят к развитию торако-диафрагмального синдрома, ограничивающего работу всех органов грудной клетки.
III. Особенности строения сердца и сосудов:
IV. Патология органов дыхания со снижением жизненной емкости легких:
Миксоматозная дегенерация створок, хорд, подклапанных структур — генетически детерминированный процесс разрушения и утраты архитектоники коллагеновых и эластических структур соединительной ткани с накоплением в рыхлом фиброзном слое кислых мукополисахаридов. При этом признаки воспаления отсутствуют. В основе — дефект синтеза коллагена III типа, что приводит к истончению фиброзного слоя, створки увеличены, рыхлые, избыточные, края закручены, иногда определяется бахрома. Первичный локус аутосомно-доминантного миксоматоза при ПМК локализован в хромосоме 16. Morales A. B. (1992) выделяет миксоидную болезнь сердца.
В популяционных исследованиях феномен ПМК выявлен у 22,5% детей в возрасте до 12 лет. У детей с ДСТ ПМК обнаруживается значительно чаще — у 45–68%.
Клинические проявления ПМК у детей варьируют от минимальных до значительных и определяются степенью соединительнотканной дисплазии сердца, вегетативными и психоневрологическими отклонениями.
Большинство детей старшего возраста жалуются на кратковременные боли в грудной клетке, сердцебиение, одышку, ощущение перебоев в сердце, головокружение, слабость, головные боли. Боли в сердце дети характеризуют как колющие, давящие, ноющие и ощущают в левой половине грудной клетки без какой-либо иррадиации. Они возникают в связи с эмоциональным напряжением и сопровождаются, как правило, вегетативными нарушениями: неустойчивым настроением, похолоданием конечностей, сердцебиением, потливостью, проходят самопроизвольно или после приема седативных средств. Отсутствие в большинстве случаев ишемических изменений в миокарде по данным комплексного обследования позволяет расценить кардиалгии как проявление симпаталгии, связанной с психоэмоциональными особенностями детей с ПМК. Кардиалгии при ПМК могут быть связаны с региональной ишемией папиллярных мышц при их чрезмерном натяжении. С нейровегетативными нарушениями также связаны сердцебиение, ощущение «перебоев» в работе сердца, «покалывание», «замирание» сердца. Головные боли чаще возникают при переутомлении, переживаниях, в утренние часы перед началом занятий в школе и сочетаются с раздражительностью, нарушением сна, тревогой, головокружением.
При аускультации характерными признаками пролапса митрального клапана являются изолированные щелчки (клики), сочетание щелчков с позднесистолическим шумом, изолированный позднесистолический шум, голосистолический шум.
Происхождение шума связано с турбулентным током крови, связанным с выбуханием створок и вибрацией натянутых хорд. Позднесистолический шум выслушивается лучше в положении лежа на левом боку, усиливается при проведении пробы Вальсальвы. Характер шума может меняться при глубоком дыхании. На выдохе шум усиливается и иногда приобретает музыкальный оттенок. Нередко сочетание систолических щелчков и позднего шума наиболее отчетливо выявляется в вертикальном положении после физической нагрузки. Иногда при сочетании систолических щелчков с поздним шумом в вертикальном положении может регистрироваться голосистолический шум.
Голосистолический шум при первичном пролапсе митрального клапана наблюдается редко и свидетельствует о наличии митральной регургитации. Этот шум занимает всю систолу и практически не меняется по интенсивности при перемене положения тела, проводится в подмышечную область, усиливается при проведении пробы Вальсальвы.
Основными методами диагностики ПМК являются двухмерная Эхо-КГ и допплерография. ПМК диагностируют при максимальном систолическом смещении створок митрального клапана за линию кольца митрального клапана в парастернальной продольной позиции на 3 мм и более. Наличия изолированного смещения передней створки за линию кольца митрального клапана в четырехкамерной верхушечной позиции недостаточно для диагностики ПМК, это служит основной причиной его гипердиагностики.
Эхо-КГ-классификация миксоматозной дегенерации (МД) (Г. И. Сторожаков, 2004):
Степень регургитации при ПМК зависит от наличия и выраженности миксоматозной дегенерации, количества пролабирующих створок и глубины пролабирования.
В состоянии покоя митральная регургитация (МР) первой степени диагностируется у 16–20%, вторая степень — у 7–10% и третья степень — у 3–5% детей с ПМК.
Прогноз больного с ПМК определяет степень митральной регургитации. При этом любая степень пролабирования приводит к изменениям перфузии миокарда, изменениям чаще в области передней стенки ЛЖ и межжелудочковой перегородки (Нечаева Г. И., Викторова И. А., 2007)).
Острая митральная недостаточность возникает из-за отрыва сухожильных нитей от створок митрального клапана (синдром «болтающегося» клапана — loppy mitral valve), в детском возрасте наблюдается казуистически редко и в основном связана с травмой грудной клетки у больных на фоне миксоматозной дегенерации хорд. Основным патогенетическим механизмом острой митральной недостаточности является легочная венозная гипертензия, возникающая из-за большого объема регургитации в недостаточно растяжимое левое предсердие. Клиническая симптоматика проявляется внезапным развитием отека легких.
У детей митральная недостаточность при ПМК протекает чаще всего бессимптомно и диагностируется при допплерэхокардиографическом исследовании. В последующем при прогрессировании регургитации появляются жалобы на одышку при физической нагрузке, снижение физической работоспособности, слабость, отставание в физическом развитии.
Факторами риска развития «чистой» (не воспалительной) митральной недостаточности при синдроме пролабирования по данным двухмерной эхокардиографии являются:
ПМК является высоким фактором риска возникновения инфекционного эндокардита. Абсолютный риск возникновения заболевания выше, чем в популяции, в 4,4 раза.
Диагностика инфекционного эндокардита при ПМК представляет определенные трудности. Поскольку створки при пролапсе избыточно фестончатые, это не позволяет выявить начало формирования бактериальных вегетаций по данным эхокардиографии. Поэтому основное значение в диагностике эндокардита играют: 1) клиническая симптоматика инфекционного процесса (лихорадка, ознобы, сыпь, и другие симптомы), 2) появление шума митральной регургитации и факт обнаружения возбудителя при повторных высевах крови.
Частота внезапной смерти при синдроме ПМК зависит от многих факторов, основными из которых являются электрическая нестабильность миокарда при наличии синдрома удлиненного интервала QT, желудочковых аритмий, сопутствующая митральная недостаточность, нейрогуморальный дисбаланс.
Риск внезапной смерти при отсутствии митральной регургитации низкий и не превышает 2:10 000 в год, в то время как при сопутствующей митральной регургитации увеличивается в 50–100 раз.
В редких случаях в основе внезапной сердечной смерти у больных с ПМК может лежать врожденная аномалия коронарных артерий (аномальное отхождение правой или левой коронарной артерии), приводящая к острой ишемии миокарда и его некрозу.
Таким образом, основными факторами риска внезапной смерти у детей с синдромом ПМК являются: желудочковые аритмии III–V градации по Lown; удлинение корригированного интервала QT более 440 мс; появление ишемических изменений на ЭКГ во время физической нагрузки; кардиогенные обморочные состояния в анамнезе.
ДСТС являются одними из неблагоприятных факторов, предрасполагающих к развитию аритмических осложнений в детском и подростковом возрасте, в том числе гемодинамически значимых. В структуре нарушений ритма у детей с ДСТС чаще выявляются наджелудочковая экстрасистолия в патологическом количестве и желудочковая экстрасистолия, взаимосвязанные со степенью кардиальной дисплазии (Гнусаев С. Ф., соавт., 2006).
Морфологическими проявлениями синдрома ДСТС у детей с сопутствующей патологией почек, по данным Домницкой Т. М., Гавриловой В. А. (2000), являются: шаровидная или треугольная форма сердца, закругление верхушки сердца, увеличение массы сердца в 1,4–2,5 раза, утолщение и укорочение хорд митрального клапана, отхождение хорд в виде веера, гипертрофия сосочковых мышц, воронкообразная форма митрального клапана, открытое овальное окно. Миксоматозная дегенерация створок атриовентрикулярных клапанов наблюдалась у большинства больных с синдромом ДСТС и заболеваниями органов мочевой системы (частота ее колебалась от 66,7% до 77%). Фиброэластоз эндокарда был выявлен у 10 детей анализируемой группы.
В популяции детей наиболее часто выявлялись смещение септальной створки трехстворчатого клапана в полость желудочка в пределах 10 мм, нарушенное распределение хорд передней створки митрального клапана, дилятация синусов Вальсальвы, увеличенная евстахиева заслонка более 1 см, дилятация ствола легочной артерии, ПМК, диагонально расположенные трабекулы в полости левого желудочка.
Тактика ведения детей с первичным ПМК различается в зависимости от степени выраженности пролабирования створок, характера вегетативных и сердечно-сосудистых изменений. Основными принципами лечения являются: 1) комплексность; 2) длительность; 3) учет направленности функционирования вегетативной нервной системы.
Обязательным является нормализация труда, отдыха, распорядка дня, соблюдение правильного режима с достаточным по продолжительности сном.
Вопрос о занятиях физкультурой и спортом решается индивидуально после оценки врачом показателей физической работоспособности и адаптивности к физической нагрузке. Большинство детей при отсутствии митральной регургитации, выраженных нарушений процесса реполяризации и желудочковых аритмий удовлетворительно переносят физическую нагрузку. При наличии врачебного контроля им можно вести активный образ жизни без каких-либо ограничений физической активности. Детям можно рекомендовать плавание, лыжи, коньки, катание на велосипеде. Не рекомендуются спортивные занятия, связанные с толчкообразным характером движений (прыжки, борьба каратэ и др.). Обнаружение у ребенка митральной регургитации, желудочковых аритмий, изменений обменных процессов в миокарде, удлинения интервала QT диктует необходимость ограничения физической активности и занятий спортом. Этим детям разрешается занятие лечебной физкультурой под контролем врача.
Лечение строится по принципу общеукрепляющей и вегетотропной терапии. Весь комплекс терапевтических мероприятий должен строиться с учетом индивидуальных особенностей личности больного и функционального состояния вегетативной нервной системы.
Важной частью комплексного лечения детей с ДСТС является немедикаментозная терапия: психотерапия, аутотренинг, физиотерапия (электрофорез с магнием, бромом в области верхнешейного отдела позвоночника), водные процедуры, иглорефлексотерапия, массаж позвоночника. Внимание врача должно быть направлено на санацию хронических очагов инфекции, по показаниям проводится тонзиллэктомия.
Медикаментозная терапия должна быть направлена на: 1) лечение вегетативно-сосудистой дистонии; 2) предупреждение возникновения нейродистрофии миокарда; 3) психотерапию; 4) антибактериальную профилактику инфекционного эндокардита.
При умеренных проявлениях симпатикотонии назначается фитотерапия седативными травами, настойка валерианы, пустырника, сбор трав (шалфей, багульник, зверобой, пустырник, валериана, боярышник), обладающий одновременно легким дегидратационным эффектом. При наличии изменений процесса реполяризации на ЭКГ, нарушениях ритма проводятся курсы лечения препаратами, улучшающими обменные процессы в миокарде (панангин, карнитин, Кудесан, витамины). Карнитин назначают в дозе 50 мг/кг в сутки на 2–3 мес. Карнитин выполняет центральную роль в липидном и энергетическом обмене.
Являясь кофактором бета-окисления жирных кислот, он переносит ацильные соединения (жирные кислоты) через митохондриальные мембраны, предупреждает развитие нейродистрофии миокарда, улучшает его энергетический обмен. В наших исследованиях 35 детям с экстрасистолией (более 15 в одну минуту) в состав комплексной терапии был включен карнитин. По окончании лечения у 25 детей экстрасистолия значительно уменьшилась, у 10 детей — не определялась.
Отмечен благоприятный эффект от применения препарата Коэнзим Q10®, который значительно улучшает биоэнергетические процессы в миокарде и особенно эффективен при вторичной митохондриальной недостаточности.
Ранняя диагностика ДСТ у детей позволяет осуществлять соответствующую реабилитационную терапию и предотвращать прогрессирование заболевания. Одним из наиболее ярких терапевтических результатов является эффективное лечение детей с ДСТ (главным образом с ПМК) при помощи магнийсодержащего препарата магния оротата — Магнерот®. Выбор препарата был обусловлен известными свойствами иона магния, отмечающимися у антиаритмических препаратов I и IV класса (мембраностабилизирующие и антагонисты кальция), а также отсутствием побочных эффектов, которые могут появляться при применении традиционной антиаритмической терапии. Учитывалось также и то, что действующим веществом препарата является магния оротат, который, индуцируя синтез протеинов, участвуя в обмене фосфолипидов, являющихся составной частью клеточных мембран, необходим для фиксации внутриклеточного магния (Громова О. А., 2007).
Препарат Магнерот® применялся в виде монотерапии в дозе 40 мг/кг в сутки в течение первых 7 дней приема, затем по 20 мг/кг в сутки в течение 6 месяцев. Результатом лечения явилось уменьшение на 20–25% глубины пролабирования створок митрального клапана и уменьшение степени регургитации на 15–17%. Терапия препаратом Магнерот® не влияла на размеры левых отделов сердца и сократимость миокарда, показатели которых до лечения находились в пределах нормы.
В исследованиях, проведенных Е. Н. Басаргиной (2008), выявлен антиаритмический эффект препарата Магнерот®. При проведении суточного мониторирования ЭКГ у детей 2-й и 3-й групп было отмечено уменьшение количества желудочковых комплексов на 50% и более у 18 (27,7%) больных. Причем у 6 детей отмечено исчезновение желудочковой аритмии или уменьшение количества желудочковых комплексов до 30–312 за сутки. У 14 (21,5%) детей количество желудочковых комплексов уменьшилось не менее чем на 30%. У двух больных отмечено увеличение количества желудочковых экстрасистол до 30% от исходного уровня. Таким образом, антиаритмическая эффективность препарата Магнерот® составила 27,7%. Подобные результаты ранее получены и в других исследованиях (Домницкая Т. М. и соавт., 2005).
В то же время редкие суправентрикулярные и желудочковые экстрасистолы, если не сочетаются с синдромом удлиненного интервала QT, как правило, не требуют назначения каких-либо антиаритмических препаратов.
Таким образом, дети с синдромом ДСТС нуждаются в своевременной диагностике с использованием допплерэхокардиографии, электрокардиографии, в ряде случаев суточного мониторирования ЭКГ, назначении индивидуальной терапии и наблюдении детским кардиологом.
Терапия препаратом Магнерот® у детей с синдромом ДСТС приводит к уменьшению признаков пролапса клапанов, частоты выявления митральной регургитации, уменьшению выраженности клинических проявлений вегетативной дисфунуции, частоты желудочковых аритмий, сопровождается повышением уровня внутриэритроцитарного магния.