Миокарда левого желудочка что это такое
Миокардит
Миокардит — совокупность морфологических изменений тканей сердечной мышцы воспалительного характера. Протекает болезнь в острой и хронической форме и является чаще следствием инфекционных заболеваний, реже — неинфекционных. Отличается значительной вариабельностью клинических проявлений, выраженность которых во многом зависит от степени поражения миокарда, локализации патологического очага, особенностей протекания воспалительного процесса.
«Клиника АВС» — многопрофильный медицинский центр, который оказывает специализированную помощь пациентам с заболеваниями сердца. Здесь работает опытный медицинский персонал, врачи высшей категории, кандидаты медицинских наук. Клиника оснащена современным высокоинформативным диагностическим оборудованием, что в комплексе позволяет поставить точный диагноз в кратчайшие сроки и оказать грамотную медицинскую помощь независимо от сложности и стадии развития заболевания.
Общие сведения
Миокардит сердца развивается в разном возрасте (но чаще в 30-40 лет). Часто протекает под видом инфекционного процесса, которым был вызван, поэтому может оставаться незамеченным длительное время. В дальнейшем возможны рецидивы заболевания, развитие тяжелой острой симптоматики и серьезных осложнений.
Воспаление миокарда сопровождается повреждением кардиомиоцитов, в результате воздействия инфекционного или другого кардиотоксического агента. Помимо этого в воспалительный процесс могут быть вовлечены клетки соединительнотканной структуры, проводящей системы и пр.
Причины миокардита
Классификация миокардитов
По нозологической принадлежности миокардиты классифицируется на:
Симптомы миокардита
Степень поражения сердечной мышцы, локализация воспалительного очага, наличие распространения на перикард — во многом определяют клиническую картину. Симптомы миокардита заключаются в недостаточной сократительной способности сердечной мышцы и нарушениях ритма сердца.
Миокардит сердца может иметь слабовыраженные симптомы, протекать скрыто или остро. Чаще пациенты жалуются на боли в сердце, ощущение нехватки воздуха, повышенную потливость, быструю утомляемость. Внешние признаки: бледность эпидермиса с синим оттенком, увеличение вен шеи, отечность.
В результате обследования выявляется артериальная гипотония, увеличение сердца, нарушение пульса, кровоснабжения органов, внутрисердечной проводимости, аритмия, систолический шум на верхушке сердца, приглушенность I тона.
Осложнения миокардита
Следствием воспаления становится разрастание соединительной ткани, развитие кардиосклероза. При тяжелой форме развивается сердечная недостаточность (ухудшается доставка крови к тканям). Возможно развитие тромбоэмболии, приводящей к инсульту, инфаркту. Патология может стать причиной внезапного летального исхода.
Диагностика миокардита
Симптоматика неспецифична, что усложняет постановку диагноза. Врачи собирают анамнез, а также изучают данные лабораторных и инструментальных исследований.
Для постановки диагноза могут понадобиться данные следующих показателей/анализов:
Лечение миокардита
Терапия зависит от первопричины и стадии болезни. При легкой форме рекомендуется снижение двигательной активности, коррекция рациона (ограничение соли, воды, увеличение потребления витаминизированных, белковых продуктов).
В более тяжелых состояниях необходим постельный режим. Фармакотерапия может включать:
Лечение миокардита также может включать установку кардиостимулятора, трансплантацию сердца.
Прогноз при миокардите
При латентном и малосимптомном протекании патологии возможно самоизлечение. Если клиническая картина выражена, прогноз ухудшается: выздоровление наблюдается в половине случаев, в остальных — развивается дилатационная кардиомиопатия. Сердечная аритмия может спровоцировать летальный исход. В клинической практике имеются случаи тяжелого протекания патологии с быстрым прогрессированием сердечной недостаточности и внезапной смертью.
Профилактика миокардита
Специфической профилактики не существует. Но рекомендуется соблюдать ряд мер, которые помогут предупредить развитие патологии: своевременно и полностью лечить инфекционные заболевания, избегать укусов клещей, соблюдать правила личной гигиены, не пропускать плановую вакцинацию, вести ЗОЖ, периодически проходить профилактическое обследование у кардиолога.
Миокардит имеет в каждом случае разные симптомы и лечение у взрослых. В «Клинике АВС» высококвалифицированные кардиологи, ангиохирурги, флебологи и другие специалисты окажут полный спектр медицинской помощи кардиохирургического профиля.
Гипертрофия левого желудочка
Гипертрофия левого желудочка: виды, причины, симптомы, диагностика, лечение и профилактика
Гипертрофия левого желудочка представляет собой заболевание, характеризующееся уплотнениями в левых стенках органа сердечного желудочка. В случае обнаружения у пациентов различных уплотнений, расположенных в перегородках в межпограничной области правого, а также левого желудочка. Данная патология влияет на процесс потери былых эластичных свойств желудочковых стенок организма.
Современная медицина классифицирует заболевание по следующим разновидностям недомоганий:
Причины
В основном недуг провоцируется наследственным фактором. У людей, имеющих родственников в любом поколении с наличием сердечных болезней, существует риск генетической предрасположенности к отклонению. Это говорит о том, что у них растет вероятность уплотнения в стенке. Недуг вызывается:
Все эти факторы повышают кровяную пульсацию, из-за которой утолщаются сердечные мышцы. Именно поэтому и возникают уплотнения в органе.
Симптомы
В зависимости от стадии патологии, возраста пациента и функциональных способностей его организма дефект может не иметь никаких признаков.
В основном заболевание не имеет никаких признаков на первой стадии, когда увеличение веса миокарда не становится препятствием и не мешает его кровообращению.
Если обнаружено несоответствие в размере органа и кровоснабжении, то видны первые проявления дефекта. Недуг характеризуется кардиалгией (болями в грудной клетки), быстрой утомляемостью, головокружениями и обмороками.
Нарушения в нервной системе способствуют развитию аритмий и блокад. При присоединении недостаточности в левом предсердии появляется одышка как при покое, так и при физических нагрузках. Это отмечается на поздних стадиях.
Диагностика
Провести осмотр пациента может только кардиолог, который руководствуется сбором анамнеза и осмотром. Одним из эффективных способов считают электрокардиографию., позволяющую измерить толщину сердечной мышцы.
При гипертрофии на ЭКГ видны следующие изменения:
Помимо указанных выше методов диагностики, врач проводит обследование с помощью магнитно-ядерного резонанса, компьютерной томографии и рентгена грудной клетки.
Лечение
Терапию проводят бета-блокаторами в комплексе с верапамилом. Этим методом удается уменьшить симптоматику, провоцируемую сердечно-сосудистой патологией. В качестве дополнений к терапии медикаментозными средствами рекомендуют соблюдать диету. Также нужно отказаться от привычек, наносящих вред организму, если они имеются.
Чтобы лечение было эффективным необходимо: отказаться от сигарет, понизить уровень потребления пищевой соли, сбросить лишнюю массу тела.
Рацион должен быть обогащен молочными и кисломолочными продуктами, морепродуктами, свежими овощами и фруктами. Потребуется сократить количество употребления изделий из муки, ограничить сладости и животные жиры. Физическая активность должна быть умеренного характера.
Врачи не исключают вероятность того, что понадобится оперативное вмешательство, чтобы удалить участок мышцы сердца, которая подверглась гипертрофии. Важно отметить, что развитие данного недуга часто происходит на протяжении нескольких лет жизни.
Профилактика
Риск заболевания можно снизить путем полного отказа от спиртных напитков, кофе и сигарет, активного образа жизни, осуществления систематического контроля над работой сердца, сокращения потребления соли в пищу, отказа от жирных продуктов и введения в рацион большого количества фруктов и овощей.
Что такое сердечная недостаточность? Причины возникновения, диагностику и методы лечения разберем в статье доктора Гринберг М. В., кардиолога со стажем в 32 года.
Определение болезни. Причины заболевания
Сердечная недостаточность — синдром, при котором нарушена способность сердца перекачивать кровь. Заболевание проявляется одышкой, повышенной утомляемостю, хрипами в лёгких, отёками голеней и стоп.
Выделяют острую и хроническую формы:
Распространённость
В России хроническая сердечная недостаточность чаще регистрируется у женщин. Возможно, это связано с более пристальным их вниманием к своему здоровью.
Причины хронической сердечной недостаточности
Сердечная недостаточность не является самостоятельным заболеванием, это результат развития многих сердечно-сосудистых болезней. Она возникает в основном из-за атеросклероза, ишемической болезни сердца и гипертонии.
Другие факторы риска:
Причины острой сердечной недостаточности
Острая сердечная недостаточность может возникнуть как обострение хронической формы заболевания, а также на фоне инфаркта миокарда, разрыва хорд митрального клапана и других тяжёлых состояний.
Симптомы сердечной недостаточности
В начале заболевания симптомы сердечной недостаточности отмечаются исключительно при физических нагрузках.
Реакция со стороны сердца. Из-за нарушения кровообращения появляется одышка — частое и глубокое дыхание, не соответствующее уровню нагрузки. При повышении давления в лёгочных сосудах возникает кашель, иногда с кровью. При физической активности и употреблении большого количества пищи может усилиться сердцебиение. Пациент жалуется на чрезмерную утомляемость и слабость. С течением времени симптомы нарастают и теперь беспокоят не только при физической активности, но и в состоянии покоя.
Реакции со стороны печени. Сердечную недостаточность сопровождает застой крови в сосудах печени, из-за чего возникает чувство тяжести и боли под правым ребром.
Патогенез сердечной недостаточности
Сердце, подобно насосу, нагнетает кровь в сосуды и перекачивает её из одной части тела в другую:
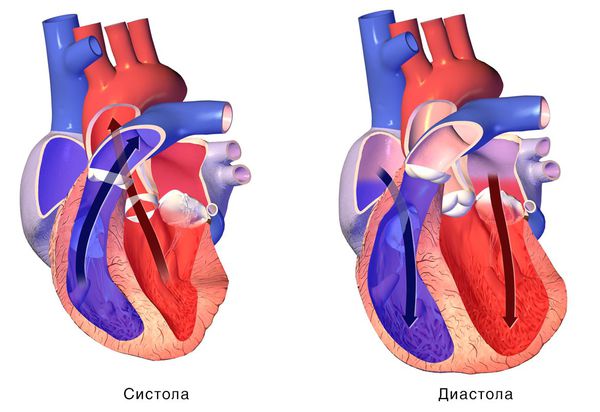
При сокращении сердечной мышцы, называемой систолой, кровь выталкивается из сердца. При расслаблении сердечной мышцы, или диастоле, она возвращается в сердце.
Если расслабляющая или сократительная способность сердца уменьшается, то развивается сердечная недостаточность. Это происходит, как правило, из-за слабости сердечной мышцы и/или потери её эластичности. В результате сердце качает недостаточно крови. Она может также накапливаться в тканях и вызывать застой.
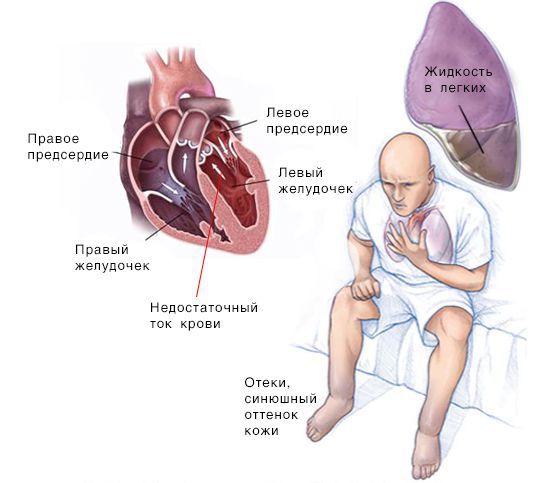
Скопление крови, поступающей в левую часть сердца, приводит к застою в лёгких и затруднению дыхания. Скопление крови, приходящей в правую половину сердца, вызывает застой жидкости в других частях тела, например в печени и ногах.
При сердечной недостаточности, как правило, поражены обе половины сердца. Но одна из них может страдать от заболевания сильнее, чем другая. В таких случаях выделяют правостороннюю и левостороннюю сердечную недостаточность.
Классификация и стадии развития сердечной недостаточности
Выделяют следующие формы сердечной недостаточности:
Недостаточность левого желудочка сердца
Левосторонняя сердечная недостаточность бывает левожелудочковой и левопредсердной. Для неё свойственно снижение выброса левого желудочка и/или застой крови на пути к левым отделам сердца, то есть в венах малого круга кровообращения.
Симптомы при левосторонней сердечной недостаточности (СН): слабость, головокружения, бледность кожи, одышка и быстрая утомляемость.
Недостаточность правого желудочка сердца
Симптомы при правосторонней СН: периферические отёки, цианоз и скопление жидкости в брюшной полости.
Изолированная сердечная недостаточность встречается редко и кратковременно. В последующем нарушение затрагивает все камеры сердца и развиваются типичные симптомы болезни.
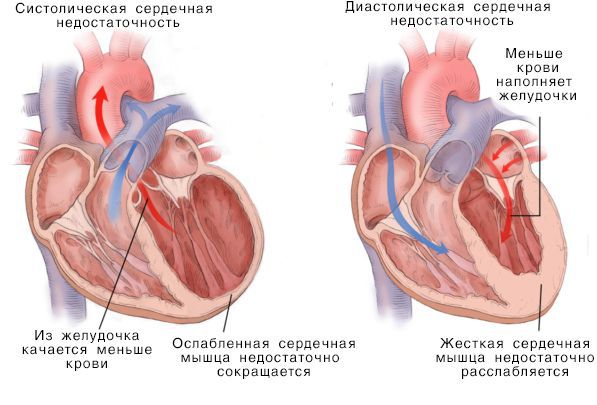
Систолическая и дистолическая сердечная недостаточность
Нарушение насосной функции левого желудочка может быть вызвано систолической и диастолической дисфункцией. Систолическая дисфункция более распространена и связана со снижением сократимости миокарда — мышечной ткани сердца. В большинстве случаев причиной систолической хронической сердечной недостаточности становится ИБС, сочетаясь с артериальной гипертензией и сахарным диабетом.
Помимо привычных терминов “диастолическая сердечная недостаточность” и «систолическая сердечная недостаточность», используются названия “сердечная недостаточность с сохраненной фракцией выброса ЛЖ (СНСФВ)” и «сердечная недостаточность со сниженной фракцией выброса (СН СФВ)».
Острая и хроническая сердечная недостаточность
Симптомы при хронической и острой СН различаются лишь интенсивностью и сроками развития.
Стадии развития сердечной недостаточности
Современная классификация хронической сердечной недостаточности объединяет модифицированную классификацию Российской кардиологический школы по стадиям, которые могут только ухудшаться (В. Х. Василенко, М. Д. Стражеско, 1935 г.), и международную классификацию по функциональным классам, которые определяются способностью больного переносить физическую нагрузку (тест с 6-ти минутной ходьбой) и могут ухудшаться или улучшаться (Нью-Йоркская классификация кардиологов). [2]
Классификация ХСН Российского общества специалистов по сердечной недостаточности
| ФК | ФК ХСН (могут изменяться на фоне лечения) | НК | Стадии ХСН (не меняются на фоне лечения) |
|---|---|---|---|
| 1ФК | Ограничений физической активности нет; повышенная нагрузка сопровождается одышкой и/или медленным восстановлением | 1 ст | Скрытая сердечная недостаточность |
| 11ФК | Незначительное ограничение физической активности: утомляемость, одышка, сердцебиение | 11а ст | Умеренно выраженные нарушения гемодинамики в одном из кругов кровообращения |
| 111ФК | Заметное ограничение физической активности: по сравнению с привычными нагрузками сопровождается симптомами | 11б ст | Выраженные нарушения гемодинамики в обоих кругах кровообращения |
| 1У ФК | Симптомы СН присутствуют в покое и усиливаются при минимальной физической активности | 111 ст | Выраженные нарушения гемодинамики и необратимые структурные изменения в органах-мишенях. Финальная стадия поражения сердца и других органов |
Классификация сердечной недостаточности Нью-Йоркской кардиологической ассоциации
Класс I. Заболевание сердца не ограничивает физическую активность. Обычная нагрузка не вызывает усталость, сердцебиение и одышку.
Класс II. Болезнь незначительно ограничивает физическую активность. В покое симптомов нет. Обычная физическая нагрузка вызывает усталость, сердцебиение или одышку.
Класс III. Физическая активность значительно ограничена. В покое симптомов нет. Небольшая физическая активность вызывает усталость, сердцебиение или одышку.
Осложнения сердечной недостаточности
Осложнения хронической сердечной недостаточности:
Диагностика сердечной недостаточности
Лечение сердечной недостаточности
Этапы оказания помощи пациенту с острой сердечной недостаточностью
При сердечной недостаточности не стоит заниматься самолечением. Своевременное обращение к врачу поможет избежать негативных последствий.
Цели терапии
Правильно подобранная медикаментозная терапия способна улучшить качество жизни и значительно продлить её продолжительность у больных даже с тяжелыми формами хронической сердечной недостаточности (по данным литературы — до 10 лет). [4]
Стандарты диагностики и лечения сердечной недостаточности, которые утверждены Минздравом, предписывают определенные исследования и манипуляции для пациентов, обратившихся с симптомами, напоминающими сердечную недостаточность; там же есть список лекарственных средств, но без указания, кто и как должен это лечить. Терапевты в поликлиниках не имеют соответствующей подготовки и не могут грамотно оказывать помощь этим больным.
Нужна ли госпитализация при сердечной недостаточности
Причиной госпитализации является декомпенсация — выраженное нарастание отёков и одышки, тахикардия и нарушение сердечного ритма.
В России сегодня почти нет специализированных отделений, где принимали бы больных с этим заболеванием, проводили бы дифференциальную диагностику и подбирали лечение (в Западной Европе введена врачебная специальность «специалист по сердечной недостаточности»). Кто реально занимается индивидуальным подбором лекарственных препаратов для больного? Терапевт, который назначает преимущественно фуросемид (мочегонный препарат), выводящий калий, снижающий давление и ускоряющий наступление летального исхода?
Кардиологические отделения районных больниц, куда с огромным трудом можно госпитализировать тяжелого больного на очень короткий срок, где опять же назначат фуросемид и лишь выведут избыточно накопленную жидкость, а через 1-2 месяца опять наступит ухудшение (правило 4-х госпитализаций: время между каждой последующей госпитализацией сокращается, состояние ухудшается, после 4-й госпитализации больных не остается!) В то время как современные препараты в постепенно повышающихся дозах могут обеспечить гемодинамическую разгрузку сердца, улучшить состояние пациента, уменьшить потребность в госпитализациях, продлить жизнь больного.
При хронической сердечной недостаточности показано сохранять режим питания и нагрузок и непрерывно принимать лекарственные препараты. Одно-двухдневный пропуск может ухудшить состояние, симптомы могут вернуться, и станет неизбежной госпитализация. Хроническая сердечная недостаточность часто встречается у людей пожилого возраста и сочетается с энцефалопатией, и помощь близких может значительно повысить их приверженность к лечению. Нужно обучение правильному питанию, режиму дня, контролю за задержкой жидкости (за рубежом эти функции выполняет специально обученная медсестра, которая осуществляет патронаж больного).
Острая или тяжелая форма хронической сердечной недостаточности подразумевает постельный режим, полный психический и физический покой. В остальных случаях показаны умеренные нагрузки, которые не сказываются на самочувствии. Следует потреблять не более 500-600 мл жидкости в сутки, соли – 1-2 г. Назначается витаминизированное, легкоусвояемое диетическое питание, олигомерные питательные смеси.
Медикаментозное лечение
Если развивается приступ острой сердечной недостаточности левого желудочка (отёк легких), больной подлежит госпитализации, где ему оказывают неотложную помощь. Лечение заключается в введении диуретиков, нитроглицерина, препаратов, которые повышают сердечный выброс (добутамин, дофамин), проводятся ингаляции O2.
Если развивается асцит, показано проведение пункционного удаления жидкости из брюшной полости, при возникновении гидроторакса — плевральная пункция.
Поскольку сердечная недостаточность сопровождается выраженной гипоксией тканей, пациентам показана кислородная терапия. [10]
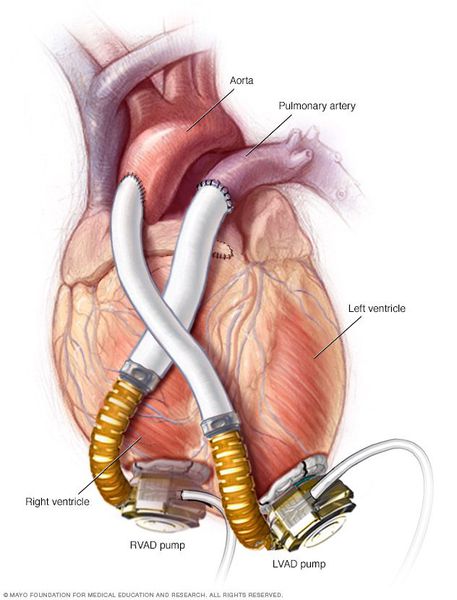
Хирургические и механические методы лечения
Питание и режим дня при сердечной недостаточности
Пациенту с сердечной недостаточностью следует уменьшить употребление жидкости до одного литра в сутки. Также следует исключить солёности, пряности и копчёности.
При заболевании нужно больше двигаться и выполнять посильные нагрузки: чаще ходить пешком и заниматься лёгкой гимнастикой.
Прогноз. Профилактика
До 1990-х годов 60 − 70 % пациентов с хронической сердечной недостаточностью умирали в течение пяти лет. Современная терапия позволила уменьшить смертность: сейчас в России при этой болезни она составляет 6 % в год, а среди пациентов с клинически выраженными формами — 12 % [16]
Отдалённый прогноз зависит от степени тяжести заболевания, образа жизни, эффективности подобранного лечения и приверженности ему, сопутствующих заболеваний и т. д.
Успешное лечение на ранних стадиях может полностью компенсировать состояние пациентов; при третьей стадии сердечной недостаточности прогноз самый печальный.
Чтобы сердечная недостаточность не прогрессировала, нужно соблюдать рекомендованный режим физической активности, регулярно и без пропусков принимать назначенные лекарства и регулярно наблюдаться у кардиолога.
Кардиология
Гипертрофия левого желудочка обычно возникает у пациентов с гипертонической болезнью. Это поражение сердца опасно тем, что может привести к смерти человека. Вообще, согласно статистике, смертность при гипертрофии левого желудочка возникает в 4% случаев.
Это, как мы уже отметили, может быть гипертоническая болезнь или пороки сердца, как врожденные, так и приобретенные, частые и значительные нагрузки. Высок риск развития гипертрофии у спортсменов, грузчиков, представителей других профессий, которые требуют состояния пограничной загруженности.
Очень опасна резкая и интенсивная нагрузка, которой подвергается сердце людей, которые ведут преимущественно сидящий образ жизни, но в определенной жизненной ситуации вынуждены подвергнуть себя физическим нагрузкам. Это же относится к курящим и тем, кто ежедневно употребляет спиртные напитки. Гипертрофия левого желудочка опасна тем, что миокард получает резкую и высокую нагрузку, и если он с ней не справится, то может наступить инфаркт или инсульт.
Гипертрофия левого желудочка бывает как врожденной, так и приобретенной, на фоне развития основного заболевания.
Если говорить о симптомах данного поражения сердца, то его самым ярким проявлением является стенокардия. Она возникает при сжатии сосудов, которые питают сердечную мышцу. Также к симптомам гипертрофии левого желудочка можно отнести мерцательную аритмию и проявления в виде фибрилляции предсердий и голодания миокарда.
В ряде случаев сердце может замирать на несколько мгновений, что приводит к потере сознания пациентом. Отмечаются одышка, головные боли, нарушения сна, боль в сердце, общая слабость и плохое самочувствие.
Сама гипертрофия левого желудочка может быть симптомом одного из следующих заболеваний:
Лечение гипертрофии левого желудочка состоит в применении препаратов, которые снижают симптомы нарушений сердечно-сосудистой системы. Также пациенту рекомендуется соблюдать диету, отказаться от вредных привычек, в том числе от курения и употребления спиртного.
Нельзя исключить при гипертрофии левого желудочка и оперативное вмешательство.
При выявлении любых из перечисленных симптомов следует обратиться к врачу-кардиологу
Записаться на прием Вы можете по телефону 8 (928) 337-60-60.
Гипертрофия левого желудочка неясной этиологии
В статье приведены клинические наблюдения и рассматриваются некоторые причины гипертрофии миокарда неясной этиологии, в том числе гипертрофическая кардиомиопатия (ГКМП), болезнь Фабри, AL и ATTR-амилоидоз. Важность своевременной диагностики трех последних заболеваний связана с тем, что сегодня стало возможным патогенетическое их лечение, позволяющее затормозить прогрессирования поражения сердца. Важное значение в диагностике ГКМП, болезни Фабри, наследственного ATTR-амилоидоза и некоторых других генетических заболеваний имеют изучение семейного анамнеза и молекулярно-генетическое исследование. При обследовании пациентов с необъяснимой гипертрофией левого желудочка необходимо обращать внимание на экстракардиальные проявления, которые могут оказаться ключом к правильному диагнозу, например, полиневропатия и нефротический синдром при системном амилоидозе, ангиокератомы и нейропатическая боль при болезни Фабри, прогрессирующая мышечная слабость и повышение активности креатинфосфокиназы при болезни Помпе, птоз век при митохондриальных заболеваниях и др. Для подтверждения диагноза амилоидоза следует проводить гистологическое исследование биоптата сердца или других органов и тканей.
С.В. Моисеев. Гипертрофия левого желудочка (ГЛЖ) часто встречается в практике кардиолога. Она может быть заподозрена на основании ЭКГ, однако более надежными методами оценки массы миокарда являются эхокардиография и особенно магнитно-резонансная томография (МРТ). При эхокардиографии критерием ГЛЖ считают увеличение индекса массы миокарда левого желудочка, соответственно, >115 г/м2 у мужчин и >95 г/м2 у женщин (с поправкой на площадь поверхности тела) или >50 г/м2,7 у мужчин и >47 г/м2,7 у женщин (с поправкой на рост) [1], а при МРТ – >85 г/м2 у мужчин и >81 г/м2 у женщин [2]. В зависимости от относительной толщины стенки (ОТС) левого желудочка [(2 × толщина задней стенки)/ конечный диастолический размер левого желудочка] выделяют концентрическую (ОТС≥0,43) и эксцентрическую (ОТС Е.В. Привалова. ГКМП – это наследственное заболевание, которое передается по аутосомно-доминантному типу [4]. В соответствии с рекомендациями Евро пейского общества кардиологов 2014 г., ГКМП может быть диагностирована при наличии гипертрофии миокарда ≥15 мм по крайней мере в одном сегменте левого желудочка, которую нельзя объяснить другими причинами, а у родственников пациента с установленным диагнозом – при наличии гипертрофии миокарда ≥13 мм [3]. Гипертрофия миокарда при ГКМП может быть как асимметричной (рис. 1), так и симметричной. У 4060% пациентов с ГКМП определяются мутации генов, кодирующих белки саркомеров сердца, прежде всего тяжелой цепи бета-миозина (MYH7) и миозин-связывающего белка С (MYBPC3). Реже встречаются мутации генов, кодирующих тропонины I и T (TNNI3, TNNT2), α1-цепи тропомиозина (TPM1) и легкой цепи миозина 3 (MYL3). В целом у пациентов с мутациями генов саркомерных белков выше частота семейного анамнеза ГКМП и внезапной смерти и отмечаются более выраженные ГЛЖ и миокардиальный фиброз, чем у пациентов без мутаций [5]. При обследовании пациента важно оценить наличие обструкции выносящего тракта левого желудочка [6]. Критерием ее является градиент давления в выносящем тракте, который измеряют допплеровским методом, ≥30 мм рт. ст. в покое или после провокационных проб (проба Вальсальвы, физическая нагрузка). Гемодинамически значимым считают увеличение этого показателя ≥50 мм рт. ст. [3].

В.Ю. Каплунова. Пациент К., 45 лет, обследован в клинике госпитальной терапии имени А.А. Остроумова в октябре 2018 г. Старший брат пациента внезапно умер в возрасте 54 лет. ГКМП была диагностирована у другого брата, умершего в возрасте 54 лет, и 29-летней дочери пациента. С 18-летнего возраста у больного выслушивался систолический шум по левому краю грудины при отсутствии клинических проявлений и хорошей переносимости физической нагрузки. В возрасте 27 лет появились одышка, сердцебиение, перебои в работе сердца, головокружение и дурнота, дискомфорт в области сердца при умеренной физической нагрузке. В возрасте 33 лет обнаружена асимметричная ГЛЖ (толщина межжелудочковой перегородки – 20 мм, задней стенки – 12 мм) с признаками обструкции выносящего тракта левого желудочка и градиентом давления в покое 45 мм рт. ст. Диагностирована обструктивная форма ГКМП. С 44-летнего возраста отмечает пароксизмы фибрилляции предсердий с последующим переходом аритмии в постоянную форму. При эхокардиографии было выявлено нарастание гипертрофии межжелудочковой перегородки до 31 мм и увеличение градиента давления до 94 мм рт. ст. в покое. В Научном центре сердечно-сосудистой хирургии им. А.Н. Баку ле ва выполнена миэктомия доступом из правого желудочка, которая привела к уменьшению степени обструкции выносящего тракта левого желудочка и диастолической дисфункции. При молекулярно-генетическом исследовании у пробанда и его дочери выявлена миссенс мутация в 22 экзоне гена, кодирующего тяжелую цепь β миозина (MYHT A870C).
Представленное наблюдение иллюстрирует типичные проявления и течение ГКМП: асимметричная гипертрофия межжелудочковой перегородки, которая была выявлена в молодом возрасте, медленно нарастала и длительное время не сопровождалась клиническими симптомами, в частности застойной сердечной недостаточностью, обструкция выносящего тракта левого желудочка с высоким градиентом давления в его полости, семейный анамнез (диагноз ГКМП и/или случаи внезапной сердечной смерти у близких родственников), мутация гена, кодирующего саркомерный белок, которая была обнаружена как у пробанда, так и его дочери. Лечение ГКМП обычно начинают с β-адреноблокаторов, не обладающих вазодилатирующей активностью, которые уменьшают градиент давления в полости левого желудочка и клинические симптомы. При их неэффективности могут быть использованы дизопирамид или верапамил. При выраженной гипертрофии межжелудочковой перегородки и высоком градиенте давления в левом желудочке может быть выполнена миэктомия, которая более чем в 90% случаев позволяет ликвидировать или значительно уменьшить обструкцию выносящего тракта, улучшить переносимость физической нагрузки и выживаемость [7].
Е.В. Привалова. Дифференциальная диагностика ГКМП с другими заболеваниями, сопровождающимися ГЛЖ, может представлять трудности, например, при наличии умеренной гипертрофии миокарда, особенно симметричной, не сопровождающейся обструкцией выносящего тракта левого желудочка, и при отсутствии семейного анамнеза. Мутации генов саркомерных белков определяются не у всех пациентов с ГКМП, а у части больных с необъяснимой ГЛЖ молекулярно-генетическое исследование не проводится по экономическим причинам. Следует учитывать, что асимметричная гипертрофия межжелудочковой перегородки, характерная для ГКМП, встречается и при других заболеваниях, в том числе вторичной гипертрофии миокарда при артериальной гипертонии. Причиной ГЛЖ могут быть не только перегрузка левого желудочка давлением, но и физические тренировки, хотя в крупном исследовании увеличение толщины стенки левого желудочка более 12 мм было выявлено всего у 1,7% из 947 спортсменов, занимающихся различными видами спорта, а толщина стенки не превышала 16 мм. Более частым эхокардиографическим признаком “сердца спортсмена» была дилатация полости левого желудочка, которая определялась в 38% случаев [8]. Важное значение для диагностики некоторых заболеваний, сопровождающихся ГЛЖ, имеет тщательный анализ клинической картины, позволяющий выявить те или иные экстракардиальные проявления болезни, которые отсутствуют при ГКМП. Проведение биопсии миокарда для подтверждения диагноза ГКМП не требуется, однако гистологическое исследование может быть обоснованным для исключения инфильтративных заболеваний, сопровождающихся утолщением стенки левого желудочка.
Е.А. Каровайкина. Болезнь Фабри – это редкое заболевание, которое характеризуется нарушением обмена гликофосфолипидов вследствие недостаточности или отсутствия лизосомного фермента – α-галактозидазы А [9]. Причиной дефицита этого фермента являются мутации гена GLA, расположенного на Х-хромосоме, поэтому типичные клинические проявления болезни Фабри наблюдаются чаще и более выражены у гемизиготных мужчин, однако они нередко встречаются и у гетерозиготных женщин. При классическом фенотипе болезни Фабри первые симптомы, в частности нейропатическая боль (эпизоды жгучей боли в кистях и стопах, возникающей при лихорадке, физической нагрузке, стрессе и быстрых изменениях температуры окружающей среды), ангиокератомы (поверхностные ангиомы, локализующиеся на передней брюшной стенке, в частности внутри или вокруг пупка, в паховой области, на ягодицах, верхних конечностях, губах; рис. 2), снижение или отсутствие потоотделения, желудочно-кишечные нарушения, появляются в детском или подростковом возрасте, а в возрасте 20-40 лет развивается поражение внутренних органов, в том числе сердца, почек (протеинурия и прогрессирующее снижение скорости клубочковой фильтрации) и центральной нервной системы (транзиторные ишемические атаки и инсульт). При атипичном “кардиальном» варианте заболевания ГЛЖ развивается в возрасте 40-50 лет и старше при отсутствии ранних симптомов. Результаты нескольких крупных скрининговых исследований свидетельствуют о том, что патогенные мутации гена GLA, ассоциирующиеся с развитием болезни Фабри, могут быть обнаружены у 0,5-1% пациентов с диагнозом ГКМП [10].

А.С. Моисеев. Иллюстрацией ГЛЖ, обусловленной болезнью Фабри, могут служить следующие два наблюдения. Пациент Л., 48 лет, был обследован в клинике им. Е.М. Тареева в октябре 2016 года. С 19 лет выраженная лимфедема нижних конечностей и снижение потоотделения. В возрасте 47 лет появились редкие боли за грудиной, не связанные с физической нагрузкой, а при эхокардиографии выявлено утолщение межжелудочковой перегородки и стенки левого желудочка до 14 мм при отсутствии дилатации камер сердца и нарушений систолической функции. Наблюдался у кардиолога с диагнозом ГКМП. Через 1 год при скрининге обнаружено снижение активности α-галактозидазы А в высушенных пятнах крови, увеличение уровня глобо триазилсфингозина (Lyso-GL3) до 117 нг/мл (в норме G), которые позволили установить диагноз болезни Фабри. На ЭКГ отмечались признаки ГЛЖ (рис. 3). При МРТ сердца наблюдались увеличение индекса массы миокарда левого желудочка до 123 г/м2 и признаки интрамиокардиального фиброза. Кроме того, имелись симптомы поражения почек – снижение расчетной скорости клубочковой фильтрации до 62 мл/мин/1,73 м2 при отсутствии протеинурии.

Одновременно мы обследовали 67-летнюю мать пациента, у которой за 2 года до госпитализации в клинику также была выявлена необъяснимая ГЛЖ, сопровождавшаяся постоянной формой фибрилляции предсердий, частой желудочковой экстрасистолией и сердечной недостаточностью, в связи с чем принимала β-адреноблокаторы, мочегонные средства, дигоксин, антикоагулянты. При МРТ сердца определялись утолщение межжелудочковой перегородки (19 мм) и задней стенки левого желудочка (12 мм), увеличение индекса массы миокарда левого желудочка до 141 г/м2 и участки интрамиокардиального фиброза. При МРТ головного мозга выявлены многочисленные очаги в белом веществе, а при осмотре окулистом – воронковидная кератопатия, характерная для болезни Фабри, диагноз которой подтверждался результатами молекулярногенетического исследования (мутация с.145C>G), повышением уровня Lyso-GL3 до 23 нг/мл и снижением активности α-галактозидазы А. Пациент и его мать в течение 1,5 лет получают ферментозаместительную терапию.
Представленные наблюдения демонстрируют важность скрининга в диагностике болезни Фабри у пациентов с необъяснимой ГЛЖ, так как клинически заподозрить правильный диагноз было сложно в связи с отсутствием типичных ранних симптомов – нейропатической боли и ангиокератом. С целью диагностики болезни Фабри у мужчин необходимо определять активность α-галактозидазы А и/или уровень Lyso-GL3 в высушенных пятнах крови. У женщин активность фермента нередко остается нормальной или снижается незначительно, поэтому более информативным считают определение уровня Lyso-GL3. Для подтверждения диагноза проводят молекулярно-генетическое исследование с целью выявления патогенной мутации гена GLA (в Российской Федерации все эти исследования выполняются бесплатно).
Н.Р. Носова. При анализе клинической картины обращали на себя внимание позднее развитие ГЛЖ и наличие ее не только у пробанда, но и его матери. Как указано выше, поражение внутренних органов при болезни Фабри, в отличие от некоторых других наследственных болезней, у мужчин обычно отмечается в возрасте 30-40 лет, а у женщин – в более старшем возрасте. Наследование болезни Фабри сцеплено с Х-хромосомой, поэтому у матери пациента обычно наблюдаются те или иные проявления заболевания, хотя фенотип его может отличаться. У пробанда с 18-летнего возраста отмечались снижение потоотделения, которое встречается у большинства мужчин с болезнью Фабри, и лимфедема. По данным регистра Fabry Outcomes Survey (n=714), частота лимфедемы при этом заболевании составила 16% у мужчин и 6% у женщин [11]. У матери пробанда была выявлена вихревидная кератопатия (коричнево-золотистые отложения в роговице в виде волнообразных линий, исходящих из одной центральной точки), которая является одним из клинических критериев диагноза болезни Фабри. По нашим данным, частота вихревидной кератопатии у 69 взрослых пациентов с болезнью Фабри составила 65,2%, в том числе 56,4% у мужчин и 76,7% у женщин [12]. В отличие от ГКМП, гипертрофия миокарда как у пробанда, так и его матери была выражена умеренно и не сопровождалась обструкцией выносящего тракта левого желудочка. У взрослых пациентов с болезнью Фабри обычно наблюдается поражение не только сердца, но и почек (альбуминурия/протеинурия, снижение скорости клубочковой фильтрации) и головного мозга (очаговые изменения в белом веществе при МРТ, транзиторные ишемические атаки/инсульт).
Е.А. Каровайкина. При болезни Фабри проводят заместительную терапию рекомбинантными препаратами α-галактозидазы А (агалсидазой альфа в дозе 0,2 мг/кг или агалсидазой бета в дозе 1 мг/кг), которые вызывают регресс ГЛЖ или по крайней мере замедляют прогрессирование кардиомиопатии. По данным D. Ger main и соавт., у пациентов с болезнью Фабри, начавших лечение в более молодом возрасте (18-30 лет), средняя масса миокарда левого желудочка снижалась на 3,6 г в год, в то время как без лечения у мужчин того же возраста она увеличивалась на 9,5 г в год (р В.В. Рамеев. Причиной утолщения стенок сердца мо жет быть не только гипертрофия кардиомиоцитов, но и инфильтрация миокарда нерастворимым фибриллярным гликопротеидом – амилоидом. В настоящее время известно около 30 амилоидогенных белков, однако более 95% случаев амилоидоза сердца обусловлены ALамилоидозом или реже транстиретиновым (ATTR) амилоидозом. AL-амилоидоз развивается при отложении моноклональных иммуноглобулинов у больных лимфоплазмаклеточными дискразиями, в том числе множественной миеломой. ATTR-амилоид (мутантный и дикого типа) образуется из транстиретина, синтезируемого в основном печенью и выполняющего функции транспортного белка тироксина и витамина А. Причи ной развития ATTR-амилоидоза дикого типа (стар ческого) считают возрастное снижение активности ферментных систем гепатоцитов, что приводит к пре имущественнои секреции нестабильных мономерных форм транстиретина, которые легко агрегируют в тканях с образованием амилоида. В основе наследственного ATTR-амилоидоза лежат мутации в гене TTR, сопровождающиеся синтезом транстиретина, который не способен образовывать тетрамеры и обладает очень высокой амилоидогенностью.
А.С. Рамеева. Пациентка Б., 50 лет, впервые обследована в клинике им. Е.М. Тареева в январе 2015 года. В течение года беспокоили боли в области сердца и нарастающая сердечная недостаточность. При эхокардиографии выявлено утолщение межжелудочковой перегородки и задней стенки левого желудочка до 14 мм, нарушение диастолической функции по рестриктивному типу. При коронарографии обнаружен умеренный стеноз правой коронарной артерии (50%). При обследовании в российском кардиологическом научном центре в декабре 2014 года определялись небольшая протеинурия (0,14 г/л), снижение вольтажа зубцов ЭКГ (рис. 4), увеличение толщины межжелудочковой перегородки и задней стенки левого желудочка до 18 мм, дилатация левого предсердия при отсутствии дилатации левого желудочка и снижения фракции выброса, при МРТ сердца – диффузное неравномерное субэндокардиальное накопление контрастного вещества. Выс ка зано предположение об амилоидозе, диагноз которого был подтвержден при биопсии миокарда. При исследовании крови методом Freelite отмечено резкое увеличение концентрации свободных легких цепей лямбда типа до 1383 мг/л (в норме 5,7-26,3 мг/л), указывавшее на наличие AL-амилоидоза. При трепанобиопсии диагностирована множественная миелома (увеличение числа плазматических клеток до 20%). Пациентке проводилась терапия бортезомибом, мелфаланом и дексаметазоном, на фоне которой нормализовалась концентрация свободных легких цепей лямбда типа и достигнута компенсация сердечной недостаточности.

В.В. Рамеев. Таким образом, у пациентки был диагностирован AL-амилоидоз с поражением сердца в рамках множественной миеломы. Заподозрить амилоидоз сердца позволяли возраст пациентки, быстрое развитие тяжелой сердечной недостаточности, которая плохо поддавалась симптоматической терапии, эхокардиографические признаки рестриктивного поражения сердца (увеличение левого предсердия при отсутствии дилатации левого желудочка и снижения фракции выброса), симметричное утолщение межжелудочковой перегородки и стенки левого желудочка без обструкции выносящего тракта, снижение вольтажа зубцов комплекса QRS на ЭКГ. Последний признак отличает амилоидоз сердца от ГЛЖ, хотя истинное снижение амплитуды QRS (менее 5 мм в отведениях от конечностей и менее 10 мм в грудных отведениях) наблюдается только у половины больных AL-амилоидозом сердца [14]. Однако даже при отсутствии низкого вольтажа комплексов QRS следует учитывать возможное его несоответствие степени ГЛЖ при эхокардиографии. Важное диагностическое значение имеют результаты МРТ сердца, которая позволяет не только измерить массу миокарда левого желудочка, но и выявить диффузное накопление гадолиния в субэндокарде [15].
В представленном наблюдении диагноз был подтвержден при биопсии миокарда, хотя для гистологического исследования могут быть использованы и другие ткани, более доступные для биопсии, в том числе слизистая оболочка прямой или двенадцатиперстной кишки, подкожно-жировая клетчатка, почка. На наличие AL-амилоидоза указывала моноклональная секреция лямбда-цепей иммуноглобулинов, выявленная с помощью метода Freelite, а также снижение отношения каппа- и лямбда-цепей до 0,01 (для AL-амилоидоза характерна величина этого показателя 1,65). У 7-10% больных AL-амилоидоз развивается в рамках множественной миеломы, для исключения которой всем пациентам следует проводить биопсию костного мозга.
Данный случай демонстрирует возможность “изолированного» поражения сердца при AL-амилоидозе, хотя у большинства пациентов наблюдаются и другие проявления, в том числе протеинурия/нефротический синдром, увеличение печени и селезенки, макроглоссия, периорбитальная пурпура, диарея, невропатия и/или ортостатическая гипотензия. У пациентки имелась небольшая протеинурия, однако она могла быть связана с застоем крови по большому кругу кровообращения.
Современная химиотерапия, включающая в себя ингибитор протеасом бортезомиб, позволяет добиться полного или частичного гематологического ответа у значительной части больных AL-амилоидозом, предупредить отложение амилоида в других органах и прогрессирование сердечной недостаточности.
П.П. Тао. Пациент В., 65 лет, русский, был обследован в клинике им. Е.М. Тареева в декабре 2015 года. В течение трех лет отмечается нарастающее снижение болевой, температурной и тактильной чувствительности в области кистей и стоп по типу “перчаток» и “носков», а в течение одного года – прогрессирующая застойная сердечная недостаточность. При электромиографии выявлены грубые аксонально-демиелинизирующие нарушения, наиболее выраженные в малоберцовых нервах, а при эхокардиографии – картина рестриктивного поражения сердца: дилатация левого предсердия, утолщение стенок левого желудочка, зоны гипокинезии в межжелудочковой перегородке, уплотнение эндокарда, нормальная фракция выброса левого желудочка. Уровень мозгового натрийуретического пропептида был повышен в 30 раз по сравнению с верхней границей нормы. При коронарографии обнаружен стеноз передней межжелудочковой ветви (65%) и правой коронарной артерии (75%). Проведены чрескожная коронарная ангиопластика и стентирование правой коронарной артерии, однако после вмешательства сердечная недостаточность сохранялась, появилась ортостатическая артериальная гипотензия. По данным эхокардиографии, толщина межжелудочковой перегородки достигла 22 мм, определялись множественные очаги зернистости в миокарде, фракция выброса левого желудочка снизилась с 57% до 45%. При МРТ сердца с контрастированием гадолинием на фоне выраженного утолщения стенок левого желудочка отмечено циркулярное субэндокардиальное диффузное накопление контрастного вещества в миокарде левого и передней стенки правого желудочков (рис. 5). Проводилась повторная биопсия слизистой оболочки прямой кишки, однако амилоид выявить не удалось. При иммунохимическом исследовании исключена моноклональная секреция легких цепей иммуноглобулинов, характерная для AL-амилоидоза. При молекулярно-генетическом исследовании обнаружена мутация гена TTR (Val30Met), подтверждающая диагноз наследственного ATTR-амилоидоза. При сцинтиграфии миокарда с 99mTcPYP выявлено накопление радиоизотопного препарата 2 степени, в связи с чем от биопсии миокарда было решено воздержаться. С целью восстановления тетрамерной структуры мутантного транстиретина пациент в течение 2 лет получает тафамидис 20 мг/сут. Переносимость лечения удовлетворительная, существенного прогрессирования амилоидоза не произошло.

В.В. Рамеев. Как и в предыдущем наблюдении, заподозрить амилоидоз у 65-летнего пациента позволяло типичное рестриктивное поражение левого желудочка, характеризующееся развитием тяжелой сердечной недостаточности при отсутствии дилатации и существенного снижения фракции выброса левого желудочка. При эхокардиографии определялись множественные очаги зернистости, которые нередко выявляют у пациентов с амилоидной инфильтрацией миокарда, а при МРТ сердца – диффузное накопление гадолиния в субэндокарде. В пользу системного амилоидоза свидетельствовала и периферическая полиневропатия, которая встречается как при AL-, так и семейном ATTR-амилоидозе и может предшествовать поражению сердца. В большинстве случаев развивается неуклонно прогрессирующая, симметричная дистальная невропатия, начинающаяся с сенсорных расстройств, в первую очередь болевой и температурной чувствительности, с последующим присоединением нарушений вибрационной и позиционной чувствительности и двигательных нарушений. Ранними симптомами невропатии бывают парестезии или мучительные дизестезии. Часто встречается синдром запястного канала, проявляющийся болями и парестезиями в I-III пальцах кисти с постепенной атрофией мышц тенара и обусловленный сдавлением срединного нерва в запястном канале амилоидом, откладывающимся в связках запястья [16].
Учитывая отсутствие моноклональной секреции легких цепей иммуноглобулинов и наличие мутации гена TTR, был установлен диагноз наследственного ATTRамилоидоза [17]. Диагноз амилоидоза должен быть подтвержден при гистологическом исследовании, однако результаты повторной биопсии прямой кишки оказались отрицательными. Тем не менее, наличие ATTRамилоидоза не вызывало сомнения с учетом типичной клинической картины и результатов молекулярно-генетического исследования. Кроме того, при сцинтиграфии было выявлено накопление 99mTcPYP в миокарде 2 степени (т.е. умеренное накопление, соответствующее таковому в костной ткани). В 2016 году в многоцентровом исследовании было показано, что накопление в миокарде 99mTcPYP 2-3 степени (рис. 6) при отсутствии моноклональной гаммапатии обладает 100% специфичностью в диагностике ATTR-амилоидоза сердца и фактически позволяет отказаться от биопсии миокарда [18]. Более того, сцинтиграфия с 99mTcPYP дает возможность дифференцировать ATTR-амилоидоз от AL-амилоидоза, при котором накопление радиоактивного препарата в миокарде отсутствует или не превышает 1 степени.

С середины 90-х годов ХХ века для лечения ATTRамилоидоза применяли трансплантацию печени, позволяющую восстановить синтез нормального транс тиретина. В последние годы более перспективной тактикой лечения считают медикаментозную стабилизацию тетрамерной структуры транстиретина и предотвращение образования амилоидогенных мономеров белка. Первый такой препарат – тафамидис – уже применяется в Европе и в Российской Федерации.
С.В. Моисеев. Представленные наблюдения иллюстрируют широкий спектр причин ГЛЖ неясной этиологии, которые включают в себя не только истинную гипертрофию миокарда, но и некоторые инфильтративные заболевания, такие как системный амилоидоз, имитирующие ГКМП. Разработать четкий алгоритм дифференциальной диагностики ГКМП достаточно сложно, учитывая вариабельность течения заболеваний, сопровождающихся ГЛЖ. Например, некоторые тяжелые генетические заболевания, такие как болезнь Помпе (гликогеноз II типа, связанный с дефицитом фермента кислой α-глюкозидазы в лизосомах), могут проявиться в возрасте 40-50 лет и старше, в то время как при системных заболеваниях, в том числе болезни Фабри или амилоидозе, экстракардиальные симптомы иногда отсутствуют. Ключевую роль в диагностике наследственных заболеваний, таких как ГКМП, ATTRамилоидоз, болезни Фабри, Помпе, Данона и др., играют изучение семейного анамнеза и молекулярногенетическое исследование.