Миотоническая дистрофия что это
Миотоническая дистрофия что это
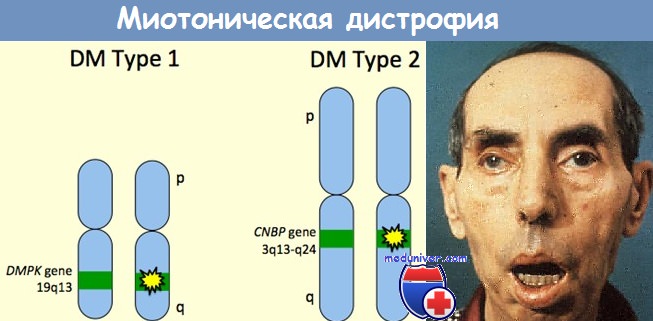
Миотоническая дистрофия — это самый распространенный тип мышечной дистрофии у взрослых. Заболевание обычно не ограничивается поражением скелетных мышц, а является, мультисистемным, с изменениями в поджелудочной железе, гонадах, щитовидной железе, миокарде и головном мозге. Заболевание передается по наследству аутосомно-доминантным путем. Дефектный ген локализован в хромосоме 19 (19q 13.2—13.3), и в норме кодирует миотонин-протеинкиназу — фермент, встречающийся в различных тканях и отвечающий за процесс фосфорилирования белков. Генерализацию заболевания объясняют широкой представленностью фермента в клетках. На молекулярном уровне дефект гена характеризуется экспансией триплетов (амплификацией повторения триплетов) гуанин-цитозинтимин.
Частота триплетных повторов варьирует и напрямую связана с тяжестью заболевания и обратно пропорциональна возрасту начала заболевания.
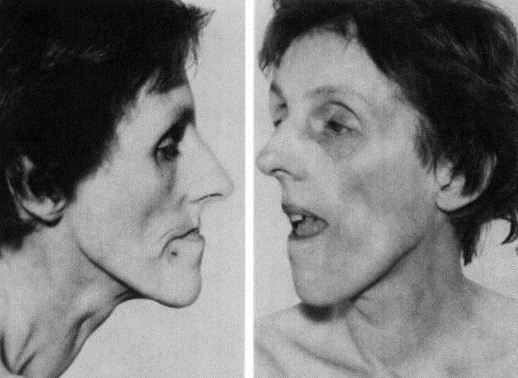
Поражение мышц. Характерной особенностью является слабость мышц лица. Лицо становится удлиненным и худым с ранним облысением в области лба. Также наблюдается птоз, который, однако, не столь выражен, как при миастении gravis или при синдроме Kearns-Sayre. Обычно отмечается атрофия височных и жевательных мышц. Слабость грудино-ключично-сосцевидной мышцы, как правило, более выраженная, чем в мышцах плеча и задней группе мышц шеи. В конечностях преимущественно страдают задние группы мышц, причем они поражаются значительно позже, чем вышеперечисленная мускулатура.
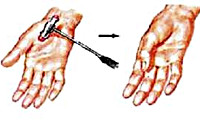
Проксимальная мускулатура конечностей вовлекается в процесс в самую последнюю очередь. Таким образом, в отличие от больных другими видами дистрофий, пациенты с миотонической дистрофией длительное время сохраняют способность к самостоятельному передвижению. Миотония — это удлинение периода расслабления мышцы после сокращения. Довольно часто больные даже не жалуются на миотонию. Изредка их беспокоит скованность мышц. Выявить миотонию можно перкуссией возвышения большого пальца или языка. Больные не могут быстро разжать руку после рукопожатия. При истинной миотонии повторное сокращение мышц способствует уменьшению миотонии.
Клинический диагноз подтверждается наличием миотонических разрядов на ЭМГ. Методы молекулярной диагностики (ПЦР) позволяют выявить экспансию триплетных повторов.
Общие признаки миотонической дистрофии. Кроме неврологических симптомов у многих больных отмечаются признаки системного поражения, которые даже могут быть ведущими в клинической картине. В этих случаях диагностика миотонической дистрофии затруднена. Поздняя диагностика очень опасна, т. к. пациентам необходима профилактическая и лечебная поддержка. Признаки системного поражения включают катаракту, тубулярную атрофию яичек у мужчин, блокаду сердечного проведений, нарушения ритма сердца, которые могут привести к внезапной смерти.
Тяжелые аритмии часто наблюдаются в фенотипически легких случаях, при этом кардиомиопатия у этих больных не выражена. Даже при легком поражении мышц отмечаются выраженные запоры и холелитиаз. При вовлечении в процесс диафрагмы может возникнуть гиповентиляция. Часто больные жалуются на чрезмерную сонливость. Из-за нарушения функции сердечно-сосудистой и легочных систем большую опасность для больных представляют хирургические вмешательства под наркозом. Препараты группы деполяризующих миорелаксантов могут значительно ухудшить состояние пациента, опиаты и барбитураты могут способствовать развитию дыхательной недостаточности.
К сожалению, часто бывает так, что диагноз миотонической дистрофии ставится только тогда, когда у больного наблюдаются осложнения со стороны сердечно-сосудистой системы после проведения общей анестезии. Нередко у больных миотонической дистрофией отмечаются легкое снижение интеллекта, апатия и сонливость. Врожденная миотоническая дистрофия — это более тяжелая форма дистрофии, чем описанная выше. Она манифестирует при рождении. У новорожденных наблюдается двусторонняя слабость лицевой мускулатуры, гипотония, задержка умственного развития, угнетение дыхания. Во время беременности часто отмечаются многоводие и вялые движения плода. Носителями патологического гена являются только женщины.
— Вернуться в оглавление раздела «Неврология.»
Миотоническая дистрофия
Это тяжелое наследственное прогрессирующее заболевание, наследуемое по аутосомно-доминантному типу. Миотоническая дистрофия первого типа проявляется преимущественно в возрасте 16–20 лет, второго типа — в 30–40 лет. Мужчины болеют в три раза чаще женщин.
Причины и виды миотонической дистрофии
Генетическая основа заболевания первого типа — повреждение гена миотонинпротеинкиназы (DMPK), локализованного на коротком плече 19 хромосомы, заключающееся в увеличении числа тринуклеотидных повторов CTG. Молекулярно-генетическая причина миотонической дистрофии второго типа заключается в увеличении количества повторов CCTG в интроне 1 гена ZNF9, картируемом на 3 хромосоме.
Миотоническая дистрофия второго типа считается более мягкой и проявляется у больных старшей возрастной группы. Эта форма болезни сопровождается полиморфной симптоматикой, которая может включать в себя:
Заболевание первого типа характеризуется вовлечением мышц шеи и лица, дистальных отделов конечностей, в то время как при втором типе наблюдается проксимальный паттерн поражения скелетных мышц.
Миотоническая дистрофия проявляется слабостью мышц лица, провисанием челюсти, опущением века, атрофией мышц предплечий и икр. Она вызывает нарушения сердцебиения, апноэ сна, влияет на ЖКТ, обуславливая запоры и другие расстройства пищеварения.
Диагностика миотонической дистрофии
Обследование начинается с изучения истории болезни пациента и семейного анамнеза. Диагностика включает в себя:
Обнаружить миотоническую дистрофию в период внутриутробного развития ребенка позволяет антенатальная диагностика (неинвазивное генетическое тестирование).
Медико-генетический центр «Геномед» проводит молекулярно-генетические исследования для обнаружения этого заболевания: поиск мутаций в генах DMPK и ZNF9, пренатальная ДНК-диагностика.
Лечение и профилактика миотонической дистрофии
Заболевание является неизлечимым, однако комплексный подход к терапии позволяет замедлить его прогрессирование. Лечение включает в себя:
Профилактика повторных эпизодов миотонической дистрофии в семьях с отягощенным анамнезом заключается в проведении предимплантационной и пренатальной ДНК-диагностики.
Дистрофическая миотония Россолимо-Штейнерта-Куршмана
Дистрофическая миотония Россолимо-Штейнерта-Куршмана — наследственное медленно прогрессирующее заболевание, в основе которого лежит дефект миотонин-протеинкиназы, приводящий к развитию миотонии в сочетании с дистрофическими изменениями мышечной ткани. Заболевание проявляется миотоническими спазмами, атрофическими изменениями мышц шеи, лица и дистальных отделов конечностей, снижением интеллекта, аритмиями и эндокринной патологией. Диагностика дистрофической миотонии основывается на клинических данных, результатах генеалогического анализа и исследования ДНК. Лечение симптоматическое, направленное против симптомов миотонии (фенитоин, прокаинамид, хинин, мочегонные) и мышечной дистрофии (анаболические стероиды, АТФ).
МКБ-10
Общие сведения
Дистрофическая миотония Россолимо-Штейнерта-Куршмана является наследственным заболеванием и передается от родителей к детям по аутосомно-доминантному типу. Классическая форма этого заболевания развивается преимущественно в возрастном периоде от 10 до 20 лет. В более редких случаях встречается врожденная дистрофическая миотония Россолимо-Штейнерта-Куршмана, клинические симптомы которой проявляются сразу же после рождения.
Морфологически при миотонии Россолимо-Штейнерта-Куршмана отмечается сочетание гипертрофических изменений одних мышечных волокон с атрофией других, замещение части мышечных волокон жировой и соединительной тканью. Изучение образцов мышечной ткани под электронным микроскопом показывает деструкцию миофибрилл и изменение размера митохондрий.
Причины
Последние исследования генетического набора больных дистрофической миотонией показали, что основу заболевания составляет дефект в гене DMPK, находящемся в 19-й хромосоме и отвечающем за синтез миотонин-протеинкиназы. У больных дистрофической миотонией выявляется значительное увеличение тринуклеотидных CTG-повторов в основной части гена DMPK. При этом именно от количества повторов зависит форма и тяжесть миотонии.
В норме число тринуклеотидных повторов варьирует от 5 до 37. Увеличение повторов до 50-80 приводит к появлению мягкой формы миотонии Россолимо-Штейнерта-Куршмана. Если количество тринуклеотидных повторов находится в промежутке от 100 до 500, развивается поздняя форма заболевания. Врожденные формы дистрофической миотонии возникают при повышении числа CTG-повторов от 500 до 2000. Исследования показали, что увеличение тринуклеотидных повторов происходит в основном в женских гаметах в процессе мейоза. В связи с этим при передаче заболевания от матери у ребенка возникает более тяжелая форма миотонии или ее врожденный вариант.
Симптомы классической формы
В классическом варианте миотония Россолимо-Штейнерта-Куршмана начинает проявляться после первых 5 лет жизни и может манифестировать до 35-летнего возраста. Но наиболее часто клинические проявления заболевания возникают в возрастном диапазоне от 10 до 20 лет. Они представляют собой сочетание типичных симптомов миотонии с признаками миопатии, поражением сердечно-сосудистой системы и ЦНС, эндокринными нарушениями и катарактой.
Из миотонических проявлений для миотонии Россолимо-Штейнерта-Куршмана характерны миотонические спазмы, наиболее выраженные в жевательных мышцах и мышцах-сгибателях кисти. Наблюдаются также механические реакции миотонического типа, выявляемые при ударе неврологическим молоточком. Отличительной особенностью миотонии Россолимо-Штейнерта-Куршмана является наличие атрофических изменений в различных группах мышц. При этом течение заболевания характеризуется постепенным угасанием симптомов миотонии на фоне прогрессирующей мышечной дистрофии.
Чаще всего при миотонии Россолимо-Штейнерта-Куршмана поражаются мышцы дистальных отделов конечностей, мимическая мускулатура, грудино-ключично-сосцевидные и височные мышцы. Поражение мимических мышц проявляется характерным маскообразным печальным выражением лица больных дистрофической миотонией. Атрофические изменения мышц глотки и гортани приводят к развитию миопатического пареза гортани с нарушением голоса и затруднением глотания. Миопатические изменения могут возникать в дыхательной мускулатуре. Наряду с миотоническими спазмами они приводят к ухудшению легочной вентиляции, появлению приступов апноэ во сне, возникновению застойной или аспирационной пневмонии.
Нарушения сердечно-сосудистой системы наблюдаются примерно в половине случаев дистрофической миотонии. К ним относятся аритмии, связанные с нарушением проводимости, и гипертрофия левого желудочка. Наиболее распространена блокада ножек пучка Гиса. Из признаков поражения ЦНС чаще всего наблюдается гиперсомния и снижение интеллектуальных способностей, доходящее до легкой степени дебильности.
Эндокринные расстройства при миотонии Россолимо-Штейнерта-Куршмана затрагивают в основном половую сферу. У мужчин они проявляются снижением либидо, крипторхизмом, импотенцией, гипогонадизмом, у женщин — гирсутизмом, нарушениями менструального цикла (олигоменореей, дисменореей) и ранним климаксом. Типичным является изменение структуры волос в сочетании с алопецией. У мужчин отмечается выпадение волос на висках и в области лба, у женщин — диффузное или очаговое облысение.
Симптомы врожденной формы
Первые признаки врожденной формы миотонии Россолимо-Штейнерта-Куршмана могут проявляться еще в период внутриутробного развития. Как правило, они выражаются в значительном снижении двигательной активности плода, которое диагностируется акушером-гинекологом по данным акушерского УЗИ в III триместре беременности.
После рождения ребенка преобладают симптомы миопатии. Отмечается диффузная гипотония мышц, более выраженная в мимической, жевательной и глазодвигательной мускулатуре, а также в мышечных группах дистальных отделов конечностей. Характерны затруднения вскармливания и дыхательные расстройства. Миотоническая симптоматика начинает проявляться несколько позже. Врожденная дистрофическая миотония сопровождается задержкой моторного развития и олигофренией. Типично быстрое прогрессирование симптомов заболевания, часто приводящее к смертельному исходу еще в раннем детстве.
Диагностика
Типичное сочетание миотонии с признаками дистрофических изменений мышечной ткани, умственной отсталостью, нарушениями со стороны сердечно-сосудистой и эндокринной систем позволяет неврологу предположить миотонию Россолимо-Штейнерта-Куршмана. Подтверждением диагноза являются результаты генеалогического анализа, свидетельствующие об аутосомно-доминантном типе наследования заболевания, и данные ДНК-анализа. Дополнительно проводится электромиография, электронейрография, исследования половых гормонов, ЭКГ. К диагностике пациентов с миотонией Россолимо-Штейнерта-Куршмана могут дополнительно привлекаться генетики, кардиологи, эндокринологи, гинекологи, андрологи.
При диагностике дистрофической миотонии ее необходимо дифференцировать ее от других видов миотонии. Так, наличие мышечных атрофий позволяет отличить миотонию Россолимо-Штейнерта-Куршмана от миотонии Томсена, для которой типична мышечная гипертрофия. От миотонии Беккера заболевание отличается ранним поражением мышц лица и доминантным типом наследования. Кроме того, следует проводить дифференциальный диагноз миотонии Россолимо-Штейнерта-Куршман с миопатиями, БАС и амиотрофией Шарко-Мари-Тута.
Лечение миотонии Россолимо-Штейнерта-Куршмана
Радикальной терапии миотонии Россолимо-Штейнерта-Куршмана пока не существует. Пациентам, имеющим это заболевание, показана диета со сниженным содержанием калия. Им также следует избегать переохлаждения, которое провоцирует миотонические спазмы. Уменьшению миотонических проявлений способствует прием хинина, прокаинамида, фенитоина в сочетании с ацетазоламидом. Показаны анаболические стероиды ( нандролона деканоат, метиландростендиол, метандростенол), небольшие дозы АТФ, витамины группы В.
Миотоническая дистрофия что это
Миотония означает нарушение расслабления скелетной мышцы после ее напряжения и медленный, тонический ответ на механическую или электрическую стимуляцию. Электромиографически миотония характеризуется повторяющимися ответами двигательных единиц, что создает классический рисунок «пикирующего бомбардировщика» (подъем — спад). Миотония вызывается нестабильностью клеточной мембраны мышц и имеет чисто мышечное происхождение.
Она может возникать при некоторых генетических заболеваниях и синдромах, включая миотоническую дистрофию, наиболее часто встречающееся генетическое расстройство, так же как и при «каналопатиях» или расстройствах ионных каналов.
Миотоническая дистрофия (dystrophia myotonica, болезнь Штейна) — относительно часто встречающееся заболевание с частотой 13,5 на 100000 живых новорожденных. Оно передается по аутосомно-доми-нантному механизму и характеризуется сочетанием миотонии с дистрофическими процессами в мышцах. Миотоническая дистрофия — мультисистемное заболевание, поражающее скелетную и гладкую мышечную ткань, а также глаза, сердце, эндокринную систему и центральную нервную систему.
Клинические проявления составляют континуум от легких до тяжелых форм и разделяются на три частично перекрывающих друг друга фенотипа: легкий, классический и врожденный.
а) Клинические проявления классической формы. Клиническая картина миотонической дистрофии вариабельна. У пациентов с легкой миотонической дистрофией 1 типа (ДМ1) могут наблюдаться только катаракта, легкая миотония или сахарный диабет. Они могут жить полноценной активной жизнью, длительность жизни нормальная или немного снижена. При классической миотонической дистрофии заболевание обычно начинается в возрасте двадцати или тридцати лет, реже — после 40 лет. Однако классическая ДМ1 может проявляться и в детском возрасте, когда наблюдаются невыраженные симптомы, такие, как миотоническое лицо и миотония.
Миотония выявляется при постукивании по мышце, например, по тенару или языку, большой палец при этом находится в положении отведения, на языке на несколько секунд после перкуссии остается ямочка. Миотония расслабления выявляется при пожимании руки пациента: пациент отпускает захват, разжимая сгибатели пальцев сгибанием запястья.
Наблюдается характерное распределение мышечной атрофии и слабости. Атрофия начинается с мышц лица — особенно жевательных и височных мышц, что делает лицо пациента длинным и тонким, с пустыми височными ямками,— и грудинноключичнососцевидных мышц. Затем поражается плечевой пояс, и, что характерно, также истончаются плечелучевые мышцы и передние мышцы голени. У некоторых пациентов отмечается незначительная мышечная слабость, даже при наличии видимой атрофии, но если она развивается до достижения возраста 20 лет, высока вероятность ее прогрессирования и развития тяжелой мышечной слабости дистальных отделов в среднем возрасте.
Редко, после нескольких десятилетий течения болезни, миотоническая дистрофия приковывает пациента к инвалидному креслу. У больных с развитой стадией заболевания могут развиться поражения дыхательной мускулатуры и выраженная аспирация (Thornton, 1999).

Обратите внимание на эквиноварусные стопы. Ребенок с легкой формой заболевания, начавшейся в неонатальном периоде (справа).
Обратите внимание на выгнутую «шатровую» верхнюю губу, открытый рот, небольшой птоз и pectum excavatum.
Поражение гладкой мышечной ткани может проявляться снижением моторной функции желудка, характерной жалобой являются запоры. У взрослых могут развиваться облысение, атрофия яичек, гиперинсулинемия и нарушения секреции гормона роста (Hudson et al, 1987). Нарушения сердечной проводимости — наиболее серьезное осложнение из-за опасности ранней смерти, вызванной блокадой проводимости или аритмией. В литературе число пациентов с нарушениями ЭКГ, аритмиями или другой патологией сердца колеблется от 50% до 90% (Hawley et al., 1991; Morgenlanderet al., 1993). Задние катаракты не видны до достижения возраста 8-10 лет даже при осмотре на щелевой лампе, они развиваются позже и могут быть первым и иногда единственным проявлением болезни.
Нарушения интеллекта у пациентов со взрослой формой миотонической дистрофии встречаются редко; но могут наблюдаться нарушения личности в виде замкнутости, обсессивно-компульсивных и пассивно-агрессивных черт (Delaporte, 1998).
Гиперсомния и апноэ во сне относятся к другим характерным, хотя и поздним проявлениям заболевания (Rubinsztein et al., 1998). Продолжительность жизни может быть снижена из-за пневмонии и дыхательной недостаточности или сердечно-сосудистых осложнений, например аритмии (de Die-Smulders et al., 1998).
б) Клинические проявления врожденной формы. Врожденная форма болезни имеет совершенно другую клиническую картину (Hageman А.Т. et al, 1993). Заболевание начинается в пренатальном периоде; примерно в половине случаев развивается многоводие; роды обычно в тазовом предлежании, младенец может быть маленьким для своего срока гестации. Часто встречаются множественные врожденные контрактуры. Гипотония, мышечная слабость и лицевая диплегия с выгнутой кверху «шатровой» губой — наиболее заметные признаки. Из-за поражения межреберных мышц и диафрагмы примерно в половине случаев развивается дыхательная недостаточность, которая обычно рано приводит к смерти.
Состояние выживших младенцев постепенно улучшается, обычно они обретают способность ходить, хотя позже у них развивается прогрессирующая миопатия в классической форме. Миотония никогда не развивается до достижения возраста 3-4 лет, даже по данным ЭМГ, часто и значительно позже. У менее тяжело пораженных пациентов, переживающих неонатальный период, в большинстве случаев присутствуют психические нарушения, которые обычно связаны с расширением желудочков и церебральная атрофия (Regev et al., 1987).
Тяжелые и относительно легкие формы врожденной миотонической дистрофии могут наблюдаться у кровных родственников.
в) Диагностика и лечение. Существует два основных генетических варианта миотонической дистрофии — ДМ1 и ДМ2. ДМ1 вызывается увеличением тринуклеотидной последовательности ЦТГ гена миотонин-протеинкиназы, DMPK. Длина цепочки ЦТГ, превышающая 35 последовательностей, является аномальной. Молекулярное генетическое тестирование выявляет мутации почти у 100% больных, тестирование используется в клинике для диагностики, в том числе и пренатальной. Как и при других заболеваниях, вызываемых удлинением ДНК, наблюдаются влияние пола и постепенное ухудшение при передаче по наследству.
В последующих поколениях длина повторяемого участка обычно увеличивается, особенно при передаче по материнской линии. Существует стойкая корреляция между длиной участка, возрастом дебюта заболевания и тяжестью клинической картины, самые длинные участки вызывают врожденные формы болезни (Jaspert et al., 1995; Takahashi et al., 1996). Классическая ДМ1 вызывается при количестве повторов в 100-1000, врожденная миотоническя дистрофия связана с числом повторов >2000. В подавляющем большинстве случаев врожденная ДМ1 наследуется от матери. Увеличение числа повторов ЦТГ вызывает аномалию процессинга транскриптов РНК, нарушает альтернативный сплайсинг и уровень экспрессии других генов, что отражается различными проявлениями болезни (например, поражение хлоридных каналов вызывает миотонию, аномалии инсулиновых рецепторов приводят к диабету) (Ranum и Day, 2004).
Миотоническая дистрофия 2 типа (ДМ2, ранее проксимальная миотоническая миопатия) гораздо более редкое заболевание, встречающееся чаще всего у взрослых. Она также наследуется по аутосомно-доминантному типу и вызывается увеличением количества последовательностей ЦЦТГ интрона 1 гена ZNF9, кодирующего протеин «цинкового пальца» 9 (Thornton et al., 1994; Udd et al., 1997; Liquori et al., 2001). ДМ2 также характеризуется клиническими и электрофизиологическими проявлениями миотонии, катарактами, облысением лобной области у мужчин, нарушением сердечной проводимости и эндокринопатиями. В отличие от ДМ1, тяжелой врожденной формы ДМ2 не существует.
Иногда миотоническую дистрофию необходимо дифференцировать с другими формами наследственных дистальных миопатий, в том числе с миозитом с включенными тельцами, миофибриллярной миопа-тией и миопатией Мийоши. У младенцев дифференциальная диагностика сложнее, хотя постановке правильного диагноза помогают общий вид младенца и поражение лица. Пациенты с врожденными миопатиями и с врожденными мышечными дистрофиями могут выглядеть очень похожими на больных с миотонической дистрофией. Обследование матери, особенно на предмет миотонии, является главным диагностическим исследованием, хотя иногда у матери через месяцы или годы после рождения больного младенца может и не выявляться миотония, даже при ЭМГ.
Если длина последовательности ЦТГ DMPK в нормальных пределах, и если после молекулярного тестирования на ZNF9 исключена ДМ2, для выявления других причин заболевания мышц часто необходимо выполнить ЭМГ, определить уровень сывороточной КК и/или провести исследование биоптата мышечной ткани.
Большое значение имеет наблюдение пациентов с миотонической дистрофией, включая ежегодное выполнение ЭКГ и/или холтеровского мониторирования с целью выявления нарушений сердечной проводимости, а также измерение уровня глюкозы крови натощак и содежания гликозилированного гемоглобина для скрининга диабета. Миотония редко бывает настолько тяжелой, чтобы требовалось лечение (Ricker et al, 1999). Используются прокаинамид, хинин и мексилетин.
Редактор: Искандер Милевски. Дата публикации: 14.1.2019
Миотонический синдром
Длительность миотонической атаки может быть продолжительностью от секунд до минут и по интенсивности колебаться от небольшого дискомфорта до выраженного нарушения двигательных возможностей. Как правило, миотоническая атака возникает после интенсивной физической нагрузки или после длительного периода отдыха, но иногда возникает как реакция на низкие температуры или даже резкий звук.
При миотонии идет вовлечение только скелетной мускулатуры, выполняющей произвольные движения. Таким образом, миотоническая атака может возникнуть только при выполнении осознанных движений, но не поражает мышцу сердца или мышечные структуры пищеварительного тракта. В зависимости от типа и серьезности миотония может возникнуть в ногах, лице, руках, в плечах, стопе, в мышцах век глаз и даже способности говорить четко.
Как правило, миотонические синдромы являются генетически детерминированными и могут быть у любого человека. Миотонические нарушения могут быть как у женщин, так и мужчин и в любом возрасте могут быть симптомы миотонических атак. В зависимости от выраженности миотонических симптомов первые признаки этих нарушений могут появиться в подростковом возрасте или у взрослых. Наследование миотонических синдромов происходит двумя путями аутосомально-доминантным генетическим паттерном или аутосомально-рецессивным генетическим паттерном.
Аутосомально доминантное наследование
Нарушения, связанные с аутосомально-доминантным наследованием обычно проявляется в каждом поколении без исключений. Аутосомальный означает то, что генетическая ошибка может располагаться на любой хромосоме, в каждой клетке организма, за исключением половых хромосом. Доминантный означает, что достаточно одного родителя носителя дефектного гена для передачи заболевания по наследству. И так как нарушения могут передаваться любым родителем, то любой ребенок от родителя с генетическим дефектом имеет 50% шанс наследовать это нарушение. Выраженность нарушения и возраст дебюта могут варьировать в зависимости от конкретного индивидуума.
Аутосомально-рецессивное наследование
При аутосомально-рецессивном наследовании заболевание появляется в одном поколении и обычно без наличия семейного анамнеза этого состояния. Оба родителя могут быть носителями этого гена. Носитель дефектного гена может не отмечать какой-либо симптоматики. Рецессивность означает то, что для проявления этого гена и заболевания необходимо, чтобы у обоих родителей был дефектный ген. Дети обоего пола могут наследовать дефектный ген по этому типу наследования. При каждой беременности у 25 % детей есть вероятность наследования дефектного гена от обоих родителей. Если ребенок наследует дефектный ген от одного родителя, то он будет носителем дефектного гена, но, скорее всего, проявляться это симптомами не будет. В 50% случаев ребенок будет носителем гена. В то же время вероятность того, что ребенок не наследует дефектный ген и не будет носителем и не будет иметь клиническую манифестацию, составляет 25%.
Виды миотоний
Миотония конгенита
Миотония конгенита наиболее часто встречающаяся непрогрессирующая форма миотонического синдрома и вызвана мутацией гена, отвечающего за натриевые ионные каналы мышц. Эта форма миотонии не оказывает влияние на продолжительность жизни и имеет незначительное влияние на структуру тела или рост опорно-двигательного аппарата. Существует две формы миотонии конгенита в зависимости от типа наследования.
Частой и довольно тяжелым типом миотонии конгенита является генерализованная миотония Бейкера, и наследование этого заболевания происходит по аутосомально-рецессивному типу. Дебют этой формы миотонии бывает в детстве или раннем подростковом возрасте, но иногда при тяжелом течение дебют может быть и в раннем детском возрасте. Симптоматика может нарастать прогрессивно, в течение нескольких лет после постановки диагноза или постепенно нарастать до достижения пациентом двадцатилетнего возраста.
Основным симптомом обеих заболеваний является генерализованная миотония, вызванная произвольными движениями. Как правило, такая симптоматика провоцируется значительной физической нагрузкой или наоборот длительным периодом отдыха и мышечной релаксации. Миотония более выражена в ногах, что вызывает затруднения при ходьбе и иногда даже падения. Также миотонией бывают охвачены мышцы плечевого пояса и головы, что может вызвать затруднения при хватании предметов, жевании или мигании. В редких случаях при миотонии Бейкера может быть обездвиживающая слабость, появляющаяся после миотонической атаки.
После миотонической атаки при обоих типах миотонии снять скованность можно с помощью повторных движений в скованных мышцах. Как правило, скованность увеличивается после нескольких первых сокращений заинтересованных мышц, а затем после пяти сокращений миотоническая скованность исчезает, что позволяет восстановить нормальную работу мышц на определенный промежуток времени. Это эффект называется эффектом разминки (разогрева) и позволяет людям с миотонией заниматься тяжелыми физическими нагрузками и силовыми видами спорта.
И хотя миотония конгенита не оказывает значительного влияния формирование опорно-двигательного аппарата, в то же время миотония влияет на размер определенных мышц. Обе миотонии Бейкера и Томсена могут вызывать необычное увеличение размеров скелетных мышц, особенно в области ног ягодиц, но также и в области рук плеч и мышц спины. Такое увеличение может считаться мышечной гипертрофией и иногда такие пациенты выглядят как настоящие атлеты. При миотонии Бейкера гипертрофия мышц более выражена, чем при миотонии Томсена.
Парамиотония конгенита
Эта миотония является редкой патологией, связанной нарушением натриевых каналов и передающаяся по аутосомно-доминантному типу. Этот тип миотонии не сокращает продолжительность жизни, и интенсивность миотонии сохраняется стабильной в течение жизни. Дебют заболевания возникает в период между рождением и ранним детским возрастом. Характерным симптомом парамиотонии конгенита является генерализованная миотоническая скованность, которая в большей степени поражает руки и лицо, а также области шеи и руки. Так же, как и при других непрогрессирующих миотониях, парамиотония конгенита провоцируется интенсивными произвольными нагрузками, а в некоторых случаях провоцируются низкой температурой. Во многих случаях, миотонические атаки индуцированные холодом и связанную с ними мышечную скованность можно снять теплом.
Атаки миотонической скованности часто сопровождаются обездвиживающей слабостью в заинтересованных зонах. Слабость может быть более длительной, чем эпизод миотонической скованности, ослабляя мышцы на период от нескольких минут до нескольких часов. Но слабость не характерна для парамиотонии конгенита. Кроме того, в отличие от других непрогрессирующих форм миотонии, для парамиотонии не характерно наличие эффекта разминки, при котором происходит снижение скованности после нескольких сокращений мышц. Наоборот, миотоническая скованность обычно увеличивается после продолжающейся активности мышц, что еще больше снижает двигательную активность. Этот феномен обычно называют парадоксальной миотонией.
Синдром Шварц Джемпела
Причина синдрома Шварца-Джемпела не известна. Не исключается, что этот вид миотонии является разновидностью мышечных нарушений, а также возможно иметь связь с нарушениями в нервной системе или является сочетанием нарушениям в мышцах и нервах.
Диагностика
Даже на основании физикального обследования врач может провести определенные диагностические тесты, такие как миотоническая реакция на нагрузку, воздействие холодом или другие стимуляции. Но очень важно диффенцировать эти миотонии с прогрессирующими заболеваниями, такими как миотонические дистрофии. И для дифференциального диагноза необходимы специальные методы исследования. Эти исследования включают проведение ЭМГ, который позволяет определить электрическую активность мышечных ткани; лабораторные исследования (анализы крови и анализ ДНК) биопсию мышц, которая бывает иногда необходима для окончательного диагноза мышечного заболевания.
Лечение
В настоящее время не существует методов лечения, позволяющих избавиться полностью от какого либо миотонического синдрома. Лечение носит симптоматический характер. Если миотонические атаки становятся интенсивными, возникает необходимость применения медикаментов, позволяющих снизить симптоматику. Наиболее известным препаратом является мексилитен, а также такие препараты как гуанин, прокаинамид, тегретол, фенитоин. Но все эти препараты имеют массу побочных эффектов и поэтому их длительное употребление не желательно. Наиболее оптимально, когда пациент знает провоцирующие миотонические атаки факторы и старается по возможности избегать провоцирующих ситуаций, а после атак дает возможность мышцам восстановиться с помощью отдыха.
Использование материалов допускается при указании активной гиперссылки на постоянную страницу статьи.