Миртазапин или ципралекс что лучше
Как использовать миртазапин в клинической практике?
М. Ю. Дробижев, С. В. Кикта
ГОУ ВПО ММА им. И.М.Сеченова, ГМУ УД президента РФ.
С появлением значительного числа новых антидепрессантов (тимоаналептиков), открываются возможности для индивидуального подбора препарата наиболее адекватного психопатологическим особенностям курируемого состояния. Реализация такой возможности сопряжена с точной оценкой спектра психотропной активности препарата, включая симптомы (синдромы мишени) и их соответствие механизмам действия препарата. Вместе с тем эта имеющаяся в открытой печати информация порой разноречива.
Возьмем, к примеру, миртазапин, доступный в настоящее время в нашей стране как в виде брендового препарата (Ремерон), так его дженериков, включая Миртазонал (произведенный фирмой Актавис). Характеристики спектра психотропной активности этого антидепрессанта можно встретить в различных источниках. Так, в распространенном и доступном для практикующих психитаров справочнике Vidal сообщается, что Миртазонал ослабляет выраженность таких симптомов депрессии как ангедония, психомоторная заторможенность, нарушения сна, снижение массы тела, суицидальные мысли, колебания настроения, потеря интереса к жизни (6). При этом указывается, что этих эффектов препарат достигает за счет блокады центральных пресинаптических α2-рецепторов, которые повышают норадренергическую нейротрансмиссию, а также усиления нейротрансмиссии в серотонинергических синапсах только через серотониновые 5-HT1-рецепторы, т.к. другие серотониновые 5-HT2- и 5-HT3-рецепторы блокируются.
Что же касается того, как Миртазонал (равно как и другие антидепрессанты) достигает указанных эффектов, то сообщается следующее. Депрессии с проявлениями позитивной аффективности поддаются лечению этим препаратом (наряду с иными антидепресантами) вне зависимости от его фармакологических свойств (воздействие на серотонинергические, норадернергические структуры мозга и т.д.). При депрессивных состояниях с негативной аффективностью Миртазонал (равно как и другие современные антидепрессанты, обладающие высокой, по сравнению с ТЦА, нейрохимической селективностью) легче переносятся, не сопряжен с поведенческой токсической, и гипотетически более эффективен.
В пределах терапевтической схемы, которая развивается другой известной школой отечественной психофармакологии, возглавляемой профессором С.Н. Мосоловым, место Миртазонала представляется следующим образом. В первом издании справочного руководства по психотропным и противоэпилептическим препаратам, разрешенным к применению в России (7) сообщается, что препарат может назначаться как при депрессиях с тревогой и ажитацией, так и заторможенностью, апатией, поскольку относится к сбалансированным антидепрессантам с преобладанием анксиолитического и мягкого седативного действия. Иная версия показаний излагается в следующем издании справочного руководства (3). В качестве показаний для Миртазонала фигурирует лишь депрессии с тревогой и ажитацией. В то же время сам препарат рассматривается уже в качестве седативного антидепрессанта. Важно, также, что в обоих случаях не уточняется, как представленный спектр психотропной активности соотносится с механизмом действия этого медикаментозного средства: селективное воздействие на определенный подтип постсинаптических серотониновых рецепторов.
Наконец, приведем данные фундаментального обзора, посвященного рассматриваемому препарату, напечатанному в одном из наиболее солидных отечественных изданий, посвященных психиатрии и психофармакологии (2). Автор этой публикации П.В. Морозов, обобщая накопленный опыт работы с антидепрессантом, сообщает о высокой эффективность препарата при лечении депрессий с тревогой и бессонницей и быстроте начала действия. Однако и из этого обзора остается неясно, как психотропная активность антидепрессанта связана с его довольно сложным механизмом действия. Так, указывается лишь, что препарат является специфическим антагонистом центральных α2-рецепторов и обладает незначительным действием на α1-рецепторы. Блокада пресинаптических α2-рецепторов вызывает увеличение высвобождения норадреналина. Последующая активация α1-рецепторов ведет к активизации серотониновых клеток, а непосредственная блокада ингибирования α2-гетерорецепторов, расположенных на окончаниях этих нейронов, ведет к увеличению высвобождения серотонина. Причем указанный нейротрансмиттер действует в дальнейшем только серотониновые рецепторы первого типа (5HT1-рецепторы), в то время как 5HT2-, 5HT3-рецепторы (второго и третьего типа) блокированы рассматриваемым антидепрессантом.
Таблица 1.
Показатели, характеризующие практику применения антидепрессантов, в сравнении с рекомендациями, представленными в справочнике Vidal (4, 6)
| Антидепрессант | Доля больных, принимавших препарат | суточные дозы (мг) | ||||||
| Средняя | Минимальная | Максимальная | ||||||
| абс. | % | Циркадиан ± ст. отклон. | Vidal | Циркадиан | Vidal | Циркадиан | Vidal | |
| амитриптилин | 839 | 25,7 | 87,0±54,2 | 150-200 | 10 | 25-50 | 350 | 400 |
| кломипрамин | 152 | 4,7 | 90,3±51,6 | 100-150 | 25 | 75 | 350 | 250 |
| имипрамин | 138 | 4,2 | 73,1±43,5 | 150 | 20 | 25 | 225 | 200 |
| пипофезин | 81 | 2,5 | 86,4±34,3 | 150-200 | 25 | 25-50 | 200 | 400 |
| пирлиндол | 158 | 4,8 | 124,2±74,3 | 150-300 | 25 | 50-75 | 400 | 400 |
| венлафаксин | 129 | 4,0 | 123,6±72,3 | — | 37,5 | 75 | 450 | 375 |
| дулоксетин | 50 | 1,5 | 68,0±23,4 | 60 | 30 | 30-60 | 120 | 120 |
| милнаципран | 84 | 2,6 | 86,8±45,8 | 100 | 25 | — | 300 | 250 |
| миртазапин | 39 | 1,2 | 31,2±9,4 | 30 | 15 | — | 60 | — |
| миансерин | 75 | 2,3 | 40,7±21,2 | 30-90 | 15 | 30-45 | 120 | — |
| мапротилин | 95 | 2,9 | 90,2±42,4 | 25-150 | 20 | 25 | 200 | 150 |
| сертралин | 215 | 6,6 | 79,0±42,4 | — | 20 | 50 | 200 | 200 |
| циталопрам | 44 | 1,3 | 28,6±11,6 | — | 10 | 20 | 60 | 60 |
| эсциталопрам | 128 | 3,9 | 14,92±8,1 | 10 | 5 | — | 60 | 20 |
| пароксетин | 322 | 9,9 | 27,2±12,2 | 20 | 10 | — | 80 | 50 |
| флуоксетин | 125 | 3,8 | 30,8±15,4 | — | 20 | 20 | 80 | 80 |
| флувоксамин | 178 | 5,5 | 134,0±76,7 | 100 | 25 | 50-100 | 400 | 300 |
| тианептин | 640 | 19,6 | 36,9±6,8 | 37,5 | 12,5 | — | 100 | 37,5 |
Его получали лишь 1,2% из числа обследованных больных. На практике это означает, что нередки случаи, когда практикующие психиатры имеют весьма незначительный опыт использования миртазапина.
Таблица 2.
СДМ, депрессивные синдромы и их тяжесть (1).
| Депрессивные синдромы | СДД | СДН | СДС |
| тяжелые | + | + | + |
| среднетяжелые | |||
| с заторможенностью и апатией по С.Н. Мосолову (3) | + | + | — |
| с негативной аффективностью по А.Б. Смулевичу (5) | + | + | — |
| с позитивной аффективностью по А.Б. Смулевичу (5) | — | + | + |
| тоскливые | — | + | + |
| соматизированные | — | + | + |
| деперсонализационные | + | + | — |
| тревожно-апатические | + | — | + |
| дисфорические | — | + | + |
| астено-адинамические | + | + | — |
| легкие | |||
| с тревогой и ажитацией по С.Н. Мосолову (3) | — | — | + |
| тревожные | — | — | + |
| астенические | — | + | — |
| адинамические | — | + | — |
| апатические | + | — | — |
| ангедонические | + | — | — |
Важно, что между проявлениями СДД, СДН, СДС и механизмом действия антидепрессантов устанавливаются значимые соотношения. Действительно, подавляющее большинство современных препаратов, обладающих тимоаналептическими свойствами, можно дифференцировать на группы, в соответствии с их способностью восполнять недостаток одного, двух или даже трех моноаминов, что рассматривается в качестве т.н. первичных фармакологических свойств антидепрессантов (таблица 3).
Таблица 3.
Классификация антидепрессантов: группы и механизмы действия (1).
Возвращаясь теперь к Миртазоналу, укажем, что согласно современным представлениям, этот антидепрессант относится к препаратам тройного действия, восполняющего дефицит трех моноаминов (дофамина, серотонина, норадреналина). Происходит это следующим образом (рисунок 1).
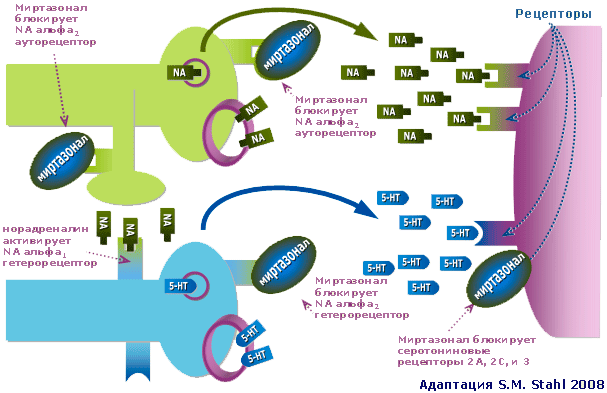
Рис 1. Норадренергический и серотонинергический нейроны при депрессии: действие Миртазонала
Миртазонал блокирует различные регуляторные α1 и α2 адренорецепторы (10). Последние (α2 адренорецепторы) необходимы, прежде всего, для самого норадреналинового нейрона, что он «понимал» достаточно ли он эффективно действует. Располагаясь на этом нейроне (за это они называются ауторецепторами) α2 адренорецепторы как бы тестируют окружающее пространство на наличие норадреналина. Если последнего много, он воздействует на α2 аутоадренорецепторы и норадреналиновый нейрон перестает выбрасывать рассматриваемый нейротрансмиттер. Блокада этих рецепторов приводит к обратному результату. Норадреналиновый нейрон продолжает «работать», выбрасывая норадреналин. В результате подвергаются редукции симптомы, связанные с СДН.
Однако регуляторные α2 адренорецепторы имеются и на серотониновом нейроне (за это они называются гетерорецепторами). Воздействуя на эти гетерорецепторы, норадреналин способен прекратить выброс серотонина. Блокада этих рецепторов, напротив, способствует выделению указанного нейротрансмиттера. В результате подвергаются редукции симптомы, связанные с СДС. Кроме того, уровень серотонина повышается и иным способом.
Наконец, назначение Миртазонала ведет к усилению нейротрансмиссии в серотонинергических синапсах через серотониновые рецепторы первого типа (5-HT1), т.к. аналогичные рецепторные структуры 2-го и 3-го типов (5-HT2 и 5-HT3) блокируются этим антидепрессантом.
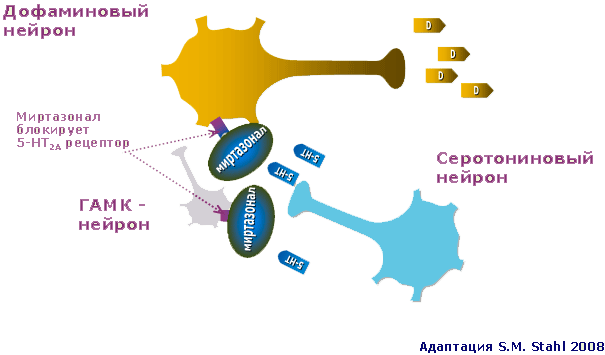
Следует, однако, отметить, что роль серотониновых рецепторов 2-го типа в механизме действия Миртазонала на этом не исчерпывается. Дело в том, что блокада серотониновых рецепторов типа 2А и 2С способствует выделению в головном мозге дофамина и норадреналина. Происходит это следующим образом (рисунок 2).
Рис. 2. Серотониновый, дофаминовый и ГАМК-нейроны при депрессии: действие Миртазонала
Регуляторные серотониновые рецепторы типа 2А (5-НТ2А) располагаются как на ГАМКергическом, так и на дофаминовом нейроне. При воздействии на них серотонина способны работа этих нейронов затрудняется. В результате редуцируется активирующее воздействие ГАМК на дофаминовый нейрон. Последний, кроме того, тормозится при непосредственном воздействии серотонина на его собственные 5-НТ2А рецепторы. Миртазонал, блокируя эти серотониновые рецепторы способствует активации дофаминовых нейронов. Это в свою очередь ведет к увеличению содержания в головном мозге дофамина. В результате подвергаются редукции симптомы, связанные с СДД.
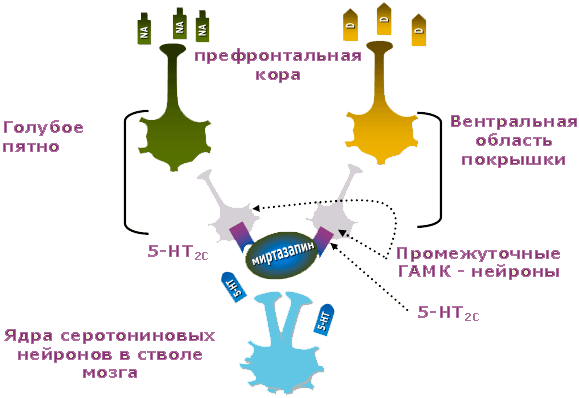
В многом сходное действие оказывает Миртазонал на серотониновые рецепторы типа 2С (5-НТ2С) (рисунок 3).
Рис. 3. Серотониновый, дофаминовый и норадреналиновый нейроны при депрессии: действие Миртазонала
Эти регуляторные рецепторы под действием серотонина способны затормозить ГАМКергические нейроны. Последние, в свою очередь, снижают активность норадреналиновых и дофаминовых нейронов. Миртазонал, блокируя серотониновые рецепторы типа 2С (5-НТ2С), напротив, растормаживает ГАМКергические нейроны. Те в свою очередь повышают активность норадреналиновых и дофаминовых нейронов. В результате в головном мозге растет уровень норадреналина и дофамина, а симптомы, свойственные СДН и СДД, редуцируются.
Кроме того, широкому использованию препарата могут препятствовать т.н. дополнительные фармакологические свойства Миртазонала. Имеется в виду способность препарата блокировать H1 гистаминовые, серотониновые рецепторы 3-го типа (5-НТ3). Это приводит к развитию седативного эффекта, улучшению сна, аппетита (блокада H1 гистаминовых рецепторов), а также выраженному противорвотному действию (блокада 5-НТ3 рецепторов) (10). Кроме того, по некоторым данным Миртазонал является частичным агонистом каппа 3 опиоидных рецепторов (9). Соответственно, предполагается, что антиноцицептивное (обезболивающее) действие препарата, весьма важное при лечении соматизированных депрессий, реализуется не только через нормализацию обмена норадреналина и серотонина, но и в результате воздействия на опиоидную систему. Казалось бы, все эти дополнительные фармакологические свойства могут быть только терапевтически желательными при лечении депрессий. Однако следует учитывать, что все указанные свойства, в отличие от первичных, развиваются достаточно быстро, уже в первые дни приема. В результате у практикующего психиатра вполне может сложиться впечатление, что Миртазонал наиболее востребован лишь при лечении тревожных и соматизированных депрессий, протекающих с нарушениями сна и аппетита. Между тем, такое использование свойств препарата будет чрезмерно узким. Соответственно, частота назначений Миртазонала может напрямую зависеть от информированности врачей относительно механизмов действия антидепрессантов.
Место эсциталопрама в лечении депрессивных и тревожных расстройств
Захарова К.В., Ахапкин Р.В.
За последние годы значительное число лекарственных препаратов, как различных, так и сходных по своей химической структуре и механизмам действия, было предложено для лечения депрессивных и тревожных расстройств. Вместе с тем селективные ингибиторы обратного захвата серотонина (СИОЗС), признанные в качестве стандарта тимоаналептической и анксиолитической терапии, сохраняют лидерство среди современных антидепрессантов по количеству назначений.
Эсциталопрам селективно ингибирует обратный захват серотонина, повышая концентрацию нейромедиатора в синаптической щели, усиливая и пролонгируя действие серотонина на постсинаптические рецепторы. При этом эсциталопрам является наиболее селективным из антидепрессантов класса СИОЗС, так как практически не связывается с серотониновыми (5–НТ), дофаминовыми (D–1 и D–2), α–адренергическими, гистаминовыми, м–холинорецепторами, а также бензодиазепиновыми и опиатными рецепторами [Owens M.J. с соавт., 2001]. Антидепрессивный эффект обычно развивается через 2–4 недели после начала лечения, а максимальный противотревожный терапевтический эффект достигается примерно через 3 месяца после начала лечения. Эсциталопрам не вызывает значимого подавления активности основных изоферментов семейства цитохромов Р 450 in vitro, в связи с чем маловероятно его вовлечение в клинически важные фармакокинетические лекарственные взаимодействия у пациентов [von Moltke L. с соавт., 2001]. Эсциталопраму присущ несколько иной, чем у других серотонинергических антидепрессантов, механизм действия: он взаимодействует не только с первичным местом связывания белка–транспортера серотонина, но и со вторичным (аллостерическим) местом, что приводит к более быстрой, мощной и стойкой блокаде обратного захвата серотонина за счет модулирующего влияния аллостерического связывания. Это позволило говорить об «аллостерической модуляции», усиливающей антидепрессивное действие, «двойном воздействии на серотонин» и выделении нового класса антидепрессантов – «аллостерических ингибиторов реаптейка серотонина» (АИРС) [Абрамова Л.И. с соавт., 2007]. Определенные экспериментальным путем особенности действия эсциталопрама, вероятно, лежат в основе его клинического преимущества по сравнению с большинством других современных антидепрессантов, которое становится более очевидным при терапии тяжелых депрессий.
Клиническая эффективность эсциталопрама в отношении депрессивных расстройств доказана множественными публикациями результатов клинических испытаний. Так, доля респондеров колебалась от 65,8 до 68%, причем это правомерно в отношении как молодых, так и пожилых пациентов [Бородин В.И. с соавт., 2005; Rash A., Bose A., 2005; Kasper с соавт., 2005; Sidney H. с соавт., 2006, 2009]. Данные исследования относились к депрессиям легкой и средней степени тяжести, также были получены данные и в отношении тяжелого депрессивного эпизода. Состояние ремиссии было достигнуто у 53,3% пациентов, а респонс – у 70%. Эсциталопрам оказывал мощное сбалансированное действие на все три компонента депрессивного состояния – тимический, тревожный и идеомоторную заторможенность [Абрамова Л.И. с соавт., 2007]. Эсциталопрам может рекомендоваться не только для купирования острой фазы депрессивного состояния, но и для длительного поддерживающего лечения и предупреждения рецидивов. Это также обусловлено его минимальным взаимодействием с другими лекарственными средствами, которые могут потребоваться для лечения сопутствующих соматических заболеваний [Rapaport M.H. с соавт., 2004].
Для сравнения эффективности и переносимости эсциталопрама и других антидепрессантов можно привести результаты обширного мета–анализа, оценивающего 12 антидепрессантов последнего поколения при терапии большого депрессивного эпизода. В анализ были включены 127 рандомизированных контролируемых исследований (25 928 пациентов), проведенных за период с 1991 по 2007 г. Сравнивались результаты терапии пациентов (возраст 18 лет и старше) в остром периоде униполярной большой депрессии. Анализировали результаты терапии ряда антидепрессантов в терапевтических дозах, таких как бупропион, циталопрам, дулоксетин, эсциталопрам, флуоксетин, флувоксамин, милнаципран, миртазапин, пароксетин, ребоксетин, сертралин и венлафаксин. При анализе использовался ITT–подход. Миртазапин, эсциталопрам, венлафаксин и сертралин были значительно более эффективными, чем дулоксетин (1,39; 1,33; 1,30 и 1,27 соответственно), а также чем флувоксамин (1,41; 1,35; 1,30 и 1,27 соответственно), пароксетин (1,35; 1,30; 1,27 и 1,22 соответственно) и ребоксетин (2,03, 1,95; 1,89 и 1,85 соответственно). Ребоксетин оказался значительно менее эффективным, чем все остальные исследованные антидепрессанты. Эсциталопрам и сертралин показали наилучший профиль переносимости, т.е. пациентам, получавшим эти препараты, реже отменяли терапию, чем больным, получавшим дулоксетин, флувоксамин, пароксетин, ребоксетин и венлафаксин. Наиболее важными с клинической точки зрения результатами является то, что эсциталопрам и сертралин, вероятнее всего, представляются препаратами первого выбора, с которых следует начинать лечение умеренной или тяжелой депрессии, поскольку их применение ассоциируется с максимально благоприятным соотношением между эффективностью и переносимостью [Cipriani A. с соавт., 2009].
В литературе также имеются данные, показывающие эффективность эсциталопрама и в лечении тревожных расстройств (панического расстройства, генерализованного тревожного расстройства и социальной фобии). Общая эффективность терапии эсциталапрамом при паническом расстройстве составила 81%. Частота панических атак уменьшилась у большинства пациентов, и у 63% из них наблюдалась полная редукция панических атак на 10–й неделе лечения. Анализ понедельной динамики антипанической эффективности эсциталопрама показал, что значимое снижение суммарной частоты панических атак по сравнению с фоновым показателем (5,2±0,7) происходило на 3–й неделе лечения (2,2±0,37 р Литература
1. Абрамова Л.И., Олейчик И.В., Иванец Н.Н., Кинкулькина М.А., Андреев Б.В., Макерова Е.А., Мухин А.А. // Ципралекс (эсциталоапрам) при лечении тяжелых эндогенных депрессий: особенности терапевтической эффективности и переносимости./ Психиатр. и психофрмакотер., 2007, том 09, №2, 48–53.
2. Бородин В.И, Канаева Л.С., Захарова К.В., Миронова Н.В.// Клиническая эффективность и переносимость препарата «Ципралекс» (эсциталопрам) при терапии легких и умеренно выраженных депрессий./ Психиатр. и психофрмакотер., 2005.–N 5.,287–291.
3. Воробьёва О.В., Шавловская О.А., Рябоконь И.В. Эффективность препарата Эсциталопрам (Ципралекс) в лечении панических атак. // MEDI.RU – Подробно о лекарствах. — 2009.
4. Колюцкая Е. В., Стась С. Ю. Эсциталопрам в терапии панического расстройства // MEDI.RU – Подробно о лекарствах. — 2009.
5. A. Cipriani, T. Furukawa, G. Salanti, J. Geddes, J. Higgins, R. Churchill, N. Watanabe, A. Nakagawa, I. Omori, H. McGuire // Comparative efficacy and acceptability of 12 new–generation antidepressants: a multiple–treatments meta–analysis./ The lancet, Volume 373, Issue 9665, Pages 746–758.
6. Jonathan R.T. Davidson M.D., Anjana Bose, Andrew Korotzer, Hongjie Zheng// Escitalopram in the treatment of generalized anxiety disorder: Double–blind, placebo controlled, flexible–dose study./ Depression and Anxiety, Volume 19, Issue 4, pages 234–240, 2004.
7. Kasper S., Stein D.J., Loft H., Nil R.// Escitalopram in the treatment of social anxiety disorder: randomised, placebo–controlled, flexible–dosage study./ British Journal of Psychiatry,2005, 186: 222–226.
8. Lisa L. von Moltke, David J. Greenblatt, Gina M. Giancarlo, Brian W. Granda, Jerold S. Harmatz, Richard I. Shader// Escitalopram (S–Citalopram) and Its Metabolites in Vitro: Cytochromes Mediating Biotransformation, Inhibitory Effects, and Comparison to R–Citalopram./Drag Metab Dispos, 2001;29:1102–9.
9. Owens M.J., Knight D.L., Nemeroff C.B.// Second–generation SSRIs: human monoamine transporter binding profile of escitalopram and R–fluoxetine./ Biol.Ps., 2001;50:345–50.
10. Rash A., Bose A.// Эсциталопрам в клинической практике (результаты открытого натуралистического исследования) (расширенный реферат). / Психиатр. и психофармакотер., 2005, том 07, № 6, 356–363.
11. Rapaport M.H., Bose A., Hongjie Z.//Escitalopram continuation treatment prevents relapse of depressive episodes./ J Clin Psych., 2004;65:44–49.
12. Sidney H. Kennedy, Henning F. Andersen, and Raymond W. Lam// Efficacy of escitalopram in the treatment of major depressive disorder compared with conventional selective serotonin reuptake inhibitors and venlafaxine XR: a meta–analysis./ J Psychiatry Neurosci. 2006 March; 31(2): 122–131.
Сравнение эффективности и переносимости 12 антидепрессантов нового поколения: результаты метаанализа
A.Cipriani, Toshiaki A.Furukawa, G.Salanti, J.Geddes, J.Higgins, R.Churchill, N.Watanabe, A.Nakagawa, Ichiro M.Omori, H.McGuire, M.Tansella, C.Barbui
Проведенные предыдущие традиционные метаанализы эффективности антидепрессантов II поколения показали противоречивые результаты. В данной работе авторы использовали метаанализ множественных препаратов, благодаря этому появилась возможность анализировать как результаты прямых сравнительных исследований, так и косвенные данные. Это позволило оценить эффективность и переносимость 12 антидепрессантов последнего поколения при терапии большой депрессии. В анализ были включены 127 рандомизированных контролируемых исследований (25 928 пациентов), проведенных за период с 1991 по 2007 г. Сравнивались результаты терапии пациентов (возраст 18 лет и старше) в остром периоде униполярной большой депрессии. Анализировали результаты терапии ряда антидепрессантов в терапевтических дозах, таких как бупропион, циталопрам, дулоксетин, эсциталопрам, флуоксетин, флувоксамин, милнаципран, миртазапин, пароксетин, ребоксетин, сертралин и венлафаксин. При анализе использовался ITT-подход.
Миртазапин, эсциталопрам, венлафаксин и сертралин были значительно более эффективными, чем дулоксетин (1,39; 1,33; 1,30 и 1,27 соответственно), а также чем флувоксамин (1,41; 1,35; 1,30 и 1,27 соответственно), пароксетин (1,35; 1,30; 1,27 и 1,22 соответственно) и ребоксетин (2,03; 1,95; 1,89 и 1,85 соответственно). Ребоксетин оказался значительно менее эффективным, чем все остальные исследованные антидепрессанты. Эсциталопрам и сертралин показали наилучший профиль переносимости, т.е. пациентам, получавшим эти препараты, реже отменяли терапию, чем больным, получавшим дулоксетин, флувоксамин, пароксетин, ребоксетин и венлафаксин. Выявлены важные клинические различия по параметрам эффективности и переносимости ряда антидепрессантов, говорящие в пользу большей эффективности и лучшей переносимости сертралина и эсциталопрама. В то же время сертралин имеет наиболее благоприятный баланс между клиническим эффектом, переносимостью и расходами на лечение и поэтому может быть рекомендован как препарат выбора для терапии умеренной или тяжелой большой депрессии у взрослых больных.
Введение
Прогресс в последние 20 лет привел к тому, что на фармацевтический рынок был внедрен ряд новых препаратов для лечения депрессии. Многие из этих лекарственных средств имеют сходную химическую структуру и обладают одинаковыми механизмами действия на предполагаемые мишени. Чем эти препараты отличаются один от другого в плане эффективности и безопасности, не всегда ясно. Аналогичная ситуация сложилась в кардиологии со статинами, не всегда очевидны преимущества того или иного препарата из этой подгруппы, используемой для профилактики заболеваний сосудов. Кроме того, некоторые из так называемых новых препаратов химически идентичны существующим с истекающими патентами и не являются новинками в плане своих терапевтических возможностей. Некоторые различия в эффективности антидепрессантов II поколения были подчеркнуты в проведенных систематических обзорах. В данной публикации представлен обзор всех рандомизированных контролируемых исследований эффективности и переносимости 12 антидепрессантов нового поколения в терапии большого депрессивного расстройства. В работе использовался метод метаанализа множественных препаратов, также известный как метод метаанализа смешанных схем лечения, или сетевой метаанализ. Метод позволяет интегрировать данные прямых сравнительных исследований (при сравнении препаратов в одном рандомизированном исследовании), а также проводить непрямые сравнения (если объединяются данные эффективности препаратов, полученные в разных исследованиях, и сопоставляются с эффективностью общепринятого препарата сравнения). Целью данного метаанализа столь большой группы препаратов являлось получение данных, которые служили бы подспорьем врачу при выборе конкретной терапевтической стратегии.
Методы
Отбор исследований и сбор данных
На начальном этапе данного проекта был создан рабочий вариант протокола исследования, который был выложен в открытый доступ на публичный веб-сайт. Кроме того, к моменту публикации данной статьи все данные также будут доступны для ознакомления. При проведении данного анализа учитывались только рандомизированные контролируемые исследования, в которых сравнивали любые из 12 антидепрессантов нового поколения (бупропион, циталопрам, дулоксетин, эсциталопрам, флуоксетин, флувоксамин, милнаципран, миртазапин, пароксетин, ребоксетин, сертралин и венлафаксин), использовавшиеся в виде монотерапии для купирования обострения у взрослых пациентов с униполярной большой депрессией. Из анализа исключали пациентов из плацебо-групп, а также рандомизированные в контролируемые исследования, проведенные у женщин с послеродовой депрессией. Поиск соответствующих исследований проводился по базе данных общества Cochrane в регистре контролируемых исследований депрессии, тревоги и неврозов (исследования и ссылки CCDANCTR), проведенных до 30 ноября 2007 г.
В фармацевтические компании, регуляторные органы и исследовательские центры были разосланы запросы для получения дополнительной информации. Исследования подвергались оценке на возможность потенциального включения в анализ. Оценку проводила команда из 2 человек, которые независимо друг от друга просматривали найденные ссылки и резюме, изучали полноту данных и качество проведения исследований. Для того чтобы унифицировать эту оценку, использовалась специальная структурированная форма. При необходимости получения дополнительной информации (в случае ее отсутствия в публикациях) осуществлялась связь с непосредственными исследователями. Качество проведенного исследования оценивалось по следующим градациям: адекватное, неясное или неадекватное (в соответствии с адекватностью проведения процедур рандомизации и «ослепления»). В анализ включались только исследования с оценкой «адекватное» и «неясное».
Для оценки эффективности и переносимости препарата считалась длительность терапии обострения, равная 8 нед. В случае если данные за 8 нед терапии отсутствовали, использовались результаты за период от 6 до 12 нед (предпочтение отдавалось длительности, предусмотренной оригинальным исследованием для оценки эффективности терапии). В качестве основного критерия эффективности использовали процент больных, достигнувших терапевтического ответа и прекративших прием препарата, и пациентов, выбывших из исследования. Оба показателя отражают эффективность и переносимость препарата, наиболее часто использующиеся для оценки результатов терапии острого периода. В данном исследовании терапевтический ответ определялся как доля пациентов, у которых через 8 нед отмечалось по крайней мере 50% снижение баллов по шкале депрессии Гамильтона (HDRS) или по шкале оценки депрессии Монтгомери-Асберга (MADRS), либо пациент должен был иметь оценку по шкале общего клинического впечатления (CGI): «значительное улучшение» или «очень значительное улучшение». В тех случаях, когда в исследованиях имелись данные по всем трем шкалам, для анализа использовались результаты по шкале HDRS. В качестве показателя, отражающего переносимость терапии, использовалась доля пациентов, преждевременно завершивших исследование, которая в данном анализе определялась как число больных, досрочно вышедших из исследования вне зависимости от причин в течение первых 8 нед лечения.
Выбор использовавшихся в данном метаанализе дихотомических параметров эффективности имеет под собой клинические причины. Число пациентов, как ответивших на терапию, так и выбывших из исследования, является четким показателем эффективности и переносимости лечения. Использование частоты терапевтического ответа вместо оценки динамики баллов симптоматики для анализа эффективности призвано облегчить интерпретацию результатов для клиницистов. В случае если среди данных исследований отсутствовали необходимые дихотомические показатели эффективности, однако указывались баллы и стандартные отклонения по шкалам оценки депрессии (например, HDRS или MADRS) на момент начала и завершения исследования, число пациентов, ответивших на лечение через 8 нед (в диапазоне от 6 до 12 нед), высчитывалось с помощью валидной методики. Число пациентов, ответивших на терапию, рассчитывалось на основе «пролеченной популяции пациентов» или общем числе рандомизированных пациентов независимо от того, как проводился анализ результатов в оригинальном исследовании. Для того чтобы анализ соответствовал клинической практике, использовался консервативный подход, т.е. в случае если на каких-либо участников исследования отсутствовали данные, то они вносились в анализ исходя из предположения, что у них не наступило терапевтического ответа.
Сначала был проведен метаанализ в парах на базе модели со случайными эффектами, в рамках которого производилось совмещение исследований, в которых сравнивались одни и те же препараты. Данный вид анализа позволял учесть предположение, согласно которому в разных исследованиях оценивались разные, но связанные друг с другом терапевтические эффекты. Статистическая гетерогенность данных и величина I2-статистики оценивались визуально по графикам. Анализ проводился с помощью программы «Stata 9». Затем с помощью программы «WinBUGS» (MRC Biostatistics Unit, Cambridge, UK) в рамках Байсовского анализа проводился анализ на модели случайных эффектов с использованием модели Маркова и методики Монте-Карло. Для каждой терапевтической группы каждого исследования были смоделированы бинарные результаты и вычислены соотношения рисков (OR) для исследований, проводивших разные сравнения. Подобный метод комбинирует как прямые, так и косвенные показатели для каждой изучаемой пары препаратов. Тест на достоверность учитывался при значении p