Митогенный эффект что это
Главная
Рецепторы для митогенов
Митогены — это вещества, которые могут вызвать клеточное деление, а в случае В-клеток стимулировать неспецифическим образом (т. е. независимо от связывания антигена) также и секрецию Ig. Некоторые митогены стимулируют как Т-, так и В-клетки, тогда как другие относительно специфичны только в отношении В-клеток. Последние называются поликлональными В-клеточными активаторами (ПВА). У человека стимуляция В-клеток с помощью ПВА, как правило, зависит от Т-клеток, так что непонятно, действуют ли эти вещества непосредственно на В-клетки. Мышиные В-клетки, по-видимому, отвечают на некоторые ПВА в отсутствие Т-клеток; поэтому принято считать, что такие ПВА действуют прямо на В-клетки и что В-клетки несут специфические рецепторы для каждого из них.
Поликлональные активаторы В-лимфоцитов
| Поликлональные β-клеточные активаторы | Источник |
| Липополисахарид (ЛПС) Липопротеин (ЛП) Водорастворимый митоген из Nocardia Полинуклеотиды, например полиинозин-полицитозин Очищенный белок туберкулина Декстран Декстран-сульфат Вирус Эпштейна-Барр Митоген из фитолакки | Грамотрицательные бактерии то же Nocardia Синтетический Микобактерия Синтетический » — Фитолакка |
Перечень некоторых ПВА приведен в таблице. Несмотря на наличие обширной литературы, посвященной биологическим эффектам ПВА, биохимическая природа рецепторов для ПВА до сих пор неизвестна.
Поскольку не все В-клетки способны отвечать на любой ПВА, чувствительность к тому или иному ПВА служит одним из отличительных признаков субпопуляции В- клеток. Например, у мышей приблизительно одна из трех В- клеток селезенки отвечает на ЛПС. Кроме того, в период онтогенеза чувствительность к различным ПВА появляется на разных стадиях. Хотя одна зрелая В-клетка может отвечать на несколько митогенов, Ветцель и Кеттман показали, что смесь двух ПВА, ЛПС и декстран-сульфата вызывает непосредственную стимуляцию каждой мышиной В-клетки. Следовательно, все В-клетки имеют рецепторы для ЛПС и (или) декстран- сульфата. Физиологическая роль ПВА неясна; тот факт, что целый ряд этих веществ выделяют из клеточных стенок бактерий, позволяет предположить, что поликлональный ответ может играть важную роль в защите хозяина от патогенных микроорганизмов.
Наиболее хорошо изученным ПВА является компонент бактериальной клеточной стенки — ЛПС, вызывающий несколько биологических эффектов. Химические и биологические свойства ЛПС подробно рассмотрены в обзоре Моррисона и Райана. Липополисахарид состоит из полисахаридного остова, к которому ковалентно присоединен липид, обладающий собственно биологической активностью и называемый липидом А. Следует отметить, что ЛПС часто содержит примесь липопротеинов, также представляющих собой ПВА. Действие липопротеина отличается от действия липидной части ЛПС. С целью идентификации предполагаемого «рецептора для ЛПС» были проведены исследования прямого связывания радиоактивно меченного ЛПС с клетками. По крайней мере в одном случае наблюдали предпочтительное взаимодействие ЛПС с В-клетками по сравнению с Т-клетками или тимоцитами. Однако в других опытах было продемонстрировано, что ЛПС столь же эффективно присоединяется и к Т-клеткам. Взаимодействие ЛПС с В-клетками в этих опытах представляло собой типичный случай неспецифического связывания, т.е. не достигалось насыщения и не наблюдалось конкурентного ингибирования с помощью ЛПС. Это и неудивительно, поскольку липидная часть ЛПС весьма липофильна и может встраиваться в искусственные мембраны. Таким образом, ЛПС, вероятно, связывается неспецифически с любой мембраной, а обнаруженная клеточная специфичность обусловлена, по-видимому, иными эффектами присоединенного митогена. Можно думать поэтому, что эксперименты по связыванию вряд ли дадут какую-либо ценную информацию о «рецепторах» для ЛПС, хотя подобный подход может быть успеш-ным в случае других ПВА. С этой точки зрения вызывают интерес данные о взаимодействии В-клеточного митогена polyl*polyC с отдельной субпопуляцией В-клеток.
Более убедительный довод в пользу существования специфического рецептора для ЛПС был получен при использовании мышей линии C3H/HeJ, клетки которых не отвечают на липидную часть ЛПС (но чувствительны к липо- протеину). Это наследуемый признак, и он кодируется единственным геном, локализованным в хромосоме 4. В остальных отношениях мыши линии C3H/HeJ совершенно нормальны, и их клетки отвечают на другие ПВА, что говорит о наличии какой-то генетически детерминированной «структуры», необходимой для проявления действия ЛПС. Должен ли такой структурой быть мембранный рецептор, не ясно, однако, согласно данным Форни и Кутиньо, В-клетки мышей C3H/HeJ, по-видимому, действительно, лишены мембранного рецептора для ЛПС. В опытах упомянутых авторов кроликов иммунизировали клетками селезенки мышей линии СЗН/Tif (которые нормально отвечают на ЛПС), а затем полученную антисыворотку адсорбировали с помощью клеток C3H/HeJ. Поскольку единственным различием между двумя линиями мышей является способность их клеток отвечать на ЛПС, адсорбированная антисыворотка должна была узнавать только продукт предполагаемого «гена ответа на ЛПС». Она и на самом деле обладала свойствами, ожидаемыми для антител против рецептора для ЛПС.
Было описано несколько других антител, обладающих митогенной активностью по отношению к В-клеткам. В частности, у мышей В-клеточными митогенами оказались антитела против вируса лейкемии Френд, причем их действие могло быть блокировано с помощью анти-gp 70. Это означает, что один из вирусных белков, вероятно, функционирует в качестве рецептора ПВА. Некоторые миеломные белки, включая антиидиотипические и антигаптенные, также представляют собой ПВА. Пока не понятно, обусловлена ли митогенная активность этих белков их антигенной специфичностью или же она определяется какими-то иными свойствами. То, что sIg сами по себе могут быть рецепторами для ПВА, подтверждается наличием митогенных свойств у анти- Ig-антител, хотя в данном случае анти-^-антитела, стимулирующие сшивку sIg, вероятно, просто имитируют эффект антигена.
Следует привести еще два соображения. Во-первых, очевидно, что продукты Т-клеток могут индуцировать пролиферацию В-клеток и секрецию ими Ig. Во-вторых, Моллер и др. считают, что все TI-антигены, независимо от их структуры, являются ПВА по определению и, следовательно, должны существовать ПВА-рецепторы для каждого TI-антигена. Прямых данных в пользу существования таких ПВА-рецепторов практически нет, и вывод об их наличии основан исключительно на особенностях биологической активности ТI-антигенов.
СОДЕРЖАНИЕ
Клеточный цикл
Эндогенные митогены
Отношение к раку
Митогены важны в исследованиях рака из-за их влияния на клеточный цикл. Рак частично определяется отсутствием или нарушением контроля клеточного цикла. Обычно это комбинация двух аномалий: во-первых, раковые клетки теряют зависимость от митогенов. Во-вторых, раковые клетки устойчивы к антимитогенам.
Независимость от митогенов
Вместо того, чтобы требовать эндогенных или внешних митогенов для продолжения клеточного цикла, раковые клетки могут расти, выживать и размножаться без митогенов. Раковые клетки могут потерять свою зависимость от внешних митогенов различными путями.
В-третьих, нижестоящие эффекторы митогенной передачи сигналов часто мутируют в раковых клетках. Важным митогенным сигнальным путем у человека является путь Ras-Raf-MAPK. Митогенная передача сигналов обычно активирует Ras, GTPase, которая затем активирует остальную часть пути MAPK, в конечном итоге экспрессируя белки, которые стимулируют развитие клеточного цикла. Вероятно, что большинство, если не все, раковые образования имеют мутации в пути Ras-Raf-MAPK, чаще всего в Ras. Эти мутации позволяют конститутивно активировать этот путь независимо от присутствия митогенов.
Устойчивость к антимитогенам
Клеточная пролиферация часто регулируется не только внешними митогенами, но и антимитогенами, которые ингибируют прохождение клеточного цикла за пределы G1. В нормальных клетках антимитогенная передача сигналов в результате повреждения ДНК препятствует репликации и делению клеток. Опухолевые клетки, устойчивые к антимитогенам, позволяют клеточному циклу продвигаться вперед, когда это необходимо предотвратить с помощью какого-либо антимитогенного механизма. Эта устойчивость к антимитогенам может возникать просто из-за чрезмерной стимуляции положительными митогенами. В других случаях опухолевые клетки обладают мутациями потери функции в некоторой части антимитогенного пути. Например, рассмотрим хорошо известный антимитоген, трансформирующий фактор роста (TGF-). TGF-работает путем связывания с рецепторами клеточной поверхности и активации регуляторных белков гена Smad. Затем белки Smad вызывают повышение уровня p15, который ингибирует циклин D1 и предотвращает развитие клеточного цикла. Во многих случаях рака происходит мутация потери функции в белках Smad, что сводит на нет весь антимитогенный путь.
Требуются множественные мутации
Для распространения рака требуется не одна, а несколько митогенных мутаций. Как правило, множественные мутации в различных подсистемах (онкогене и гене-супрессоре опухоли) являются наиболее эффективными при возникновении рака. Например, мутация, которая гиперактивирует онкоген Ras, а другая, инактивирующая опухолевый супрессор pRb, является гораздо более канцерогенным, чем любой из этих белков по отдельности. Опухолевые клетки также устойчивы к реакции на стресс гиперпролиферации. Нормальные клетки имеют апоптотические белки, которые реагируют на чрезмерную стимуляцию митогенных сигнальных путей, вызывая гибель или старение клеток. Это обычно предотвращает возникновение рака из-за единственной онкогенной мутации. В опухолевых клетках обычно имеется другая мутация, которая также ингибирует апоптотические белки, подавляя реакцию гиперпролиферации на стресс.
Использование в иммунологии
Другое использование
Роль инсулинорезистентности в развитии сахарного диабета и других состояний. Современные возможности коррекции
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Нарушению периферических эффектов инсулина — инсулинорезистентности (ИР) отводится важнейшая роль в развитии многих метаболических заболеваний, из которых наиболее значимыми традиционно являются сахарный диабет (СД) 2 типа и атеросклеротические дислипидемии, ассоциированные с развитием сердечно-сосудистых заболеваний (ССЗ). На рубеже 1990–2000-х гг. широко распространилось понятие метаболического синдрома. Сегодня считается, что говорить о метаболическом синдроме некорректно в связи с недостаточной доказательной базой, однако патофизиологическая роль ИР, механизмы ее развития и пути преодоления по-прежнему в фокусе научного интереса.
Снижение чувствительности рецепторов к инсулину ухудшает его эффекты, запуская порочный круг нарушений, включающих компенсаторную гиперсекрецию инсулина, дисфункцию β-клеток поджелудочной железы, ухудшение утилизации глюкозы тканями, метаболические и гемодинамические нарушения, последующее усиление ИР, органные повреждения и ССЗ. Ранняя терапия, направленная на улучшение чувствительности к инсулину, восстановление его эффектов, могла бы стать одним из эффективных методов первичной профилактики СД 2 типа и ССЗ. В статье рассмотрены механизмы формирования резистентности к инсулину, а также эндотелиальной дисфункции в условиях ИР, приводящие к кардиоваскулярным осложнениям, и новый подход к коррекции этих нарушений.
Ключевые слова: инсулинорезистентность, эндотелиальная дисфункция, сахарный диабет, гипогликемические средства в комбинациях.
Для цитирования: Демидова Т.Ю., Зенина С.Г. Роль инсулинорезистентности в развитии сахарного диабета и других состояний. Современные возможности коррекции. РМЖ. Медицинское обозрение. 2019;3(10(II)):116-122.
T.Yu. Demidova, S.G. Zenina
Pirogov Russian National Research Medical University, Moscow
Insulin resistance has long been considered to play a major role in the development of many metabolic disorders including type 2 diabetes and atherosclerotic dyslipidemia associated with cardiovascular disorders. In the late 1990s and early 2000s, the conception of metabolic syndrome has become popular, scientific societies have developed and applied its definitions. However, it is generally accepted now that the evidence base for metabolic syndrome is poor. Nevertheless, current researches still focus on the pathogenic role of insulin resistance, mecha-nisms of its development, and ways to improve insulin sensitivity.
Insulin resistance is of crucial importance for the development of obesity and type 2 diabetes. Reduced sensitivity of receptors to insulin impairs its effects and triggers a vicious circle of disturbances which involves compensatory oversecretion of insulin, pancreatic β-cell dysfunction, impaired tissue utilization of glucose, metabolic and hemodynamic disturbances, increased insulin resistance, organ damage, and cardiovascular disorders. Early treatment aimed to improve insulin sensitivity and recover its effects could become an effective primary prevention of type 2 diabetes and cardiovascular disorders. This paper discusses the mechanisms of the development of insulin resistance and endothelial dysfunction resulting in cardiovascular complications and a novel approach to overcome them.
Keywords: insulin resistance, endothelial dysfunction, diabetes, combinations of hypoglycemic agents.
For citation: Demidova T.Yu., Zenina S.G. Insulin resistance and its role in the development of diabetes and other conditions. Current modalities to improve insulin sensitivity. RMJ. Medical Review. 2019;10(II):116–122.
В статье рассмотрены механизмы формирования резистентности к инсулину, а также эндотелиальной дисфункции в условиях инсулинорезистентности, приводящие к кардиоваскулярным осложнениям, и новый подход к коррекции этих нарушений.
Введение
По данным Международной диабетической федерации, в 2017 г. количество больных сахарным диабетом (СД) в мире составляло 412 млн. К 2040 г. ожидается увеличение этого числа до 642 млн, что близко к численности населения Европы [1]. Судя по темпам роста числа больных и распространенности заболевания, СД 2 типа можно с полной уверенностью рассматривать как неинфекционную пандемию XXI века. Согласно современному определению, СД 2 типа — заболевание, которое развивается в силу либо преимущественной инсулинорезистентности (ИР) и относительной инсулиновой недостаточности, либо преимущественного нарушения секреции инсулина с ИР и проявляется нарушением углеводного обмена. Однако ИР чаще всего представляет собой наиболее ранний дефект, формирующийся еще на этапе избыточного веса и ожирения, которые у 90% больных сопутствуют СД 2 типа.
ИР — это нарушение биологического ответа на воздействие эндогенного или экзогенного инсулина тканей-мишеней — преимущественно печени, адипоцитов и скелетных мышц. К основным биологическим эффектам инсулина относят регуляцию всех видов метаболизма (углеводного, жирового, белкового) и митогенных процессов (роста, дифференцировки тканей, синтеза ДНК, транскрипции генов). ИР может развиваться в различных органах и тканях, вызывая глюкозотоксичность и повышая риск сосудистых заболеваний опосредованно, через повышение уровня липопротеинов очень низкой плотности и триглицеридов, стимулируя ускорение процессов гликозилирования белков и липидов (рис. 1) [2]. Инсулин также участвует в регуляции функций органов и тканей, которые не являются инсулинозависимыми, например эндотелия и сосудистой стенки. При гиперинсулинемии и ИР метаболические пути, регулируемые инсулином, и даже необязательно связанные с глюкозой, избыточно активируются. Например, в почках инсулин стимулирует повышенную реабсорбцию натрия. Системная гиперинсулинемия приводит к избыточной реабсорбции натрия, что способствует увеличению внутрисосудистого объема и повышению артериального давления. В яичниках клетки имеют рецепторы к инсулину, которые реагируют на минимальные изменения базальной концентрации инсулина. В условиях гиперинсулинемии эти рецепторы индуцируют выработку андрогенов, что приводит к гиперандрогении, клинически проявляющейся в гирсутизме, олигоменорее и поликистозности яичников. В печени, в то время как повышенная концентрация инсулина способствует глюконеогенезу, печеночные инсулинчувствительные механизмы липогенеза, не обладая резистентностью, гиперактивируются, что приводит к увеличению плотности липопротеидов. При ИР развивается дислипидемия — высокий уровень триглицеридов и липопротеинов низкой плотности и низкий уровень липопротеинов высокой плотности. Таким образом, нарушение активности инсулина способствует развитию атеросклероза.
При ИР под действием свободных жирных кислот (СЖК) повреждаются кардиомиоциты, что приводит к гипертрофии и ригидности сердечной мышцы (кардиомиопатия). В итоге повышается диастолическое давление, уменьшается ударный объем, нарушается диастолическое расслабление.
Таким образом, множественные проявления синдрома ИР являются результатом реакции на повышенные концентрации инсулина, которые индуцируются для поддержания нормального метаболизма глюкозы. ИР стоит рассматривать в совокупности с ожирением, нарушениями углеводного обмена, эндотелиальной дисфункцией, атеросклерозом, синдромом поликистозных яичников, липодистрофией, почечной и сердечной недостаточностью, поскольку все эти процессы патогенетически связаны. Поэтому современное понятие ИР не сводится к параметрам, характеризующим только метаболизм углеводов, а включает также изменения метаболизма жиров, белков, функции клеток эндотелия, экспрессии генов и др.
Эффекты инсулина в тканях-мишенях
Инсулин прямо или косвенно влияет на функцию практически всех тканей организма, вызывая большое разнообразие биологических реакций. Его метаболическое действие на печень, мышцы и жировую ткань является предметом глобальных исследований, поскольку эти ткани отвечают за обмен веществ в организме и запас энергии, а также выполняют важные функции в развитии резистентности к инсулину, ожирения и СД 2 типа. Инсулин является основным гормоном, ответственным за поступление, использование и хранение питательных веществ в клетках. Он влияет на углеводный обмен (увеличивает утилизацию глюкозы мышечной и жировой тканями, увеличивает синтез гликогена печенью и мышцами, повышает фосфорилирование глюкозы, уменьшает глюконеогенез и гликогенолиз), жировой обмен (повышает липогенез, увеличивает синтез жирных кислот, уменьшает липолиз), белковый обмен (увеличивает поглощение аминокислот, синтез белка и синтез нуклеиновых кислот) [3, 4]. Таким образом, основное действие инсулина на ткани — это активация процессов анаболизма и, соответственно, подавление процессов катаболизма.
В эндотелии инсулин выполняет специфические функции, в частности регулирует экспрессию молекул клеточной адгезии VCAM-1, VEGF, эндотелина-1, гемооксигеназы-1 [5]. Но одно из наиболее важных действий заключается в том, что этот гормон увеличивает экспрессию и активацию эндотелиального фермента синтазы оксида азота (eNOS), которая приводит к образованию оксида азота (NO) в эндотелии сосудов. NO в эндотелии диффундирует как в просвет, так и в клетки гладких мышц сосудов, где активирует фермент гуанилатциклазу и вызывает расслабление сосудов. Таким образом, усиление кровотока за счет действия инсулина вызывает увеличение использования глюкозы в тканях-мишенях [6].
Эндотелий может также регулировать транспорт инсулина в периферические ткани, в частности в скелетные мышцы, жировую ткань, центральную нервную систему и др. Инсулин может оказывать защитное (антиатерогенное) или повреждающее (проатерогенное) действие в зависимости от уровня и его активации различными чувствительными к инсулину путями [7].
Митогенный эффект инсулина реализуется через взаимодействие как с собственными рецепторами, так и с рецепторами инсулиноподобных факторов (ИФР). Митогенное действие инсулина заключается в активации пренил-трансфераз, в увеличении фарнезилированного белка р21RAS, экcпрессирующего онкоген ras, RHO, Rab и, как следствие, в увеличении клеточного ответа на ИФР-1, эпидермального фактора роста, фактора роста тромбоцитов, способности мутированного белка р21RAS инициировать клеточную пролиферацию и превращать нормальные клетки в злокачественные. Это приводит к накоплению молекулярных повреждений, развитию ожирения и атеросклероза, увеличению риска развития онкологии, старению организма в целом [8].
Инсулин может оказывать и нормализующее влияние на митогенез. Способствуя высвобождению ИФР-1 и многих других факторов роста и цитокинов, он стимулирует мобилизацию эндотелиальных прогениторных клеток (ЭПГ) из костного мозга или тканевых депо. ЭПГ обеспечивают регенерацию поврежденных или старых сосудов. Но в условиях длительной гиперинсулинемии, обусловленной ИР, количество ЭПГ снижается и репаративные процессы в поврежденном эндотелии протекают неполноценно, еще более усугубляя хронические дегенеративные состояния [9].
Молекулярные механизмы действия инсулина и формирования ИР
Инсулин представляет собой пептид из 51 аминокислоты, который вырабатывается и секретируется β-клетками островков поджелудочной железы. Его биологическое действие начинается, когда он связывается со своим рецептором, интегральным мембранным гликопротеином, который образован двумя α-субъединицами и двумя β-субъединицами. Субъединица α является полностью внеклеточной и связывается с внеклеточной областью β-субъединицы, а также с другой α-субъединицей через дисульфидные мостики. Каждая β-субъединица состоит из внеклеточного домена, трансмембранного домена и внутриклеточного домена тирозинкиназы, который активируется аутофосфорилированием [10].
Рецептор инсулина относится к семейству рецепторов с внутренней тирозинкиназной активностью. Связывание инсулина с α-субъединицей рецептора вызывает конформационные изменения, которые потенцируют его каталитическую активацию и аутофосфорилирование нескольких остатков тирозинкиназы, расположенных в цитозольной области β-субъединицы. Аутофосфорилированные остатки потом распознаются различными адаптерными белками, из которых IRS-1 и IRS-2 (члены семейства субстратов инсулина) являются двумя основными видами и наиболее распространенными посредниками на начальной стадии передачи сигнала инсулина. IRS действует как адаптерная молекула, которая организует образование молекулярных комплексов и запускает внутриклеточные сигнальные каскады [11].
Нарушение чувствительности к инсулину может развиваться на трех уровнях — дорецепторном, рецепторном и пострецепторном.
На дорецепторном уровне ИР обусловливает патологические изменения инсулина, секрецию клетками поджелудочной железы проинсулина вместо инсулина, блокаду нормального взаимодействия гормона со своим рецептором на поверхности клеток (например, при хронической почечной недостаточности). ИР, развивающаяся на дорецепторном уровне, часто бывает обусловлена мутациями кодирующего гена.
Рецепторный уровень ИР обусловлен уменьшением числа рецепторов на поверхности клетки или снижением их сродства к инсулину.
Но в большинстве случаев ИР бывает вызвана дефектами передачи инсулинового сигнала на пострецепторном уровне, эти дефекты обусловлены структурно-функциональными нарушениями со стороны белков, вовлеченных в детерминацию сигнальных процессов.
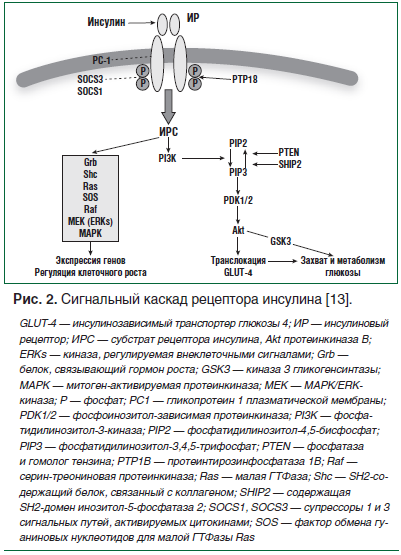
Основные метаболические эффекты инсулина, в т. ч. его стимулирующее влияние на поглощение глюкозы клетками-мишенями, реализуются при помощи сигнального пути фосфатидилинозитол-3-киназы (PI3K) и протеинкиназы В (Akt). Под действием PI3K из фосфатидилинозитол-4,5-бисфосфата (PIP2) образуется вторичный мессенджер — фосфатидилинозитол-3,4,5-трифосфат (PIP3), ответственный за последующую активацию PI3K/Akt пути. Влияние инсулина на захват глюкозы периферическими тканями через активацию PI3K/Akt пути осуществляется путем транслокации глюкозного транспортера GLUT-4 из цитозоля в плазматическую мембрану и дальнейшего трансмембранного переноса глюкозы в клетку. IRS-1 соединяется с PI3К и активирует ее, в результате чего происходит фосфорилирование и активация eNOS. В исследованиях блокаторы PI3К и Akt уменьшают инсулинстимулированную продукцию NO [12].
Атерогенные свойства инсулина связаны с его стимуляцией другой сигнальной системы — митогенактивированной протеинкиназы (МАРК). В результате активации этого пути происходит рост и пролиферация эндотелиальных клеток, усиливаются миграция в интиму, пролиферация гладкомышечных клеток и продукция коллагена, что способствует ускорению атеросклероза (рис. 2).
При ожирении, которое сопровождает СД 2 типа, адипоцитами синтезируется избыточное количество провоспалительных цитокинов (интерлейкина-6, фактора некроза опухоли), что приводит к хроническому воспалительному процессу, в результате которого нарушается путь передачи инсулинового сигнала и повреждаются функции митохондрий, тем самым нарушается гомеостаз глюкозы. При ожирении в кровоток поступает избыток СЖК. В результате их накопления и метаболизма в миоцитах образуются метаболиты: церамиды, диаглицерол или ацил-КоА, что ведет к нарушению передачи сигнала инсулина, и происходит селективное угнетение PI3К-сигнального пути, в то время как МАРК-сигнальный путь усиливается. Это обусловливает проатерогенный эффект инсулина в условиях ИР, который реализуется через ремоделирование стенки сосуда и способствует развитию сосудистых осложнений [14].
ИР и эндотелиальная дисфункция
Для эндотелия характерна базальная выработка вазодилататора — NO, образующегося из L-аргинина с участием eNOS. NO обладает антиатерогенными, антиоксидантными свойствами, регулирует многие функции эндотелия и является чувствительным индикатором повреждения [15]. При ИР страдают важнейшие функции эндотелия — усиливается выработка вазоконстрикторов и снижается синтез вазодилататоров, что приводит в конечном итоге к спазму артериальных сосудов и росту артериального давления. Причинами эндотелиальной дисфункции могут быть различные факторы, в т. ч. ИР, гипергликемия, гиперлипидемия, действие цитокинов, свободнорадикальное повреждение при накоплении продуктов перекисного окисления липидов. При ИР NO утрачивает свои антигипертензивные, антисклеротические и антитромботические защитные свойства.
Индуцированное СЖК нарушение работы PI3К-пути приводит к блокированию активности eNOS по аминокислотному остатку серина, понижению продукции NO, эндотелиальной дисфункции и сосудистому ремоделированию (утолщению комплекса интима-медиа). Это является важным предиктором сердечно-сосудистой патологии (рис. 3) [16]. Хроническая ИР стимулирует продукцию инсулина поджелудочной железой, способствуя прогрессированию дисфункции β-клеток, снижению уровня инсулина и повышению уровня глюкозы плазмы. Гипергликемия сокращает способность эндотелия к синтезу NO и влияет на функционирование сосудов через целый ряд механизмов, главным образом через гиперпродукцию активных форм кислорода (АФК) (см. рис. 3) [16]. Одна из первых мишеней гипергликемии — дыхательная цепь митохондрий, в которой происходит выработка избыточного количества супероксид-аниона (О2 – ). Дальнейшее повышение АФК и индуцируемой ими протеинкиназы С замыкает этот порочный круг. Активация протеинкиназы С глюкозой ведет к снижению выработки NO (см. рис. 3). Митохондриальные АФК далее активируют сигнальные каскады, вовлеченные в патогенез сердечно-сосудистых осложнений, включая поток полиолов, образование продуктов гликозилирования и рецепторов к ним, протеинкиназу С и гексозаминовый путь (см. рис. 3).
ИР и эндотелиальная дисфункция — это тесно ассоциированные состояния, приводящие к метаболическим и кардиоваскулярным заболеваниям. Прогрессирование ИР при СД идет параллельно с прогрессированием эндотелиальной дисфункции до атеросклероза.
ИР как основное патогенетическое звено в развитии СД 2 типа
Стоит ли рассматривать ИР в качестве обязательного патогенетического компонента при СД 2 типа, остается предметом большого научного интереса.
ИР встречается, кроме СД, при многих других заболеваниях и физиологических состояниях [17]:
физиологическая ИР (как следствие повышения секреции соматотропного гормона в пубертатном возрасте, при беременности, при богатой жирами диете, во время ночного сна);
метаболическая ИР (СД 2 типа, ожирение, декомпенсация СД 1 типа, избыточный прием алкоголя, инфекция, стресс);
эндокринная ИР (тиреотоксикоз, гипотиреоз, синдром Кушинга, акромегалия, синдром поликистозных яичников, феохромоцитома);
неэндокринная ИР (эссенциальная артериальная гипертензия, цирроз печени, ревматоидный артрит, травма, ожоги, сепсис, хирургические вмешательства).
Очевидно, что различные внешнесредовые факторы могут ускорять развитие ИР, например возраст, избыточная масса тела и висцеральное ожирение, избыток насыщенных жиров (СЖК) и легкоусвояемых углеводов в питании, физическая гиподинамия и саркопения, курение, прием некоторых лекарственных препаратов (бета-адреноблокаторы, глюкокортикостероиды, диуретики тиазидового ряда) и др.
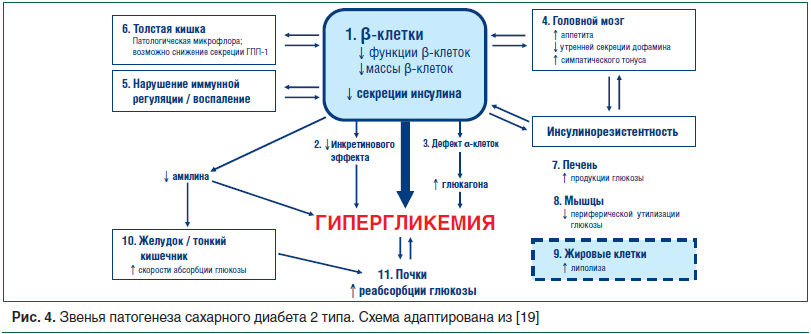
Имеется много подтверждений того, что роль ИР в развитии СД 2 типа остается ведущей у подавляющего числа пациентов и, по-видимому, нуждается в обязательной коррекции на любом этапе. Согласно современному представлению о патогенезе СД не менее
3 звеньев из 11 непосредственно связаны с ИР: нарушение утилизации глюкозы мышечной и жировой тканью, а также повышенная продукция глюкозы в печени
(рис. 4), что обеспечивает стойкое повышение уровней глюкозы крови в течение суток. Вместе с тем ИР ассоциирована с усиленным липолизом висцеральных адипоцитов, перегрузкой портальной системы СЖК и формированием локального воспаления в висцеральном жировом депо. Во многом из-за ИР формируются специфические для СД атерогенные сдвиги в липидном спектре, жировая инфильтрация печени, переключение на жировые источники энергообеспечения вместо углеводных, что нефизиологично в нормальной ситуации. Компенсаторная гиперинсулинемия со временем начинает снижаться, β-клеточная секреция постепенно истощается, диктуя потребность в многокомпонентной противодиабетической терапии, включая введение инсулина. В силу многочисленных патологических процессов, среди которых ИР играет не последнюю роль, при СД возрастает гиперглюкагонемия за счет гиперактивности панкреатических α-клеток. Повышается уровень провоспалительных цитокинов и интерлейкинов, что также ассоциируется с тканевой ИР и прогрессирующей гипергликемией. Высока вероятность того, что эндотелиальная дисфункция и изменения проницаемости сосудистых капилляров влияют на действие периферического инсулина [18].
Следует помнить, что прогрессирующая хроническая гипергликемия в силу феномена глюкозотоксичности усугубляет ИР и потерю чувствительности β-клеток к глюкозному стимулу, способствует образованию и накоплению конечных продуктов гликирования, усиливает провоспалительные процессы, замыкая порочный круг метаболических и органных нарушений.
Новый подход к коррекции ИР и эндотелиальной дисфункции
Важнейшая роль, которую играет ИР в развитии различных заболеваний, обусловливает необходимость коррекции данного состояния. Известно, что эффективным методом уменьшения ИР является коррекция массы тела, модификация питания и регулярная аэробная физическая активность. При снижении веса уменьшается масса висцеральных адипоцитов, нормализуются обменные процессы, включая уровни гликемии, липидов, СЖК, а также восстанавливается тирозинкиназная активность инсулиновых рецепторов. По-видимому, дефект тирозинкиназной активности развивается на фоне гипергликемии, нарушения внутриклеточного метаболизма глюкозы и гиперинсулинемии, которые регрессируют на фоне снижения веса.
Однако снизить массу тела и удержать полученный результат удается ничтожно малому количеству пациентов. Немедикаментозные подходы признаются самыми трудно выполнимыми и характеризуются низкой «выживаемостью» достигнутых результатов. Нарушения пищевого поведения, вредные алиментарные привычки, гиподинамия, стрессы, психологические проблемы остаются мощными классическими барьерами на пути такого метода коррекции. У пациентов с СД есть множество дополнительных проблем, связанных с гиперинсулинемической картиной, приемом сахароснижающих препаратов с высокими рисками гипогликемий, которые диктуют высокую потребность в медикаментозной поддержке на всех этапах лечения. Среди большого портфеля противодиабетической терапии лишь 2 класса препаратов непосредственно влияют на чувствительность тканей к инсулину — это бигуаниды и тиазолидиндионы.
Метформин, единственный представитель группы бигуанидов, остается самым часто используемым и признанным веществом для коррекции ИР, особенно у людей с СД и предиабетом. Метформин улучшает чувствительность тканей к инсулину за счет усиления инсулинстимулированного фосфорилирования тирозина инсулиновых рецепторов, увеличения их количества на мембранах клеток, повышения активности PI3К, а также уменьшения экспрессии ферментов глюконеогенеза и симпатической активности. Он устраняет ИР (преимущественно в печени), что проявляется снижением процессов гликогенолиза и глюконеогенеза. Он в меньшей степени влияет на ИР в мышечной и жировой ткани, поэтому не всегда достаточно эффективен даже в максимальной дозировке. Кроме того, желудочно-кишечные расстройства, часто вызываемые метформином, становятся причиной его отмены. При длительном применении метформина может развиться дефицит витамина В12. Противопоказаниями к его первичному назначению являются почечная (СКФ Литература
Только для зарегистрированных пользователей