Митохондриальная дисфункция у детей что это
Митохондриальные заболевания
Митохондриальные заболевания (МЗ) — группа наследственных заболеваний, связанных с дефектами в функционировании митохондрий, приводящими к нарушениям энергетических функций в клетках.
Историческая справка:
Понятие «митохондриальные болезни» сформировалось в медицине в конце ХХ века. В первую очередь были изучены болезни, связанные с мутациями митохондриальной ДНК, открытой в начале 60-ых годов. Полная первичная структура митохондриальной ДНК человека была опубликована в 1981 го¬ду и уже в конце 80-ых годов была доказана ведущая роль ее мутаций в развитии ряда наследственных заболеваний. К последним относятся: наследственная атрофия зрительных нервов Лебера, синдром NARP (нейропатия, атаксия, пигментный ретинит), синдром MERRF (миоклонусэпилепсия с «рваными» красными волокнами в скелетных мышцах), синдром MELAS (митохондриальная энцефаломиопатия, лактат-ацидоз, инсультоподобные эпизоды), синдром Кернса-Сейра (пигментный ретинит, наружная офтальмоплегия, блокада сердца, птоз, мозжечковый синдром), синдром Пирсона (поражение костного мозга, панкреатическая и печеночная дисфункции) и многие другие.
В меньшей степени изучены наследственные митохондриальные дефекты, связанные с повреждением ядерного генома.
Патогенез.
Митохондрии отвечают за выработку большей части энергии, необходимой для функционирования клеток. Фактически они являются настолько важным источником энергии, что в каждой клетке их сотни. При МЗ могут «выключиться» как часть митохондрий, так и все они, что приводит к прекращению выработки необходимой энергии
Поскольку наиболее энергоемкими являются нервные и мышечные клетки, при МЗ наиболее распространены мышечные и неврологические проблемы, такие, как мышечная слабость, непереносимость физических нагрузок, потеря слуха, нарушения баланса и координации, эпиприступы.
Когда клетка заполнена дефектными митохондриями, она не только лишена АТФ, но в ней могут накапливаться неиспользуемые молекулы топлива и кислород, что приводит к катастрофическим последствиям. В этом случае избыточные молекулы топлива используются для синтеза АТФ неэффективно, в результате чего могут образовываться потенциально опасные продукты, такие, как молочная кислота (Это также происходит, когда клетки испытывают недостаток кислорода, например – мышечные клетки при усиленных физических нагрузках). Накопление молочной кислоты в крови – лактатацидоз – ассоциировано с мышечной усталостью, и может вызывать повреждение нервной и мышечной тканей.
При этом неиспользуемый в клетке кислород может трансформироваться в разрушительные соединения, именуемые реактивными формами кислорода, включая т. н. свободные радикалы (Они являются мишенью для т. н. антиоксидантных препаратов и витаминов).
Синтезированная в митохондриях АТФ – основной источник энергии для сокращения мышечных и возбуждения нервных клеток (т. к. клетки этих тканей наиболее метаболически активны, энергетически зависимы). Таким образом, нервные и мышечные клетки особенно чувствительны к дефектам митохондрий. Комбинированный эффект от потери энергии и накопления токсинов в этих клетках, надо полагать, и вызывает развитие симптомов митохондриальных миопатий и энцефаломиопатий
Клиника
Характерные признаки митохондриальных цитопатий:
•скелетные мышцы: низкая толерантность к физической нагрузке, гипотония, проксимальная миопатия, включающая фациальные и фарингеальные мышцы, офтальмопарез, птоз
•сердце: нарушения сердечного ритма, гипертрофическая миокардиопатия
•центральная нервная система: атрофия зрительного нерва, пигментная ретинопатия, миоклонус, деменция, инсультоподобные эпизоды, расстройства психики
•периферическая нервная система: аксональная нейропатия, нарушения двигательной функции гастроинтестинального тракта
•эндокринная система: диабет, гипопаратиреоидизм, нарушение экзокринной функции панкреас, низкий рост
Таким образом, типичны для митохондриальных заболеваний вовлеченность разных органов и одновременное проявление внешне не связанных между собой аномалий. Примерами служат:
1. Мигрени с мышечной слабостью
2. Наружная офтальмоплегия с нарушением проводимости сердечной мышцы и мозжечковой атаксией
3. Тошнота, рвота с оптической атрофией и кардиомиопатией
4. Низкорослость с миопатией и инсультоподобным и эпизодами
5. Экзокринная дисфункция поджелудочной железы с сидеробластной анемией
6. Энцефало- миопатия с диабетом
7. Диабет с глухотой
8. Глухота с наружной офтальмоплегией, птозом и ретинопатией
9. Задержка развития или потеря навыков и офтальмоплегия, офтальмопарез
Характер и тяжесть клинических проявлений митохондриальных болезней определяется:
• тяжестью мутации мтДНК;
• процентным содержанием мутантной мтДНК в конкретных органах и тканях;
• энергетической потребностью и функциональным резервом органов и тканей, содержащих мтДНК (их “порогом чувствительности” к дефектам окислительного фосфори лирования).
Миопатия
Основные симптомы митохондриальной миопатии – истощение мышц и их слабость, и непереносимость физических нагрузок.
У некоторых индивидов слабость наиболее выражена в мышцах, контролирующих движения глаз и век. Два наиболее частых следствия такой слабости – это постепенный паралич движения глаз (прогрессирующая наружная офтальмоплегия, ПНО), и опущение верхних век (птоз). Зачастую люди автоматически компенсируют ПНО движениями головы для того, чтобы смотреть в различных направлениях, и могут даже не подозревать о каких либо проблемах. Птоз потенциально более неприятен, поскольку может ухудшить зрение, а также придает лицу апатичное выражение, но он может быть скорректирован хирургическим путем, либо использованием специальных очков с устройством для подъема века
Митохондриальные миопатии могут также вызывать слабость других мышц лица и шеи, что приводит к заплетающейся речи и трудностям с глотанием. В этих случаях могут помочь речевая терапия (занятия с логопедом) или включение в рацион питания таких продуктов, которые легче проглатываются.
Энцефаломиопатия
Митохондриальная энцефаломиопатия, как правило, включает некоторые из вышеупомянутых симптомов миопатии, дополненными одним или несколькими неврологическими симптомами. Также как и при миопатии, наблюдается значительная вариабельность симптомов обоего типа и тяжести течения у разных индивидов.
Среди наиболее частых симптомов митохондриальной энцефаломиопатии – нарушения слуха, мигренеподобные головные боли и эпиприступы. По крайней мере, в одном синдроме головные боли и эпиприступы часто сопровождается инсультоподобными эпизодами
Дополнительно к поражению глазных мышц, митохондриальная энцефаломиопатия может поражать как сами глаза, так и участки головного мозга, ответственные за зрение. Например, потеря зрения вследствие оптической атрофии (дегенерации зрительного нерва) или ретинопатии (дегенерации некоторых клеток, выстилающих глазное дно) – обычные симптомы митохондриальной энцефаломиопатии. По сравнению с мышечными проблемами, эти эффекты с большей вероятностью приводят к серьезным нарушениям зрения
Довольно часто митохондриальная энцефаломиопатия вызывает атаксию, или сложности с балансом и координацией.
Диагностика.
Ни один из отличительных симптомов митохондриального заболевания – мышечная слабость, непереносимость нагрузок, ухудшение слуха, атаксия, эпиприступы, неспособность к обучению, катаракта, диабет и низкорослость – не является уникальным именно для такого заболевания. Однако комбинация трех или более из этих симптомов у одного индивида свидетельствует в пользу митохондриального заболевания, особенно если симптомы затрагивают более одной системы организма
Физикальное обследование обычно включает в себя тесты на силу и выносливость, такие например, как повторяющиеся сжатия-разжатия кулака, или подъем и спуск по небольшой лестнице. Неврологическое обследование может включать в себя проверку рефлексов, зрения, речи и базовых когнитивных способностей.
Существует ряд рутинных клинических методов исследования, которые можно использовать при подозрении на митохондриальную цитопатию:
•лактатный ацидоз является практически постоянным спутником митохондриальных болезней (только этот признак является недостаточным для постановки диагноза, так как он может выявляться и при других патологических состояниях; в этом отношении может быть полезным измерение уровня лактата в венозной крови после умеренной физической нагрузки, например на велоэргометре)
•ЭЭГ – данные ЭЭГ не является достаточно специфическими
Образцы мышечных биоптатов целесообразно делить на три части – одна для микроскопического исследования (гистология, гистохимия и электронная микроскопия), вторая для энзимологического и иммунологического анализа (изучение характеристик компонентов дыхательной цепи) и третья – непосредственно для молекулярно-генетического анализа. Поиск известных мутаций на мышечном материале позволяет в большинстве случаев успешно осуществлять ДНК-диагностику болезни. При отсутствии из вестных мутаций мтДНК в мышечной ткани следующим этапом является развернутый молекулярно-генетический анализ – секвенирование всей цепи мтДНК (или кандидатных генов ядерной ДНК) с целью выявления нового варианта мутации.
Лечение.
Что касается терапии митохондриальных цитопатий, то речь может идти пока только о симптоматической.
Лечение митохондриальных болезней проводится обычно по двум основным направлениям:
•предупреждение повреждения митохондриальных мембран свободными радикалами с помощью антиоксидантов (витамин Е, a-липоевая кислота) и мембранопротекторов.
В практику входят всё новые препараты комбинированного действия, такие, например, как идебенон (Нобен) – улучшенный структурный аналог коэнзима Q10, благоприятно влияющий на активность дыхательного пути и обладающий выраженным антиоксидантным, антиапоптотическим и нейротрофическим действием.
Очевидно, что расширение терапевтического арсенала при митохондриальных болезнях диктует настоятельную необходимость того, чтобы практические врачи различных специальностей (неврологи, психиатры, педиатры, генетики, гематологи и др. ) были хорошо знакомы с алгоритмом диагностики этих заболеваний.
Митохондриальная дисфункция у детей что это
Митохондриальные миопатии встречаются относительно редко, но внутри этой группы болезней часто наблюдаются поражения ЦНС и нервно-мышечной системы. Разделение чисто миопатических и более комплексных форм в некоторой степени искусственно, так как митохондрии имеются в каждой клетке. Неравномерная гетероплазмия, из-за которой, вероятно, в скелетной мускулатуре могут преобладать патогенные митохондриальные мутации по сравнению с другими тканями, может также вызывать выраженное поражение преимущественно мышечной ткани и симптоматику миопатии, что может иметь и иные объяснения (DiMauro и Gurgel-Giannetti, 2005).
Изменчивые клинические проявления и сложность методов исследований, необходимых для постановки точного этиопатогенетического диагноза, превращают эти расстройства в сложную задачу для клиницистов. Тем не менее, существует несколько распознаваемых синдромов, и их генетические, биохимические, патофизиологические и клинические проявления изучаются все больше (Schapira и Cock, 1999; DiMauro и Gurgel-Giannetti, 2005; DiMauro и Hirano, 2005).
Митохондриальная дисфункция может развиться на любом этапе митохондриального метаболизма липидов и других соединений. Эти проблемы обсуждаются в отдельной статье на сайте. В данном разделе описаны только миопатии при митохондриальных болезнях, вызванных дисфункцией системы переноса электронов (дыхательной цепи).
а) Клинические проявления. Митохондриальные миопатии могут проявиться в любой период от рождения до взрослого возраста и чрезвычайно разнообразны по симптоматике, тяжести и исходу (Harding et al., 1988; DiMauro 1993). Некоторые являются составной частью комплексных энцефаломиопатий (глава 8), тогда как другие полностью или преимущественно ограничены патологией поперечнополосатой мускулатуры.
При клиническом проявлении в виде чисто миопатического процесса со слабостью преимущественно проксимальных отделов конечностей, такие симптомы, как утомляемость, миалгия, непереносимость физических нагрузок (легкая нагрузка вызывает непропорциональные тахикардию и диспноэ) и эпизодическая вызванная физической нагрузкой миоглобулинурия, хотя и не являются патогномоничными симптомами, являются ключевыми при постановке диагноза. Птоз и прогрессивная наружная офтальмоплегия — очень важные диагностические признаки (Moraes et al., 1989), так же, как и наличие кардиомиопатии.
Часто наряду с миопатией наблюдаются другие проявления мультисистемного поражения, что способствует синдромальной диагностике, например синдрома Кернса-Сейра. В исследовании Jackson et al. (1995) важными признаками расстройств дыхательной цепи явились материнское наследование, глухота и офтальмоплегия. Отсутствие прибавки в весе, пигментный ретинит, диабет, нарушения интеллекта, припадки и мозжечковая атаксия также имеют диагностическое значение. Гипотония может быть выраженной, но она имеет меньшее значение при дифференциальной диагностике.

Обратите внимание на красные отложения—скопления митохондрий — под сарколеммой наиболее пораженных волокон.
Те же, но менее выраженные изменения начинают развиваться и в других волокнах.
б) Методы исследований. Если клинически не удается распознать имеющийся синдром, первые диагностические признаки, полученные при помощи лабораторных и инструментальных методов исследования, указывающие на патологические изменения в дыхательной цепи — это повышение уровня лактата в крови и ЦСЖ или аномалии базальных ганглиев, выявленные при лучевом исследовании (Jackson et al., 1995). При некоторых описанных синдромах, обычно не проявляющихся преимущественно миопатией (напр. MELAS, MERRF, NARP), мутации можно выявить при исследовании циркулирующих в крови лейкоцитов, таким образом, исчезает необходимость выполнения биопсии.
Даже если отсутствует выраженная слабость, гистологическое и гистохимическое исследование мышечной ткани дает указания или подтверждает диагноз митохондриального расстройства. Характерные морфологические аномалии, лучше всего видные при трехцветной окраске по Гомори, — это так называемые рваные красные мышечные волокна, возникающие из-за скопления митохондрий под сарколеммой. При электронной микроскопии можно выявить патологические митохондриальные структуры, которые могут содержать паракристаллиновые включения.
Тем не менее, рваные красные волокна при подтвержденных митохондриальных болезнях могут постоянно или временно отсутствовать. Дальнейшее обследование включает в себя гистохимическое окрашивание для оценки активности ферментов — сукцинатдегидрогеназы (СДГ), которая служит доказательством пролиферации митохондрий, и оксидазы цитохрома С (СОХ). СОХ кодируется как ядерной, так и митохондриальной ДНК (мтДНК), и мозаичный паттерн указывает на аномалию гетероплазменной мтДНК, тогда как общее снижение свидетельствует о мутации ядерной ДНК (Taylor et al., 2004).
Обычно разорванные красные мышечные волокна СОХ-негативны (Byrne et al., 1985), но могут быть и СОХ-позитивными (Taylor et al., 2004; DiMauro и Hirano, 2005). В некоторых случаях наблюдается избыток липидов и гликогена. Биохимический анализ активности комплекса дыхательной цепи может выявить дефекты в одном компоненте дыхательной цепи или нескольких комплексах, но такой анализ выполняется только в специализированных центрах. Дальнейшее уточнение проводится с помощью молекулярных генетических исследований зон митохондриальной и ядерной ДНК, ответственных не только за дыхательную цепь, но также за плотность митохондрий, их структуру и даже передвижение (DiMauro и Hirano, 2005).
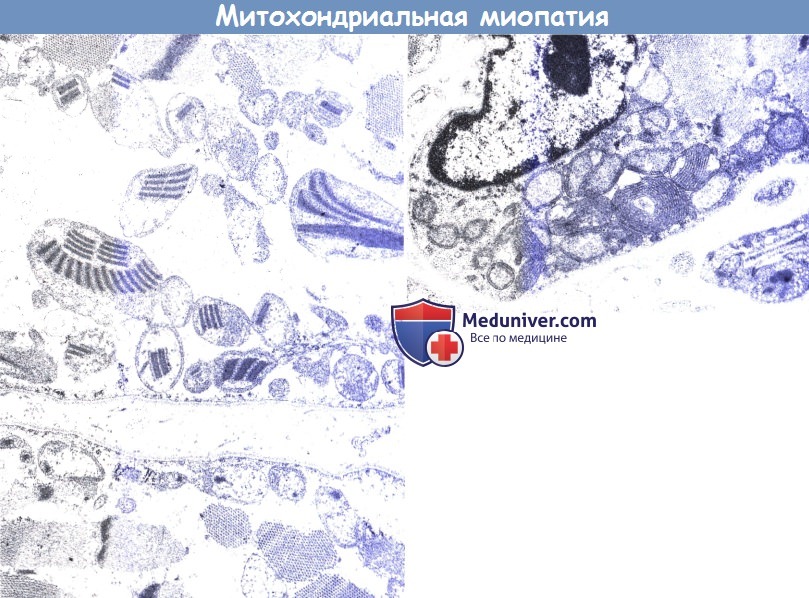
13-летний пациент с типичным анамнезом (слева). Обратите внимание на классические включения по типу «парковки» внутри митохондрии. Пятилетний пациент (справа).
Обратите внимание на пролиферацию крист внутри митохондрии. «Парковочные места» и упорядоченные паракристаллические включения в возрасте до 7-8 лет обычно не видны.
в) Клинические синдромы миопатии. Выраженная генетическая гетерогенность, отсутствие корреляции фенотип-генотип и мультисистемная природа митохондриальных расстройств свидетельствуют о том, что, хотя открыто несколько синдромов энцефалопатии с поражением мышц (например, MERRF, MELAS), существует очень мало фенотипов, характеризующихся преимущественно или исключительно миопатией. Ниже обсуждаются некоторые исключения.
г) Цитохром С оксидаза (СОХ). Одна интересная форма недостаточности СОХ проявляется тяжелым врожденным лактацидозом, слабостью и гипотонией, которые могут быть изолированными или сопровождаться поражением сердца и/или почек. Болезнь дебютирует у младенцев в возрасте от нескольких недель до трех месяцев и обычно быстро прогрессирует, вызывая дыхательную недостаточность (Zeviani et al., 1985; Darin et al., 2003). Обратимая форма недостаточности СОХ проявляется у новорожденных снижением спонтанной двигательной активности, птозом, арефлексией, повышением уровня КК и лактата сыворотки крови, но лактата в ЦСЖ не зафиксировано (Zeviani et al., 1987).
Такая же обратимость была описана при мутации гена СОХШ мтДНК, вызывающей недостаточность СОХ, которая проявляется в детстве непереносимостью физической нагрузки, генерализованной мышечной слабостью с болезненными мышечными крампи и утомляемостью (но без миоглобинурии) (Horvath et al., 2004). Nozaki et al. (1990) описали недостаточность СОХ, остро манифестирующую в возрасте семи лет, сопровождающуюся птозом, офтальмоплегией и остановкой дыхания; после терапии коэнзимом Q10 наступило выздоровление.
д) Недостаточность коэнзима Q10 (KoQ10). При манифестации недостаточности в мышцах коэнзима Q10 (убихинона) доминируют симптомы энцефалопатии, мозжечковой атаксии, также отмечается некоторая мышечная слабость (Musumeci et al., 2001). Наоборот, в некоторых случаях заболевание дебютирует симптомами миопатии: непереносимостью физической нагрузки, прогрессирующей мышечной слабостью проксимальных отделов и нагрузочной миоглобинурией. Наблюдаются разорванные мышечные волокна, накопление липидов, снижение содержания KoQ10 и снижение активности комплексов дыхательной цепи I+III и II+III (Di Giovanni et al., 2001).
Миопатия может быть изолированной (Lalani et al., 2005), но ей также могут сопутствовать симптомы энцефалопатии, например припадки или атаксия. Очень важна правильная диагностика этого расстройства, так как отмечается выраженный положительный эффект перорального приема KoQ10 (Lalani et al., 2005), хотя и не всегда (Aure et al., 2004).
ж) Другие митохондриальные миопатии. Развитие сидеробластной анемии в подростковом возрасте может быть патогномоничным признаком синдрома, названного «миопатия и сидеробластная анемия» (MLASA); заболевание начинает манифестировать непереносимостью физической нагрузки в детском возрасте. Были выявлены мутации гена псевдоуридинсинтетазы 1 (PUS1) (Bukhovskaya et al., 2004). Манифестирующая в детстве непереносимость физических нагрузок также является ранним проявлением мутации гена цитохрома b мтДНК (Andreau et al., 1999).
Прогрессирующая наружная офтальмоплегия (ПНО) наблюдается при синдроме Кернса-Сейра как одно из проявлений мультисистемного расстройства, что в 80% случаев вызвано точечной мутацией мтДНК мт 3243 (Hirano и Pavlakis, 1994). Множественные делеции мтДНК, вызванные мутациями генов ANTI, Twinkle и POLG1, наблюдаются при наследственной форме ПНО без других системных нарушений, хотя большинство случаев манифестируют во взрослом возрасте (Agostino et al., 2003).
з) Лечение. Лечение митохондриальных болезней рассмотрено в отдельной статье на сайте.
Редактор: Искандер Милевски. Дата публикации: 15.1.2019
Метаболический (митохондриальный) инсульт у детей
С.К. Евтушенко, Донецкий национальный медицинский университет им. М. Горького
метаболический инсульт, митохондриальные болезни, дети.
Анализируя литературу и собственные наблюдения, мы пришли к выводу, что наблюдается существенное расхождение в трактовке этиологии и патогенеза развития МИ как взрослыми, так и детскими неврологами [2].
Приводят к заблуждению взрослых неврологов и данные МРТ, которые нередко бывают противоречивыми даже при наличии симптоматики типичного инсульта. В выводах по МР-томограммам при МИ описывается разнополюсная картина: от типичных ишемических очагов, локальных отеков (имитирующих опухоль) до «отсутствия» патологии при наличии гемиплегии.
И все же данные позитронно-эмиссионной томографии с радиоактивной метаболической меткой нередко свидетельствуют о возможности развития «белого, прозрачного» инсульта как одного из патогномоничных признаков соматического нарушения, нередко употребляемого как термин «псевдоинсульт МИ». Как ни парадоксально, в детской практике последствия метаболического (митохондриального) инсульта четко дифференцируются на МРТ-экспозиции в виде оссификаций: базальных ядер, мамиллярных ганглиев, очагов в ножках мозга [17, 38].
Существует и другое использование клиницистами термина «псевдоинсульт», когда ишемический инсульт по началу клиники, времени развития и локальности поражения определенных структур мозга диагностируется как очаговый и зачастую трактуется как опухоль мозга. Хотя возможна и другая картина, при которой опухоль имитирует инсульт. В свое время сотрудником нашей кафедры была защищена кандидатская диссертация по проблеме ишемических инсультов, имитирующих клинику опухолей головного мозга (Е.И. Вирозуб, 1988). При этом была показана возможность дифференциальной диагностики по крови и ликвору с использованием методики противомозговых антител к различным структурам мозга. Впервые на подобном материале была апробирована клиническая модель трансбарьерной «утечки» мозговых антигенов (С.К. Евтушенко, 1985). Исследования последних лет по проблеме псевдоинсульта привели к тому, что и во взрослой неврологии все реже употребляется термин «псевдоинсульт» и предпочтение отдается термину «метаболический инсульт».
Наиболее частой причиной метаболического инсульта у детей являются четко очерченные митохондриальные заболевания. Хотя МИ (применительно к терминологии соматогенных псевдоинсультов) у детей встречаются реже, но они также связаны с хронической патологией поджелудочной железы, печени, почек, диабетом, ацетонемическими состояними и др.
Классическими синдромами, связанными с митохондриальными заболеваниями и манифестной патологией нервной системы, являются следующие синдромы:
В вышеприведенных синдромах представлены кардинальные проявления основных митохондриальных заболеваний. Естественно, каждый из них имеет ряд неврологических и соматических проявлений, присущих только конкретному митохондриальному синдрому [10, 24].
Выделяют и другие, но реже встречаемые в практике детского невролога митохондриальные заболевания, проявляющиеся также преимущественно патологией нервной системы [7, 10]:
Основным биохимическим признаком всей митохондриальной патологии являются лактат-ацидоз с повышением уровня молочной и пировиноградной кислот в крови и ликворе, ацидурия.
Другие, менее встречаемые синдромы, имеющие митохондриальную основу, мы привели в нашей статье с тремя целями:
Указанные классические митохондриальные синдромы чаще всего осложняются МИ. Это положение можно объяснить с позиции нейрогенетики на этапе современных знаний о митохондриальных заболеваниях.
Именно основные митохондриальные заболевания связаны с точечными мутациями ядерной ДНК и наследуются по материнской линии (MERRF, MELAS, NARP, MNGIE), другие же обусловлены делециями или дупликациями (крупными перестройками митохондриальной ДНК), носят спорадический характер и не передаются потомству. Увеличение риска развития иных видов инсультов обусловливается генетической предрасположенностью и факторами окружающей среды [20, 22, 25].
Известно, что одним из важнейших регуляторов апоптоза является транскрипционный фактор, белок Р53, экспрессия которого в нейронах происходит в ответ на различные повреждения, включая оксидантный стресс, эксайтотоксичность, повреждение ДНК [11, 28].
В настоящее время выявлена достоверная зависимость ВаmН1 полиморфных вариантов гена Р53 и Rsa-1 полиморфизма гена PARP-1 от объема ишемического инфаркта мозга [11].
Индукция апоптоза в нейронах рецептора Fas при помощи взаимодействия с адапторным белком FADD (Fas Associated Death Domain) приводит к возникновению первичного апоптического сигнала, который, в свою очередь, индуцирует олигомеризацию каспазы-8, что активирует саморасщепление фермента с образованием активной протеиназы и реализацию в целом процесса апоптоза клетки [30].
Исходя из вышеприведенных фактов, можно утверждать, что существует ассоциация полиморфизмов генов рецепторного пути индукции апоптоза FADD, Fas и митохондриального пути PARP-1, P53, влияющих в итоге не только на риск возникновения инсульта, но и на объем инфаркта мозга [11].
Выявленные ассоциации свидетельствуют о совокупном участии генов рецепторного и митохондриальных путей индукции апоптоза в формировании необратимого повреждения мозга при церебральной ишемии, включая метаболические расстройства [11].
В подтверждение значимости программированных механизмов клеточной смерти в формировании очагового повреждения ткани головного мозга рядом авторов стратегически обосновывается важность использования именно нейропротекторной и метаболической терапии в комплексе лечебных мероприятий, как в остром периоде инсульта, так и в восстановительном [8, 15]. Заглядывая в будущее, можно говорить о возможности предупреждения инсультов выключением определенных генов, например гена, ответственного за высокий уровень холестерина в крови (и делать это начиная с подросткового периода). Эндрю Файер и Крейг Меллоу (2004) получили Нобелевскую премию, доказав возможность искусственно вызывать РНК-интерференцию генов, тем самым нейтрализуя уже у эмбриона предрасположенность к определенным болезням.
В настоящей работе мы анализируем литературные и собственные данные по MELAS-синдрому, поскольку ядром указанной патологии являются как преходящие, так и стойкие нарушения мозгового кровообращения (инсульты), возникающие и в церебральных, и в спинальных сосудах [3, 9, 13].
При этом в сосудах мозга после инсультов находят достаточно серьезные изменения. Вместе с тем не до конца ясным остается вопрос о патогенезе развития преходящих и стойких нарушений мозгового кровообращения, которые нередко заканчиваются быстрым нивелированием неврологического дефицита.
По нашим представлениям, начальные проявления МИ носят ишемически-гипоксический характер. Не исключается, что в дальнейшем инсульт может трансформироваться в геморрагический (чаще не массивный). Вот почему некоторые авторы описывают как ишемический, так и геморрагический МИ [8, 13, 15].
В данной ситуации существенно влияет фактор нарушения местного фибринолиза, возникшего по типу микро-ДВС-синдрома. Ведь патологический процесс «гнездится» как в эндотелии (васкулопатии), так в стенке сосудов (ангиопатии), но может развиваться и в глиальной ткани мозга, насыщенной митохондриями [9].
Чрезвычайно важным обстоятельством является тот факт, что подобные изменения обнаруживаются и в сосудах спинного мозга. Непосредственно в паренхиме спинного мозга наблюдается уменьшение числа нейронов в передних и задних рогах, дегенерация кортико-спинальных путей, задних и боковых столбов [30].
Тщательный собственный клинический анализ состояния 12 детей (8 мальчиков и 4 девочки в возрасте от 5 до 15 лет) показал, что в «чистом» виде MELAS-синдром можно было заподозрить у 4 детей. В то же время остальным 8 больным требовалась длительная дифференцированная диагностика даже после случившегося инсульта. У этих больных изначально ведущим синдромом была мышечная слабость, затем миопатический синдром, протекавший сочетанно с энцефалопатическими проявлениями (головная боль, головокружение, преходящие парестезии и др.), а потом возникали преходящие нарушения мозгового кровообращения и инсульты.
В диагностике MELAS-синдрома (как и других митохондриальных заболеваний у детей) следует учитывать:
Клинические проявления MELAS-синдрома
Синдром энцефаломиопатии является тем фундаментом, к которому присоединяется (или возникают самостоятельно) другие, но уже соматические проявления (рвота, псевдоацетонамические состояния, плохой аппетит, нарушение ритма сердца, похудение, боль в животе и др.) На фоне подобных состояний у детей и развиваются преходящие или стойкие нарушения мозгового кровообращения.
Лечение митохондриальных заболеваний начинается с рекомендации соблюдения режима питания, исключающего длительные промежутки между приемами пищи. В пищевом рационе снижают потребление жиров (до 15-20 % по калорийности) и повышают квоту углеводов (> 60 % по калорийности). В остром периоде используют частое кормление, обильное питье с дополнительным, в том числе парентеральным, введением глюкозы [2-4, 8, 29].
Лечение MELAS-синдрома проводится на основе патогенетической превентивной терапии (1-2 мес., 3-4 курса в год) и в период острых его проявлений.
В течение последних двух десятилетий исследования митохондриальной ДНК сыграли ведущую роль в эволюционной генетике и популяционных исследованиях, что послужило организации в 58 странах специализированных митохондриальных центров и созданию Ассоциации помощи больным детям и взрослым с МБ. Создание подобного центра в Украине сегодня является не только научной, но и практической необходимостью.