Митохондриальная миопатия что это
Митохондриальная миопатия что это
Митохондриальные миопатии встречаются относительно редко, но внутри этой группы болезней часто наблюдаются поражения ЦНС и нервно-мышечной системы. Разделение чисто миопатических и более комплексных форм в некоторой степени искусственно, так как митохондрии имеются в каждой клетке. Неравномерная гетероплазмия, из-за которой, вероятно, в скелетной мускулатуре могут преобладать патогенные митохондриальные мутации по сравнению с другими тканями, может также вызывать выраженное поражение преимущественно мышечной ткани и симптоматику миопатии, что может иметь и иные объяснения (DiMauro и Gurgel-Giannetti, 2005).
Изменчивые клинические проявления и сложность методов исследований, необходимых для постановки точного этиопатогенетического диагноза, превращают эти расстройства в сложную задачу для клиницистов. Тем не менее, существует несколько распознаваемых синдромов, и их генетические, биохимические, патофизиологические и клинические проявления изучаются все больше (Schapira и Cock, 1999; DiMauro и Gurgel-Giannetti, 2005; DiMauro и Hirano, 2005).
Митохондриальная дисфункция может развиться на любом этапе митохондриального метаболизма липидов и других соединений. Эти проблемы обсуждаются в отдельной статье на сайте. В данном разделе описаны только миопатии при митохондриальных болезнях, вызванных дисфункцией системы переноса электронов (дыхательной цепи).
а) Клинические проявления. Митохондриальные миопатии могут проявиться в любой период от рождения до взрослого возраста и чрезвычайно разнообразны по симптоматике, тяжести и исходу (Harding et al., 1988; DiMauro 1993). Некоторые являются составной частью комплексных энцефаломиопатий (глава 8), тогда как другие полностью или преимущественно ограничены патологией поперечнополосатой мускулатуры.
При клиническом проявлении в виде чисто миопатического процесса со слабостью преимущественно проксимальных отделов конечностей, такие симптомы, как утомляемость, миалгия, непереносимость физических нагрузок (легкая нагрузка вызывает непропорциональные тахикардию и диспноэ) и эпизодическая вызванная физической нагрузкой миоглобулинурия, хотя и не являются патогномоничными симптомами, являются ключевыми при постановке диагноза. Птоз и прогрессивная наружная офтальмоплегия — очень важные диагностические признаки (Moraes et al., 1989), так же, как и наличие кардиомиопатии.
Часто наряду с миопатией наблюдаются другие проявления мультисистемного поражения, что способствует синдромальной диагностике, например синдрома Кернса-Сейра. В исследовании Jackson et al. (1995) важными признаками расстройств дыхательной цепи явились материнское наследование, глухота и офтальмоплегия. Отсутствие прибавки в весе, пигментный ретинит, диабет, нарушения интеллекта, припадки и мозжечковая атаксия также имеют диагностическое значение. Гипотония может быть выраженной, но она имеет меньшее значение при дифференциальной диагностике.

Обратите внимание на красные отложения—скопления митохондрий — под сарколеммой наиболее пораженных волокон.
Те же, но менее выраженные изменения начинают развиваться и в других волокнах.
б) Методы исследований. Если клинически не удается распознать имеющийся синдром, первые диагностические признаки, полученные при помощи лабораторных и инструментальных методов исследования, указывающие на патологические изменения в дыхательной цепи — это повышение уровня лактата в крови и ЦСЖ или аномалии базальных ганглиев, выявленные при лучевом исследовании (Jackson et al., 1995). При некоторых описанных синдромах, обычно не проявляющихся преимущественно миопатией (напр. MELAS, MERRF, NARP), мутации можно выявить при исследовании циркулирующих в крови лейкоцитов, таким образом, исчезает необходимость выполнения биопсии.
Даже если отсутствует выраженная слабость, гистологическое и гистохимическое исследование мышечной ткани дает указания или подтверждает диагноз митохондриального расстройства. Характерные морфологические аномалии, лучше всего видные при трехцветной окраске по Гомори, — это так называемые рваные красные мышечные волокна, возникающие из-за скопления митохондрий под сарколеммой. При электронной микроскопии можно выявить патологические митохондриальные структуры, которые могут содержать паракристаллиновые включения.
Тем не менее, рваные красные волокна при подтвержденных митохондриальных болезнях могут постоянно или временно отсутствовать. Дальнейшее обследование включает в себя гистохимическое окрашивание для оценки активности ферментов — сукцинатдегидрогеназы (СДГ), которая служит доказательством пролиферации митохондрий, и оксидазы цитохрома С (СОХ). СОХ кодируется как ядерной, так и митохондриальной ДНК (мтДНК), и мозаичный паттерн указывает на аномалию гетероплазменной мтДНК, тогда как общее снижение свидетельствует о мутации ядерной ДНК (Taylor et al., 2004).
Обычно разорванные красные мышечные волокна СОХ-негативны (Byrne et al., 1985), но могут быть и СОХ-позитивными (Taylor et al., 2004; DiMauro и Hirano, 2005). В некоторых случаях наблюдается избыток липидов и гликогена. Биохимический анализ активности комплекса дыхательной цепи может выявить дефекты в одном компоненте дыхательной цепи или нескольких комплексах, но такой анализ выполняется только в специализированных центрах. Дальнейшее уточнение проводится с помощью молекулярных генетических исследований зон митохондриальной и ядерной ДНК, ответственных не только за дыхательную цепь, но также за плотность митохондрий, их структуру и даже передвижение (DiMauro и Hirano, 2005).
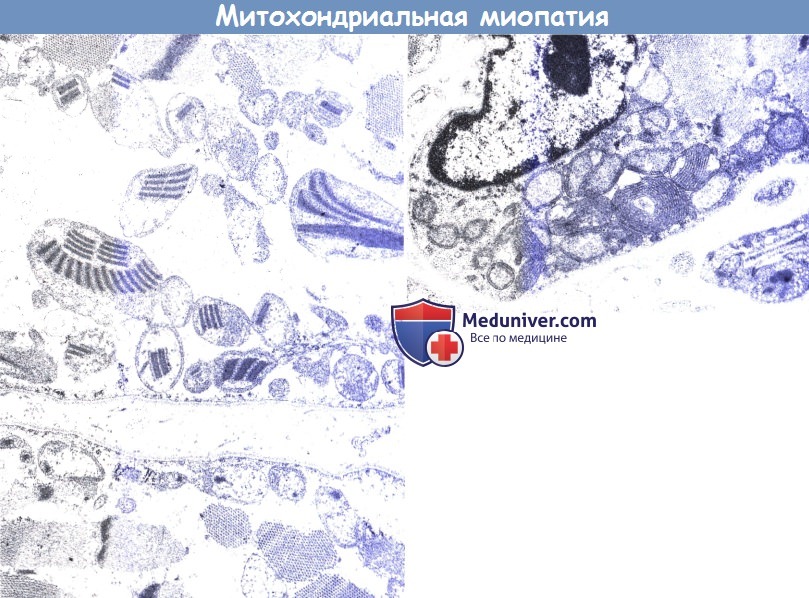
13-летний пациент с типичным анамнезом (слева). Обратите внимание на классические включения по типу «парковки» внутри митохондрии. Пятилетний пациент (справа).
Обратите внимание на пролиферацию крист внутри митохондрии. «Парковочные места» и упорядоченные паракристаллические включения в возрасте до 7-8 лет обычно не видны.
в) Клинические синдромы миопатии. Выраженная генетическая гетерогенность, отсутствие корреляции фенотип-генотип и мультисистемная природа митохондриальных расстройств свидетельствуют о том, что, хотя открыто несколько синдромов энцефалопатии с поражением мышц (например, MERRF, MELAS), существует очень мало фенотипов, характеризующихся преимущественно или исключительно миопатией. Ниже обсуждаются некоторые исключения.
г) Цитохром С оксидаза (СОХ). Одна интересная форма недостаточности СОХ проявляется тяжелым врожденным лактацидозом, слабостью и гипотонией, которые могут быть изолированными или сопровождаться поражением сердца и/или почек. Болезнь дебютирует у младенцев в возрасте от нескольких недель до трех месяцев и обычно быстро прогрессирует, вызывая дыхательную недостаточность (Zeviani et al., 1985; Darin et al., 2003). Обратимая форма недостаточности СОХ проявляется у новорожденных снижением спонтанной двигательной активности, птозом, арефлексией, повышением уровня КК и лактата сыворотки крови, но лактата в ЦСЖ не зафиксировано (Zeviani et al., 1987).
Такая же обратимость была описана при мутации гена СОХШ мтДНК, вызывающей недостаточность СОХ, которая проявляется в детстве непереносимостью физической нагрузки, генерализованной мышечной слабостью с болезненными мышечными крампи и утомляемостью (но без миоглобинурии) (Horvath et al., 2004). Nozaki et al. (1990) описали недостаточность СОХ, остро манифестирующую в возрасте семи лет, сопровождающуюся птозом, офтальмоплегией и остановкой дыхания; после терапии коэнзимом Q10 наступило выздоровление.
д) Недостаточность коэнзима Q10 (KoQ10). При манифестации недостаточности в мышцах коэнзима Q10 (убихинона) доминируют симптомы энцефалопатии, мозжечковой атаксии, также отмечается некоторая мышечная слабость (Musumeci et al., 2001). Наоборот, в некоторых случаях заболевание дебютирует симптомами миопатии: непереносимостью физической нагрузки, прогрессирующей мышечной слабостью проксимальных отделов и нагрузочной миоглобинурией. Наблюдаются разорванные мышечные волокна, накопление липидов, снижение содержания KoQ10 и снижение активности комплексов дыхательной цепи I+III и II+III (Di Giovanni et al., 2001).
Миопатия может быть изолированной (Lalani et al., 2005), но ей также могут сопутствовать симптомы энцефалопатии, например припадки или атаксия. Очень важна правильная диагностика этого расстройства, так как отмечается выраженный положительный эффект перорального приема KoQ10 (Lalani et al., 2005), хотя и не всегда (Aure et al., 2004).
ж) Другие митохондриальные миопатии. Развитие сидеробластной анемии в подростковом возрасте может быть патогномоничным признаком синдрома, названного «миопатия и сидеробластная анемия» (MLASA); заболевание начинает манифестировать непереносимостью физической нагрузки в детском возрасте. Были выявлены мутации гена псевдоуридинсинтетазы 1 (PUS1) (Bukhovskaya et al., 2004). Манифестирующая в детстве непереносимость физических нагрузок также является ранним проявлением мутации гена цитохрома b мтДНК (Andreau et al., 1999).
Прогрессирующая наружная офтальмоплегия (ПНО) наблюдается при синдроме Кернса-Сейра как одно из проявлений мультисистемного расстройства, что в 80% случаев вызвано точечной мутацией мтДНК мт 3243 (Hirano и Pavlakis, 1994). Множественные делеции мтДНК, вызванные мутациями генов ANTI, Twinkle и POLG1, наблюдаются при наследственной форме ПНО без других системных нарушений, хотя большинство случаев манифестируют во взрослом возрасте (Agostino et al., 2003).
з) Лечение. Лечение митохондриальных болезней рассмотрено в отдельной статье на сайте.
Редактор: Искандер Милевски. Дата публикации: 15.1.2019
Митохондриальные заболевания
Митохондриальные заболевания (МЗ) — группа наследственных заболеваний, связанных с дефектами в функционировании митохондрий, приводящими к нарушениям энергетических функций в клетках.
Историческая справка:
Понятие «митохондриальные болезни» сформировалось в медицине в конце ХХ века. В первую очередь были изучены болезни, связанные с мутациями митохондриальной ДНК, открытой в начале 60-ых годов. Полная первичная структура митохондриальной ДНК человека была опубликована в 1981 го¬ду и уже в конце 80-ых годов была доказана ведущая роль ее мутаций в развитии ряда наследственных заболеваний. К последним относятся: наследственная атрофия зрительных нервов Лебера, синдром NARP (нейропатия, атаксия, пигментный ретинит), синдром MERRF (миоклонусэпилепсия с «рваными» красными волокнами в скелетных мышцах), синдром MELAS (митохондриальная энцефаломиопатия, лактат-ацидоз, инсультоподобные эпизоды), синдром Кернса-Сейра (пигментный ретинит, наружная офтальмоплегия, блокада сердца, птоз, мозжечковый синдром), синдром Пирсона (поражение костного мозга, панкреатическая и печеночная дисфункции) и многие другие.
В меньшей степени изучены наследственные митохондриальные дефекты, связанные с повреждением ядерного генома.
Патогенез.
Митохондрии отвечают за выработку большей части энергии, необходимой для функционирования клеток. Фактически они являются настолько важным источником энергии, что в каждой клетке их сотни. При МЗ могут «выключиться» как часть митохондрий, так и все они, что приводит к прекращению выработки необходимой энергии
Поскольку наиболее энергоемкими являются нервные и мышечные клетки, при МЗ наиболее распространены мышечные и неврологические проблемы, такие, как мышечная слабость, непереносимость физических нагрузок, потеря слуха, нарушения баланса и координации, эпиприступы.
Когда клетка заполнена дефектными митохондриями, она не только лишена АТФ, но в ней могут накапливаться неиспользуемые молекулы топлива и кислород, что приводит к катастрофическим последствиям. В этом случае избыточные молекулы топлива используются для синтеза АТФ неэффективно, в результате чего могут образовываться потенциально опасные продукты, такие, как молочная кислота (Это также происходит, когда клетки испытывают недостаток кислорода, например – мышечные клетки при усиленных физических нагрузках). Накопление молочной кислоты в крови – лактатацидоз – ассоциировано с мышечной усталостью, и может вызывать повреждение нервной и мышечной тканей.
При этом неиспользуемый в клетке кислород может трансформироваться в разрушительные соединения, именуемые реактивными формами кислорода, включая т. н. свободные радикалы (Они являются мишенью для т. н. антиоксидантных препаратов и витаминов).
Синтезированная в митохондриях АТФ – основной источник энергии для сокращения мышечных и возбуждения нервных клеток (т. к. клетки этих тканей наиболее метаболически активны, энергетически зависимы). Таким образом, нервные и мышечные клетки особенно чувствительны к дефектам митохондрий. Комбинированный эффект от потери энергии и накопления токсинов в этих клетках, надо полагать, и вызывает развитие симптомов митохондриальных миопатий и энцефаломиопатий
Клиника
Характерные признаки митохондриальных цитопатий:
•скелетные мышцы: низкая толерантность к физической нагрузке, гипотония, проксимальная миопатия, включающая фациальные и фарингеальные мышцы, офтальмопарез, птоз
•сердце: нарушения сердечного ритма, гипертрофическая миокардиопатия
•центральная нервная система: атрофия зрительного нерва, пигментная ретинопатия, миоклонус, деменция, инсультоподобные эпизоды, расстройства психики
•периферическая нервная система: аксональная нейропатия, нарушения двигательной функции гастроинтестинального тракта
•эндокринная система: диабет, гипопаратиреоидизм, нарушение экзокринной функции панкреас, низкий рост
Таким образом, типичны для митохондриальных заболеваний вовлеченность разных органов и одновременное проявление внешне не связанных между собой аномалий. Примерами служат:
1. Мигрени с мышечной слабостью
2. Наружная офтальмоплегия с нарушением проводимости сердечной мышцы и мозжечковой атаксией
3. Тошнота, рвота с оптической атрофией и кардиомиопатией
4. Низкорослость с миопатией и инсультоподобным и эпизодами
5. Экзокринная дисфункция поджелудочной железы с сидеробластной анемией
6. Энцефало- миопатия с диабетом
7. Диабет с глухотой
8. Глухота с наружной офтальмоплегией, птозом и ретинопатией
9. Задержка развития или потеря навыков и офтальмоплегия, офтальмопарез
Характер и тяжесть клинических проявлений митохондриальных болезней определяется:
• тяжестью мутации мтДНК;
• процентным содержанием мутантной мтДНК в конкретных органах и тканях;
• энергетической потребностью и функциональным резервом органов и тканей, содержащих мтДНК (их “порогом чувствительности” к дефектам окислительного фосфори лирования).
Миопатия
Основные симптомы митохондриальной миопатии – истощение мышц и их слабость, и непереносимость физических нагрузок.
У некоторых индивидов слабость наиболее выражена в мышцах, контролирующих движения глаз и век. Два наиболее частых следствия такой слабости – это постепенный паралич движения глаз (прогрессирующая наружная офтальмоплегия, ПНО), и опущение верхних век (птоз). Зачастую люди автоматически компенсируют ПНО движениями головы для того, чтобы смотреть в различных направлениях, и могут даже не подозревать о каких либо проблемах. Птоз потенциально более неприятен, поскольку может ухудшить зрение, а также придает лицу апатичное выражение, но он может быть скорректирован хирургическим путем, либо использованием специальных очков с устройством для подъема века
Митохондриальные миопатии могут также вызывать слабость других мышц лица и шеи, что приводит к заплетающейся речи и трудностям с глотанием. В этих случаях могут помочь речевая терапия (занятия с логопедом) или включение в рацион питания таких продуктов, которые легче проглатываются.
Энцефаломиопатия
Митохондриальная энцефаломиопатия, как правило, включает некоторые из вышеупомянутых симптомов миопатии, дополненными одним или несколькими неврологическими симптомами. Также как и при миопатии, наблюдается значительная вариабельность симптомов обоего типа и тяжести течения у разных индивидов.
Среди наиболее частых симптомов митохондриальной энцефаломиопатии – нарушения слуха, мигренеподобные головные боли и эпиприступы. По крайней мере, в одном синдроме головные боли и эпиприступы часто сопровождается инсультоподобными эпизодами
Дополнительно к поражению глазных мышц, митохондриальная энцефаломиопатия может поражать как сами глаза, так и участки головного мозга, ответственные за зрение. Например, потеря зрения вследствие оптической атрофии (дегенерации зрительного нерва) или ретинопатии (дегенерации некоторых клеток, выстилающих глазное дно) – обычные симптомы митохондриальной энцефаломиопатии. По сравнению с мышечными проблемами, эти эффекты с большей вероятностью приводят к серьезным нарушениям зрения
Довольно часто митохондриальная энцефаломиопатия вызывает атаксию, или сложности с балансом и координацией.
Диагностика.
Ни один из отличительных симптомов митохондриального заболевания – мышечная слабость, непереносимость нагрузок, ухудшение слуха, атаксия, эпиприступы, неспособность к обучению, катаракта, диабет и низкорослость – не является уникальным именно для такого заболевания. Однако комбинация трех или более из этих симптомов у одного индивида свидетельствует в пользу митохондриального заболевания, особенно если симптомы затрагивают более одной системы организма
Физикальное обследование обычно включает в себя тесты на силу и выносливость, такие например, как повторяющиеся сжатия-разжатия кулака, или подъем и спуск по небольшой лестнице. Неврологическое обследование может включать в себя проверку рефлексов, зрения, речи и базовых когнитивных способностей.
Существует ряд рутинных клинических методов исследования, которые можно использовать при подозрении на митохондриальную цитопатию:
•лактатный ацидоз является практически постоянным спутником митохондриальных болезней (только этот признак является недостаточным для постановки диагноза, так как он может выявляться и при других патологических состояниях; в этом отношении может быть полезным измерение уровня лактата в венозной крови после умеренной физической нагрузки, например на велоэргометре)
•ЭЭГ – данные ЭЭГ не является достаточно специфическими
Образцы мышечных биоптатов целесообразно делить на три части – одна для микроскопического исследования (гистология, гистохимия и электронная микроскопия), вторая для энзимологического и иммунологического анализа (изучение характеристик компонентов дыхательной цепи) и третья – непосредственно для молекулярно-генетического анализа. Поиск известных мутаций на мышечном материале позволяет в большинстве случаев успешно осуществлять ДНК-диагностику болезни. При отсутствии из вестных мутаций мтДНК в мышечной ткани следующим этапом является развернутый молекулярно-генетический анализ – секвенирование всей цепи мтДНК (или кандидатных генов ядерной ДНК) с целью выявления нового варианта мутации.
Лечение.
Что касается терапии митохондриальных цитопатий, то речь может идти пока только о симптоматической.
Лечение митохондриальных болезней проводится обычно по двум основным направлениям:
•предупреждение повреждения митохондриальных мембран свободными радикалами с помощью антиоксидантов (витамин Е, a-липоевая кислота) и мембранопротекторов.
В практику входят всё новые препараты комбинированного действия, такие, например, как идебенон (Нобен) – улучшенный структурный аналог коэнзима Q10, благоприятно влияющий на активность дыхательного пути и обладающий выраженным антиоксидантным, антиапоптотическим и нейротрофическим действием.
Очевидно, что расширение терапевтического арсенала при митохондриальных болезнях диктует настоятельную необходимость того, чтобы практические врачи различных специальностей (неврологи, психиатры, педиатры, генетики, гематологи и др. ) были хорошо знакомы с алгоритмом диагностики этих заболеваний.
Митохондриальная миопатия что это
Митохондриальные миопатии — это группа заболеваний мышц, которые возникают в результате нарушения функции тканевого дыхания при патологиях митохондрий. Болезни проявляются нарастающей мышечной слабостью, атрофией мускулатуры, прогрессирующими двигательными расстройствами, которые могут сопровождаться судорогами, поражениями сердца, ухудшением слуха и зрения. Диагностика предполагает лабораторные (исследование мышечных биоптатов, генетическое тестирование, биохимические анализы), инструментальные методы (ЭМГ, церебральное МР-сканирование). Лечение включает симптоматические препараты, физиотерапию, ЛФК.
МКБ-10
Общие сведения
Термин «митохондриальная миопатия» объединяет в себе несколько патологий со сходным патогенезом. Наиболее часто дети страдают синдромами MELAS, MERRF, синдромом Кернса-Сайра с хронической прогрессирующей наружной офтальмоплегией. Изучение молекулярно-генетических особенностей этих болезней началось в 1980-х гг. Распространенность патологий у детей составляет около 11,5 случая на 100 тыс. населения. Из-за мультисистемности поражения, клинического полиморфизма, вариабельности течения этот вид миопатии представляет серьезные трудности в диагностике.

Причины
Миопатии обусловлены наследственными либо спорадическими мутациями в митохондриальной ДНК или в ядерных генах, контролирующих работу митохондрий. Известно более 300 вариантов генных дефектов — однонуклеотидных замен, делеций, вызывающих нарушения функционирования митохондрий. Митохондриальные миопатии имеют ряд генетических аспектов, выделяющих их среди всех наследственных заболеваний. Принципиальные различия:
Патогенез
Митохондрия — универсальная органелла, присутствующая во всех клетках, кроме эритроцитов. Она имеет дыхательную цепь, которая включает 5 ферментных комплексов из нескольких десятков субъединиц каждый. Ферменты обеспечивают окислительное фосфорилирование для синтеза АТФ — аденозинтрифосфата, выступающего основным источником энергии в организме.
При митохондриальных заболеваниях может быть 4 варианта патогенетических механизмов развития. Как правило, при поражениях мышц наблюдаются дефекты электронного транспорта и окислительного фосфорилирования, что сопровождается нарушениями образования энергетических молекул. Другие варианты расстройств включают нарушения обмена пирувата, дефекты метаболизма жирных кислот, дисфункцию цикла Кребса.
При миопатиях отмечаются полисистемные расстройства. Мышечная и нервная ткань, больше других зависимые от энергопроизводства, страдают в первую очередь. Поражение проявляется нарушениями обмена веществ в мышцах, дегенеративными процессами, атрофией миофибрилл и их замещением соединительной тканью. Со временем патологический процесс распространяется на сердечную мышцу, эндокринную систему, почки и печень, что определяет различные «маски» миопатии.
Симптомы митохондриальной миопатии
Патологии манифестируют у детей раннего возраста, иногда они присутствуют с рождения. Общим признаком является миопатический синдром, который включает прогрессирующую мышечную слабость, снижение тонуса скелетной мускулатуры, непереносимость физических нагрузок. Типично отставание в моторном развитии: дети поздно начинают сидеть, ползать, ходить, у них сохраняется неуклюжесть движений, проблемы с поддержанием равновесия.
Клинические особенности определяются типом заболевания. При синдроме MERRF мышечная слабость сопровождается разнообразными судорожными приступами (атоническими, тонико-клоническими, миоклоническими), расстройствами координации вследствие мозжечковой атаксии. Для синдрома MELAS характерны повторные инсульты, умственная отсталость, нейросенсорная тугоухость.
У детей распространен синдром Кернса-Сайра, при котором клинические признаки дополняются расстройствами глотания, нарушениями работы проводящей системы сердца, снижением слуха. Хроническая прогрессирующая наружная офтальмопатия может возникать как компонент болезни Кернса-Сайра, так и развиваться изолированно, что чаще бывает в старшем возрасте.
Осложнения
Отличительными особенностями миопатического синдрома являются необратимость, неуклонное прогрессирование. Сначала мышечная слабость появляется в проксимальных отделах конечностей, затем поражает все тело ребенка: в процесс вовлекается гладкая мускулатура органов дыхания и пищеварения, что чревато дыхательной недостаточностью, аспирационными пневмониями, тотальным параличом. Такие пациенты теряют способность к самообслуживанию, требуют круглосуточного ухода.
Миопатии осложняются деформациями позвоночника, искривлениями нижних конечностей на фоне слабости мышечного корсета. Вследствие атрофии зрительных нервов у больных с синдромом MERRF возникает слепота. Опасным последствием многих вариантов митохондриальной патологии являются инсульты, эпилептический статус, мозговой отек, которые становятся основными причинами летального исхода.
Диагностика
Первичное обследование детей с подозрением на митохондриальную миопатию проводится у невролога, для уточнения диагноза показана консультация генетика. При осмотре учитывается неврологический статус ребенка, показатели мышечной силы и тонуса, уровень развития когнитивных навыков. Постановка диагноза требует комплексного обследования, включающего следующие методы:
Лечение митохондриальных миопатий
В клинической неврологии отсутствуют эффективные методы терапии патологии у детей. Суть медицинской помощи сводится к уменьшению моторного дефицита, своевременной коррекции осложнений, стимуляции обменных процессов в митохондриях. Наибольшую результативность демонстрируют следующие группы медикаментов:
Важным компонентом лечения у детей является нейродиетология, которая предполагает исключение веществ, оказывающих негативное влияние на обменные процессы (терапия «обхождения блока»). Рекомендована кетогенная диета, другие виды высокожировых диет. По показаниям проводится лечебное энтеральное или парентеральное питание, в тяжелых случаях устанавливается гастростома.
Прогноз и профилактика
Вы можете поделиться своей историей болезни, что Вам помогло при лечении митохондриальной миопатии.
1. Митохондриальные болезни: миопатии, энцефаломиопатии и энцефаломиелополиневропатии/ В.М. Казаков, А.А. Скоромец, Д.И. Руденко, Т.Р. Стучевская// Неврологический журнал. — 201 — №
2. Митохондриальная патология у детей/ В.М. Студеникин, О.В. Глоба// Лечащий врач. — 201 — №
3. Влияние дисфункции митохондрий на клинические проявления наследственных миопатий/ Д.А. Харламов, В.С. Сухоруков// Российский вестник перинатологии и педиатрии. — 201 — №
4. Митохондриальные миопатии в сочетании с кардиомиопатией. Новые подходы к лечению/ О.С. Страхова, Ю.М. Белозеров, С.В. Перминов, В.В. Давыдкин// Альманах клинической медицины. — 200 — №
