Митохондрии что это у человека
Митохондрии: как позаботиться о них и о своем здоровье?
Крошечные структуры внутри наших клеток связаны с болезнями сердца, старением и депрессией. Вот все, что нужно об этом знать
Примерно 2,5 млрд лет назад на Земле была заключена эпохальная сделка. Как гласит теория симбиогенеза, одноклеточные организмы, тогда еще не умевшие использовать кислород для жизни, приняли в себя бактерии, которые обладали этим ценным навыком, и так обзавелись собственными мини-фабриками по быстрому производству энергии.
Результат этой успешной бизнес-стратегии — наши митохондрии. Хоть эти крошечные органеллы (уменьшительное от «органа») давно живут внутри клеток, занимая около 25% их объема, они, похоже, не забыли о том, что когда-то были бактериями — у них, например, есть собственная ДНК. Стоит помнить об этом и нам, чтобы знать их слабые места и обеспечивать им правильное техобслуживание.
А это важно, потому что митохондрии выполняют много ключевых функций — от снабжения организма энергией до регулирования иммунитета. Именно проблемы с митохондриями многие ученые считают основной причиной старения и развития рака, сердечно-сосудистых заболеваний, диабета и болезней Паркинсона и Альцгеймера. Даже ментальные нарушения, возможно, связаны со сбоями в их работе.
Митохондрии и старение
Главная задача митохондрий — обеспечить организм энергией. Любой фабрике для производства нужно не только оборудование, но и сырье. Для митохондрий это сырье — глюкоза и жиры, которые мы получаем с пищей, и кислород, который мы вдыхаем: митохондрии используют 80% его объема из каждого вдоха.
Клетка перерабатывает сырье (глюкозу и жиры) в понятные для митохондрии метаболиты. Их митохондрия прогоняет с помощью кислорода через восемь последовательных реакций (они называются циклом Кребса) и превращает в топливо для наших клеток — АТФ. Задача этой молекулы — легко распадаться, выделяя максимум энергии, которую клетки направляют на строительные нужды. Синтез белков, запасание углеводов и жиров в организме и просто поддержание жизни — для всего этого нужно много АТФ. Впрочем, абсолютное количество этого вещества в организме не так велико — всего около 60 г, но АТФ постоянно распадается и воссоздается, и общий суточный оборот его примерно равен массе вашего тела.
Ни один механизм не совершенен. Наши внутриклеточные фабрики по производству АТФ — тоже. Когда митохондрия превращает глюкозу и кислород в энергию, образуется побочный продукт — активные формы кислорода. Они нестабильны и могут участвовать в совершенно ненужных реакциях, повреждая при этом клеточные структуры. Их влияние должны компенсировать антиоксиданты — активные формы азота или специальные белки. Они реагируют с активными формами кислорода и превращают их в безопасные соединения.
Вот как, например, описан механизм старения в потрясающем исследовании, опубликованном в Nature. Ученые создали генетически измененных мышей, клетки которых синтезировали и использовали дефектный рабочий белок. Обычно этот белок копирует митохондриальную ДНК перед тем, как митохондрия делится. Но дефектный белок при копировании не повторял ДНК дословно, а вносил случайные ошибки. В результате митохондриальные мутации у мышей накапливались быстрее, чем у обычных. При рождении и в раннем подростковом возрасте мыши-мутанты развивались нормально, но потом быстро приобретали старческие недуги: худели, теряли подкожный жир и лысели, у них развивались кифоз, остеопороз и анемия, фертильность снижалась, а сердце аномально увеличивалось. Такие мыши жили недолго.
Митохондрии и мозг
Основной потребитель энергии митохондрий — мозг: ему нужно в 10 раз больше кислорода и глюкозы, чем другим тканям. Потому дисфункция митохондрий еще и приводит к гибели нейронов, а гибель нейронов — к нейродегенерации и болезням Альцгеймера и Паркинсона, предполагают ученые.
Чтобы понять, как дисфункция митохондрий связана с болезнью Паркинсона, исследователи из Великобритании и Германии проанализировали состояние митохондрий и мозга здоровых пожилых людей и пожилых с болезнью Паркинсона. Сначала они взяли образцы мозга, тонко порезали и опустили в специальный краситель. Этот краситель связывается с одним из белков, который митохондрии используют для синтеза АТФ, — цитохромом С. Потом отмыли ткани мозга. Нейроны покрасились, но особенным образом: чем ярче окрас, тем больше цитохрома С в нейроне и тем здоровее митохондрии.
Яркие нейроны с большим количеством цитохрома С оказались у здоровых пожилых людей. У людей с болезнью Паркинсона нейроны окрасились не так ярко. Их митохондрии страдали от дефицита белка и хуже превращали кислород и глюкозу в энергию: у них попросту не хватало оборудования.
Возник новый вопрос: почему в митохондриях людей с болезнью Паркинсона так мало цитохрома С? Ученые предположили: ген митохондрий повредился так неудачно, что они не производят достаточно этого белка. Так и оказалось: информация потерялась, а почему — неизвестно. Поврежденные нейроны с неполным геномом были и у здоровых, и у больных пожилых людей. При Паркинсоне их просто было намного больше, а у здорового молодого человека — не было вовсе.
Как именно здоровье митохондрий влияет на нейроны? Исследовать мозг живого человека сложно, поэтому обратимся к исследованиям на мышах. Но сначала вспомним важную вещь: чтобы синтезировать АТФ, митохондрии добывают энергию из кислорода и еды. Но не вся эта энергия идет на синтез АТФ. Часть митохондрии тратят на обогрев тела, часть — на образование активных форм кислорода. А чтобы рассеивать энергию в виде тепла и согреть тело, у митохондрий есть специальные белки.
С этими белками и поиграли ученые, создав мышей с дефектами: одни не могли эффективно синтезировать белки для рассеивания тепла, другие — наоборот, синтезировали их больше обычного. Митохондрии мышей с недостатком белков-энергоотводов производили больше активных форм кислорода: энергии просто некуда было деться. У этих мышей еще и было меньше митохондрий в нейронах. То есть нейроны получали и больше вреда, и меньше энергии. Потом ученые использовали на мышах нейротоксин, который вызывает гибель нейронов и Паркинсон. Мыши с недостатком белков заболевали гораздо быстрее.
Митохондрии и иммунитет
Бактерия слилась с клеткой, стала производить для нее энергию — и стала митохондрией. Скорее всего, изначально эта бактерия обеспечивала хозяина еще и защитой. Активные формы кислорода она использовала, чтобы разрушить и переварить захваченные клеткой патогены — бактерии или вирусы. Возможно, именно это сотрудничество стало нашей иммунной системой.
Сейчас митохондрии помогают организму быстро и эффективно реагировать на травмы. Когда клетки повреждаются, высвобождается митохондриальная ДНК — и попадает в кровь. Митохондриальная ДНК похожа на бактериальную, поэтому организм считывает это как сигнал опасности и активирует иммунный ответ.
А еще митохондрии активируют иммунные клетки. Например — макрофаги. Когда макрофаги получают от организма сигнал, что в тело проник патоген, митохондрии макрофагов переквалифицируются из энергостанций в военные сооружения. Они перестают синтезировать АТФ и полностью переходят на синтез активных форм кислорода. Активные формы кислорода, во-первых, говорят организму, что самое время начать сражение с патогеном, а во-вторых, и сами могут его уничтожить.
Митохондрии активны и в Т-клетках. Это спецагенты иммунитета, которые проверяют другие клетки на наличие вирусов, а если находят заболевшие — уничтожают. Как и другие митохондрии, митохондрии Т-клеток сливаются друг с другом и, наоборот, разделяются, меняют форму и размер, чтобы адаптировать процесс производства энергии к состоянию организма. Когда все спокойно, они длинные: это помогает эффективнее работать и производить меньше активных форм кислорода. Но когда организм идентифицирует угрозу (это может быть физическая травма, например), митохондрии Т-клеток фрагментируются — и в крови становится много коротких сегментов митохондриальной ДНК. В таком состоянии митохондрии образуют больше активных форм кислорода и тем самым дают иммунитету понять, что пора действовать.
Митохондрии и психика
Когда мышь испытывает психологический стресс, ее Т-клетки активируются, а митохондрии фрагментируются так же, как если бы ее организм столкнулся с вирусом. Если же создать таких мышей, Т-клетки которых всегда активны, а митохондрии — фрагментированы, они будут тревожными, заторможенными, нелюбопытными и лишенными всякой мотивации. А это уже классическая депрессивная симптоматика. Что ставит перед учеными новый вопрос: что, если митохондрии виноваты в проблемах с настроением у человека?
Чтобы проверить гипотезу, исследователи заставили крыс конкурировать за социальную иерархию. Доминирующие позиции заняли животные с меньшим уровнем тревожности. Потом ученые изучили митохондрии прилежащего ядра мозга крыс — отдела, который регулирует эмоции и поведение что у грызунов, что у людей. Оказалось, у крыс-аутсайдеров митохондрии функционируют хуже. А еще в них меньше белков для превращения кислорода и глюкозы в энергию — то есть не хватает оборудования, чтобы митохондрия работала эффективно. Различие оказалось врожденным.
Неизвестно, делают ли нас, людей, тревожными и депрессивными врожденные особенности митохондрий так же, как и грызунов. Но на стресс митохондрии человека реагируют тем же образом. В одном эксперименте, например, людей подвергли стрессу: обвинили в краже или нарушении ПДД — и заставили за две минуты продумать стратегию защиты. В крови участников увеличилось количество митохондриальной ДНК, которая активировала иммунную реакцию, — совсем как в случае с мышами.
Как оценить состояние митохондрий?
Надежного и доступного не-ученым теста для оценки состояния митохондрий пока нет, хотя изобрести его исследователи пытаются. По словам биолога-физиолога, научного сотрудника Университета 2035 Екатерины Зворыкиной, все же есть два метода, которые позволяют примерно понять, насколько корректно они работают.
I. Эргоспирометрия
Простой способ оценить функциональность митохондрий — эргоспирометрия, которую регулярно делают спортсмены. До и во время выполнения физической нагрузки у человека регистрируют ЭКГ и отслеживают потребление кислорода. Человек бежит по беговой дорожке, а параллельно происходит анализ газообмена. Потом данные сравнивают с состоянием покоя и выводят коэффициент. Если показатель не соответствует норме, это может говорить о перетренированности. А перетренированность — косвенный признак, что митохондрии в плохом состоянии.
Информация полезна тем, кто много и усиленно тренируется. Остальным вряд ли стоит делать тест. Если результат плохой, это может говорить о развитии рака и ряда хронических заболеваний, но для их мониторинга есть и более удобные чекапы.
II. Биохимические тесты
Более точный метод — анализ биохимических маркеров. Помогут следующие тесты.
Но важно помнить: биохимические анализы разработаны для диагностики митохондриальных заболеваний, а не для оценки состояния митохондрий здоровых людей. То же повышение уровня лактата может быть маркером перетренированности, а может говорить о самых разных заболеваниях: от митохондриальной дисфункции до ишемической болезни. Интерпретировать результаты анализов нужно с врачом.
Как помочь митохондриям?
Главная причина нездоровья митохондрий — окислительный стресс, когда активных форм кислорода слишком много. Лекарств для митохондрий пока нет. Но помочь им можно, скорректировав образ жизни. Вот главные интервенции, которые советует биохимик и биохакер Екатерина Щербакова, научный сотрудник ФГБНУ «ЦНИИТ» и автор книги «Питание биохакера».
Ограничить калории
Мы едим, чтобы кормить митохондрии. И для них важно, сколько мы едим. Ограничение калорийности — единственная диета, которая безоговорочно увеличивает продолжительность жизни у лабораторных организмов: от дрожжей и мух до грызунов и обезьян. У них снижается уровень воспаления, а аутофагия, естественный процесс избавления от «клеточного мусора», активируется. В том числе активируется митофагия — аутофагия митохондрий, что позволяет удалять неработающие митохондрии.
Одновременно с этим повышается уровень нейротрофического фактора мозга (BDNF), что способствует формированию новых нейронов и синапсов. В результате ограничение калорий замедляет гибель нейронов у животных с болезнями Хантингтона, Альцгеймера, Паркинсона. А еще — снижает частоту возрастных заболеваний: рака, диабета, болезней сердца.
Почему так? Молекулярных бонусов ограничения калорий несколько. Например, оно приводит к восстановлению одного из главных клеточных антиоксидантов — глутатиона, а также уровня кофермента NAD+, который помогает превращать питательные вещества в энергию. А еще голод активирует сиртуины. Эти белки имеют две функции. Во-первых, выключают гены, использовать которые клетка в режиме голода не должна. Во-вторых, участвуют в устранении повреждений ДНК, в том числе — вызванных активными формами кислорода.
Морить себя голодом ради здоровья митохондрий не нужно. Достаточно урезать суточную калорийность рациона на 25%. Так сделали в одном американском исследовании со здоровыми людьми с лишним весом. Женщины, например, вместо 2200 ккал съедали 1650 ккал — что меньше нормы, но не настолько, чтобы мучиться от голода. Через шесть месяцев у участников эксперимента уменьшилось повреждение митохондриальной ДНК. Митохондрий стало больше, и они стали эффективнее функционировать. Похожие эффекты ученые наблюдают и у мышей при интервальном голодании.
Почему голод помогает митохондриям? С точки зрения организма, клетка в бедственном положении. Она бросает все силы на производство энергии. При этом активируются ферменты антиоксидантной защиты, репарации. В результате увеличивается и количество, и работоспособность митохондрий.
Кормить митохондрии витаминами и антиоксидантами
Просто ограничить калории недостаточно. Митохондрии нуждаются в витаминах, микроэлементах и антиоксидантах.
Подкармливать кишечные бактерии гранатом и орехами
В кишечнике человека живет множество бактерий. Среди них есть союзники, которые помогают иммунной системе распознавать патогены. Эти кишечные бактерии общаются не только с иммунными клетками, но и с митохондриями.
Странно ли это? Вовсе нет, если вспомнить о бактериальном происхождении митохондрий. Общаются митохондрии и бактерии на языке метаболитов. Например, бактерии выделяют короткоцепочечные жирные кислоты, которые нужны митохондриям для синтеза АТФ. Или уролитин А — вещество, которое активирует митофагию — процесс уничтожения дефектных митохондрий, которые уже производят не энергию, а активные формы кислорода.
Уролитин А синтезируют бактерии Eggerthellaceae. Они используют для этого вещества, которые есть во фруктах и ягодах (гранат, малина) и орехах (идеальный вариант — грецкий). А еще для Eggerthellaceae и для других кишечных союзников полезны клетчатка, ферментированная пища, пробиотики и пребиотики.
Больше двигаться
Самый эффективный способ улучшить работу митохондрий — регулярные тренировки: они увеличивают и количество, и качество митохондрий. Так происходит потому, что сокращение мышц — процесс энергозатратный. Сами по себе мышцы не сокращаются. Чтобы их стимулировать, организм использует АТФ. А АТФ синтезируют митохондрии. Потому стоит нам начать двигаться, как клетки адаптируются, чтобы получать больше АТФ: ведь она теперь активнее тратится.
Мышечные клетки ускоряют работу своих митохондрий: синтезируют белки, необходимые для расщепления жирных кислот, — и отправляют их в митохондрии. Митохондрии получают больше белков, расщепляют жиры быстрее, используют больше кислорода и глюкозы — и синтезируют больше АТФ. Параллельно мышечные клетки запускают процесс биогенеза митохондрий. Митохондрий в клетке становится больше — и мы получаем больше АТФ.
Но и это еще не все. Когда мы занимаемся спортом, клетка остро нуждается в АТФ и поднимает планку для митохондрий. Чтобы отсеять плохо работающие органеллы, она активно синтезирует специальные белки, которые проверяют, насколько хорошо те работают. Если белки обнаруживают, что митохондрия работает так себе, клетка ее уничтожает. Иными словами, когда мы активно двигаемся, мы избавляемся от дефектных митохондрий.
Тренироваться разнообразно
Различные типы тренировок воздействуют на различные типы мышечных волокон — и по-разному влияют на митохондрии. Обычно советуют аэробные тренировки: одного упражнения на выносливость уже достаточно, чтобы митохондрии стали работать немного эффективнее. При длительных тренировках объем митохондрий обычно увеличивается на 40–50%, и это происходит параллельно с улучшением работы митохондрий.
Но аэробные тренировки бывают разными — и по-разному влияют на мышцы и митохондрии. Продолжительные кардионагрузки вроде длительного бега, плавания и езды на велосипеде задействуют в первую очередь медленные мышечные волокна и митохондрии в них. Для адаптации митохондрий в красных мышечных и белых мышечных волокнах нужна высокоинтенсивная, но короткая тренировка. Например, интервальная тренировка спринта (SIT) или интервальная тренировка высокой интенсивности (HIIT) — они сочетают и аэробную, и анаэробную нагрузку.
А вот польза чисто анаэробных тренировок для митохондрий — вопрос спорный. Раньше считалось, что силовые тренировки не так хороши, как кардио: они увеличивают объем мышц, но не меняют качество самих мышечных клеток, а значит, не влияют на работу митохондрий. Но появляются новые данные, согласно которым упражнения с отягощениями стимулируют биогенез митохондрий в мышцах и производство митохондриями энергии [1, 2]. Так что самое практичное решение — сочетать разные типы нагрузки: и бегать на длинные дистанции, и делать интервальные тренировки высокой интенсивности, и не забывать про силовые тренировки.
Не забывать отдыхать
Спорт для митохондрий полезен, но не когда его слишком много. Если перестараться, можно повредить мышечные клетки, что приведет к их атрофии и синдрому перетренированности. А еще изнурительные тренировки стимулируют повышенное образование активных форм кислорода, что вредит митохондриям.
Также по теме. Микробиом: как полюбить полчища населяющих нас бактерий. Ссылка.
Митохондрии в клетках организма: раб или большой начальник?
В Главном здании МГУ имени М.В. Ломоносова состоялась лекция доктора биологических наук, профессора Дмитрия Борисовича Зорова «Митохондрии и болезни».
Митохондрия – это органоиды в клетках, являющиеся источником энергии для этих клеток. Они считаются частью клетки и отвечают за превращение органических веществ из пищи в энергию для тела.
«Самое важное значение этой органеллы состоит в том, что она вырабатывает аденозинтрифосфат (АТФ). Проще говоря, является «электростанцией» в нашем организме, без нее клетки не могут полноценно функционировать – постепенно «старятся» и погибают», – комментирует лектор.
В 1926 году Айвен Уоллин предположил, что митохондрии когда-то были самостоятельно живущими бактериями, а в процессе эволюции стали частью нашего организма. Даже находясь внутри человеческой клетки, митохондрия продолжает оставаться самостоятельной: у нее есть своя «кухня» по синтезу белка, включая и собственные молекулы ДНК и РНК.
Сегодня снова перед научным миром встает вопрос, что представляет собой митохондрия?
«Известно, что у митохондрии 1 500 собственных белков, и каждый из них имеет определенную функцию. Так, только часть белков отвечает за энергообразование, у другой же части белков – иные задачи. Революция произошла в 1996 году, когда митохондрии приписали новую роль – участие в клеточной гибели», – объясняет Зоров.
Существует 14 разных видов гибели клеток. В этот момент митохондрия «выпускает» из себя разные сигнальные вещества, которые можно рассматривать, как инициаторов окончательного процесса гибели клеток. Казалось бы, эта «убийственная» функция нежелательна, не нужна организму, однако, это не так. Ведь клетки в организме человека – разные, некоторых из них делятся. Если отменить деление клеток – организму будет «плохо», если же запретить уничтожение клеток – в организме могут начать развиваться фатальные процессы. Например, возникновение раковой опухоли.
При нарушении работы этих незаметных нам «энергоблоков» начинаются проблемы с энергообменом в клетке. При легких формах нарушения человек не выдерживает простых физических нагрузок, которые он способен переносить, исходя из своего возраста. Более серьезные нарушения провоцируют необратимые изменения в энергообмене, и как следствие, сильные нарушения в работе клеток.
«Для митохондрий не присуще рекомбинирование генов, но при этом скорость мутации значительно выше. Во время деления митохондрии распределение генов между новыми клетками имеет совершенно случайный характер. Вероятность возникновения мутации от 1 до 99%. Причем спрогнозировать ее нет никакой возможности. И чем больше больных генов, тем больше вероятность нарушения», – говорит Дмитрий Борисович.
Может ли человек сам влиять на работу митохондрий для предотвращения «коллапсов»?
«На самом деле, мы можем достаточно легко увеличить количество митохондрий в нашем организме и даже улучшить качество их работы. К слову, сделать это помогают фитнес-тренировки. Митохондрии не могут эффективно работать без кислорода. Именно физические нагрузки способствуют увеличению количества митохондрий и изменению их формы», – поясняет Зоров.
А что происходит в старости?
Когда основная масса митохондрий будет повреждена свободными радикалами или их количество резко сократится, то они не смогут производить достаточное количество энергии для поддержания жизни – наступает старение мышечных волокон человека. Это отражается на внутренних органах, которые начинают чахнуть.
«Однако если митохондриям дать возможность эффективно генерировать энергию, занимаясь физическими нагрузками аэробного характера, поддерживая низкокалорийную диету, то старение организма происходит не так стремительно», – подытоживает ученый.
Болезни и изменения клеточного метаболизма
Автор
Редакторы
Нейродегенеративные и онкологические болезни — самые распространенные возрастные патологии после болезней сердца и сосудов. Как показывают исследования, эти патологии тесным образом связаны с энергетическим обменом и митохондриальной дисфункцией. Детальное и масштабное изучение изменений клеточного метаболизма при развитии этих патологий способствует разработке более совершенных диагностических инструментов, позволяющих обнаруживать заболевание на самой ранней его стадии.
Биоэнергетика
Спецпроект о клеточном энергетическом метаболизме, работе митохондрий и АТФ, а также о заболеваниях, связанных с нарушениями функций клеточных «батареек».
Спонсор спецпроекта — «БиоХимМак» — поставщик научного и медицинского оборудования в лаборатории России и стран СНГ.
Наверное, у каждого, кто начинает знакомиться с удивительной организацией наших клеток, возникает чувство восхищения невероятной сложностью внутриклеточного мира. Каждую секунду в миллиардах наших клеток протекают сложные и строго скоординированные процессы. И одним из таких очень важных процессов является производство в митохондриях главной энергетической молекулы — аденозинтрифосфата, или АТФ. Сегодня уже хорошо известно, что работа митохондрий очень тесно связана со здоровьем и продолжительностью жизни [1]. Митохондрии производят энергию для поддержания жизни, но при этом они же служат основными источниками активных форм кислорода, избыток которых для клеток губителен.
Энергетический обмен
Любой живой организм находится в постоянной связи с окружающей средой, непрерывно обмениваясь с ней веществом. В этом процессе можно выделить три этапа:
Внутриклеточный метаболизм, в свою очередь, включает в себя два типа реакций: катаболизм и анаболизм.
Катаболизм — это процесс расщепления и окисления органических молекул, приводящий к образованию тепла и энергетических молекул, АТФ. Именно за счет постоянного производства—расщепления последних съеденные нами калории направляются «по адресу»: гидролиз двух высокоэнергетических (макроэргических) связей в молекулах АТФ обеспечивает энергией всевозможные синтетические и транспортные процессы в клетках.
На первом этапе катаболизма под воздействием пищеварительных ферментов сложные органические соединения (белки, полисахариды, жиры) распадаются на более простые — аминокислоты, моносахариды, жирные кислоты и глицерин, — которые клетка использует для реакций анаболизма (пластического обмена) и получения энергии. Аминокислоты идут на синтез белков. Жирные кислоты выполняют энергетическую функцию, входят в состав клеточных мембран и служат субстратом для синтеза эйкозаноидов
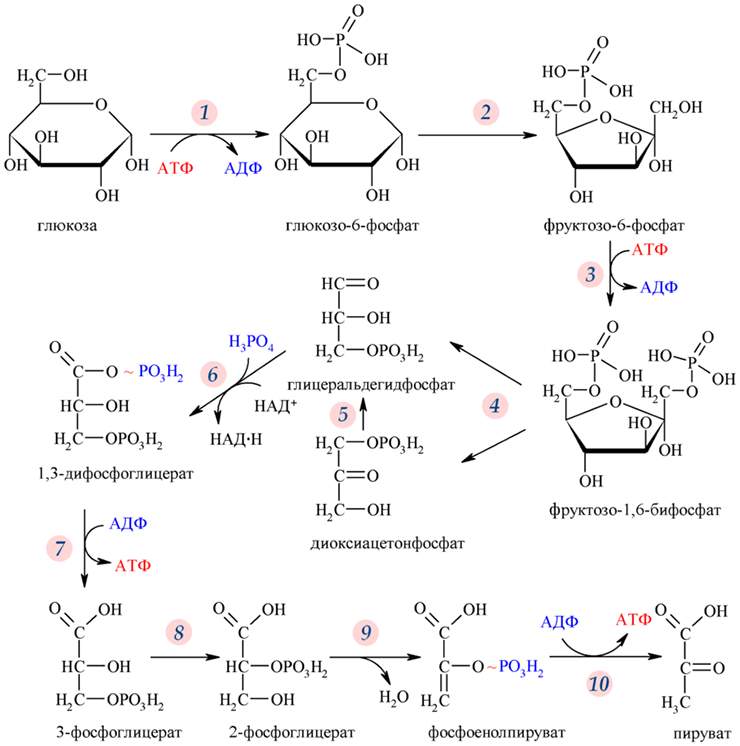
На втором этапе происходит гликолиз — расщепление молекул глюкозы (рис. 1) до пировиноградной кислоты (ПВК). Дальнейший ход реакций зависит от присутствия или отсутствия кислорода в клетке. Если кислорода нет (анаэробный процесс), то ПВК у микроорганизмов и растений будет превращаться в этанол, а в организме животных — в молочную кислоту [2]. Каждый, кто подвергал себя тяжелым физическим нагрузкам, мог почувствовать конечный результат анаэробного метаболизма в виде боли и скованности в мышцах из-за скопившейся в них молочной кислоты.
Рисунок 1. Реакции гликолиза. На 10 этапах гликолиза (пяти подготовительных и пяти этапах синтеза АТФ) из шестиуглеродной молекулы глюкозы образуются две трехуглеродные молекулы пировиноградной кислоты. Полученная от расщепления глюкозы энергия запасается в «энергетической валюте» клетки — двух молекулах АТФ и двух молекулах НАДФ.
Если же кислород в клетке есть, ПВК будет расщепляться на углекислый газ и воду и тоже высвобождать заключенную в углеводной молекуле энергию. Этот процесс называется аэробным клеточным дыханием и проходит в специальных органеллах — митохондриях. Окисление в митохондриях дает гораздо больше энергии, чем гликолиз.
Митохондрии и производство АТФ
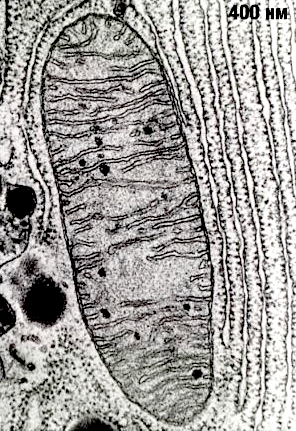
Рисунок 2. Митохондрия под электронным микроскопом.
Митохондрии — настоящее биологическое чудо, сотворенное эволюцией. Несмотря на очень маленький размер (в одной клетке может быть более 1000 митохондрий), эти органеллы поражают чрезвычайно сложной организацией (рис. 2). Они представляют собой вытянутые «пузырьки», окруженные двумя мембранами. Считается, что митохондрии сформировались в результате поглощения археями-фагоцитами пурпурных фотосинтезирующих бактерий, которые, приспосабливаясь к избытку кислорода, освоили аэробное дыхание [3], [4]. Мембраны митохондрий состоят из липидов и гидрофобных, нерастворимых в воде белков. (Здесь мы так подробно описываем строение митохондрий не случайно, а для того чтобы потом было понятно, как их нормальная работа и дисфункция влияют на здоровье.)
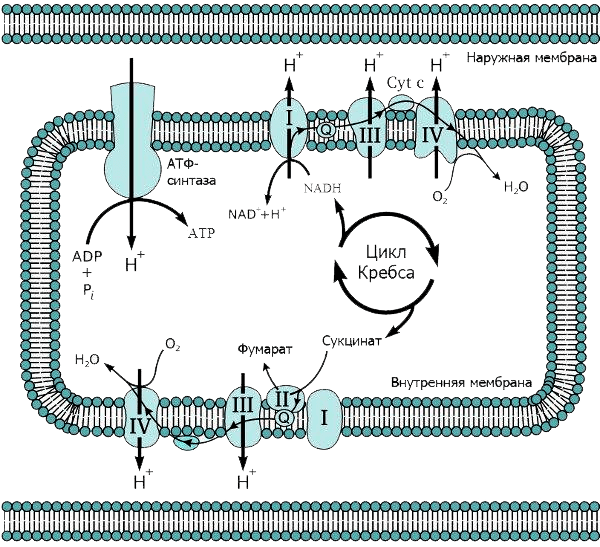
Строение мембран очень важно для процесса дыхания. Внешняя мембрана митохондрий — гладкая, а внутренняя — многократно складчатая. Эти складки (или кристы) позволяют увеличить рабочую площадь мембраны, что необходимо для размещения там всего комплекса белков, осуществляющих дыхание. Вначале окисляются углеродные атомы углеводов, жирных кислот и аминокислот до СО2 (гликолиз, цикл Кребса и β-окисление жирных кислот), а полученные таким образом электроны используются для образования НАДФ. Далее НАДФ окисляется молекулярным кислородом с образованием воды. НАДФ-оксидазная реакция сопровождается выделением очень большого количества свободной энергии (около 1,1 эВ при переносе одного электрона с НАДФ на кислород), которая может запасаться дыхательной цепью в виде трансмембранной разности электрохимических потенциалов ионов H+ (протонов).
Работа же дыхательных белков-ферментов похожа на работу насосов: передавая электроны друг другу, они перекачивают протоны в межмембранное пространство (см. видео 1). В результате внутренняя мембрана митохондрии заряжается подобно конденсатору. Создаются потенциалы: электрический (положительные заряды — снаружи митохондриальной мембраны, отрицательные — внутри органеллы) и химический (возникает разница концентраций протонов: внутри митохондрии их меньше, снаружи — больше). Известно, что электрический потенциал на мембране митохондрий, которая служит хорошим диэлектриком, достигает 200 мВ при толщине мембраны всего 10 нм [5]. Для сравнения: потенциал действия на мембранах нервных клеток при передаче сигнала достигает всего 30 мВ.
Видео 1. Как работает митохондрия
Накопившись в межмембранном пространстве, протоны, подобно электрическому току, устремляются назад, в митохондрию — туда, где их концентрация ниже. Однако они могут проходить только по специальным каналам АТФ-синтазы, встроенной во внутреннюю мембрану: протонный канал (ротор) этого фермента закреплен в мембране, а каталитический комплекс торчит внутрь митохондрии, в матрикс (рис. 3). Поток протонов раскручивает ротор, как река водяную мельницу. В результате ротор вращается с невероятной скоростью — 300 оборотов в секунду (см. видео 2)! И именно это вращение приводит к образованию высокоэнергетической молекулы — АТФ [6]. Подсчитано, что в сутки в организме взрослого человека синтезируется и расходуется около 40 кг АТФ, при этом жизнь каждой молекулы очень коротка.
Рисунок 3. Схема дыхательной цепи митохондрий.
Видео 2. Работа АТФ-синтазы в мембране митохондрии
Всё вышесказанное имеет самое непосредственное отношение к старению. Дело в том, что в процессе дыхания ферменты работают не совсем «чисто», и в результате образуются побочные продукты — активные формы кислорода (АФК). Пока человек молод и здоров, образующиеся в митохондриях АФК не представляют для него ощутимой угрозы, так как легко нейтрализуются организмом. Но когда человек стареет, ведет нездоровый образ жизни или имеет генетическую предрасположенность к определенным болезням, его защитные системы дают сбой, рушась одна за другой.
Жирные кислоты и дисфункция митохондрий
То, что старение и возрастные патологии сопровождаются дисфункцией митохондрий, которые начинают производить меньше АТФ и хуже обновляться, уже ни у кого не вызывает сомнения. Выяснилось также, что дисфункция митохондрий и старение тесным образом связаны с повышением уровня свободных жирных кислот в крови [7], чему сильно способствуют малоподвижность и нерациональное питание. Жирные кислоты, попадая в клетку, способны напрямую снижать синтез АТФ, разобщая окисление и фосфорилирование. Этот связанный с терморегуляцией организма феномен был открыт еще шесть десятилетий назад академиком Скулачевым и его коллегами [8]. Снижение синтеза АТФ, в свою очередь, запускает сразу несколько негативных цепных реакций, связанных с возрастными болезнями и старением в целом.
И вот что происходит. Повышение уровня свободных жирных кислот в организме приводит к резистентности к инсулину: инсулинзависимые клетки перестанут реагировать на этот гормон. В результате нарушается усвоение глюкозы и жирных кислот, ухудшается окисление последних. Дело в том, что характерный для состояния инсулинорезистентности высокий уровень инсулина активирует целый каскад реакций, который блокирует работу фермента карнитинпальмитоилтрансферазы I (СРT1), участвующего в переносе жирных кислот внутрь митохондрий [9]. Из-за этого ухудшается синтез АТФ, а жирные кислоты накапливаются в цитоплазме клеток, вызывая эффект липотоксичности. Кроме резистентности к инсулину, избыток жирных кислот в организме вызывает резистентность к еще одному «пищевому» гормону — лептину. А из-за этого страдает функция одного из главных участников биогенеза (обновления) митохондрий — коактиватора рецептора гамма, активируемого пролифераторами пероксисом (PGC-1α). В итоге митохондрии производят меньше АТФ, стареют, погибают и провоцируют гибель клеток путем апоптоза [10].
Ну и наконец, избыток жирных кислот вызывает стресс эндоплазматического ретикулума (ЭПР) — внутриклеточного органоида, участвующего в синтезе белков и множестве других процессов. При стрессе ЭПР в цитоплазму высвобождаются ионы кальция, способные вызывать дисфункцию и гибель митохондрий [11]. Ионы кальция могут накапливаться в клетке и по другой причине — из-за ухудшения работы ионных насосов, откачивающих кальций из клетки. А причиной этому служит нарушение работы митохондрий, сопровождающееся снижением синтеза АТФ, без которого отказываются работать ионные насосы. В итоге формируется порочный круг: снижение выработки АТФ приводит к дисфункции митохондрий, что еще больше снижает выработку АТФ, и т.д.
Жирные кислоты, церамиды и повреждения нейронов
Как выяснилось, избыток жирных кислот и дисфункция митохондрий напрямую связаны с возникновением возрастных нейродегенеративных патологий. Надо сказать, что клетки нервной системы — самые уязвимые для возрастного окислительного стресса и снижения синтеза АТФ. Такая исключительная чувствительность нейронов к дефициту энергии и повышению генерации АФК объясняется несколькими причинами.
Во-первых, нервная ткань в силу своей физиологии нуждается в наибольшем потреблении кислорода. Вследствие этого в митохондриях нейронов происходит интенсивный окислительный метаболизм, который и становится основной причиной повышенной генерации АФК.
Во-вторых, из-за того, что мембраны нейронов содержат много ненасыщенных жирных кислот, они легко подвергаются перекисному окислению липидов. Так как активность антиоксидантных систем в ткани головного мозга ниже, чем в других органах, а с возрастом сокращается и количество некоторых ферментов-антиоксидантов, становится понятным, почему клетки нервной системы наиболее чувствительны к окислительным повреждениям [12].
В настоящее время известно несколько факторов, повреждающих нейроны. Среди них — белки, образующие внутри- и внеклеточные агрегаты (β-амилоидный белок и другие), а также церамиды и липофусцин. На их количество влияет прежде всего избыток жирных кислот в организме. Отягчающим обстоятельством в этом случае выступает чрезмерное содержание насыщенных кислот (пальмитиновой и стеариновой) в пищевом рационе. Всё это вместе служит мощным стимулом развития разнообразных нейродегенеративных заболеваний, таких как болезнь Альцгеймера [13], [14].
Но каким же образом пальмитиновая кислота может способствовать нейродегенерации? Установлено, что из-за избытка этой кислоты накапливаются церамиды, которые участвуют в регуляции терминальной дифференцировки, пролиферации и апоптоза нейронов. Посредством нескольких химических реакций они воздействуют на регуляторы клеточного цикла, повышая концентрацию ингибиторов киназ p21/SDI1 и p27/KIP1. Таким образом церамиды останавливают клеточный цикл, что, в свою очередь, активирует главного «стража генома» — белок р53 — и «насылает» на клетку апоптоз [15]. Кроме этого, при деградации церамида образуется вещество сфингозин, обладающее цитотоксическим действием и способное вызывать как апоптоз, так и некроз клеток. Но и это еще не всё. Обнаружено, что накопление насыщенных жирных кислот (пальмитиновой и стеариновой) стимулирует специальные клетки головного мозга (астроглию) на эндогенный (внутренний) синтез церамидов. Эти произведенные церамиды запускают цепную реакцию следующего вида: церамиды → повышение секреции провоспалительных цитокинов и оксида азота → увеличение производства АФК и окислительный стресс → активация стресс-регулируемых киназ (CDK5 и GSK-3) в нейронах → образование β-амилоидного белка и гиперфосфорилирование τ-белка [16].
Нейродегенеративные патологии и дисфункция митохондрий
Сегодня важнейшими и самыми распространенными нейродегенеративными патологиями считают болезни Альцгеймера, Паркинсона, Хантингтона, а также боковой амиотрофический склероз. Их возникновение связывают со структурными изменениями различных белков, приводящими к образованию внутриклеточных агрегатов. К таким белкам относятся:
Болезнь Альцгеймера (БА) — тяжелое нейродегенеративное заболевание, для которого характерны синаптическая дисфункция и гибель нейронов, что сопровождается снижением когнитивных способностей: ухудшением памяти и мышления, постепенной потерей социальных и моторных навыков [17]. В зоне риска развития болезни находятся в основном пожилые люди. Лишь 1–2% людей в возрасте до 65 лет страдают БА. Согласно одной из гипотез развития БА — амилоидной, — болезнь возникает из-за накопления в головном мозге агрегатов β-амилоида. Этот пептид состоит из 39–43 аминокислотных остатков и является фрагментом крупного трансмембранного белка под названием предшественник бета-амилоида (amyloid precursor protein, APP). Находясь в избытке, молекулы β-амилоида начинают «склеиваться» и образовывать нерастворимые бляшки (рис. 4). Именно в таком состоянии белок нарушает работу нервных клеток и вызывает симптомы БА. У страдающих БА в пораженных участках мозга находят большое количество амилоидных бляшек и нейрофибриллярных клубков [18].
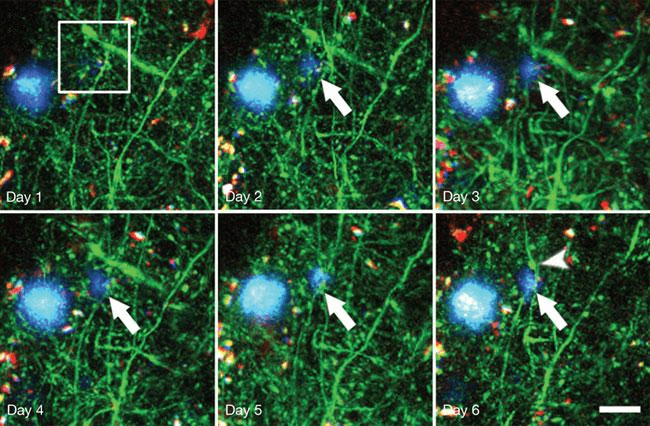
Рисунок 4. Образование амилоидной бляшки у генно-инженерных мышей (показано длинной стрелкой). На 6-й день уже видна дистрофия нейрона (короткая стрелка). Синим цветом обозначены отложения амилоида, зеленым — нейроны. Длина масштабной линейки — 20 мкм; снимки сделаны с помощью мультифотонного микроскопа.
Однако амилоидная гипотеза — не единственная, объясняющая возникновение БА. В 1993 году Аллен Роузес, профессор Университета Дьюка, предложил еще одну гипотезу возникновения БА — генетическую, связанную с геном APOE, кодирующим аполипопротеин Е (ApoE). Выяснилось, что наследование одного из вариантов гена APOE — APOE4 — в несколько раз повышает шансы заболеть БА. Всё больше исследователей склоняются к мысли, что β-амилоид излишне «демонизирован» и не является первопричиной развития БА. Неудавшаяся терапия, направленная на очистку клеток от β-амилоида, подтверждает, что с этой болезнью не всё до конца ясно [19].
Болезнь Паркинсона (БП) — еще одно тяжелое и довольно распространенное возрастное нейродегенеративное заболевание. У больных БП в нейронах черной субстанции накапливается α-синуклеин, который образует особые гранулы — тельца Леви. Надо сказать, что существует так называемая деменция с тельцами Леви, для которой характерно скопление многочисленных телец Леви в кортикальных и субкортикальных нейронах и развитие прогрессирующего когнитивного расстройства уже в первый год заболевания. Но пока не совсем ясно, считать ли эту деменцию формой БП или же правильнее ее рассматривать как отдельное заболевание. В случае БП скопления телец Леви приводят к дисфункции нейронов и их гибели, при этом характерно поражение областей мозга из состава так называемого нигростриарного дофаминового пути. Этот путь регулирует двигательную активность, снижая напряжение в мышцах. Вот почему, когда гибнут дофаминовые нейроны, у больных возникают соответствующие симптомы: нарастающее повышение мышечного тонуса и дрожание рук. Кроме нарушения моторных функций для БП характерны и другие симптомы, связанные с нарушением сна, депрессией, тревогой, ухудшением зрения и замедлением мышления [20].
Болезнь Хантингтона (БХ) — тоже не слишком редкое нейродегенеративное заболевание [21]. Как и в случае болезни Альцгеймера, для патогенеза БХ характерно образование токсичных белковых агрегатов с участием мутантных форм белков, которые синтезируются в нервной ткани. Но если к основному «виновнику» БА, β-амилоиду, у ученых есть вопросы, в случае с БХ сомнений гораздо меньше. Установлено, что именно генетические особенности — полиморфизмы определенных участков ДНК — приводят к появлению патологических форм белка хантингтина. Такой хантингтин способен к ассоциации с другими белками нервной ткани, в результате чего образуются нерастворимые токсичные агрегаты, повреждающие кору и полосатое тело головного мозга. Для БХ типичны всплески непроизвольной двигательной активности, эмоциональные расстройства и потеря памяти. В то же время нормальная физиологическая функция белка хантингтина в организме остается под вопросом. Предполагают, что он играет какую-то роль в эмбриогенезе [22].
Все три упомянутые патологии самым тесным образом связаны с дисфункцией митохондрий. Прежде всего, надо отметить, что ее развитие под действием дефектных белков, специфичных для нейропатологий, было установлено несколькими способами: in vitro (на клеточных линиях и внеклеточных системах) и in vivo (на трансгенных животных). Обнаружили и обратную связь: оказалось, что дисфункция митохондрий может стимулировать появление дефектных белков. Так, нарушение активности дыхательного комплекса I ведет к накоплению в нервных клетках гиперфосфорилированного τ-белка и α-синуклеина [23].
Со скоплением дефектных белков связали и уже упоминавшийся стресс эндоплазматического ретикулума. Один из таких белков, α-синуклеин, может снижать активность протеасом, что заканчивается стрессом ЭПР, увеличением производства АФК и инициацией апоптозных процессов. Это происходит потому, что из митохондрий высвобождается апоптозный фактор, цитохром С, который активирует «клеточных убийц» — каспазу-9 и каспазу-3 [24]. Как полагают, на начальных этапах нейродегенерации при БА накопление β-амилоида и гиперфосфорилирование τ-белка могут быть физиологическими механизмами защиты клетки от окислительного стресса, вызванного прогрессирующей митохондриальной дисфункцией. Однако при избыточном накоплении этих белков в клетке происходит сбой в работе митохондрий. Так, у пациентов с БА обнаружили, что β-амилоид накапливается в митохондриях и нарушает реакции гликолиза и цикла Кребса, активизирует продукцию АФК. Более того, β-амилоид способен напрямую подавлять синтез АТФ. Это возможно из-за структурного сходства белка с естественным ингибитором F(1)-субъединицы АТФ-синтазы митохондрий. Также β-амилоид может взаимодействовать с митохондриальной мембраной, формируя стабильные комплексы с двумя транслоказами, TOM40 и TIM23. Такие комплексы подавляют импорт в митохондрии белков, кодируемых ядерным геномом, — субъединиц IV и Vb цитохромоксидазы. На что органелла откликается увеличением производства агрессивного пероксида водорода.
Но и это еще не всё: белок — предшественник β-амилоида может формировать поры в мембранах митохондрий и других органелл, что нарушает ионный баланс в клетке и запускает ее апоптоз [25]. Также этот белок повышает активность фосфолипазы D, в результате изменяя фосфолипидный состав митохондриальных мембран, увеличивая концентрацию фосфатидилхолина, фосфатидилэтаноламина и фосфатидной кислоты и нарушая работу мембран. Известно, что β-амилоид может связывать гем, а это ведет к дефициту гема в клетке, из-за чего нарушается работа гем-содержащего IV комплекса электронтранспортной цепи митохондрий [26].
Но не только β-амилоид способен негативно влиять на митохондрии. В экспериментах с трансгенными грызунами, экспрессирующими ген хантингтина человека, обнаружили агрегацию этого белка в митохондриях с последующим развитием их дисфункции. Другой «зловредный» белок, α-синуклеин, накапливаясь во внутренней митохондриальной мембране, способен снижать активность дыхательного комплекса I. Как следствие, митохондрии увеличивают продукцию АФК [27]. Также обнаружено, что α-синуклеин, взаимодействуя с митохондриями, может стимулировать высвобождение из них цитохрома С, а значит, инициировать апоптоз.
В целом, можно сказать, что запуск апоптоза — характерный эффект белков, вызывающих нейродегенерацию. Они могут прямо или косвенно воздействовать на регуляторные белки, связанные с апоптозом: p53, Akt, Bad, Bax, Bcl-x(L) и кальцинейрин [28].
Также описано, что сверхсинтез белка — предшественника β-амилоида приводит к повреждению системы слияния—деления митохондрий. Негативно влияют на эту же систему и на утилизацию дефектных митохондрий аутофагосомами мутации гена паркина (PARK2), обнаруженные у больных БП. Дефектные формы τ-белка и хантингтина тоже мешают нормальной работе митохондрий, ухудшая тем самым энергообеспечение отростков нервных клеток и синаптическую передачу, вызывая дегенерацию синапсов [29].
Таким образом, белки, участвующие в развитии нейродегенеративных патологий, могут способствовать митохондриальной дисфункции посредством целого ряда механизмов. В свою очередь, уже возникшая дисфункция может усугублять патологические процессы, стимулируя появление дефектных белков и замыкая тем самым порочный круг развития болезни.
Эффект Варбурга
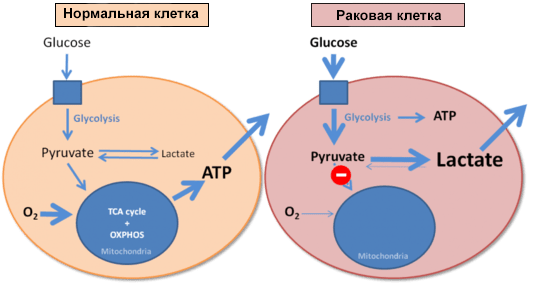
И напоследок стόит коснуться еще одного момента, связанного с патологиями и изменением клеточного метаболизма. В 1926 году немецкий биохимик Отто Варбург сравнил скорости образования молочной кислоты (лактата) в нормальных и опухолевых клетках. Оказалось, что опухолевые клетки потребляют очень много глюкозы, образуя при этом лактат. И делают это они гораздо быстрее, чем нормальные клетки: злокачественная ткань в эксперименте производила молочную кислоту в восемь раз активнее, чем это происходит в мышце, выполняющей физическую работу. Варбург установил, что раковые клетки используют гликолиз для получения энергии вне зависимости от доступности кислорода (рис. 5) [30]. В честь первооткрывателя этот феномен назвали эффектом Варбурга [2].
Рисунок 5. Энергообеспечение нормальной и раковой клеток. Синим квадратом обозначена поступающая в клетку глюкоза.
Обнаружив этот эффект, Варбург логично предположил, что его можно объяснить дисфункцией митохондрий в опухолевых клетках и нарушением окислительного фосфорилирования. Сегодня эта точка зрения ставится под сомнение, так как и в перерожденной ткани обнаруживают большое количество нормально работающих митохондрий. Около половины всей энергии опухолевые клетки получают из молекул АТФ, произведенных в митохондриях [31]. Эффект Варбурга проявляется в клетках уже в самом начале их трансформации в опухолевые. И это дает возможность проводить раннюю диагностику неопластических процессов: как только клетка начала расходовать глюкозу в повышенных масштабах, пора бить тревогу. Обнаружить эти процессы можно с помощью позитронно-эмиссионной томографии с использованием фторированного аналога глюкозы, 2-( 18 F)-2-дезокси-D-глюкозы.
Но зачем раковые клетки переходят на анаэробный гликолиз? Сейчас считается, что так они получают преимущество, заранее подготавливаясь к «тяжелым временам» — развитию гипоксии. А кроме этого, такой способ энергообеспечения дает клеткам возможность использовать промежуточные продукты гликолиза для анаболических реакций, усиления своей антиоксидантной защиты и отражения иммунной атаки организма [32].
Таким образом, изменения в метаболизме глюкозы и появление дефектных белков и внутриклеточных агрегатов могут говорить о начале развития патологии. Своевременное выявление подобных внутриклеточных процессов может сыграть решающую роль в предупреждении и терапии самых распространенных нейродегенеративных и онкологических заболеваний. А для того чтобы это было возможным, необходимо изучать фундаментальные аспекты патологий, связанные с работой митохондрий и энергетическим обменом. Сегодня уже разработаны системы, позволяющие заглянуть «вглубь» этих заболеваний и даже провести диагностику на самой ранней стадии их развития. Подробнее об этих системах, принципах их действия и исследованиях с их использованием расскажут следующие статьи спецпроекта.
ЗАО «БиоХимМак» — спонсор спецпроекта по биоэнергетике
Компания более 25 лет успешно занимается поставками научного и медицинского оборудования российских и зарубежных производителей: Beckman Coulter, Bio-Rad, Molecular Devices, Thermo Fisher Scientific, UVP, Seahorse Bioscience (part of Agilent), Immucor, MRC Holland и др. «БиоХимМак» обслуживает более 5000 научных и медико-диагностических лабораторий в России и странах СНГ.
Отдел молекулярной диагностики (Life Science MDx)
Молекулярная онкология, преимплантационный скрининг, цитогенетика, пренатальные и постнатальные исследования, диагностика инфекций, наследственных, мультифакторных заболеваний, детекция генномодифицированных источников и бактериального загрязнения в продуктах питания, криминалистические приложения — это лишь неполный перечень областей, которые входят в сферу интересов отдела.
Основные направления деятельности отдела:
Отдел работает как с инновационной продукцией (MLPA, PGS и NGS исследования, клеточная биоэнергетика Agilent Seahorse Bioscience), так и с зарекомендовавшими себя мировыми брендами — Beckman Coulter, Bio-Rad, Molecular Devices, UVP, Thermo Fisher Scientific.
Материал предоставлен партнёром — компанией «БиоХимМак»