Митохондрии в клетке осуществляют что
Митохондрии: энергостанции нашего организма
На молекулярном уровне наш организм можно рассматривать как своеобразный биологический механизм. Очень сложную, многогранную, но, тем не менее, машину, принципы работы которой мы сегодня начинаем понимать все лучше и лучше. И один из этих принципов является по-настоящему фундаментальным: никакая машина не сможет работать без притока энергии.
Для более простых механизмов этот принцип нам понятен, что называется, на интуитивном уровне. Двигатель автомобиля получает энергию, сжигая топливо в баке, телевизор использует энергию тока в розетке и так далее. Но вот с нашей собственной биологической машиной – нашим телом – все не так очевидно. То есть, наверняка наш читатель знает, что мы берем энергию из пищи (и об этом мы уже рассказывали более подробно). Но вот как именно это происходит? Где и как в нашем теле условные углеводы или жиры превращаются в ту движущую силу, которая необходима для всех без исключения процессов, протекающих в организме?
Клеточные «электростанции»
Основные объемы энергии в человеческом теле вырабатываются внутри отдельных клеток. Можно сказать, что каждая из них самостоятельно отвечает за собственное энергоснабжение. А это значит, что в каждой клетке (как минимум в тех клетках, которые имеют ядра, эритроциты не в счет), должна быть своя «электростанция». И это действительно так! Более того, нередко таких «электростанций» имеется несколько десятков или даже сотен. Зависит их число от того, насколько интенсивно работает клетка, а значит, и от того, насколько много ей требуется энергии в единицу времени. Научное название таких «электростанций» – митохондрии, а их совокупность именуют митохондриальным пулом клетки.
Как появились митохондрии?
Один из важных вопросов, который давно беспокоил научную общественность: а откуда вообще взялись митохондрии в наших клетках? Самая современная и достоверная теория предлагает крайне необычный ответ: митохондрии – это потомки бактерий.
Давным-давно одноклеточные организмы, которым предстояло стать нашими предками, научились поглощать крохотные бактерии, присутствующие в окружающей среде. Если попросту – они ими питались. Но в один прекрасный день такая протобактерия не разрушилась, попав во внутриклеточную среду. И более того, она сохранила не только целостность, но и кое-какие свои функции. В частности, способность вырабатывать энергию с помощью кислорода. Каков до этого был механизм получения энергии у тех одноклеточных, которые впоследствии станут нами, известно плохо. Но с уверенностью можно сказать, что аэробный путь, предложенный им проглоченной бактерией, был однозначно более выгодным и эффективным.
Результатом этого удивительного события стал внутриклеточный симбиоз. Бактерия вырабатывала много энергии, а одноклеточный организм-хозяин снабжал ее достаточным количеством кислорода и других необходимых соединений. Со временем протобактерия упростилась, видоизменилась и стала необходимой клеточной органеллой. Этот союз оказался настолько успешным, что сейчас на нем построено энергоснабжение практически всех эукариотических клеток растений, грибов и животных. В том числе и нас с вами [1].
Как устроены митохондрии?
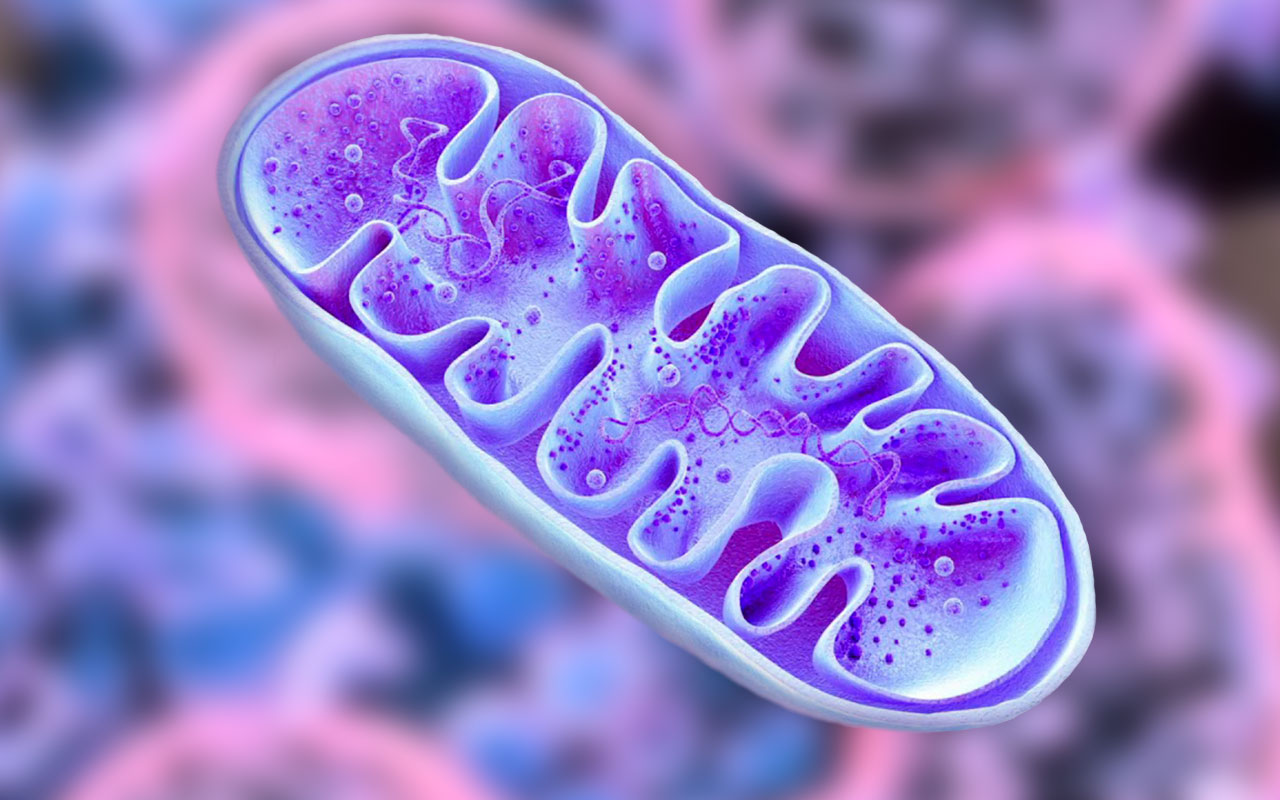
Многое в строении митохондрий до сих пор напоминает о том, что когда-то они были самостоятельными бактериями. Так, например, они окружены внешней липидной мембраной – такую мембрану имеют и все остальные клетки нашего организма. Основная функция внешней мембраны – защита митохондрии, отграничение ее от окружающей внутриклеточной среды, а также транспортировка необходимых веществ внутрь и выведение результатов ее работы наружу [2].
Внутреннее пространство митохондрии занимает матрикс. Это жидкая среда, состоящая из смеси жирных кислот, белков, рибосом и других соединений. В матриксе проходит первая стадия кислородного дыхания, то есть, выработки энергии. Кроме того, здесь находится и еще одно свидетельство прошлой самостоятельности митохондрий – митохондриальная ДНК. Да, оказывается, не весь наш генетический материал помещен в клеточное ядро! Эти небольшие кольцевые митохондриальные ДНК (мтДНК) кодируют 13 белков, которые нужны для работы самой митохондрии. В основном это ферменты, участвующие в дыхательной цепи окисления водорода [3].
Что еще интересно: люди наследуют мтДНК исключительно по материнской линии, а мтДНК, полученная от сперматозоида, разрушается сразу после оплодотворения [4]. Эта «женская» мтДНК мутирует по очень четким законам и поэтому можно отследить то, как именно она изменялась с течением времени. Ряд исследований последних лет убедительно доказал, что примерно 200 000 лет назад в Африке жила женщина, от которой свою мтДНК получило все современное человечество. Ученые поэтически назвали эту женщину «митохондриальной Евой» [5].
Наконец, между внешней мембраной и матриксом имеется и вторая, внутренняя мембрана. Она очень неровная и образует кристы – длинные складки, направленные к центру митохондрии. Именно их – как темные полосы – видели первые исследователи XIX века. На внутренней мембране как раз и происходит запасание энергии в виде молекул аденозинтрифосфата (АТФ). В процессе этого потребляется более 80% того кислорода, который попадает в нашу кровь при дыхании [6].
Чем еще заняты наши митохондрии?
Основная функция этих органелл – обеспечение энергией всех протекающих в клетке процессов. Однако, помимо этого митохондрии выполняют и еще целый ряд витальных (жизненно важных) функций. В их числе:
Опираясь на данные современных исследований, можно смело утверждать, что митохондрии, во-первых, активно участвуют во внутриклеточных процессах, а во-вторых, влияют и на физиологию всего организма. Такая «широкая специализация» стала причиной того, что нарушения работы митохондрий сегодня рассматривают как одну из важных причин появления множества заболеваний [12].
Что будет при нарушении работы митохондрий?
Очевидно, что самым первым и самым ярким проявлением дисфункции митохондрий будет уменьшение выработки энергии в клетке. На клиническом уровне такое обстоятельство может проявляться по-разному. И больше всего пострадают те ткани, которые работают максимально активно, а значит, требуют наибольшего притока энергии [13]:
Кроме того, учитывая другие функции митохондрий, о которых мы рассказывали выше, их неправильная работа может становиться фактором риска развития многих нарушений [14]:
Как улучшить работу митохондрий?
На настоящий момент предложены две стратегии того, как улучшить функции митохондриального пула. Первая связана с тем, что митохондрии, как органеллы, не статичны. Они могут сливаться, делиться, увеличиваться и уменьшаться в размерах, а также обмениваться своим генетическим материалом [15]. Это тоже своеобразное «наследие» их бактериального прошлого. В ходе таких слияний и делений поврежденные участки митохондрий и мтДНК отсеиваются и распадаются. Итогом становится образование новых, полноценных митохондрий, которые намного лучше выполняют все свои функции. То есть, благодаря этим процессам происходит обновление всего митохондриального пула клетки [16].
Мы имеем возможность ускорить это обновление. В частности, таким действием обладает функциональный продукт здорового питания под названием T8 ERA MIT UP, который недавно выпустила на рынок компания VILAVI INT LTD. В этом продукте содержится концентрат гранатового сока, который богат веществами под названием эллаготаннины [17]. Попадая в наш желудок, они быстро распадаются с образованием эллаговой кислоты, а ее, в свою очередь, перерабатывают кишечные бактерии, производя уролитин А [18]. Это соединение как раз и стимулирует митохондрии активнее обновляться путем слияния и деления. Уже есть исследования, которые показывают, что дефицит уролитина А – важный фактор преждевременного старения [19]. Помимо этого, доказано, что приток этого вещества увеличивает сопротивляемость физическим и умственным нагрузкам как раз за счет улучшения выработки энергии в митохондриях [20].
Вторая стратегия основана на защите митохондрий от разрушающего воздействия оксидативного стресса. Как мы уже говорили, в ходе выработки энергии они также синтезируют активные формы кислорода. Это молекулы-суперокислители (они же – свободные радикалы), которые играют сигнальную роль. Но, помимо этого, они обладают и немалой химической агрессивностью, являясь основной причиной оксидативного клеточного стресса [21]. А еще один действующий компонент активной формулы T8 ERA MIT UP – комплекс SibXP, содержащий полипренолы, клеточный сок пихты и хвойную пасту CGNC. При этом полипренолы – это многоатомные спирты растительного происхождения, которые обладают выраженной антиоксидантной активностью. Именно это их свойство и важно для улучшения функции митохондрий. Полипренолы химически связывают свободные радикалы, не давая им повреждать митохондриальные мембраны и ферменты. Благодаря этому выработка энергии в клетке и поддерживается на необходимом уровне [22].
Источники
1. Evans A., Neuman N. The Mighty Mitochondria. Molecular Cell. 2016, March, 3, 61 (5): 641.
2. André J. Mitochondria. Biology of the Cell. 1994, 80 (2-3): 103-6.
3. Gaston D., Tsaousis A.D., Roger A.J. Predicting proteomes of mitochondria and related organelles from genomic and expressed sequence tag data. Methods in Enzymology. 2009, 457: 21-47.
4. Al Rawi S., Louvet-Vallée S., Djeddi A., Sachse M., Culetto E., Hajjar C., Boyd L., Legouis R., Galy V. Postfertilization autophagy of sperm organelles prevents paternal mitochondrial DNA transmission. Science. 2011, 334: 1144-1147.
5. Fu Q., Mittnik A., Johnson P.L., Bos K., Lari M., Bollongino R., Sun C., Giemsch L., Schmitz R., et al. A revised timescale for human evolution based on ancient mitochondrial genomes. Current Biology. 21 March 2013, 23 (7): 553–59.
6. André J. Mitochondria. Biology of the Cell. 1994, 80 (2-3): 103-6.
7. Bock F.J., Tait S.W.G. Mitochondria as multifaceted regulators of cell death. Nature Reviews Molecular Cell Biology. 2020, February, 21 (2): 85-100.
8. Kornmann B. The endoplasmic reticulum-mitochondria encounter structure: coordinating lipid metabolism across membranes. Journal of Biological Chemistry. 2020, May, 26, 401 (6-7): 811-820.
9. Liu X., Hajnóczky G. Ca2+-dependent regulation of mitochondrial dynamics by the Miro-Milton complex. International Journal of Biochemistry and Cell Biology. 2009, 41: 1972-1976.
10. Murphy M.P. How mitochondria produce reactive oxygen species. Biochemistry Journal. 2009, 417: 1-13.
11. Clark A., Mach N. The crosstalk between the gut microbiota and mitochondria during exercise. Frontiers of Physiology. 2017, May 19, 8: 319.
12. Annesley S.J., Fisher P.R. Mitochondria in Health and Disease. Cells. 2019. July, 5, 8 (7): 680.
13. van der Giezen M., Tovar J. Degenerate mitochondria. Reports of European Molecular Biology Organization. 2005, June, 6, (6): 525-30.
14. Duchen M.R. Mitochondria in health and disease: perspectives on a new mitochondrial biology. Molecular Aspects of Medicine. 2004, August, 25 (4): 365-451.
15. Youle R.J., van der Bliek A.M. Mitochondrial fission, fusion, and stress. Science (New York, N.Y.), 2012, 337(6098), 1062–1065.
16. Ashrafi G., Schwarz T.L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death & Differentiation. 2013, January, 20 (1): 31-42.
17. Johanningsmeier S.D., Harris G.K. Pomegranate as a functional food and nutraceutical source. Annual Review of Food Science and Technology. 2011-02-28, 2 (1): 181–201.
18. Selma M.V., Beltrán D., Luna M.C., Romo-Vaquero M., García-Villalba R., Mira A., et al. Isolation of Human Intestinal Bacteria Capable of Producing the Bioactive Metabolite Isourolithin A from Ellagic Acid. Frontiers in Microbiology. 2017, 8: 1521.
19. D’Amico D., Andreux P.A., Valdés P., Singh A., Rinsch C., Auwerx J. Impact of the Natural Compound Urolithin A on Health, Disease, and Aging. Trends in Molecular Medicine, May 2021, S1471491421001180.
20. Ryu D., Mouchiroud L., Andreux P.A., Katsyuba E., Moullan N., Nicolet-Dit-Félix A.A., et al. «Urolithin A induces mitophagy and prolongs lifespan in C. elegans and increases muscle function in rodents». Nature Medicine. August 2016, 22 (8): 879–88.
21. Lin M.T., Beal M.F. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Nature. 2006, October, 19, 443 (7113): 787-95.
22. Михайлова Е.А., Локошко Д.В., Большакова Е.М. Полипренолы и долихолы, как важный компонент антиоксидантной защиты фосфолипидных мембран. Обзор данных современной научной литературы. Современная Российская наука: актуальные вопросы, достижения и инновации: сборник статей II Всероссийской научно-практической конференции, Пенза, 07 мая 2021 года. С. 97-101.
Митохондрии в клетке осуществляют что
Митохондрии представляют собой внутриклеточные органеллы эукариот, основной функцией которых является выработка АТФ в результате реакции окислительного фосфорилирования. (Logan, 2006)
Каждая митохондрия содержит высокоспециализированные мембраны, играющие ключевую роль в ее активности. Мембраны образуют два изолированных митохондриальных компартмента: внутренний матрикс и узкое межмембранное пространство. Каждый отдел содержит уникальный набор белков. В состав наружной мембраны входит белок порин, который образует широкие гидрофильные каналы в липидном бислое. (Максимович, 2015). В результате эта мембрана напоминает сито, проницаемое для всех молекул массой менее 10000 дальтон, в том числе низкомолекулярных. Эти молекулы могут проникать в межмембранное пространство, но большая их часть не способна проходить через непроницаемую внутреннюю мембрану. Основная функциональная часть митохондрии– матрикс и окружающая его внутренняя мембрана. Внутренняя мембрана содержит большое количество «двойного» фосфолипида кардиолипина (30%), что обеспечивает непроницаемость мембраны для ионов и отличается необычно высоким содержанием белка (около 70% от веса). Многие из белков являются компонентами электронтранспортной цепи, поддерживающей протонный градиент на мембране. Другой большой белковый комплекс–фермент АТФ-синтаза, катализирующий синтез АТФ, через который протоны возвращаются в матрикс по электрохимическому градиенту (Erazo-Oliveras,2014).
Роль митохондрий в энергетике клетки
Наиболее характерной особенностью митохондрий является содержание в них большого числа ферментов, участвующих в аэробном «дыхании». Большая часть энергии, которая освобождается при переносе электронов, аккумулируется в макроэргических фосфатных связях АТФ. (Максимович, 2015)
Окисление ацетильной группы в цикле Кребса ведет к образованию молекул восстановленного NADH и восстановленного FADH2. Вначале почти вся энергия, получаемая на ранних этапах окисления питательных веществ, аккумулируется в форме высокоэнергетических электронов NADH и FADH2. NADH, компонент NADH-дегидрогеназного комплекса, образовавшийся в цитозоле при гликолизе, передает свои электроны в дыхательную цепь. Так как NADH не способен проходить через внутреннюю мембрану, перенос электронов от него осуществляется непрямым путем при помощи одной из челночных систем, транспортирующих в митохондрию карнитин, который после окисления возвращается в цитозоль с последующим его восстановлением с помощью NADH. Другой субстрат, FADH2 передает свои электроны в дыхательную цепь непосредственно. Электроны этих субстратов восстанавливают молекулярный кислород (акцептор электронов) в дыхательной цепи с образованием метаболической воды. Так как большое количество высвобождаемой энергии используется ферментами внутренней мембраны для образования АТФ из AДФ, эти реакции называют окислительным фосфорилированием. На внутренней мембране создается электрохимический протонный градиент. Митохондриальная дыхательная цепь внутренней мембраны способна перемещать протоны Н+. При прохождении электронов по дыхательной цепи происходит их «откачивание» из матрикса. АТФ-синтаза может использовать энергию гидролиза АТФ для переноса Н+ через мембрану, а при достаточно большом протонном градиенте протоны начинают «течь» через фермент в обратном направлении, что сопровождается синтезом АТФ. Все белки-переносчики электронов группируются в 4 больших комплекса дыхательных ферментов, каждый из которых содержит трансмембранные белки, прочно закрепляющие комплекс во внутренней мембране митохондрии. Комплекс I (NADH-убихиноноксидоредуктаза; NADH-дегидрогеназа), комплекс II (сукцинатдегидрогеназа; сукцинат-убихинон оксидоредуктаза), комплекс III (комплекс цитохромов b, c1; убихинон-цитохром c оксидоредуктаза), комплекс IV (цитохром c оксидаза; цитохромоксидаза; цитохром с-O2 оксидоредуктаза). Каждый последующий комплекс обладает большим сродством к электронам, чем предыдущий. (Logan, 2006) Электроны последовательно переходят от одного комплекса на другой, пока не восстановят кислород, являющийся их акцептором.(Максимович, 2015)
Роль митохондрий в кальциевом гомеостазе
Центральным механизмом в реализации иммунного ответа является кальциевая сигнализация. Иммунореактивность лимфоцитов обеспечивается интеграцией митохондрий и механизмов кальциевой сигнализации. Митохондрии играют важную роль в гомеостазе Ca 2+ лимфоцитов, как и в других клетках. Они имеют огромный потенциал для его быстрого накопления, поэтому участвуют в модуляции пространственно-временного профиля кальциевых сигналов (Bonifaz 2015, Chandel 2014).
В последние годы все большее внимание исследователей привлекает изучение работы митохондрий как кальциевых депо клетки в процессе реализации специфических функций иммунокомпетентных клеток, так как белки компоненты этой сложной системы регуляции кальциевого гомеостаза могут рассматриваться в качестве молекул-мишеней для направленной регуляции функциональной активности лимфоцитов в норме и при патологических процессах (воспаление, аутоиммунная патология, аллергические реакции, иммунодефициты).
Стабильный уровень Ca 2+ в митохондриях сохраняется в результате равномерного накопления ионов и их высвобождении при значительном повышении уровня Ca 2+ в матриксе, за счет слаженной работы транспортной системы внешней и внутренней мембран митохондрий. Данная система включает основной канал тока Ca 2+ через наружную мембрану – потенциал-зависимый анионный канал; также систему унипорта внутренней мембраны и его молекулярные компоненты, регулирующие активность; два пути высвобождения Ca 2+ в цитозоль – H+/Ca 2+ насос и проницаемая пора мембраны митохондрий. Ток Ca2+ через потенциал – зависимый канал и систему унипорта осуществляется за счет электрохимического протонного градиента (Kaufman 2014).
Были определены белки, участвующие в контроле Ca 2+ тока сквозь внутреннюю мембрану митохондрий (Becker 2009). В частности, в 2010 г. были исследованы Na + /Ca 2+ насосы; белки – регуляторы поглощения Ca 2+ митохондриями, они получили название mitochondrial calcium uptake 1 белки –MICU1; затем были обнаружены и частично охарактеризованы потенциальные регуляторы тока Ca 2+ в митохондрии: MICUb, MICU2, MICU3, EMRE. На основании проведенных исследований сложилась более четкая картина осуществления поглощения ионов кальция митохондриями и сохранении гомеостаза Ca 2+ как внутри органеллы, так и клеточной системе, в целом (Becker 2009).
Шапероны в мембранах ЭПР и митохондрий обеспечивают физическое и функциональное взаимодействие между ЭПР и митохондриями. В формировании АММ главную роль играет глюкозо-регулирующий белок – шаперон GRP75, который содержится в большом количестве в митохондриях. Этот шаперон контролирует передачу кальциевого сигнала от ЭПР к митохондриям и индуцирует взаимодействие между фосфоинозитол3-фосфат-чувствительными рецепторами и VDAC1. В этом случае шаперон образует между мембранами ЭПР и митохондрий туннель для Ca2+, позволяя более эффективно проникать ионам из ЭПР во внешнюю мембрану митохондрий.
Роль митохондрий в апоптозе
Установлено, что основным компонентом, осуществляющим восприятие стимулов ПГК и активизирующим механизмы реализации той или иной формы ПГК, являются митохондрии. Предполагается, что на уровне митохондрий осуществляется интеграция сигналов активизирующих и подавляющих процесс ПГК, следствием чего является дальнейшая реализация программированной клеточной гибели или ее подавление.
На сегодняшний день показано существование трех основных форм программированной гибели клетки: апоптоз (I тип ПГК), аутофагия (II тип ПГК), некрозоподобная ПГК (III тип ПГК). Каждый из этих типов гибели клетки характеризуется собственными биохимическими, молекулярными и морфологическими особенностями (Бра 2005).
При апоптозе наблюдается уменьшение клетки в объеме, конденсация хроматина и фрагментация ДНК на олигонуклеосомные фрагменты. Митохондрии и рибосомы во время реализации апоптоза сохраняют в основном свою структуру и частично – функции. Заключительный этап апоптоза характеризуется разрушением цитоскелета, что приводит к сморщиванию клетки и ее фрагментации на апоптотические тельца, поглощаемые макрофагами или другими соседними клетками.
Ключевыми участниками терминальной фазы апоптотической программы являются цистеиновые протеазы – каспазы, осуществляющие деградацию белковых структур клетки и активирующие нуклеазы. (Бра 2005). Для аутофагии характерно набухание митохондрий и цистерн эндоплазматического ретикулума, увеличение аппарата Гольджи, секвестрация клеточных органелл аутофагическими вакуолями, конденсация хроматина и коллапс ядра.
Терминальным этапом аутофагии является разрушение клеточных органелл лизосомальными ферментами, следствием чего является деградация клетки. Образующийся после реализации аутофагии клеточный дебрис поглощается соседними клетками (Levine 2005). Заключительным событием в этом процессе является разрыв плазматической мембраны, способствующий излиянию содержимого клетки в межклеточное пространство, что способствует индукции воспалительной реакции.
Соотношение различных типов ПГК может варьироваться в зависимости от типа и силы воздействия стимула, активизирующего ПГК.
Важной особенностью митохондрий является способность к значительной амплификации исходящих от них стимулов, активирующих ПГК. Показано, что открытие митохондриальных пор является общим моментом в реализации механизмов всех обсуждаемых выше форм ПГК (Владимиров 2002). Образование пор в митохондриях приводит к выходу из митохондрий цитохрома С, способствующего образованию апоптосомы и активирующего каспазы. Этот процесс является основным механизмом апоптотической гибели клетки. Через открытые поры в митохондриях в цитоплазму высвобождаются также факторы, перемещающиеся в ядро и активирующие реализацию ПГК по независимым от каспаз механизмам: эндонуклеаза G и AIF, связывающий ДНК и активирующий нуклеазы и протеазы в ядре. Показано, что данные факторы принимают участие в развитии как апоптоза, так и некроза. Помимо активаторов ПГК, митохондрии также высвобождают ингибиторы белков, блокирующих ПГК (Smac/DIABLO, Omi/ HtrA2) и предшественников каспаз (прокаспаза 2, 3, 9) (Бра 2005).
К небелковым медиаторам клеточной гибели относятся ионы Ca2+, активирующие при их выходе в цитоплазму кальпаины и Ca 2+ зависимые липазы, что приводит к реализации некротической формы ПГК. Дополнительным фактором индукции ПГК является увеличение продукции компонентами дыхательной цепи митохондрий активных форм кислорода, активирующих механизмы апоптоза, аутофагии и некроза. На сегодняшний день известны митохондриальные апоптотические поры (mitochondrial apoptotic pores – MAP) и поры повышенной проницаемости или мегаканалы (permeability transition pores – РТP). Механизмом образования апоптотических пор в митохондриях является олигомеризация на митохондриальной мембране белков Bax и Bak. (Aradjomande 2005).
Существует мнение, что «выбор» клеткой активизации механизмов той или иной формы программированной гибели определяется количеством открытых пор в митохондриях. В том случае, если PTP формируются в нескольких митохондриях, в клетке активируется процесс аутофагии. Когда PTP открываются у большего числа митохондрий, в клетке инициируется апоптоз, что, вероятно, является следствием увеличения в цитоплазме количества цитохрома С и AIF. Наконец, когда в клетке практически во всех митохондриях открываются РТP, происходит разобщение окисления и фосфорилирования и интенсивный гидролиз АТФ митохондриальной АТФ-азой, активизируются механизмы некрозоподобной клеточной гибели (Guimaraes 2004). Минимальное количество открытых пор принципиально не влияет на процесс клеточной гибели, при большем количестве.
Считается, что определенное значение в реализации апоптоза и некрозоподобной ПГК имеет уровень продукции АТФ. Известно, что при низком уровне АТФ в клетке протекает процесс программированной гибели клетки по механизму некроза, достаточное энергообеспечение клетки способствует прохождению ПГК по механизму апоптоза (Buja 2005).
Установлено, что митохондрии обладают широким спектром белковых (цитохром С, эндонуклеаза G, AIF,) и небелковых факторов (ионы Ca2+, активные формы кислорода), активизирующих процесс клеточной гибели после высвобождения их в цитоплазму. В настоящее время существует аргументированная гипотеза, предполагающая, что накопление нарушений в митохондриальном геноме и прогрессирование митохондриальной дисфункции является одним из механизмов старения организма и развития различных патологических процессов.
На сегодняшний день известны митохондриальные апоптотические поры (MAP) и поры повышенной проницаемости или мегаканалы (permeability transition pores – РТP). Механизмом образования апоптотических пор в митохондриях является олигомеризация на митохондриальной мембране белков Bax и Bak. PTP формируются за счет объединения в единый комплекс АТФ –АДФ- антипортера, локализованного во внутренней митохондриальной мембране, циклофилина D, находящегося в матриксе митохондрий, и порина (voltage dependent anion channel, VDAC) – ионного канала внешней митохондриальной мембраны (Aradjomande, 2005).
Таким образом, Митохондриальный путь апоптоза предусматривает не только активацию каспаз, но и доставку в ядро клетки активных ферментов — эндонуклеазы G и апоптозиндуцирующего фактора, способных вызвать деградацию генетического материала без активации каспаз (Kaufman 2014).