Митотическая активность не определяется что это значит
Чем отличается доброкачественная опухоль от злокачественной
В медицине понятие доброкачественности означает лёгкое течение болезни, хорошие результаты лечения и неопасность для жизни. Под злокачественным процессом подразумевают разрушительное течение, сложность терапии, высокий риск смертности.
Для опухолей такое разделение условно. Тем не менее пациентам и врачам крайне важно определить вид опухоли. От этого зависят тактика лечения и прогноз.
Характеристика доброкачественных и злокачественных опухолей
Существуют чёткие критерии:
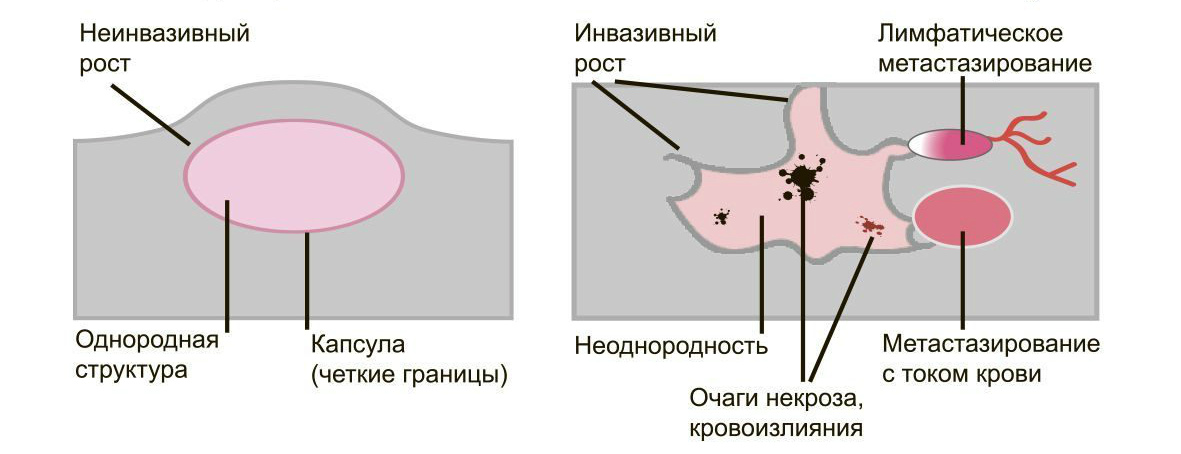
Доброкачественные опухоли чётко отграничены от здоровых тканей, часто имеют капсулу. Рак прорастает окружающие ткани, внедряется в сосуды, его контуры более аморфны.
Большинство доброкачественных опухолей могут расти годами, не проявляя симптомов. Карциномы растут быстро, нарушая функции органов и отравляя организм. Рост сопровождается утомляемостью, слабостью, потерей веса, болью.
Доброкачественные образования “сидят” на одном месте, постепенно растут и раздвигают здоровые ткани, подвижны при прощупывании. Раковые клетки слабо скреплены друг с другом, легко отделяются и разносятся лимфой и кровью по организму. Они оседают в лимфоузлах, костях, внутренних органах, образуя новые опухолевые очаги — метастазы. При пальпации узел спаян с тканями и не сдвигается.
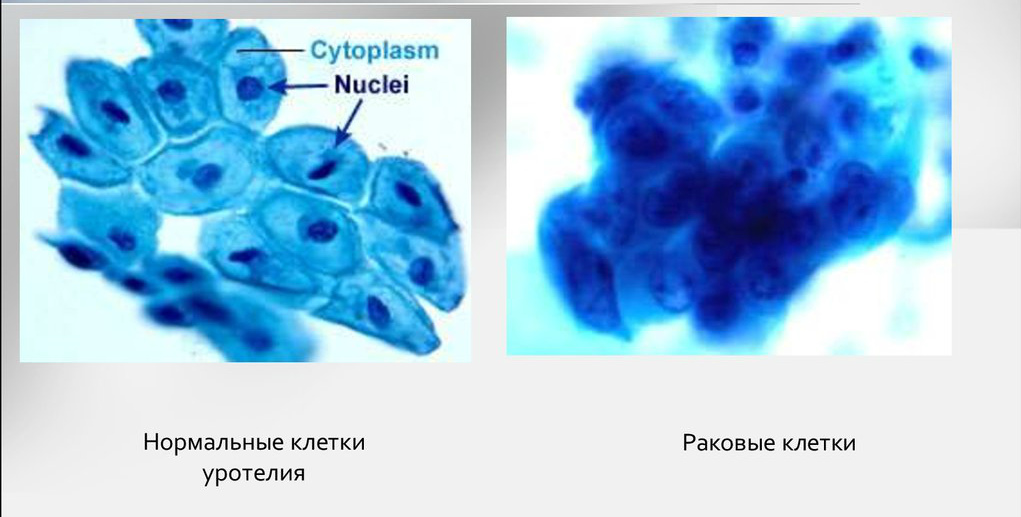
Много информации даёт биопсия. Исследование показывает, что доброкачественные клетки похожи на здоровые, их структура более чёткая. Структура злокачественных клеток сильно изменена из-за выраженных мутаций. Чем меньше клетки напоминают ткань, из которой выросли, тем хуже прогноз для лечения и жизни.
Доброкачественную опухоль, такую как аденома простаты, можно удалить и добиться полного излечения. Если возникнет рецидив, он будет на том же месте, где нашли первичный очаг. Злокачественные образования трудно удалить полностью. Даже одна оставшаяся клетка даст новую опухоль либо на старом месте, либо там, куда она попала по сосудам. Выживаемость больных существенно ниже.
Общие свойства доброкачественных и злокачественных опухолей
Есть моменты, объединяющие оба вида новообразований:
Тяжесть симптомов зависит не только от степени сдавления тканей опухолью, но и от неспособности новообразования выполнять функцию здоровых клеток.
Виды опухолей
Различия не всегда очевидны. Нужна тщательная диагностика для поиска атипичных клеток.
Может ли доброкачественная опухоль стать злокачественной
Любая опухоль способна к малигнизации. Миомы, липомы, фибромы редко переходят в рак. Кисты — крайне редко. Невусы, аденомы, полипы в желудке или кишечнике — очень часто. Многое зависит от условий, в которых находится опухоль, питания, экологии, уровня стресса, гормональных сбоев, наличия предраковых болезней.
В Клинике урологии имени Р. М. Фронштейна доступна современная диагностика опухолей, разработаны эффективные методики лечения. Обращайтесь на консультацию и наши специалисты вам помогут.
Митотическая активность не определяется что это значит
Лечение распространенных рецидивных и метастатических злокачественных опухолей остается одной из нерешенных проблем современной онкологии [4,5]. Причиной смерти таких больных, как правило, является прогрессирование опухолевого процесса в виде распространения и роста рецидивных и метастатических очагов. Основным методом лечения ЗНО был и остается хирургический компонент. Однако в тех случаях, когда вторичный опухолевый очаг невозможно или нецелесообразно удалить хирургическим путем, в онкологической практике применяют химиотерапевтическое лечение. Различные виды опухолей имеют различную степень чувствительности к цитостатическим препаратам [8]. Согласно современной классификации в зависимости от их чувствительности к противоопухолевой терапии различают три основных типа опухолей. Больных с такими опухолями, как лимфогранулематоз, семиномы, можно излечить при помощи химиотерапии. Другие опухоли не чувствительны к лечению цитостатиками (рак почки, рак щитовидной железы). Самая большая и самая распространенная группа опухолей обладает относительной чувствительностью к химиотерапевтическому лечению (рак молочной железы (РМЖ), меланомы кожи, колоректальный рак (КРР), саркомы мягкой ткани (СМТ), плоскоклеточный рак головы и шеи (ПРГШ)) [6]. Рецидивирование и метастазирование опухолей этого вида предопределяет неблагоприятный прогноз течения заболевания, и задачи вылечить больного, как правило, не ставится. Основная цель назначения лечения этих больных – продление жизни пациента. Срок дожития пациента является основным прогностическим фактором для пациентов с распространенным процессом. В свою очередь, срок дожития зависит от количества опухолевых очагов, их совокупной массы и их локализации. А также, по нашему мнению, в первую очередь, от скорости роста этих очагов.
Известно, что точка приложения любого из цитостатиков – пролиферативно-активная опухолевая клетка, находящаяся в процессе деления. Клетки опухоли, находящиеся в состоянии пролиферативного покоя, не чувствительны к цитостатикам. В свою очередь, опухолевый рост обусловлен увеличением числа клеток паренхимы вследствие их митотического деления. Одновременно с увеличением числа клеток в опухоли идут естественные процессы их убыли вследствие процессов некроза, апоптоза, миграции клеток в кроветворное и лимфатическое русло [1, 2, 3]. Совокупность всех этих процессов именуется фактором клеточных потерь (ФКП) [5]. Скорость роста опухолевых очагов определяется соотношением увеличения числа клеток (митотической активности опухоли (МАО)) и ФКП [7]. Чем быстрее скорость роста опухоли, тем быстрее опухолевый очаг достигнет величины, не совместимой с жизнедеятельностью организма. Медленно растущие опухоли будут определять более продолжительные сроки дожития пациентов с распространенным опухолевым процессом.
Мы определили две основные цели настоящей работы:
● определение влияния кинетических параметров роста рецидивных и метастатических опухолей на динамику прогрессирования онкологического заболевания.
● Оценка влияния, которое оказывает лечение цитостатиками на скорость роста рецидивных и метастатических опухолей.
К кинетическим параметрам в нашей работе были отнесены: митотическая активность опухоли (МАО), фактор клеточных потерь ФКП, а также скорость роста опухоли. Учитывая экспоненциальный характер роста опухолей за счет удвоения опухолевых клеток, скорость роста опухолей определялась как ВУО (время удвоения опухоли).
Для достижения указанных целей были поставлены следующие задачи:
1. Разработать математическую модель опухолевого роста, в которой бы учитывалось влияние структурных параметров на кинетику роста опухоли.
2. На основе указанной модели разработать компьютерную программу, позволяющую рассчитывать ФКП и скорость опухолевого роста для конкретных клинических случаев.
3. Исследовать кинетические свойства рецидивных и метастатических опухолей.
4. Оценить влияние кинетических параметров роста исследуемых опухолей на прогноз выживаемости.
5. Сопоставить кинетические параметры опухолей пациентов, получавших и не получавших химиотерапевтическое лечение.
Всего на базе Нижегородского областного онкологического диспансера было обследовано 130 пациентов с рецидивными и метастатическими опухолями различных локализаций, обладающих умеренной чувствительностью к химиотерапии. Было выбрано пять видов вторичных опухолей: саркомы мягких тканей (СМТ), колоректальный рак (КРР), меланомы кожи, рак молочной железы (РМЖ) и плоскоклеточный рак головы и шеи (ПРГШ). Информация о количественном соотношении больных в разных группах приведена в табл. 1. Каждому из исследуемых пациентов удалялись рецидивные или метастатические очаги (при технической невозможности или нецелесообразности их удаления бралась биопсия из нескольких участков очагов (преимущественно из их периферических отделов)). Проводилось морфометрическое исследование полученных гистологических препаратов. Определялись следующие структурные параметры опухолей: доля клеток паренхимы в состоянии митоза, доля клеток в интерфазе, доля клеток в состоянии пролиферативного покоя. Также определялись те доли объема, которые занимают в опухоли строма и некрозы. Прослежены результаты трехлетней выживаемости для вторичных опухолей пяти исследованных нами локализаций.
Распределение клинических наблюдений по локализациям первичных очагов и типу проведенного ранее лечения
Не получавшие химиотерапевтического лечения
Клинические аспекты классификации меланомы кожи
В статье рассмотрены основные клинические аспекты классификации меланомы кожи, в том числе параметры, влияющие на стадирование, прогностические и предиктивные факторы, а также изменения в классификации TNM 8-го издания. Особое внимание уделено современным представлениям о генетических нарушениях при меланоме и стратегиям таргетной терапии.
В статье рассмотрены основные клинические аспекты классификации меланомы кожи, в том числе параметры, влияющие на стадирование, прогностические и предиктивные факторы, а также изменения в классификации TNM 8-го издания. Особое внимание уделено современным представлениям о генетических нарушениях при меланоме и стратегиям таргетной терапии.
Меланома – злокачественная опухоль, возникающая из трансформированных меланоцитов. Эти пигментпродуцирующие клетки имеют нейроэктодермальное происхождение и в процессе эмбриогенеза мигрируют из нервного гребешка в эпидермис и другие сайты, включая менингеальные, слизистые оболочки и сетчатку глаза.
Несмотря на то что меланома может развиваться в любой ткани, где в норме присутствуют меланоциты, кожная локализация остается наиболее распространенной – до 90% всех случаев заболевания [1].
Уровень заболеваемости в мире варьируется от 37 на 100 000 в Австралии до 0,2 на 100 000 в Южной и Центральной Азии. Это напрямую связано с уровнем инсоляции как ведущим фактором развития меланомы. Кроме того, имеет значение фототип кожи по Фитцпатрику, преобладающий среди населения [1].
К сожалению, в отличие от многих солидных опухолей заболеваемость меланомой растет. Так, в США, Великобритании, Швеции и Норвегии число случаев меланомы увеличилось более чем на 3% за последние несколько лет. По оценкам ряда авторов, такая тенденция сохранится по крайней мере до 2022 г. [2].
Прогноз заболевания зависит главным образом от стадии на момент постановки диагноза. При увеличении толщины опухоли по Бреслоу возрастает риск регионарных и отдаленных метастазов.
До недавнего времени приемлемо эффективной терапии для пациентов с метастатической меланомой не существовало. Фундаментальные открытия в области изучения генетических нарушений при меланоме привели к значительному увеличению продолжительности жизни больных с продвинутыми стадиями. Это делает молекулярную классификацию меланомы не только интересной с точки зрения научных изысканий, но и практически значимой при выборе индивидуализированной терапии.
Согласно морфологической классификации Всемирной организации здравоохранения, выделяют следующие гистологические типы первичной меланомы кожи: поверхностно распространяющуюся, узловую, меланому типа злокачественного лентиго, акрально-лентигинозную, невоидную, меланому у детей, десмопластическую, меланому, возникающую на фоне гигантского врожденного невуса, меланому, развивающуюся на фоне голубого невуса, персистирующую [3]. Среди всех подтипов наиболее распространены узловая и поверхностно распространяющаяся – до 85% всех случаев меланомы. В целом прогностической значимости между гистологическими подгруппами не отмечается, значение имеет скорее присущая каждой из них толщина опухоли [4]. Так, показатель по Бреслоу узловой меланомы выше такового поверхностно распространяющейся меланомы. В то же время прогноз злокачественного лентиго не лучше, чем у других гистотипов при их стратификации по толщине. Интересна связь морфологических особенностей строения меланомы и драйверной мутации [5]. Десмопластической меланоме присущи особенности морфологической и иммуногистохимической диагностики. Способность опухолевых клеток к пери- и интраневральному распространению обусловливает частые местные рецидивы после хирургического лечения [6].
Меланома детского возраста крайне редка, частота ее возникновения в возрасте до 15 лет около 1/1 000 000, или 1,2% всех случаев злокачественных опухолей в этой группе [7].
К акральным относят меланомы, развивающиеся на ладонях, подошвах, и подногтевые меланомы. На их долю приходится около 3% общего числа меланом. Этот тип наиболее выражен у чернокожих пациентов. Считается, что акральная локализация связана с неудовлетворительным прогнозом. Однако это скорее обусловлено не столько морфофенотипическими особенностями, сколько поздней диагностикой [8].
Злокачественное лентиго и злокачественная лентиго-меланома развиваются на коже, подвергающейся хроническому солнечному облучению, что предопределяет их преимущественную локализацию на лице, шее, голове. Кроме того, заболевания чаще наблюдаются у пациентов старшей возрастной группы [9].
Факторы, влияющие на стадию заболевания
Толщина первичной опухоли была введена как прогностический фактор Александром Бреслоу еще в 1970 г. Впоследствии ее значение было подтверждено в исследованиях [10].
Увеличение толщины означает рост метастатического риска и коррелирует со снижением выживаемости.
Установлено, что с увеличением толщины опухоли значительно уменьшается пяти- и десятилетняя выживаемость [4].
Толщину опухоли измеряют только при микроскопическом исследовании, с использованием микрометра. Измерение проводят от вершины рогового слоя или основания язвенного дефекта до самой глубокой точки инвазии опухолевых клеток. При этом не учитываются распространение вдоль придатков кожи, участки регресса и сателлиты. В тех случаях, когда проведена панч- или поверхностная шейв-биопсия, разрешается суммирование двух максимальных размеров в биопсийном и операционном материале с обязательным указанием в морфологическом заключении. Если иссечение проведено не на всю толщу образования, рекомендуется указывать толщину по Бреслоу с формулировкой «не менее».
Изъязвление – второй крайне важный параметр, на основании которого Т-критерий разделяют на подгруппы «а» и «б». При многофакторном анализе установлено, что наличие изъязвления соотносится с более высоким риском развития метастазов и значительно худшим прогнозом [4]. Отмечается положительная корреляция между изъязвлением и толщиной опухоли [11].
Истинное изъязвление подразумевает комбинацию признаков: полнослойное повреждение эпидермиса (включая шиповатый слой и базальную мембрану), реактивные изменения (отложения фибрина, инфильтрация нейтрофилами, истончение или реактивная гиперплазия окружающего эпидермиса).
При оценке этого параметра важно учитывать анамнестические данные о наличии травмы или предшествующей биопсии образования.
Сателлиты, транзитные метастазы
Сателлиты и транзитные метастазы представляют собой скопления в лимфатических сосудах опухолевых клеток меланомы диаметром более 0,05 мм, четко отграниченные от основного инвазивного компонента меланомы нормальной дермой или клетчаткой и расположенные на расстоянии не менее 0,3 мм от первичной опухоли. Структуры, удовлетворяющие названным критериям, расположенные на расстоянии до 2 см от опухолевого узла, относят к сателлитам, более 2 см, но расположенные до регионарных лимфатических узлов, – к транзитным метастазам. Сателлиты и/или транзитные метастазы служат фактором неблагоприятного прогноза, прежде всего за счет риска локорегионарного рецидива, и стадируются как N2c или N3 в зависимости от наличия или отсутствия поражения регионарных лимфатических узлов.
Все остальные кожные метастазы, не подпадающие под указанные критерии, относятся к отдаленным и стадируются как М1.
Факторы, влияющие на прогноз
Согласно данным AJCC, прогностические параметры обязательно отражаются в гистологическом заключении.
Уровень инвазии по Кларку
Выделяют пять анатомических уровней инвазии по Кларку в соответствии с наибольшей степенью инвазии опухолевых клеток.
Согласно AJCC7, митотическая активность по сути заменяет уровень Кларка в качестве параметра, влияющего на стадию Т1 в отсутствие изъязвления [4].
Исключение составляют случаи, когда изъязвление отсутствует и пролиферативная активность не может быть измерена. Уровень инвазии по Кларку 4 или 5 в такой ситуации позволяет отнести меланому к Т1b.
Радиальная фаза роста может иметь in situ, или инвазивный компонент (так называемая микроинвазивная меланома). Основными признаками перехода в вертикальную фазу роста являются уровень инвазии по Кларку 3 и более, преобладание гнезд в дерме по сравнению с эпидермисом, отсутствие признаков «созревания», редукция лимфоцитарной инфильтрации по сравнению с фазой радиального роста, меньшая пигментация и больший атипизм клеток. Вертикальная фаза роста всегда инвазивная и имеет более высокий потенциал метастазирования [15].
Узловые меланомы не имеют фазы радиального роста [16].
По данным многочисленных исследований, наличие опухоль-инфильтрирующих лимфоцитов связано с более благоприятным прогнозом [17, 18]. Кроме того, выраженная лимфоцитарная инфильтрация ассоциирована с менее частым обнаружением позитивных сигнальных лимфатических узлов [19]. По степени и расположению лимфоцитарного инфильтрата в опухоли выделяют:
При меланомах феномен регрессии встречается в шесть раз чаще, чем при других солидных опухолях [20]. Точка в споре о прогностическом значении этого параметра до сих пор не поставлена. Одни авторы регрессию в тонких меланомах связывают, как правило, с метастазированием [21], другие подобной корреляции не обнаруживают [22].
Данные последних исследований показывают, что в основе регрессии лежит активация иммунных механизмов защиты. Кроме того, наличие регрессии обусловлено уменьшением риска поражения позитивных лимфатических узлов [23].
Морфологически регрессия проявляется в виде вариабельного разрушения клеток меланомы с частичным или почти полным отсутствием опухолевых клеток в дерме, вариабельного лимфогистиоцитарного инфильтрата, фиброза в дерме, меланофагоцитоза, отека и вертикально ориентированных эктатических кровеносных сосудов [24].
Полный регресс опухоли стадируется как T0.
Лимфоваскулярная инфильтрация и нейротропизм
Лимфоваскулярная инвазия определяется наличием клеток меланомы в просвете лимфатических или кровеносных сосудов. В первичной меланоме она связана с более высоким риском метастазов в лимфатических узлах, а также сателлитов и транзитных метастазов [25], хотя это подтверждается не всеми авторами. В исследовании F. Tas и K. Erturk с участием 705 пациентов показано влияние лимфоваскулярной инвазии на безрецидивную и общую выживаемость [26].
Определение нейротропизма включает наличие клеток меланомы вокруг нервных волокон (периневральная инвазия) или внутри волокон (интраневральная инвазия). Периневральная инвазия/нейротропизм коррелирует с более высокой частотой рецидивов [27].
Изменения в 8-й редакции TNM
С 2018 г. вступит в силу 8-я редакция TNM [28].
Основные изменения коснулись разделения категории Т1 на подгруппы «а» и «б». В настоящей классификации митотическая активность больше не влияет на стадирование, однако остается важным прогностическим параметром и указывается для всех инвазивных меланом. Вместо данного параметра, наряду с изъязвлением, введен показатель по Бреслоу с пороговым значением 0,8 мм. К T1a относятся меланомы с толщиной по Бреслоу менее 0,8 мм без изъязвления, к T1b – с толщиной от 0,8 мм до 1 мм и изъязвлением независимо от толщины меланомы.
Изменения коснулись и непосредственно порядка измерения. Значение толщины рекомендовано указывать с точностью до 0,1 знака после запятой. Измерение до 0,01 мм имеет низкую воспроизводимость. Исключением может быть меланома толщиной менее 1 мм.
Термины «макрометастазы» и «микрометастазы», характеризующие состояние зон регионарного лимфооттока, в новой редакции заменены на «клинически выявляемые» и «клинически недетектируемые и обнаруженные при биопсии сигнального лимфатического узла».
Метастазы, определяемые только по результатам биопсии сигнального лимфатического узла, стадируются на N1a, N2a, N3a в зависимости от количества пораженных узлов. Клинически определяемые метастазы стадируются на N1b, N2b, N3b также в зависимости от количества пораженных узлов. Особое внимание уделено сателлитам и транзитным метастазам. При их наличии имеют место стадии N1с, N2с, N3с в зависимости от статуса регионарных лимфатических узлов.
При подгрупповом анализе выживаемости пациентов со стадией III заболевания с учетом одновременно категорий Т и N выделена новая подгруппа IIID (T4bN3a/b/cM0) с самым неблагоприятным прогнозом.
При определении М-критерия значение имеют локализация отдаленных метастазов и уровень лактатдегидрогеназы (ЛДГ).
M1a – поражение кожи и мягких тканей, включая мышцы, M1b – поражение легких, M1c – поражение других висцеральных органов, кроме центральной нервной системы (ЦНС).
В новой редакции в отдельную группу M1d выделены пациенты с метастатическим поражением ЦНС как самую прогностически неблагоприятную. Уровень ЛДГ указывается и влияет на субкатегории при любом анатомическом сайте метастатического поражения M1a/b/c/d (0/I).
Молекулярно-генетическая классификация меланомы кожи
Современный уровень знаний в области молекулярной биологии меланомы и связанные с этим успехи таргетной терапии диктуют необходимость разделения меланомы кожи на молекулярно-генетические подтипы.
С практической точки зрения целесообразно выделять меланому кожи с мутациями BRAF V600, RAS и KIT. Данные мутации определяют активацию MAP-киназного каскада, отвечающего за пролиферацию и прогрессию клеточного цикла, и лежат в основе современной таргетной терапии (рисунок). Частота встречаемости различных мутаций зависит от локализации меланомы и характера ультрафиолетового воздействия (табл. 1) [29].
Мутации в гене BRAF являются наиболее частыми активирующими мутациями у пациентов с меланомой кожи (более 50%) и могут обнаруживаться как в первичном очаге, так и в метастазах [29, 30]. По данным Российской скрининговой программы, мутация BRAF встречается с частотой 60,6% (627 мутаций из 1035 исследований), чаще у молодых пациентов (до 50 лет – 72,9%, старше 50 лет – 57,1%; p = 0,00003). В возрастной группе 30–39 лет частота мутации BRAF достигает 81% [31]. Подавляющее большинство мутаций в гене BRAF определяются в кодоне V600 (табл. 2) [29]. Это, с одной стороны, существенно облегчает диагностику, с другой – предопределяет сходные конформационные изменения белка, приводящие к активации сигнального каскада, и позволяет разработать единый подход к таргетной терапии. В исследовании BRIM3 отмечалась сопоставимая эффективность таргетной терапии при мутациях BRAF V600E/K [32]. Эффективность ингибиторов BRAF при других типах мутаций требует дальнейшего изучения ввиду незначительного числа наблюдений. Оптимальной стратегией таргетной терапии меланомы кожи при наличии мутаций BRAF V600E/K на сегодняшний день считается комбинация ингибиторов BRAF и MEK (дабрафениб + траметиниб или вемурафениб + кобиметиниб) [33, 34].
Мутация в гене NRAS является второй по частоте у пациентов с меланомой кожи и составляет от 10 до 20% в зависимости от локализации и уровня инсоляции (табл. 1) [29]. Данная мутация также характеризуется наличием «горячих точек» (hot-spot) (85% мутаций локализуются в 61-м кодоне, еще 15% – в 12-м и 13-м кодонах) и сопряжена с агрессивным течением и неудовлетворительным прогнозом [35]. Основными стратегиями таргетной терапии при мутациях NRAS являются использование ингибиторов MEK (биниметиниб, NEMO trial) [36] и комбинаций ингибиторов MEK и CDK4 (биниметиниб + рибоциклиб) [37], однако эти подходы нуждаются в дальнейшем изучении.
Мутация в гене рецепторной тирозинкиназы c-KIT может играть ключевую роль в патогенезе до 20% меланом слизистой локализации и до 15% – акральной [29]. До 73% мутаций составляют пять hot-spot-мутаций в кодонах 6, 11, 13, 17 и 18, и частота объективного ответа на ингибиторы с-KIT (иматиниб, нилотиниб) может достигать 16–29% [38].
Наиболее фундаментальной является генетическая классификация меланомы кожи, разработанная коллективом авторов в рамках Cancer Genom Atlas Network (TCGA) [39]. На основании полногеномного изучения ДНК и экспрессионного анализа РНК, микро-РНК и протеинов 333 опухолевых образцов меланомы от 331 пациента (67 первичных и 266 метастатических меланом) было выделено четыре генетических подтипа в зависимости от ведущих повреждений генома: BRAF-мутированная, RAS-мутированная, NF1-мутированная и трижды негативная (triple-wild-type) меланома. Интересно, что мутационная нагрузка при меланоме выше, чем при других типах опухолей, изученных ранее по программе TCGA. До 76% мутаций в первичных меланомах и 84% мутаций в метастатических меланомах связаны с ультрафиолетовым воздействием.
BRAF-подтип считается самым распространенным (52%) и характеризуется hot-spot-мутациями в гене BRAF (V600E, V600K, V600R, K601) и более молодым возрастом пациентов.
Второй по распространенности RAS-подтип (28%) характеризуется hot-spot-мутациями (Q61, G12, G13) и гиперэкспрессией AKT3-сигналинга.
Для NF1-подтипа (14%) свойственны мутации в гене нейрофиброматоза 1-го типа и альтернативные (not-hot-spot) мутации в гене BRAF. Большая часть мутаций NF1 относится к мутациям «потери функции» (loss-of-function) и приводит к альтернативной активации MAP-киназного каскада. Для данного подтипа характерны более старший возраст пациентов и большая мутационная нагрузка.
Triple-wild-type – самый редкий подтип (6%). При таком подтипе имеют место мутации и амплификации гена KIT, PDGFRa, VEGFR1, GNA11 и GNAQ. Данный подтип имеет низкие показатели сигнатур, ассоциированных с ультрафиолетовой компонентой (30% против > 90% для остальных трех типов), и высокую частоту изменения копийности генов и сложных комплексных перестроек.
Следует отметить, что частота гиперэкспрессии иммунных сигнатур и лимфоидной инфильтрации сопоставима при всех генетических подтипах и служит основным благоприятным прогностическим фактором.
Клиническое значение генетической классификации меланомы кожи отражено в табл. 3 [39].