Митотическая активность низкая что это значит
Случай гастроинтестинальной стромальной опухоли желудка
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Гастроинтестинальные стромальные опухоли (ГИСО) являются наиболее распространенными злокачественными подслизистыми новообразованиями желудочно-кишечного тракта, с преимущественной локализацией в желудке и тонкой кишке. Особенность заболевания заключается в отсутствии специфических клинических признаков, не менее трети случаев выявляются во время обследований или хирургических вмешательств по поводу других заболеваний или на аутопсии. Алгоритм обследования больных с подозрением на ГИСО включает в себя эндоскопические и лучевые методы диагностики, в том числе ряд дорогостоящих высокотехнологичных, таких как эндоскопическая ультрасонография, компьютерная томография, иммуногистохимические и молекулярно-генетические исследования биопсийного материала. Только проведение полного комплекса обследований позволит своевременно верифицировать диагноз и выбрать оптимальную лечебную стратегию в отношении заболевания, имеющего высокий потенциал озлокачествления. Авторами приведено собственное клиническое наблюдение пациентки с ГИСО с типичной клинико-морфологической картиной, представляющее значительный интерес для клиницистов. Заболевание дебютировало у пациентки в возрасте старше 60 лет, протекало под маской органической диспепсии. В данном случае привлечение дорогостоящих высокотехнологичных методов позволило верифицировать диагноз ГИСО и направить пациентку на оперативное лечение.
Ключевые слова: гастроинтестинальная стромальная опухоль, опухоль желудка, эндоскопическая ультрасонография, иммуногистохимическое исследование, дифференциальная диагностика.
Для цитирования: Скворцова Т.Э., Оганезова И.А., Медведева О.И. и др. Случай гастроинтестинальной стромальной опухоли желудка. РМЖ. Медицинское обозрение. 2021;5(6):433-437. DOI: 10.32364/2587-6821-2021-5-6-433-437.
1 I.I. Mechnikov North-Western State Medical University, St. Petersburg, Russian Federation
2 National Center for Clinical Morphological Diagnostics LLC, St. Petersburg, Russian Federation
Gastrointestinal stromal tumors (GIST) are the most common malignant submucosal neoplasms of the gastrointestinal tract, with predominant localization in the stomach and small intestine. The disease pattern is the absence of specific clinical signs, at least a third of cases are detected during examinations or surgical interventions for other diseases or at an autopsy. The examination algorithm of patients with suspected GIST includes endoscopic and radiation diagnostic methods, including a number of high-tech and expensive techniques, such as endoscopic ultrasonography, computed tomography, immunohistochemical and molecular genetic methods for studying biopsy material. Only conducting a full set of examinations will allow timely diagnosis and choosing the optimal treatment tactics for the disease with a high risk of malignancy. The authors present their own clinical case of a patient, female, with GIST, which is of considerable interest to clinicians. The above clinical case represents a typical clinical and morphological picture of GIST. The disease onset occurred in a patient over the age of 60 years and proceeded under the guise of organic dyspepsia. In this case, the use of expensive high-tech techniques allowed to verify the diagnosis of GIST and refer the patient to surgical treatment.
Keywords: gastrointestinal stromal tumor, stomach tumor, endoscopic ultrasonography, immunohistochemistry, differential diagnosis.
For citation: Skvortsova T.E., Oganezova I.A., Medvedeva O.I. et al. Gastrointestinal stromal tumor of the stomach (clinical case). Russian Medical Inquiry. 2021;5(6):433–437 (in Russ.). DOI: 10.32364/2587-6821-2021-5-6-433-437.
Введение
Гастроинтестинальные стромальные опухоли (ГИСО) считаются редкими мезенхимальными новообразованиями, первичная заболеваемость оценивается от 7 до 20 слу-чаев на 1 млн человек в год. Однако среди злокачественных подслизистых образований желудочно-кишечного тракта именно ГИСО являются наиболее распространенными. Диагностируют заболевание, как правило, у пациентов старше 60 лет, без выраженного полового диморфизма. ГИСО могут обнаруживаться на всем протяжении пищеварительной трубки, чаще всего они локализуются в желудке (50–60%) или в тонкой кишке (25–35%), также могут встречаться в толстой ( 2 опухоли при увеличении 400), размер и локализация опухоли. При этом риск метастазирования ГИСО увеличивается в зависимости от размера первичной опухоли, независимо от митотического индекса. Также необходимо отметить значение маркера пролиферативной активности Ki-67, уровень экспрессии которого достоверно повышается с ростом риска агрессивности ГИСО, что используют для оценки степени злокачественности и прогноза. Принято считать, что ГИСО желудка при прочих равных характеристиках имеют более благоприятный прогноз [18, 20, 21].
Определение типов мутаций в различных экзонах KIT и PDGFR-α также является важным прогностическим маркером, который позволяет судить как о клиническом течении заболевания, так и о предполагаемом ответе опухоли на терапию ингибиторами тирозинкиназы [22]. По данным метаанализа L. Yan et al. [23] (20 исследований, 3780 пациентов), выживаемость без прогрессирования ГИСО была значительно хуже у пациентов с мутациями экзона 9 KIT, чем у пациентов с мутациями экзона 11 KIT (отношение шансов [ОШ] 3,60, 95% доверительный интервал [ДИ] 2,17–5,98, z=4,96, p 2 =0%). Мутации KIT значительно чаще наблюдались у пациентов с большим размером (≥5 см) ГИСО (ОШ 1,51, 95% ДИ 1,05–2,17, z=2,22, p=0,03, гетерогенность I 2 =0%, p=0,97), а также у пациентов с более высоким (≥5/50 HPFs) митотическим индексом (ОШ 1,76, 95% ДИ 1,05–2,95, z=2,15, p=0,03, гетерогенность I 2 =57%, p=0,03).
Собственное клиническое наблюдение ГИСО
Пациентка Б., 67 лет, в марте 2019 г. обратилась к терапевту по месту жительства с жалобами на боли слабой интенсивности в эпигастрии, эпизоды головокружения на фоне болевого синдрома, тошноту после приема пищи, изжогу, а также боли в гипогастрии, не связанные с актом дефекации и мочеиспусканием. Стул ежедневный, тип 4 по Бристольской шкале, без патологических примесей. Ухудшение самочувствия отмечает в последние 2 мес. В течение длительного времени страдает хроническим гастритом, хроническим некалькулезным холециститом. При физикальном обследовании состояние удовлетворительное; патологических изменений со стороны сердечно-сосудистой и дыхательной систем не выявлено; живот не вздут, мягкий, болезненный при пальпации в эпигастрии, в проекции поперечно-ободочной кишки. Анализы крови в пределах референсных значений. По данным УЗИ органов брюшной полости от 08.04.2019 печень не увеличена, эхогенность ее не изменена, диаметр воротной вены 10 мм, диаметр холедоха 4 мм; желчный пузырь с перегибами, стенки 2 мм, не утолщены, в просвете эхопозитивный подвижный осадок; поджелудочная железа размерами 16×10×14 мм, в области тела лоцируется гипоэхогенное образование 21×20 мм. Для уточнения характера выявленных изменений 23.04.2019 пациентке выполнена КТ органов грудной клетки и брюшной полости с внутривенным контрастированием (йопамидол). На серии снимков легких с двух сторон выявлены очаги с четкими, неровными, бугристыми контурами, накапливающие контрастный препарат с повышением плотности от 13 HU до 93 HU (справа в S3 размерами 8×10 мм, в аксиллярном субсегменте — до 7 мм, слева в S5 — до 3 мм), небольшие участки уплотнения легочной ткани в S6 слева и S9 справа. Увеличенных внутригрудных лимфатических узлов не выявлено. На серии снимков органов брюшной полости по заднемедиальной стенке верхней трети желудка выявлено образование, расположенное кнаружи от желудка, размерами 18×21×13 мм, с четкими контурами, накапливающее контрастный препарат с повышением плотности от 41 HU до 71 HU (рис. 1).
Образование прилежит к стенке желудка на протяжении около 10 мм. Структура паренхимы печени однородная, равномерно накапливает контрастный препарат. Внутри- и внепеченочные желчные протоки не расширены. Желчный пузырь не увеличен, содержимое его однородное, рентгеноконтрастных конкрементов не выявлено, утолщения стенки нет. Воротная и селезеночная вены не расширены, селезенка не увеличена, однородной структуры. Поджелудочная железа не увеличена, однородной структуры, очагов патологического накопления контрастного препарата не выявлено, парапанкреатическая клетчатка не инфильтрирована. Грудной и поясничный отделы позвоночника с дегенеративно-дистрофическими изменениями. Структура тел грудных и поясничных позвонков, а также подвздошных костей неоднородная за счет множественных зон разрежения костной структуры с четкими контурами. Выявляются зоны остеосклероза в теле L4 (4 мм) и в теле левой подвздошной кости (4×6 мм), гемангиома в теле Th9. Для уточнения характера костных изменений выполнена остеосцинтиграфия, убедительных данных за специфическое поражение скелета не получено. С учетом выявленного экзофитного образования, исходящего из желудка, 30.04.2019 пациентке выполнено стандартное эндоскопическое исследование: пищевод свободно проходим, слизистая гиперемирована, на всем протяжении определяется творожистый несмещаемый белесоватый налет. Розетка кардии зияет. Слизистая оболочка желудка пролабирует в пищевод, в области пищеводно-желудочного перехода — кольцо Шацкого с ранимой слизистой в этой области. Форма желудка не изменена. Слизистая диффузно гиперемирована, в антральном отделе 4 острые эрозии под фибрином размерами до 3 мм. По задней стенке желудка визуализируется незначительное сдавление просвета желудка извне на фоне неизмененной слизистой (рис. 2). Для уточнения характера новообразования 17.06.2019 пациентке выполнена ЭУС: в верхней трети тела желудка по малой кривизне, ближе к задней стенке определяется подслизистое образование размером до 15 мм, округлой формы, умеренно выступающее в просвет желудка без его деформации, покрытое неизмененной слизистой. Образование плотное при инструментальной пальпации. При сканировании стенки желудка с частотой 7,5–12 МГц определяется округлой формы, негомогенное, преимущественно гипоэхогенное образование размером до 20 мм, исходящее из мышечной стенки, с преимущественным экстраорганным ростом, с выраженным кровотоком (рис. 3).
После проведения антимикотической терапии (флуконазол 150 мг/сут 14 дней) 10.07.2019 пациентке выполнена энуклеация экстраорганного образования тела желудка с применением эндоскопической видеоассистенции. Гистологическое исследование удаленного образования: округлое, четко инкапсулированное мезенхимальное, диаметром 2,7 см, представлено веретеновидными клетками без клеточного полиморфизма с обильным коллагеновым матриксом. Картина наиболее характерна для склерозирующего варианта ГИСО. Материал был отправлен на дополнительное исследование в ООО «Национальный центр клинической морфологической диагностики», где 10.07.2019 выполнено патогистологическое исследование удаленного образования. Макроописание: округлый плотный узел диаметром 2,7 см с крупнобугристой поверхностью, на разрезе серый, волокнистый, с множественными точечными кровоизлияниями. Микроописание: четко отграниченное мезенхимальное новообразование диаметром 2,7 см представлено веретеновидными клетками с гладкомышечной дифференцировкой, с минимальным клеточно-ядерным полиморфизмом, участками обильной коллагенизации. Картина наиболее характерна для склерозирующего варианта ГИСО (рис. 4). При ИГХ-исследовании в материале определяются структуры веретеноклеточной опухоли, местами с муаровым паттерном, очаговым фиброзом и гиалинозом. Митотическая активность низкая — менее 5 митозов на 5 мм 2 при увеличении 400. Опухолевые клетки интенсивно экспрессируют CD34, DOG1, очагово экспрессируют десмин и не экспрессируют S-100 протеин (рис. 5). Индекс пролиферативной активности Ki-67 в пределах 2–5%. Заключение: гистологическая картина и иммунофенотип опухоли соответствуют гастроинтестинальной стромальной опухоли, GIST, 2-я группа. Пациентка была направлена на оперативное лечение.
Заключение
Гастроинтестинальные стромальные опухоли являются редкими мезенхимальными подслизистыми новообразованиями органов пищеварения, не имеют характерных симптомов, сложны в диагностике, и, как следствие, около 50% образований к моменту постановки диагноза успевают метастазировать. Основная стратегия лечения заключается в радикальном хирургическом лечении локализованных и местно-распространенных форм ГИСО, что позволяет добиться общей 5-летней выживаемости у 54–65% больных [2, 19].
Приведенное клиническое наблюдение представляет типичную клинико-морфологическую картину ГИСО. Заболевание дебютировало у пациентки в возрасте старше 60 лет, протекало под маской органической диспепсии. Только привлечение дорогостоящих высокотехнологичных методов — КТ, ЭУС, ИГХ-исследования позволило верифицировать диагноз ГИСО и направить пациентку на оперативное лечение.
Сведения об авторах:
Скворцова Татьяна Эдуардовна — к.м.н., доцент, доцент кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии им. С.М. Рысса ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-9362-9961.
Оганезова Инна Андреевна — д.м.н., профессор, профессор кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии им. С.М. Рысса ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0003-0844-4469.
Медведева Ольга Ивановна — к.м.н., доцент, доцент кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии им. С.М. Рысса ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-9730-7361.
Жорина Ольга Михайловна — к.м.н., заведующая отделением компьютерной томографии Клиники имени Петра Великого, доцент кафедры лучевой диагностики и лучевой терапии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-9116-737X.
Беляков Илья Александрович — заведующий патологоанатомическим отделением ООО «Национальный центр клинической морфологической диагностики»; 192283, Россия, г. Санкт-Петербург, ул. О. Дундича, д. 8, корп. 2, лит. А, пом. 6Н; ORCID iD 0000-0002-9100-7608.
Воробьев Сергей Леонидович — к.м.н., директор ООО «Национальный центр клинической морфологической диагностики»; 192283, Россия, г. Санкт-Петербург, ул. О. Дундича, д. 8, корп. 2, лит. А, пом. 6Н; ORCID iD 000-0002-7817-9069.
Контактная информация: Оганезова Инна Андреевна, e-mail: oganezova@rambler.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 14.07.2021.
Поступила после рецензирования 06.08.2021.
Принята в печать 31.08.2021.
Tatyana E. Skvortsova — C. Sc. (Med.), Associate Professor, Associate Professor of the Department of Propaedeutics of Internal Diseases, Gastroenterology and Nutrition named after S.M. Ryss, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-9362-9961.
Inna A. Oganezova — Dr. Sc. (Med.), Professor, Professor of the Department of Propaedeutics of Internal Diseases, Gastroenterology and Nutrition named after S.M. Ryss, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0003-0844-4469.
Olga I. Medvedeva — C. Sc. (Med.), Associate Professor, Associate Professor of the Department of Propaedeutics of Internal Diseases, Gastroenterology and Nutrition named after S.M. Ryss, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-9730-7361.
Olga M. Zhorina — C. Sc. (Med.), Head of the Department of Computed Tomography at the Clinic named after Peter the Great, Associate Professor of the Department of Radiation Diagnostics and Therapy, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-9116-737X.
Ilya A. Belyakov — Head of the Department of Autopsy, National Center for Clinical Morphological Diagnostics LLC; 8 bld. 2A, O. Dundich str., St. Petersburg, 192283, Russian Federation; ORCID iD 0000-0002-9100-7608.
Sergey L. Vorobiev — C. Sc., Director, National Center for Clinical Morphological Diagnostics LLC; 8 bld. 2A, O. Dundich str., St. Petersburg, 192283, Russian Federation; ORCID iD 000-0002-7817-9069.
Contact information: Inna A. Oganezova, e-mail: oganezova@rambler.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Только для зарегистрированных пользователей
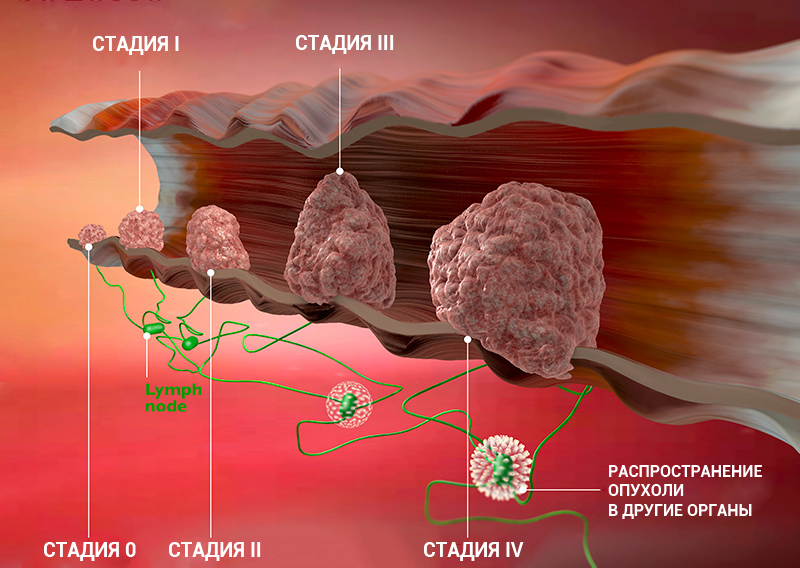
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Митотическая активность низкая что это значит
Таким образом, скорость роста опухоли определяется соотношением доли клеток в состоянии митоза и фактором клеточных потерь (ФКП) [5]. Рост опухоли обеспечен при ФКП меньше 100 %. При ФКП более 100 % наступает регрессия опухоли. В основе роста опухоли лежит удвоение ее клеток. Это определяет экспоненциальный характер кривой роста опухоли. Этот факт определил то, что в качестве параметров скорости роста опухоли мы выбрали время ее удвоения (ВУО). Чем меньше время удвоения опухоли, тем быстрее ее рост.
Цель настоящего исследования: сравнить кинетические свойства рецидивов и метастазов ЗНО различных видов.
Для достижения поставленной цели были определены следующие задачи:
Всего на базе Нижегородского областного онкологического диспансера в период с 2009 по 2012 г. нами было обследовано 130 пациентов с рецидивными и метастатическими опухолями 5 локализаций: сарком мягких тканей (СМТ), колоректального рака (КРР), меланом кожи, рака молочной железы (РМЖ) и плоскоклеточного рака головы и шеи (ПРГШ). Информация о количественном соотношении больных в разных группах приведена в таблице 1. Каждому из исследуемых пациентов удалялись рецидивные или метастатические очаги (при технической невозможности или нецелесообразности их удаления бралась биопсия из нескольких участков очагов (преимущественно из их периферических отделов)).
Распределение клинических наблюдений по локализациям первичных очагов и типу вторичных поражений
Морфологические факторы прогноза нейроэндокринных опухолей желудочно-кишечного тракта и поджелудочной железы
НЭО соответственно своему эмбриональному происхождению делятся на опухоли верхней (карциноиды легких, тимуса, желудка и двенадцатиперстной кишки), средней (аппендикса, подвздошной, тощей и проксимальной кишки) и нижней (дистальной части толстой и прямой кишки) кишки. Эффект применения химиотерапии (ХТ) в случае нерезектабельных и метастазирующих НЭО зависит как от их функциональной активности (клинического синдрома), так и от степени злокачественности опухоли или ее биологического потенциала. Важнейшими критериями злокачественного потенциала НЭО, определяющими степень их злокачественности (Grade 1 ), считают степень дифференцировки опухоли (высокодифференцированные, низкодифференцированные), наличие инвазии сосудов и нервов, некрозов, высокую митотическую и пролиферативную активность клеток опухоли.
Степень дифференцировки и степень злокачественности (Grade) опухоли
В 2000 году Всемирной организацией здравоохранения (ВОЗ) [2] была принята классификация НЭО ЖКТ и ПЖ, где эти опухоли разделены на 3 основные группы: 1) высокодифференцированные опухоли, доброкачественные и неопределенной степени злокачественности (функционирующие и нефункционирующие); 2) высокодифференцированные эндокринные карциномы низкой степени злокачественности (функционирующие и нефункционирующие); 3) низкодифференцированные эндокринные карциномы высокой степени злокачественности (мелко- и крупноклеточные эндокринные карциномы); 4) смешанные экзо-эндокринные карциномы. В настоящее время Европейской ассоциацией по нейроэндокринным опухолям (ENETS) предложено делить НЭО ЖКТ и ПЖ по степени их злокачественности (Grade) на 3 основные группы – G1, G2, G3 (табл. 1). В соответствии с этим в группы G1-G2 входят высокодифференцированные НЭО ЖКТ и ПЖ, а в группу G3 – низкодифференцированные нейроэндокринные карциномы (НЭК) [3]. Это деление базируется на параметрах, которые непосредственно отражают степень злокачественности НЭО – индексах митотической и пролиферативной активности опухолевых клеток. Индекс митотической активности может быть подсчитан при рутинном исследовании в препаратах, окрашенных гематоксилином и эозином, он определяется как количество митозов в 10 репрезентативных полях зрения (РПЗ) с равномерным распределением в них опухолевых клеток, без артефициальных изменений и при большом увеличении микроскопа (х400). Индекс пролиферации определяется при иммуногистохимическом (ИГХ) исследовании с использованием антител Ki67 (клон MIB-1) как доля клеток, ядра которых экспрессируют. Этот маркер из расчета на 100 опухолевых клеток (%) при большом увеличении микроскопа (х400). Индекс Ki67 вычисляется как среднее значение при просчете не менее 1000 клеток (оптимально- 2000 клеток). Считается, что митотический индекс более точно отражает пропорцию делящихся клеток и, следовательно, является более надежным критерием степени злокачественности НЭО, чем индекс Ki67 (4). Поэтому в морфологическом заключении при исследовании НЭО обязательно следует указывать значения и митотического индекса и индекса пролиферации. Чтобы выделить опухоли, для лечения которых рекомендовано применение более агрессивных методов терапии, следует проводить учет пролиферирующих клеток не в одном произвольно выбранном участке опухоли, а обязательно исследовать наиболее активно пролиферирующие участки опухоли – так называемые «горячие точки».
Высокодифференцированные НЭО ЖКТ и ПЖ – это опухоли низкой или промежуточной степени злокачественности, а низкодифференцированные – высокой. Низкодифференцированные НЭО имеют тенденцию к стремительной диссеминации, они устойчивы к терапии, быстро приводят к летальному исходу. Поэтому самым важным аспектом морфологического заключения является принципиальное разграничение высокодифференцированных и низкодифференцированных НЭО (рис. 1, А и Б). Высокодифференцированные НЭО – доброкачественные и неопределенной степени злокачественности (пограничные) – характеризуются слабо выраженной клеточной атипией; в высокодифференцированных эндокринных карциномах низкой степени злокачественности клеточная атипия слабо или умеренно выражена, ядра гиперхромные с отчетливыми ядрышками, характерно увеличение ядерно-цитоплазматического соотношения, митотической активности и индекса пролиферации Ki67. Большинство высокодифференцированных НЭО ЖКТ и ПЖ прогрессируют медленно, иногда в течение многих лет и даже десятилетий, но, тем не менее, являются потенциально злокачественными новообразованиями. В последние годы накоплены данные о том, что метастазы, в том числе и в печень, могут выявляться через много лет (10-30 и более) после удаления так называемых «доброкачественных» НЭО 7. Поэтому сейчас рекомендовано вообще отказаться от термина «доброкачественные НЭО» и использовать термин «НЭО неопределенной степени злокачественности» [4].
Функционирующие и нефункционирующие НЭО
Для определения функционального статуса НЭО при гистологическом исследовании используют эндокринные маркеры – пептиды и/или амины, обладающие гормональной активностью (инсулин, глюкагон, соматостатин, вазоактивный интестинальный полипептид, панкреатический полипептид, гастрин, серотонин, АКТГ, кальцитонин, и другие) [10]. НЭО часто продуцируют сразу несколько гормонов, поэтому диагноз базируется как на наличии характерного гиперфункционального синдрома, так и на выявлении доминирующей популяции эндокринных клеток, составляющей более 50% клеток опухоли. В соответствии с этим НЭО верифицируют как инсулиномы, глюкагономы, гастриномы, соматостатиномы, ПИПомы, ВИПомы, кальцитониномы, карциноиды (серотонин-продуцирующие) и др. Важная информация о функциональном статусе опухоли может быть получена при исследовании ультраструктуры опухолевых клеток. Тип эндокринных гранул в их цитоплазме и их количество позволяют уточнить диагноз НЭО, особенно при нефункционирующих опухолях.
Для НЭО различной локализации имеются и свои специфические факторы прогноза, которые следует учитывать при постановке диагноза и выборе терапии.
Нейроэндокринные опухоли ПЖ (НЭО ПЖ)
Большинство высокодифференцированных функционирующих НЭО пищеварительного тракта составляют опухоли ПЖ (табл. 2). Опухоли, которые преимущественно локализуются в теле и хвосте ПЖ (глюкагономы, инсулиномы, ВИПомы), имеют склонность к гематогенной диссеминации; гастриномы ПЖ чаще метастазируют в регионарные лимфатические узлы. НЭО ПЖ, продуцирующие островковые гормоны (инсулин, глюкагон, соматостатин и панкреатический полипептид), как правило, имеют менее злокачественный потенциал, чем те, которые продуцируют эктопические гормоны, в норме не характерные для этого органа (гастрин, нейротензин, АКТГ, кальцитонин, гормон роста и другие).
Гастриномы ПЖ обладают более злокачественным потенциалом, чем соответствующие опухоли 12-перстной кишки. Хотя обычно они прогрессируют медленно, но в большинстве случаев дают метастазы в лимфатические узлы или печень. Иммунофенотип клеток гастрином ПЖ характеризуется ко-экспрессией маркеров нейроэндокринной и экзокринной дифференцировки (хромогранина А, синаптофизина, цитокератинов 19 и 20 и/или ЭМА), следовательно, они обладают смешанным экзо-эндокринным иммунофенотипом, который и определяет их злокачественный потенциал [11, 12]. В последние десятилетия применение эффективных противоязвенных препаратов в лечении пациентов с гастриномами позволяет смягчить симптомы эндокринной гиперфункции, однако это не устраняет саму причину опухоли [13]. Это привело к тому, что во всех индустриально развитых странах в последние годы возросла летальность от гастрином, обусловленная их латентным ростом и прогрессированием. Риск смерти у пациентов с гастриномами ПЖ увеличивается при высоком уровне гастрина в сыворотке, наличии метастазов в лимфатические узлы, печень, кости, при крупных размерах опухоли, а также при ее поздней диагностике.
Глюкагономы ПЖ долго могут расти как нефункционирующие опухоли, а симптомы синдрома Маллисона (некротическая мигрирующая эритема, глоссит, хейлит, анемия, снижение веса, депрессия и венозный тромбоз) возникают, как правило, в тех случаях, когда опухоль достигает достаточно больших размеров. В этой стадии уже имеются метастазы и плохой прогноз заболевания. Соматостатиномы ПЖ также могут долго не давать симптомов. Характерный для этой опухоли синдром (сахарный диабет, снижение веса, холелитиаз, стеаторея и гипохлоргидрия) возникает не во всех случаях. Иногда соматостатиномы могут проявляться симптомами карциноидного синдрома, синдрома Кушинга или другими. В таких случаях диагноз ставится исключительно после ИГХ и электронно-микроскопического исследования – на основании экспрессии соматостатина в большинстве опухолевых клеток и наличия в них характерных эндокринных гранул. На момент постановки диагноза соматостиномы ПЖ обычно достигают больших размеров, дают метастазы в печень и имеют крайне плохой прогноз.
Нефункционирующие НЭО ПЖ (вернее опухоли без выраженного клинического синдрома) – самые сложные для постановки диагноза опухоли. Определить степень нейроэндокринной дифференцировки этих опухолей позволяет только экспрессия в них общих маркеров нейроэндокринной дифференцировки – синаптофизина, хромогранина А [1, 11, 14, 15]. НЭО ПЖ чаще всего метастазируют в печень и лимфатические узлы (парапанкреатические, ворот печени, парааортальные, мезентериальные), в редких случаях – в лимфатические узлы средостения и подмышечные, еще реже в кости, брюшину, легкие, почки, щитовидную железу. Примерно 90% пациентов с НЭО ПЖ, у которых не выявлены метастазы, и около 50% пациентов с выявленными метастазами живут 5 и более лет.
Факторами более благоприятного прогноза и длительного выживания пациентов с высокодифференцированными злокачественными НЭО ПЖ, по мнению Chu Q.D. et al. [16], являются: радикальное удаление опухоли; отсутствие метастазов в печень или появление их на поздних стадиях прогрессирования опухоли; применение «агрессивной» ХТ (в случае наличия метастазов в печени).
Факторы неблагоприятного прогноза всех высокодифференцированных НЭО ПЖ: нерадикальность выполненной операции; наличие метастазов в печень; низкая степень дифференцировки клеток опухоли; инвазия кровеносных (рис. 2 А), лимфатических сосудов и нервов (рис. 2 Б) (что наблюдается в 90% опухолей с метастазами или массивной инвазией окружающих органов и тканей и лишь в 30% опухолей без метастазов). Самыми важными факторами плохого прогноза высокодифференцированных НЭО ПЖ являются метастазы в печень, высокий митотический индекс и индекс Ki67. Определение индекса мечения Ki67 НЭО ЖКТ и ПЖ в соответствии с рекомендациями ENETS является золотым стандартом при определении риска прогрессирования НЭО ПЖ, выборе лечения и оценке эффективности ХТ (17). По нашим данным, более злокачественный потенциал и высокий риск появления метастазов в печень определяет и иммунофенотип клеток НЭО ПЖ. Так, факторами плохого прогноза является ко-экспрессия маркеров нейроэндокринной (хромогранина А, синаптофизина) и экзокринной дифференцировки (маркера клеток протокового эпителия – цитокератина 19, эпителиально-мембранного антигена, муцинов) (рис. 3 А и Б), а также ко-экспрессия нескольких гормонов в одной и той же клетке опухоли (например, инсулина и гастрина, инсулина и соматостатина, соматостатина и кальцитонина, АКТГ, гастрина и т. д.) [7]. Показано также, что экспрессия ассоциированного с метастазами гена 1 (MTA1) является еще одним потенциальным маркером злокачественного потенциала НЭО ПЖ [18].
НЭО пищевода. Высокодифференцированные НЭО пищевода встречаются очень редко (примерно 0,05% всех НЭО ЖКТ). Обычно они имеют крупные размеры (более 4 см), локализуются в дистальном отделе пищевода и не дают специфических гормональных синдромов.
НЭО желудка. Опухоли 1 типа – самые многочисленные из высокодифференцированных НЭО желудка (табл. 3). Они локализованы в пределах слизистого и подслизистого слоев тела желудка, образованы чаще всего ECL-клетками, продуцирующими гистамин, и обычно ассоциируются с развитием эндокринных синдромов. НЭО желудка 2 типа встречаюся реже, чем 1 типа, но могут развиваться при синдроме МЭН-1 и сопровождаться симптомами синдрома Золлинера-Эллисона (ЗЭС). Опухоли небольших размеров могут быть удалены эндоскопически и имеют хороший прогноз. НЭО желудка 3 типа – это обычно опухоли из ECL-, серотонин- или гастрин-продуцирующих клеток, без преимущественной локализации в желудке. Опухоли 2 и 3 типа размером более 2 см, с инвазией сосудов, глубокой инвазией мышечной пластинки обычно дают метастазы в лимфатические узлы [19, 20].
НЭО двенадцатиперстной и тощей кишки. Высокодифференцированные НЭО и локализованные в двенадцатиперстной и тощей кишке обычно растут бессимптомно [15]. Выделяют 4 типа НЭО: гастриномы, соматостатиномы, нефункционирующие серотонин-, гастрин- или кальцитонин-продуцирующие нейроэндокринные карциномы и ганглиоцитарные параганглиомы. До 2/3 опухолей этой локализации составляют гастриномы, которые обычно локализуются в верхних отделах двенадцатиперстной кишки, ассоциированы с СЗЭ, имеют небольшие размеры (не более 1 см), могут быть спорадическими, а при синдроме МЭН-1 – множественными. Дуоденальные гастриномы даже небольших размеров (менее 0,5-1 см) могут давать метастазы в регионарные лимфатические узлы, которые иногда значительно больше первичной опухоли, поэтому в некоторых случаях их ошибочно трактуют как первичные гастриномы ПЖ или «первичные гастриномы лимфатических узлов». Дуоденальные соматостатиномы обычно локализуются в области Фатерова соска и не вызывают специфического синдрома. При инвазии мышечного слоя вероятность появления метастазов в регионарных лимфатических узлах очень велика. Дуоденальные ганглиоцитарные параганглиомы обычно локализуются вблизи Фатерова соска и даже при размерах более 2 см и инвазии мышечной пластинки имеют благоприятный прогноз.
Злокачественные серотонин-продуцирующие карциноиды. Термин «карциноид» описывает НЭО различной локализации – ЖКТ, легких, тимуса и яичников. Карциноиды верхней кишки редко продуцируют серотонин, приводя к развитию карциноидного синдрома, но часто продуцируют гистамин и манифестируют атипичным карциноидным синдромом. Карциноиды средней кишки происходят из энтерохромаффинных клеток (ЕС) тощей, подвздошной, слепой и восходящей кишки; карциноидный синдром обычно манифестирует на поздних стадиях их роста – при наличии метастазов, чаще всего в печень. В классификации ВОЗ и в некоторых более поздних классификациях эти опухоли относят к высокодифференцированным нейроэндокринным карциномам (злокачественным карциноидам) низкой степени злокачественности. Очень важно уже на ранней стадии заболевания выделить карциноиды с риском быстрого прогрессирования и короткого срока выживания пациентов, требующие применения более агрессивных схем ХТ. Во многих классификациях НЭО ЖКТ с индексом Ki67