Молекула что это такое в химии
Одним из основополагающих понятий современной науки является понятие молекулы. Его введение европейскими учеными в 1860 г. дало толчок к развитию не только химии и физики, но и других естественных наук.
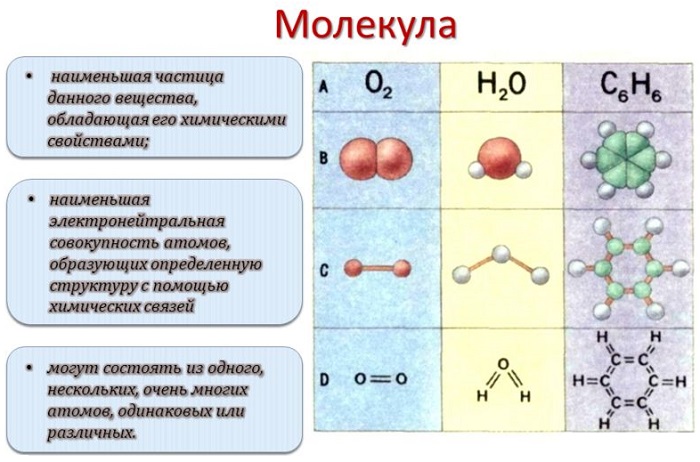
Молекулой, в наиболее общем определении, называется частица, образованная из нескольких (двух или более) атомов, объединенных между собой ковалентными связями. Она не имеет электрического заряда, все электроны в её составе имеют пару.
Молекулы, несущие заряд, называются ионами, неспаренные электроны – радикалами. Качественный и количественный состав их стабилен. Количество ядер атомов, электронов и их взаимное расположение позволяют отличать молекулы разных веществ друг от друга.
Что такое молекула в физике
В физике этим понятием оперируют при изучении свойств разных сред (газы, жидкости) и твердых тел.
Также их свойствами объясняются явления диффузии, теплопроводности и вязкость веществ.
Что такое молекула в химии
Учение о молекулах для химической науки является одним из самых главных. Именно химические исследования дали важнейшие сведения о составе и свойствах этой мельчайшей единицы вещества.
При прохождении химического превращения молекулы обмениваются атомами, распадаются. Поэтому знания о строении и состоянии этих частиц лежат в основе изучения химии веществ и их превращений.
На основании знаний о проходящей химической реакции можно предсказать строение молекул веществ, в ней участвующих. Противоположное заключение тоже будет верным: на основании сведений о строении молекулы вещества реально предсказать его поведение во время химической реакции.
Строение молекулы
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
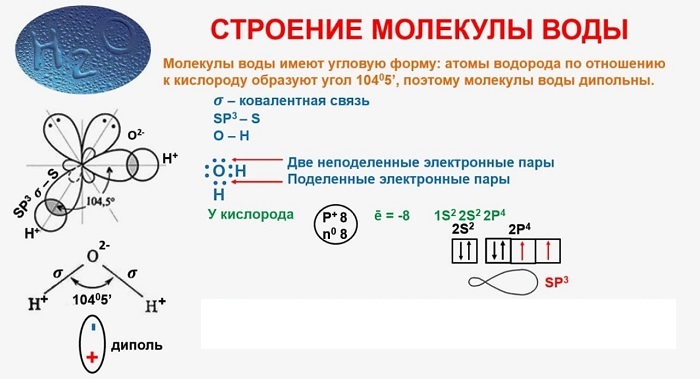
В качестве примера рассмотрим строение наименьшей частицы воды.
Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
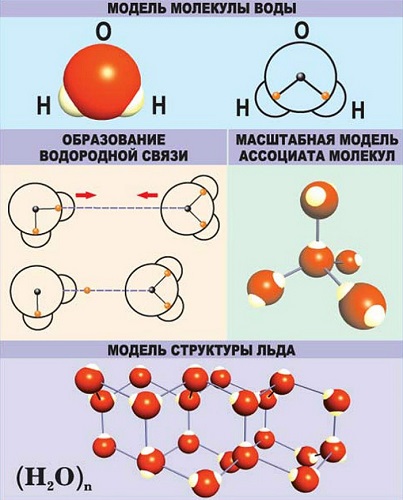
Водородная — основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
Связи характеризуются следующими показателями:
длина – степень удаления друг от друга ядер атомов, образовавших связь;
энергия – сила, прилагаемая для разрушения связи;
полярность – смещение электронного облака к одному из атомов;
порядок или кратность – количество пар электронов, образовавших связь.
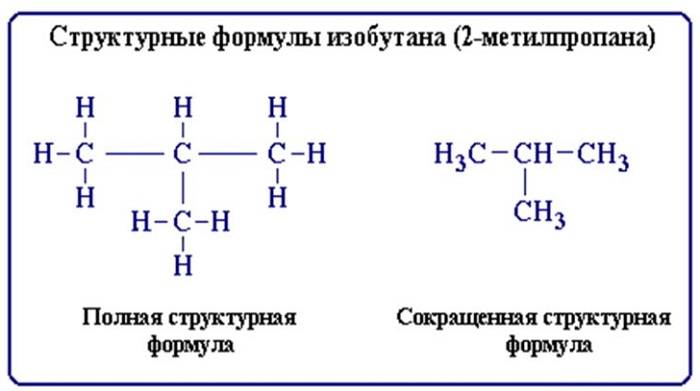
Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Масса (размер) молекулы
В зависимости о количества ядер атомов, входящих в их состав, можно выделить молекулы двухатомные, трехатомные и т. д.
В том случае, если количество атомов велико, молекула носит название макромолекулы.
Путем сложения масс атомов, входящих в состав частицы, можно определить молекулярную массу. В зависимости от её величины, все вещества делят на высоко- и низкомолекулярные.
Свойства молекулы
Современная наука выделяет следующие свойства молекул:
Знания о свойствах и строении молекул являются основополагающими для развития теоретических и прикладных наук и играют важную роль в жизни человека.
Из чего состоит все вокруг или что такое молекула?
Каждый раз, когда два атома соединяются вместе, они образуют молекулу. На самом деле все, что нас окружает – да и мы сами – состоит из триллионов различных типов молекул. Понятие молекулы было принято в 1860 году на международном съезде химиков в Карлсруэ. Согласно принятому определению молекула – это наименьшая частица химического вещества, которая обладает всеми его химическими свойствами (растворимость, вкус, способность вступать в соединения и пр). Введение понятия молекулы подтолкнуло развитие физики, химии и других естественных наук. В более общем понимании молекулой называют частицу, образованную из двух или более атомов, соединенных между собой ковалентными связями.
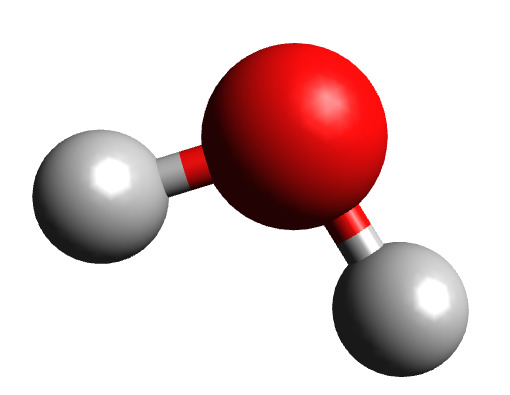
Молекула воды содержит 1 атом кислорода и 2 атома водорода
Атом – мельчайшая частица вещества, которая обладает всеми его физическими свойствами (цвет, твердость, плотность и пр.)
Когда атомы различных типов элементов соединяются вместе, они образуют молекулы, называемые соединениями. Так, вода состоит из сложных молекул, состоящих из 2 атомов водорода и 1 атома кислорода. Вот почему она называется H2O: у молекулы воды всегда будет в 2 раза больше атомов водорода, чем атомов кислорода. Существует чуть более 100 типов атомов, но типов различных веществ миллионы. Причина такого неравенства кроется в том, что они состоят из различных типов молекул.
Важно понимать, что молекулы состоят не только из различных типов атомов, но и из различных соотношений. Как и в приведенном выше примере с водой, молекула воды состоит из двух атома водорода и одного атома кислорода, что записывается как H2O. Другими примерами являются углекислый газ (C02), аммиак (NH3) и сахар или глюкоза (C6H12O6). Некоторые молекулярные формулы могут получиться довольно длинными и сложными. Давайте посмотрим на молекулу сахара:
Чтобы она получилась, нужны определенные атомы в определенном количестве. Но молекулы могут быть гораздо больше. Одна молекула витамина С состоит из 20 атомов (6 атомов углерода, 8 атомов водорода и 6 атомов кислорода – C6H8O6). Если взять эти 20 атомов витамина С и смешать, соединяя их вместе в другом порядке, то получится совершенно другая молекула, которая не только выглядит по-другому, но и действует иначе.
Молекула витамина С выглядит так
Некоторые молекулы, особенно некоторые белки, содержат сотни или даже тысячи атомов, которые соединяются вместе в цепи, которые могут достигать значительной длины. Жидкости, содержащие такие молекулы, иногда ведут себя странно. Например, жидкость может продолжать вытекать из колбы, из которой была вылита некоторая ее часть, даже после того, как колба будет возвращена в вертикальное положение.
Факты о молекулах
Чтобы всегда быть в курсе последних научных открытий, подписывайтесь на наш новостной канал в Telegram
Химические связи
Молекулы и соединения удерживаются вместе силами, называемыми химическими связями. Существует четыре типа химических связей, которые удерживают большинство соединений вместе: ковалентные связи, ионные связи, водородные и металлические, однако в качестве основных выделяют ковалентные и ионные, так как они связаны с электронами. Как известно, электроны вращаются вокруг атомов в оболочках. Эти оболочки хотят быть «полными» электронов. Когда они не заполнены, то будут пытаться соединиться с другими атомами, чтобы получить нужное количество электронов и заполнить их оболочки.
Ковалентные связи делят электроны между атомами. Это происходит, когда получается, что атомы делятся своими электронами, чтобы заполнить свои внешние оболочки. В свою очередь ионные связи образуются, когда один электрон передается другому. Это происходит, когда один атом отдает электрон другому, чтобы сформировать баланс и, следовательно, молекулу или соединение.
Еще больше увлекательных статей о том, как ученые дробят реальность на атомы, читайте на нашем канале в Яндекс.Дзен. Там выходят статьи, которых нет на сайте!
Знания о свойствах и строении молекул легли в основу современной науки и нашего понимания Вселенной
Немаловажным также является тот факт, что молекулы всегда находятся в движении. В твердых телах и жидкостях они находятся очень близко друг к другу, а их движение можно сравнить с быстрой вибрацией. В жидкостях молекулы могут свободно перемещаться между собой, как бы скользя. В газе плотность молекул обычно меньше, чем в жидкости или твердом теле того же химического соединения, а потому молекулы движутся даже более свободно, чем в жидкости. Для конкретного соединения в данном состоянии (твердом, жидком или газообразном) скорость молекулярного движения возрастает с увеличением абсолютной температуры.
Урок 3. Молекулы и простые вещества
В уроке 3 «Молекулы и простые вещества» из курса «Химия для чайников» рассмотрим, что такое молекулы, простые вещества, а также металлы и неметаллы. Напоминаю, что в прошлом уроке «Относительная атомная масса химических элементов» мы рассмотрели разные способы выражения массы химических элементов.
Атомы химических элементов существуют в природе как в свободном, так и в связанном состоянии. Например, благородные газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe — находятся в воздухе в виде одиночных атомов. Атомы всех остальных элементов в природе не существуют изолированно друг от друга. Они всегда стремятся соединиться, связаться с другими атомами за счет особых сил. Почему? Так они достигают более устойчивого состояния. Это одна из иллюстраций всеобщего принципа природы — стремления к максимально устойчивому состоянию.
Что такое молекула?
Из курса физики вы уже немного знаете о молекулах — частицах вещества, состоящих обычно из двух и более атомов. Что же такое молекула?
Молекула — наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
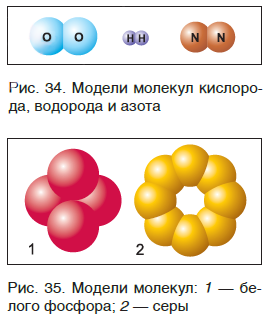
Молекулы благородных газов одноатомны, а молекулы таких веществ, как кислород, водород, азот, хлор, бром, состоят из двух атомов (рис. 34). Молекула фосфора содержит четыре атома, а серы — восемь (рис. 35).
Простые вещества
Если вещества состоят из атомов одного вида, то они относятся к простым веществам.
Простыми называются вещества, которые образованы атомами одного химического элемента.
Простые вещества — одна из форм существования химических элементов в природе. Простые вещества, состоящие из молекул, относятся к веществам молекулярного строения. При обычных условиях среди них есть газы (водород, кислород, азот, фтор, хлор, благородные газы), жидкости (бром) и твердые вещества (сера, иод, фосфор).
Элемент кислород существует в виде двух простых веществ молекулярного строения: одно из них (просто кислород) состоит из двухатомных молекул, а второе (озон) — из трехатомных.
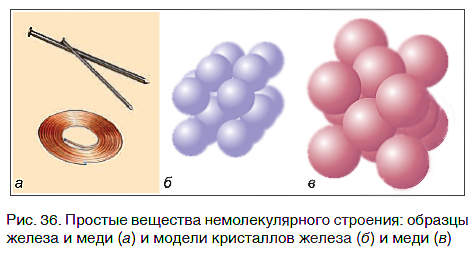
Связываясь друг с другом, атомы образуют не только молекулы. Гораздо больше простых веществ, которые имеют немолекулярное строение. Они обычно представляют собой твердые кристаллические вещества, построенные из атомов, например кристаллы алмаза, графита, меди, железа (рис. 36).
Металлы и неметаллы
Простые вещества по их свойствам делят на металлы и неметаллы.
Все металлы при комнатной температуре являются твердыми веществами (за исключением ртути), которые проводят электрический ток и теплоту, имеют характерный металлический блеск. Многие из металлов пластичны, т. е. меняют свою форму при механическом воздействии. Благодаря этому свойству металлы можно ковать, расплющивать, вытягивать в проволоку.
Большинство простых веществ — металлы, и все они имеют немолекулярное строение.

Хотя простых веществ неметаллов гораздо меньше, по своим свойствам они различаются между собой значительно сильнее, чем металлы. Почти все они плохо проводят электрический ток и теплоту. Многие из неметаллов при обычных условиях являются хрупкими твердыми веществами (рис. 37), другие — газами (рис. 38), а бром — жидкостью (рис. 39). Большинство неметаллов существует в виде молекул, но некоторые имеют немолекулярное строение, например бор, углерод, кремний.
Алмаз и графит — это простые вещества, состоящие из атомов одного и того же химического элемента — углерода. Хотя они оба имеют немолекулярное строение, свойства этих веществ сильно отличаются: алмаз — прозрачное, самое твердое в природе вещество, а графит — темно-серое, непрозрачное, мягкое вещество (рис. 40). Их свойства различны потому, что различно строение их кристаллов, хотя состоят эти кристаллы из одних и тех же атомов — атомов углерода.
Названия простых веществ
В настоящее время известно более 400 простых веществ, хотя элементов пока открыто только 118. Названия большинства простых веществ такие же, как и названия соответствующих химических элементов. Только у элемента углерода простые вещества (как вы уже знаете) имеют собственные названия, да еще у элемента кислорода есть простое вещество озон.
Необходимо различать понятия простое вещество и химический элемент, поскольку в большинстве случаев их названия совпадают.
Химический элемент — это определенный вид атомов. Поэтому название химического элемента — это то, что объединяет атомы данного вида. У всех таких атомов есть общие черты. Каждый химический элемент обозначается с помощью соответствующего химического знака.
В то же время понятие простое вещество обозначает конкретное химическое вещество, образованное атомами одного вида. Оно характеризуется определенными составом, строением, физическими и химическими свойствами.
Например, если говорят о том, что в состав какого-то вещества входит азот, то имеют в виду атомы этого химического элемента, а когда говорят об азоте, который входит в состав воздуха, то, конечно, речь идет о простом веществе.
Более подробно о различии понятий «простое вещество» и «химический элемент» вы узнаете в главах 2, 3.
Краткие выводы урока:
Надеюсь урок 3 «Молекулы и простые вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Что такое молекула?
Определение:
В космосе обнаружены как простые, так и сложные органические (углеродосодержащие) молекулы. Углерод образуется в ядрах красных гигантских звезд, где он циркулирует на поверхности и распределяется в пространстве.
Впечатление художника о простых и сложных органических (углеродосодержащих) молекулах, обнаруженных в космосе.
Она может состоять из атомов одного химического элемента, как в случае с кислородом (O2), или из различных элементов, как в случае с водой (H2O). Как компоненты материи, молекулы распространены в органических веществах (и, следовательно, в биохимии) и являются тем, что позволяет создавать жизнетворные элементы, таким как жидкая вода и воздухопроницаемые атмосферы.
Типы связей:
Ионная связь, напротив, представляет собой тип химической связи, которая включает электростатическое притяжение между противоположно заряженными ионами. Ионы, участвующие в такой связи, — это атомы, которые потеряли один или несколько электронов (называемые катионами), и те, которые приобрели один или несколько электронов (называемые анионами). В отличие от ковалентности, этот перенос называется электровалантом.
Схема молекулы воды, которая состоит из двух атомов водорода и одного атома кислорода.
История
Исторически молекулярная теория и атомная теория тесно переплетены. Первые упоминания о том, что материя состоит из “отдельных единиц”, появились в Древней Индии, где последователи джайнизма придерживались идеи, что все вещи состоят из мелких неделимых элементов, которые, соединяясь, образуют более сложные объекты.
В Древней Греции философы Левкипп и Демокрит ввели термин «атомос», имея в виду «мельчайшие неделимые части материи», от которых мы получаем современный термин «атом».
Затем в 1661 году натуралист Роберт Бойл в трактате по химии под названием «Скептический химик» утверждал, что материя состоит из различных комбинаций «корпускул» (устаревший термин для обозначения мельчайшей частицы материи), а не земли, воздуха, ветра, воды и огня. Однако эти наблюдения ограничивались областью философии.
Только в конце 18-го и начале 19-го веков Закон сохранения массы Антуана Лавуазье и Закон множественных пропорций Дальтона привели атомы и молекулы в область точной науки. Первые предположили, что элементы являются основными веществами, которые не могут быть подвергнуты дальнейшему разложению, в то время как последние предположили, что каждый элемент состоит из одного уникального типа атома и что они могут соединяться вместе, образуя химические соединения.
Сканирующий туннельный микроскоп
Еще одна находка пришла в 1865 году, когда Иоганн Йозеф Лошмидт измерил размер молекул, составляющих воздух, что дало ощущение масштаба молекул. Изобретение сканирующего туннельного микроскопа (СТМ) в 1981 году позволило впервые непосредственно наблюдать атомы и молекулы.
Сегодня наше понятие молекул получает дальнейшее развитие благодаря постоянным исследованиям в области квантовой физики, органической химии и биохимии. А когда речь заходит о поисках жизни в других мирах, необходимо понимание того, что нужно органическим молекулам, чтобы выйти из комбинации химических строительных блоков.
Что такое молекула?
В первый раз слово «молекула» большинство из нас услышали в школе на уроках природоведения. Это одно из основополагающих понятий современной химии, которое сделало возможным дальнейшее познание окружающей среды.
Что же такое молекула, из чего она состоит и зачем вообще нужно изучать молекулы?
Откуда взялось слово «молекула»?
Как и большинство химических терминов, слово «молекула» имеет в основе латынь. Оно образовано из двух слов: «мoles», имеющего значение массы, тяжести и «-cule» – уменьшительного суффикса. Дословное значение – маленькая масса.
В современной химии молекула – мельчайшая частица какого-либо вещества. Даже одна молекула любого вещества обладает всеми свойствами, которые характерны для этого вещества.
Если молекулу разделить на составные части, вещество, которое она составляла, уничтожится, распавшись на более простые элементы – атомы. На этой основе сформирован весь свод понятий, образующих современную химическую науку и практику.
Из чего состоит молекула?
Как здание состоит из кирпичиков, а любой механизм, сделанный человеком – из деталей, так и молекула состоит из простых «кирпичиков» – атомов химических элементов.
Некоторые молекулы состоят всего из одного атома – например, молекулы металлов. Но подавляющее большинство веществ, которые нас окружают, имеют гораздо более сложное молекулярное строение.
Строение любой молекулы можно записать в виде химической формулы, которая указывает, из атомов каких химических элементов состоит вещество и сколько атомов каждого вещества содержится в одной молекуле. Молекула кислорода состоит из двух одинаковых атомов элемента кислорода.
Всем известна формула воды: H2O, которая означает, что каждая молекула воды содержит один атом кислорода и два атома водорода. Еще одна известная буквально всем формула – С2Н5ОН, формула этилового спирта, которая показывает, что это вещество состоит из двух атомов углерода (С), шести атомов водорода (Н) и одного атома кислорода (О).
В процессе взаимодействия друг с другом вещества обмениваются химическими элементами, вступая в реакции. При этом образуются новые вещества, обладающие новыми свойствами, отличными от свойств исходных веществ.
Так, уголь (практически полностью состоящий из углерода), сгорая (взаимодействуя с кислородом, содержащимся в воздухе), образует углекислый газ – вещество, непригодное для дыхания, в отличие от кислорода.

Молекулы в обычном состоянии не несут электрического заряда и называются нейтральными. Те молекулы, которые получают положительный или отрицательный заряд, называются ионами, а процесс – ионизацией. Молекулы, атомы которых имеют неспаренные электроны, называются радикалами.
Чему равна масса молекулы?
Конечно, таких чувствительных весов, которые позволяли бы взвесить одну молекулу вещества, не существует в арсенале современной науки. Масса молекул и атомов вычисляется другими способами. Принято считать, что масса молекулы любого вещества равна сумме масс всех атомов, из которых состоит это вещество.
Но как узнать, сколько весит атом? Это можно узнать из Периодической таблицы элементов Менделеева, где указана масса каждого элемента. Правда, указана не в привычных нам килограммах, а в специальных единицах атомной массы.
Одна атомная единица массы (а.е.м.) равна 1/12 массы атома углерода, что в численном выражении равно 1,660*10-27 кг.
Т.е. чтобы подсчитать, сколько весит молекула вещества, нужно взять его формулу, сложить атомные массы всех входящих в нее элементов и умножить на вес атомной единицы массы.