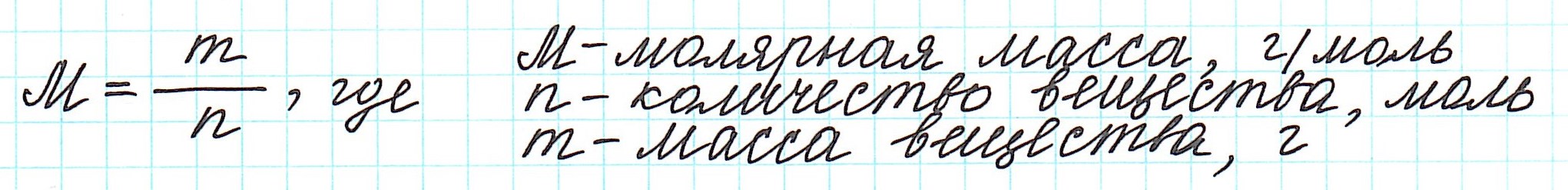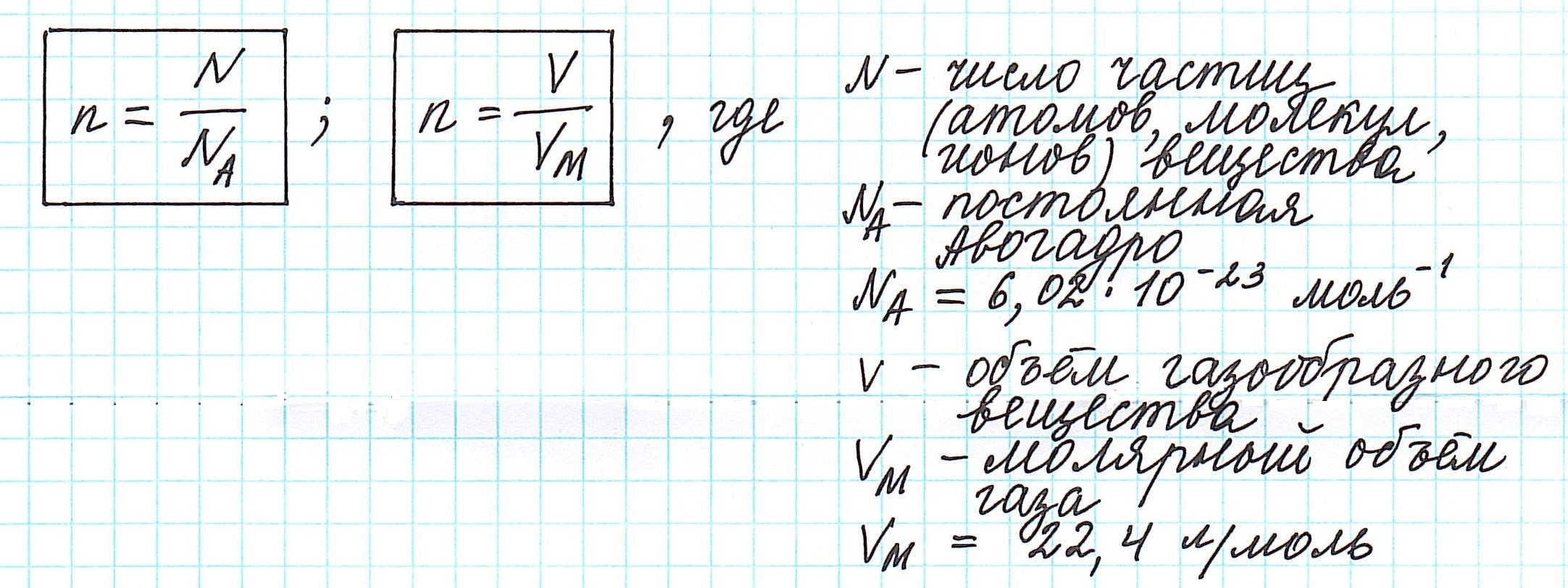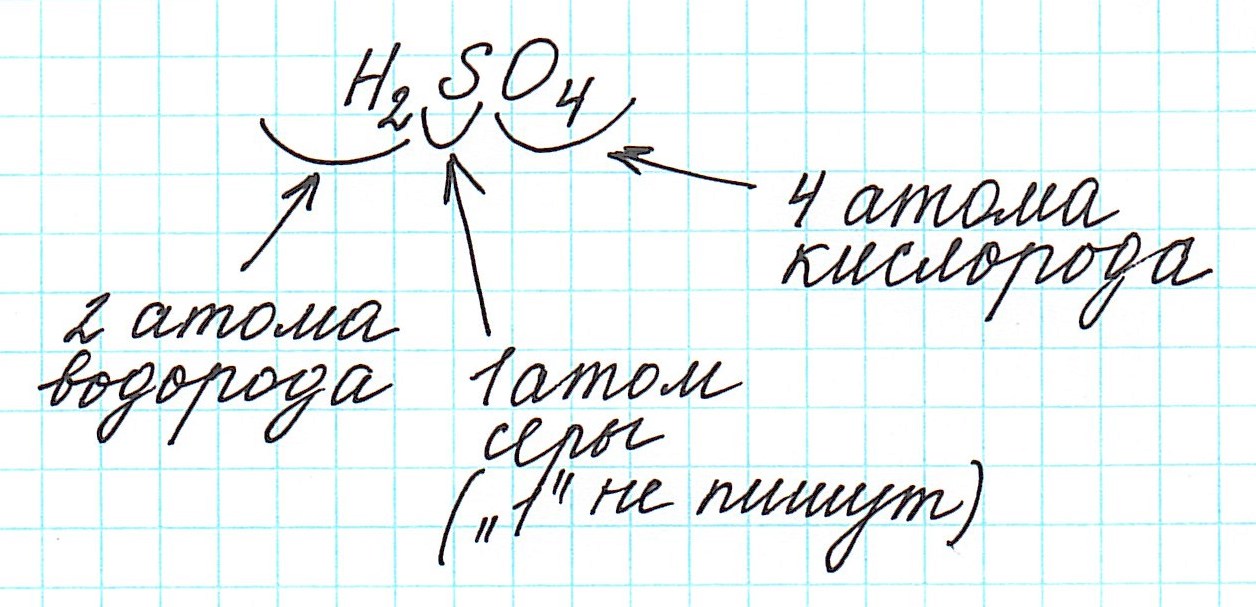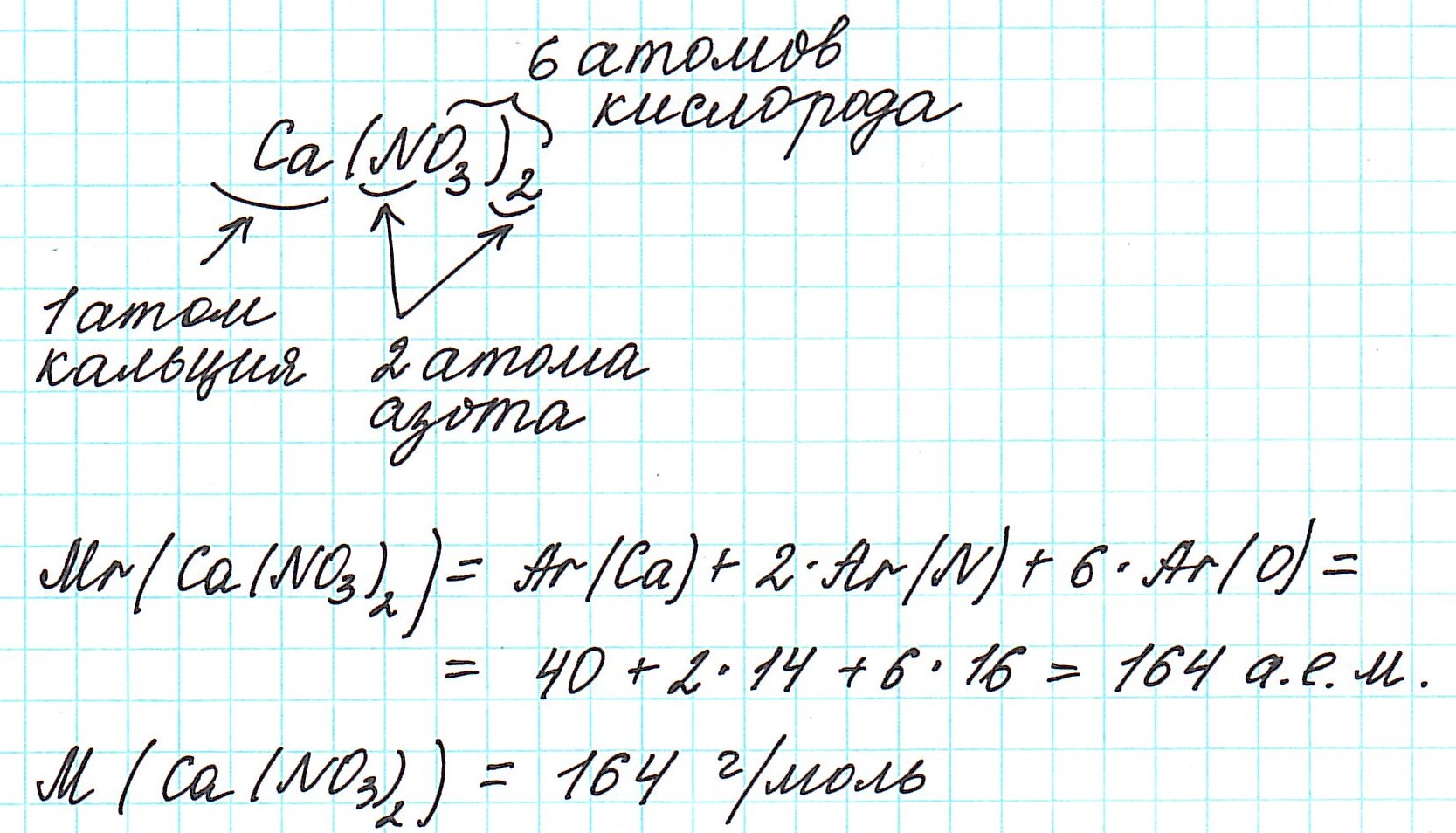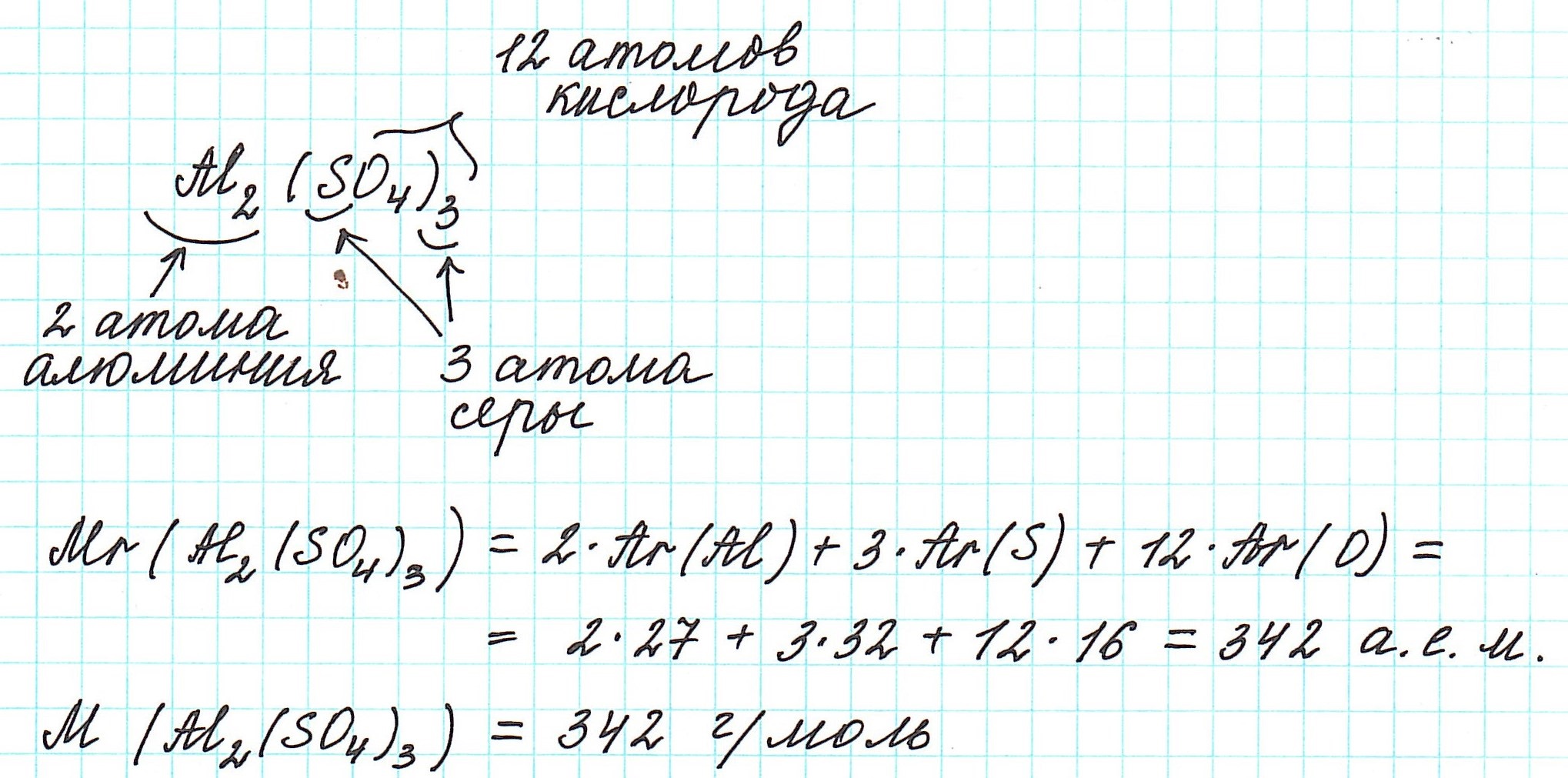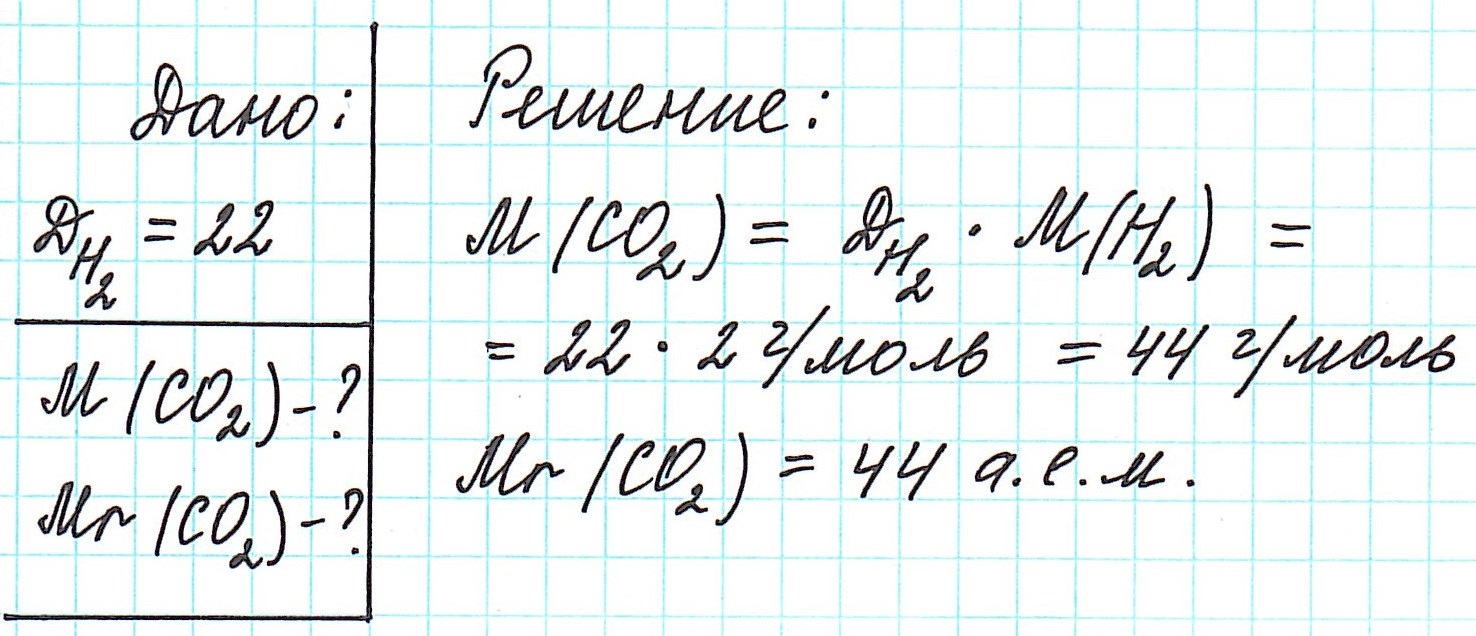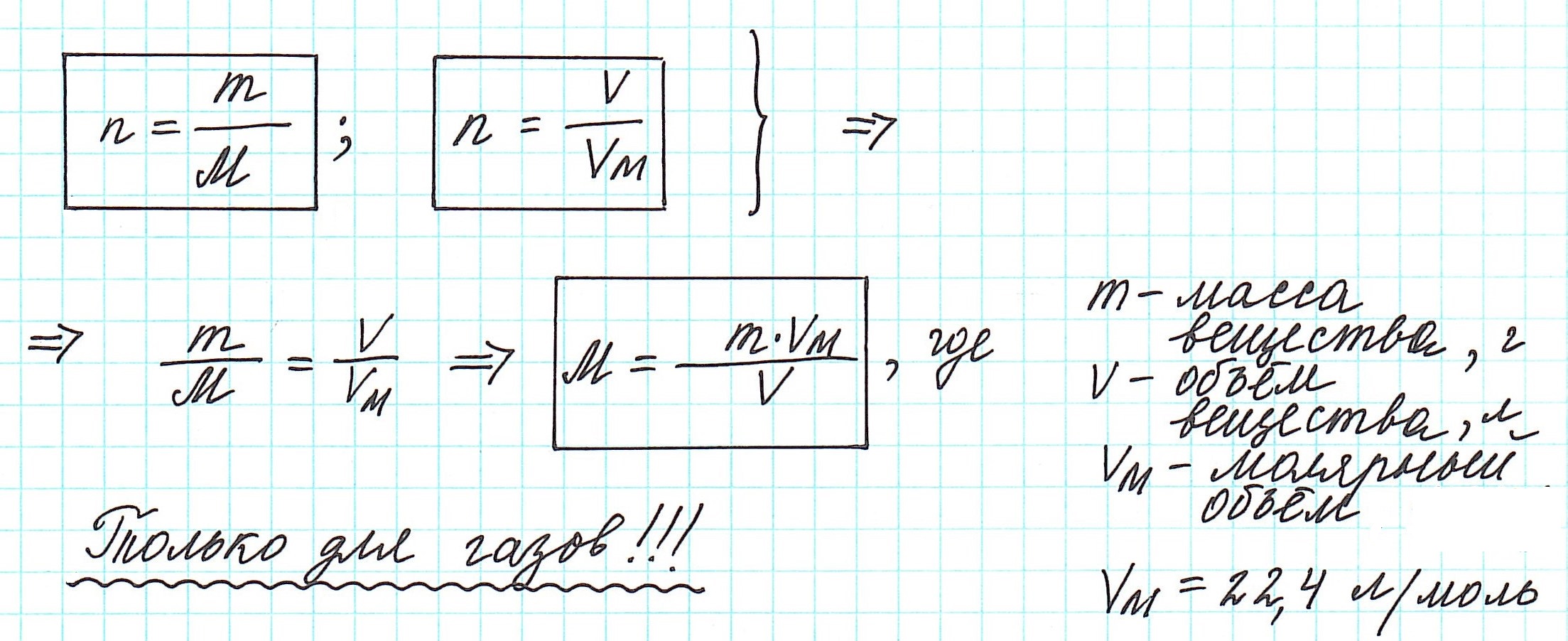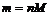Молекулярная и атомная масса в чем разница
МОЛЯРНАЯ МАССА И ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА: В ЧЕМ ОТЛИЧИЕ И ПОЧЕМУ ОНИ ЧИСЛЕННО РАВНЫ
Как вычислить молярную массу вещества? В каких единицах она измеряется?
А еще есть относительная молекулярная масса. Почему она относительная и численно равна молярной массе? Может быть это одно и то же?
Вот сколько вопросов возникает сразу в отношении такого простого на первый взгляд понятия, как молярная масса.
Разберемся по порядку и научимся ее определять.
Относительная атомная масса
Огромнейший вклад в развитие и обоснование понятия относительная атомная масса внесли в разное время французский ученый Гей-Люссак, итальянский ученый А.Авогадро и шведский ученый Й.Я. Берцелиус.
Не углубляясь в историю вопроса, вспомним, что любой химический элемент представляет собой определенную разновидность атомов. Сегодня мы знаем, что атомы химических элементов имеют свои особые характеристики.
И самая главная из них, определяющая практически все остальные, это заряд ядра. А так как заряд ядра обусловлен присутствием в нем протонов, а заряд одного протона равен +1, то и количество протонов, соответственно, также является важнейшей характеристикой атомов химических элементов.
Основную массу атома составляет ядро, которое кроме протонов содержит еще и нейтроны. Масса последних сопоставима с массой первых. Оболочку атома составляют электроны.
По числу частиц в атоме, а точнее, по их суммарной массе, атомы химических элементов можно условно разделить на тяжелые и легкие. Например, легким элементом является водород, так как его атомы имеют самую маленькую массу. А свинец — это уже тяжелый элемент. Масса его атома в 302 раза тяжелее массы атома водорода.
Но тем не менее, как бы мы не делили все атомы на тяжелые или легкие, абсолютная масса (mA) каждого из них ничтожно мала, как мала и масса составляющих их частиц. Например,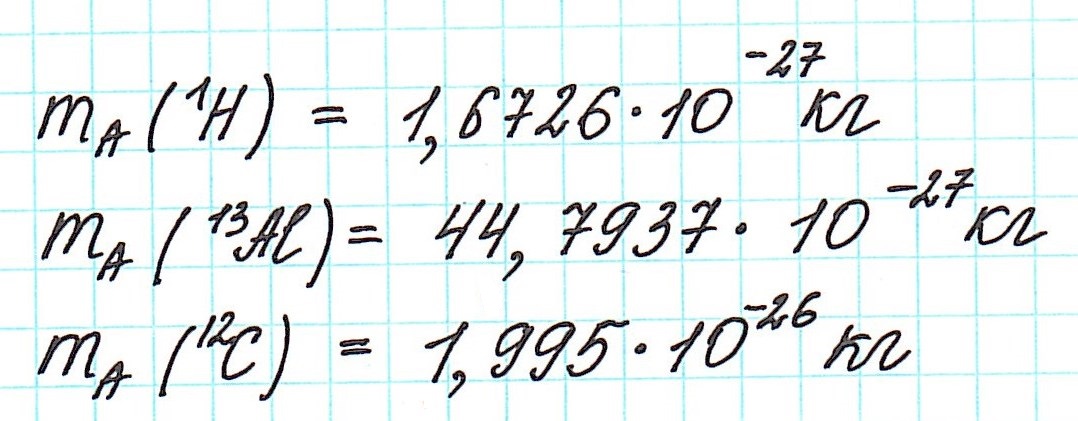
Величина, с которой сравнивают массу атома
Первоначально еще Дальтон сравнивал массы атомов с массой атома водорода, как самого легкого. Позднее появилась так называемая кислородная единица, равная 1/16 части массы атома кислорода. К ней перешли потому, что большинство атомов химических элементов образуют соединения с кислородом.
Однако, с развитием атомной физики и эта единица стала крайне неудобной. Все потому, что кислород в природе имеет несколько изотопов (а именно 3 устойчивых, всего же их 16). А изотопы, как известно, отличаются своей атомной массой. Из-за большого разнообразия изотопов и их различной устойчивости кислородная единица утратила свою актуальность.
Почему именно углерод? Да потому, что:
— у углерода всего 2 изотопа: 12 С и 13 С; причем первого 98,9%;
— количество органических веществ (их основу составляет, как известно, именно углерод) в сотни раз больше, чем неорганических;
— при переходе от кислородной единицы к углеродной уже посчитанные относительные атомные массы всех элементов изменились не существенно, что оказалось очень удобным.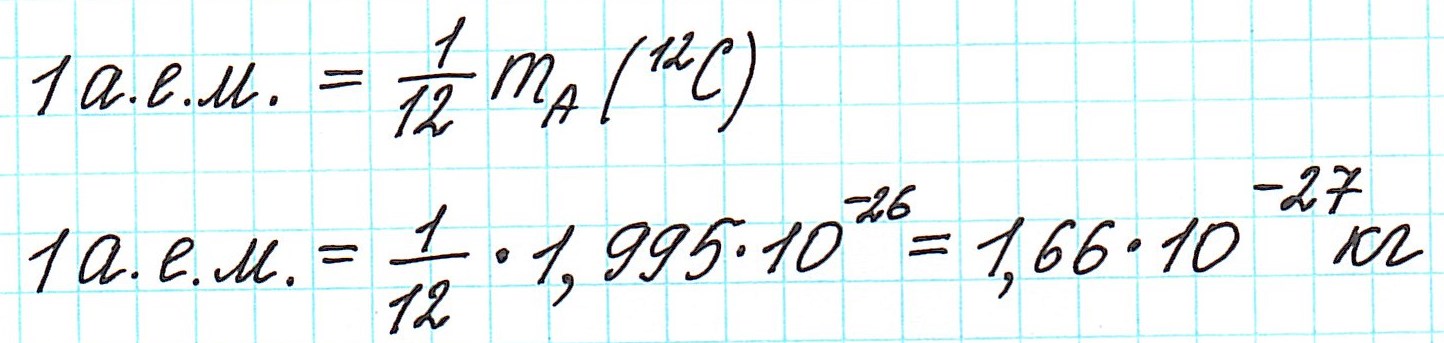
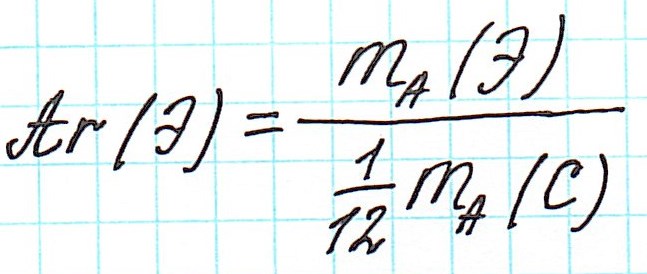
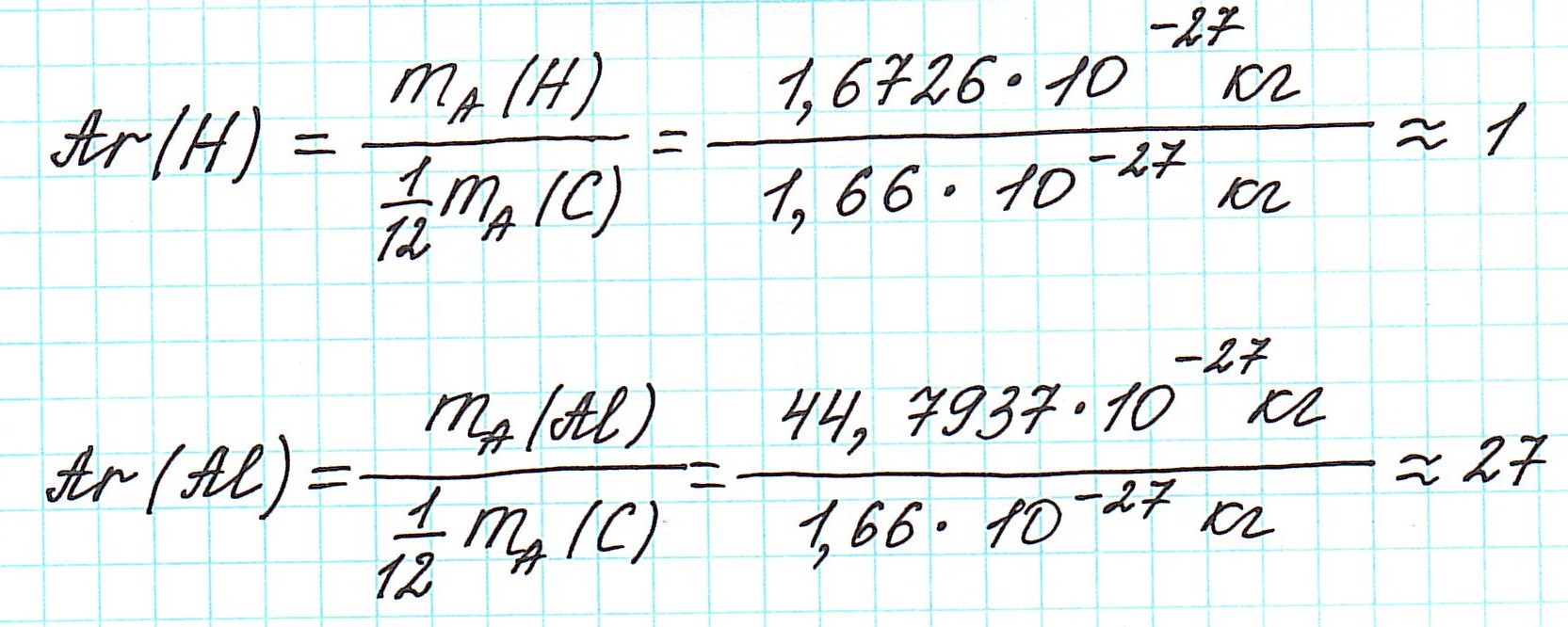
Почему атомная масса дробная?
Вернемся к строению атома.
Масса атома складывается из массы всех составляющих его частиц.
Массы протона и нейтрона приняты равными 1. А вот массой электрона обычно пренебрегают (по крайней мере в химии), так как даже относительная она безнадежно мала (0,0005485799090659(16) а.е.м.). То есть можно сказать, что масса атома определяется массой его ядра.
В составе ядра целое количество частиц. Например, в атоме одного из изотопов кислорода 8 протонов и 8 нейтронов. Значит, его Ar должна быть равна 16. Так почему же Ar представлена в периодической системе химических элементов в виде десятичной дроби? Для кислорода это Ar(О)=15,9994.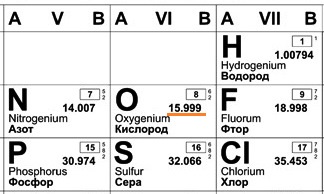
Например, химический элемент кислород в природе состоит на 99,76% из изотопа 16 О, на 0,04% из изотопа 17 О и на 0,20% из изотопа 18 О. Таким образом, Ar для кислорода является средним значением, учитывающим относительное содержание его изотопов.
Относительная молекулярная масса
А как же найти относительную молекулярную массу?
Дело в том, что молекулы характерны для веществ с ковалентными связями: вода H2O, серная кислота H2SO4, глюкоза C6H12O6 и т.д. И к ним в полной мере можно применить термин «относительная молекулярная масса».
Так как молекулы состоят из атомов, то относительная молекулярная масса (Mr) будет складываться из их относительных атомных масс. Например: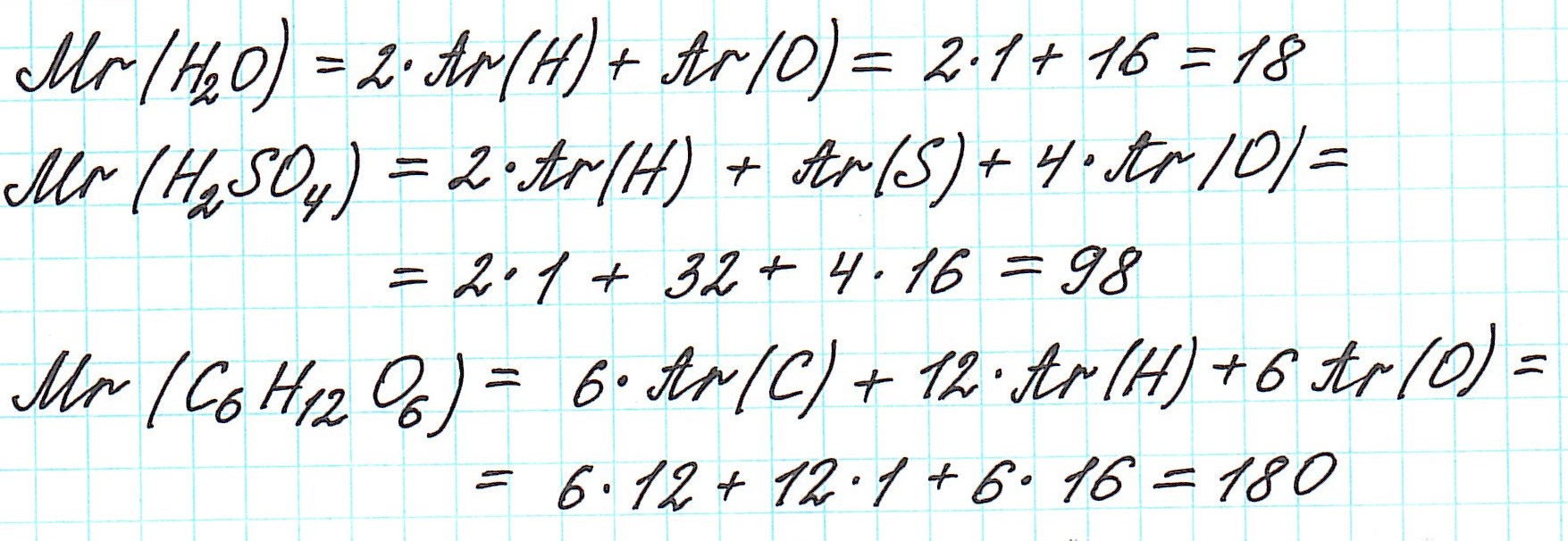
Точно так же, как относительную атомную массу (Ar), относительную молекулярную массу (Mr) будем сопоставлять с 1/12 частью атома изотопа углерода 12 С.
В последующем говорим о Mr.
Количество вещества и молярная масса
В практических расчетах все-таки требуется вычислять массы, взятые в граммах, килограммах ато и в тоннах (если речь идет о каком-то производстве, например).
Как же поступают тогда?
Количество вещества, которое содержит столько же частиц (атомов, ионов, молекул – в зависимости от строения), что и 12 г изотопа углерода 12 С, назвали молем.
Один моль вещества (любого!) всегда содержит 6,02·10 23 его частиц ( постоянная Авогадро ).
Ну, а так как атомы элементов отличаются по своей массе, то и 1 моль вещества тоже будет отличаться по массе.
Массу одного моля вещества называют молярной массой (М) и вычисляют в г/моль.
Таким образом, молярная масса и количество вещества связаны соотношением:
Можно также определить и такие отношения, связанные с количеством вещества:
Почему же относительная молекулярная и молярная массы равны?
Итак, относительная молекулярная и молярная массы, как следует из их определений – это не одно и то же.
Докажем, каким образом обе массы численно могут быть равны:
Как вычислить молярную массу вещества
Мы уже знаем, что относительная молекулярная масса складывается из относительных атомных масс.
При нахождении относительной молекулярной массы (Mr), а значит и молярной (М), выполняем следующие действия :
1) правильно записываем формулу вещества;
2) анализируем качественный состав (атомы каких элементов составляют вещество) и количественный состав (в каких количествах находятся эти атомы – смотрим по индексам, которые стоят справа внизу от знака химического элемента);
3) в периодической системе химических элементов находим элементы, атомы которых составляют вещество, и округляем относительную атомную массу, стоящую рядом со знаком элемента, до целого числа (! у хлора – до 35,5);
4) складываем относительные атомные массы всех элементов с учетом количества атомов.
Рассмотрим еще примеры:
Как вычислить молярную массу вещества, находящегося в газообразном состоянии
Это означает, что в данных условиях отношение масс газов друг к другу является отношением их молярных масс:


Вычислить молярную массу вещества (а, значит, и относительную молекулярную), находящегося в газообразном состоянии, можно, используя молярный объем газа (VM):
Итак, подведем итог:
Без вычисления молярной массы не обходится решение практически ни одной задачи. Если вы поняли, что такое молярная и относительная молекулярная массы и как их вычислять, но еще не умеете решать задачи с их применением, то самое время научиться.
Разбор простых типовых задач по химии в книге, которую вы можете совершенно БЕСПЛАТНО скачать здесь.
Разница между атомной массой и молекулярной массой
Содержание:
Что такое атомная масса?
Однако масса электрона очень мала по сравнению с массами протонов и нейтронов. Следовательно, можно сказать, что вклад электронов в атомную массу меньше. Большинство атомов периодической таблицы имеют два или более изотопов. Изотопы отличаются друг от друга разным количеством нейтронов, даже если у них одинаковое количество протонов и электронов. Поскольку количество нейтронов у них разное, каждый изотоп имеет разную атомную массу.
Более того, массы атомов чрезвычайно малы; таким образом, мы не можем выразить их в обычных единицах массы, таких как граммы или килограммы. Для наших целей мы используем другую единицу, называемую атомной единицей массы (а.е.м.), чтобы измерить атомную массу. 1 атомная единица массы составляет одну двенадцатую массы изотопа C-12. Если мы разделим массу атома на массу, составляющую одну двенадцатую массы изотопа C-12, мы можем получить его относительную массу. Однако в общем случае, когда мы говорим об относительной атомной массе элемента, мы имеем в виду его атомный вес (потому что мы вычисляем его с учетом всех изотопов).
Что такое молекулярный вес?
На практике важно измерить вес атомов и молекул. Но их трудно взвесить как отдельные частицы, поскольку их массы чрезвычайно малы по нормальным параметрам взвешивания (граммы или килограммы). Следовательно, чтобы заполнить этот пробел и измерить частицы на макроскопическом уровне, очень полезна концепция молярной массы.
Определение молекулярной массы напрямую относится к изотопу углерода-12. Масса одного моля из 12 атомов углерода составляет ровно 12 граммов, то есть его молярная масса составляет ровно 12 граммов на моль. Более того, мы можем рассчитать молекулярную массу молекул, содержащих такие же атомы, как O2 или N2 умножив количество атомов на атомный вес атомов. Однако молекулярная масса таких соединений, как NaCl или CuSO4 рассчитывается путем сложения атомных масс каждого атома.
В чем разница между атомной массой и молекулярной массой?
Более того, существует разница между атомной массой и молекулярной массой в способе вычисления этих двух величин. Мы можем легко определить атомную массу, сложив массы нейтронов, протонов и электронов атома. Однако мы определяем массу молекулы или молекулярную массу молекулы, добавляя средние массы атомов в молекуле.
На иллюстрации ниже представлена разница между атомной массой и молекулярной массой в табличной форме.
Молекулярная масса
п.1. Относительная атомная и молекулярная масса
Массы атомов и молекул, из которых состоят вещества, очень малы. Поэтому их чаще измеряют не в килограммах, а используют внесистемную единицу – атомную единицу массы.
Относительную атомную массу проще всего найти, пользуясь таблицей Менделеева.
Например:
\(A_r(\mathrm
\(A_r(\mathrm
\(A_r(\mathrm
\(A_r(\mathrm
На практике при решении учебных задач относительные атомные массы округляют и единицу измерения а.е.м. не пишут.
п.2. Количество вещества. Постоянная Авогадро
Например:
В 5 молях углерода будет содержаться \(N=5\cdot N_A\approx 6,022\cdot 10^<23>\approx 3,01\cdot 10^<24>\) атомов углерода. Причём, всё равно, будут ли эти атомы углерода образовывать уголь, графит или алмаз.
Аналогично, в 5 молях воды будет \(N=5\cdot N_A\approx 3,01\cdot 10^<24>\) молекул воды. Причём, независимо от того, в каком агрегатном состоянии находится вода: в виде пара, жидкости или льда.
Т.е., «количество вещества» всегда говорит нам о «количестве частиц», независимо от других параметров.
п.3. Молярная масса
Например:
Найдем молярную массу этилового спирта \begin
п.4. Молярный объем
Это свойство газов часто используется при изучении различных веществ и явлений в физике и химии.
п.5. Задачи
Задача 1. Масса кристалла серы равна 16 г. Сколько молекул серы \(\mathrm
Задача 2*. В кислородном генераторе на космическом корабле было получено 1,6 кг кислорода \(\mathrm
Атомная масса
А́томная ма́сса, относительная атомная масса (устаревшее название — атомный вес) — значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода 12 C, поэтому атомная масса этого изотопа по определению равна точно 12. Разность между атомной массой изотопа и его массовым числом называется избытком массы (обычно его выражают в МэВ). Он может быть как положительным, так и отрицательным; причина его возникновения — нелинейная зависимость энергии связи ядер от числа протонов и нейтронов, а также различие в массах протона и нейтрона.
Зависимость атомной массы изотопа от массового числа такова: избыток массы положителен у водорода-1, с ростом массового числа он уменьшается и становится отрицательным, пока не достигается минимум у железа-56, потом начинает расти и возрастает до положительных значений у тяжёлых нуклидов. Это соответствует тому, что деление ядер, более тяжёлых, чем железо, высвобождает энергию, тогда как деление лёгких ядер требует энергии. Напротив, слияние ядер легче железа высвобождает энергию, слияние же элементов тяжелее железа требует дополнительной энергии.
Атомная масса химического элемента (также «средняя атомная масса», «стандартная атомная масса») является средневзвешенной атомной массой всех стабильных изотопов данного химического элемента с учётом их природной распространённости в земной коре и атмосфере. Именно эта атомная масса представлена в периодической таблице Д. И. Менделеева, её используют в стехиометрических расчётах. Атомная масса элемента с нарушенным изотопным соотношением (например, обогащённого каким-либо изотопом) отличается от стандартной. Для моноизотопных элементов (таких как иод, золото и т. п.) атомная масса элемента совпадает с атомной массой его единственного представленного в природной смеси изотопа.
Молекулярной массой химического соединения называется сумма атомных масс элементов, составляющих её, умноженных на стехиометрические коэффициенты элементов по химической формуле соединения. Строго говоря, масса молекулы меньше массы составляющих её атомов на величину, равную энергии связи молекулы. Однако этот дефект массы на 9-10 порядков меньше массы молекулы, и им можно пренебречь.
Определение моля (и числа Авогадро) выбирается таким образом, чтобы масса одного моля вещества (молярная масса), выраженная в граммах, была численно равна атомной (или молекулярной) массе этого вещества. Например, атомная масса железа равна 55,847. Следовательно один моль железа (т. е. количество атомов железа, равное числу Авогадро, 6,022·10 23 ) имеет массу 55,847 г.
Прямое сравнение и измерение масс атомов и молекул выполняется с помощью масс-спектрометрических методов.
История
До 1960-х годов атомную массу определяли таким образом, чтобы нуклид кислород-16 имел атомную массу 16 (кислородная шкала). Однако соотношение кислорода-17 и кислорода-18 в природном кислороде, который также использовался в расчётах атомной массы, приводило к наличию двух разных таблиц атомных масс. Химики использовали шкалу, основанную на том, что естественная смесь изотопов кислорода должна была иметь атомную массу 16, тогда как физики присваивали то же число 16 атомной массе наиболее распространённого изотопа кислорода (имеющего восемь протонов и восемь нейтронов).
Атомная и молекулярная масса



Химические понятия
Вещество – форма материи, которая имеет массу покоя.
Поле – форма материи, которая не имеет массы покоя.
Движение (явление) – любое изменение материи.
Молекула – это наименьшая частица вещества, которая сохраняет его состав и химические свойства. Молекулы одного вещества одинаковы. Молекулы различных веществ отличаются друг от друга весом, размерами и химическими свойствами.
Молекулы непрерывно движутся.
Молекулы состоят из атомов.
Атомы – это мельчайшие частицы, которые не распадаются при химических реакциях.
Атомы одного вида, отличаются от атомов других видов весом, размерами и химическими свойствами.
Химический элемент – вид атомов с одинаковым зарядом ядра. Известно 110 химических элементов, изучено 105.
Простое вещество–форма существования элемента в свободном состоянии. Молекулы простых веществ состоят из атомов одного элемента.
Многие химические элементы образуют несколько простых веществ. Например, элемент кислород (О) образует два различных вещества: кислород (О2) и озон (О3). Элемент углерод (С) образует тоже два простых вещества: алмаз и графит. Такое явление называют аллотропией, а каждое из этих простых веществ – аллотропным видоизменением (модификацией) данного элемента. Явление аллотропиии в одних случаях обусловлено тем, что молекулы различных аллотропических видоизменений состоят из различного числа атомов, а в других случаях тем, что их кристаллы имеют различное строение.
Сложные вещества – это такие вещества, молекулы которых состоят из атомов различных элементов. Например, вода (Н2О) состоит из атомов элементов водорода и кислорода. Но нельзя говорить, что вода состоит из простых веществ водорода и кислорода.
Физические явления – форма движения материи, при которой не изменяются состав и структура вещества.
При физических явлениях изменяются отдельные свойства: форма, объем, положение тел, агрегатное состояние веществ. Например, вода при нагревании превращается в пар, а при охлаждении в лед. Это физическое явление.
Если мы разотрем мел в порошок, он не превратится в новое вещество.
Если мы нагреем стеклянную трубку, она станет мягкой, изменит форму, но стекло не превратится в новое вещество. Растирание мела, изменение формы трубки – это физические явления.
При физических явлениях одни вещества не превращаются в другие.
Химическое явление – форма движения материи, при которой происходит изменение состава и структуры реагирующих веществ. Если мы положим мел в пробирку и нальем в нее кислоту, получаются новые вещества. Сера горит и превращается в новое газообразное вещество, которое имеет неприятный запах.
Превращение мела и кислоты в новые вещества, горение серы, дерева – это химические явления (химические реакции).
При химических явлениях одни вещества превращаются в другие.
Атомная и молекулярная масса
Пользоваться этими числами при расчетах очень неудобно. Поэтому в химии и физике всегда пользуются относительными атомными и молекулярными массами. (Аг, Мг).
Атомная масса элемента измеряется в атомных единицах массы (а.е.м.). Атомная единица массы – это ½ часть массы углерода (изотопа 12 С).
Вычислим относительную атомную массу водорода:
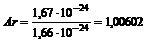
Атомную массу химического элемента можно определить по таблице Д.И.Менделеева.
Молекулярная масса вещества (Мг) равна сумме атомных масс всех атомов, входящих в состав данной молекулы.
Молекулярная масса тоже измеряется в атомных единицах массы. Молекулярную массу можно найти по формуле вещества.
Вычислим молекулярную массу серной кислоты. Формула серной кислоты H2SO4.
1.Определим по таблице атомную массу водорода, серы и кислорода: Аг(Н) = 1 а.е.м; Аг(S) = 32 а.е.м; Аг(О) = 16 а.е.м.
2. По определению, молекулярная масса серной кислоты равна сумме атомных масс всех атомов водорода, серы и кислорода, которые содержатся в молекуле. Запишем Мг(H2SO4) = (1 а.е.м. ´2) + 32 а.е.м. + (16 а.е.м. ´ 4) = 98 а.е.м.
В международной системе единиц СИ за единицу измерения количества вещества принят моль.
Моль – это количество простого или сложного вещества, которое содержит 6,02×10 23 структурных единиц (молекул, атомов, ионов, электронов, нейтронов, протонов), т.е. столько, сколько атомов содержится в 12 г (0,012 кг) изотопа углерода 12( 12 С).
6,02×10 23 – называется числом Авогадро (Na) и имеет размерность 1/моль. Na = 6,02×10 23
Масса 1 моля вещества называется молярной (или мольной) массой М.
Она равна произведению массы структурной единицы вещества (молекулы, атома, иона) в граммах на число Авогадро (Na) в 1/моль.
Поэтому молярная масса М имеет размерность г/моль; кг/моль.
Молярная (мольная) масса молекул вещества численно равна относительной молекулярной массе.
А молярная масса атомов – относительной атомной массе.
Молярная масса ионов – сумме относительных атомных масс элементов, входящих в них.
Так, например, молярная масса молекулы водорода равна
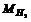
Молярная масса атомов водорода 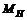
Молярная масса сульфат – иона ( 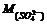
Количество молей данного вещества (n) с молярной массой М связано с массой вещества m (г) соотношением:

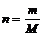
следовательно молярная масса – это соотношение массы вещества к количеству вещества, т.е.