Молекулярное строение что это
Молекулярные вещества
Молекулярные и немолекулярные вещества — один из признаков химических веществ относительно их строения.
Содержание
Молекулярные вещества
Молекулярные вещества — это вещества, мельчайшими структурными частицами которых являются молекулы
Молекулы — наименьшая частица молекулярного вещества, способная существовать самостоятельно и сохраняющая его химические свойства. Молекулярные вещества имеют низкие температуры плавления и кипения и находятся в стандартных условиях в твердом, жидком или газообразном состоянии.
К молекулярным веществам относятся:
Немолекулярные вещества
Немолекулярные вещества — это вещества, мельчайшими структурными частицами которых являются атомы или ионы.
Ион — это атом или группа атомов, обладающих положительным или отрицательным зарядом.
Немолекулярные вещества находятся в стандартных условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и кипения.
К немолекулярным веществам относятся:
Литература
См.также
Полезное
Смотреть что такое «Молекулярные вещества» в других словарях:
МОЛЕКУЛЯРНЫЕ СПЕКТРЫ — спектры испускания, поглощения и комбинационного рассеяния света (КРС), принадлежащие свободным или слабо связанным между собой молекулам. Типичные М. с. полосатые, они наблюдаются в виде совокупности более или менее узких полос в УФ, видимой и… … Физическая энциклопедия
МОЛЕКУЛЯРНЫЕ И АТОМНЫЕ ПУЧКИ — направленные потоки молекул или атомов, движущихся в вакууме практически без столкновения друг с другом и с молекулами остаточных газов. М. и а. п. позволяют изучить свойства отд. ч ц, пренебрегая эффектами, обусловленными столкновениями, кроме… … Физическая энциклопедия
Молекулярные кристаллы — кристаллы, образованные из молекул, связанных друг с другом слабыми ван дер ваальсовыми силами (см. Межмолекулярное взаимодействие) или водородной связью. Внутри молекул между атомами действует более прочная ковалентная связь. Фазовые превращения … Википедия
МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ — кристаллы, образованные из молекул, связанных друг с другом слабыми ван дер ваальсовыми силами или водородной связью (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ, МЕЖАТОМНОЕ ВЗАИМОДЕЙСТВИЕ). Внутри молекул между атомами действует более прочная, обычно… … Физическая энциклопедия
МОЛЕКУЛЯРНЫЕ СИТА — микропористые тела, избирательно поглощающие из окружающей среды вещества, размеры молекул которых меньше размеров микропор. К ним относятся природные и синтетические цеолиты. Молекулярные сита позволяют производить адсорбционное разделение… … Большой Энциклопедический словарь
МОЛЕКУЛЯРНЫЕ СПЕКТРЫ — оптические спектры испускания, поглощения и рассеяния света, принадлежащие свободным или слабо связанным молекулам. Состоят из спектральных полос и линий, структура и расположение которых типичны для испускающих их молекул. Возникают при… … Большой Энциклопедический словарь
МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ — МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ,. кристаллы, в узлах кристаллической решетки которых располагаются молекулы вещества, связанные друӠс другом слабыми или ван дер ваальсовыми силами (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ) или водородной связью (см. ВОДОРОДНАЯ… … Энциклопедический словарь
Вещества поверхностноактивные анионоактивные — Вещества поверхностно активные анионовоактивные – разновидность поверхностноактивных веществ; представляют собой высоко молекулярные органические кислоты (нафтеновые, сульфонафтеновые и др.), соли щелочноземельных и тяжелых металлов,… … Энциклопедия терминов, определений и пояснений строительных материалов
молекулярные сита — микропористые тела, избирательно поглощающие из окружающей среды вещества, размеры молекул которых меньше размеров микропор. К ним относятся природные и синтетические цеолиты. Молекулярные сита позволяют производить адсорбционное разделение… … Энциклопедический словарь
молекулярные спектры — оптические спектры испускания, поглощения и рассеяния света, принадлежащие свободным или слабо связанным молекулам. Состоят из спектральных полос и линий, структура и расположение которых типичны для испускающих их молекул. Возникают при… … Энциклопедический словарь
Вещества молекулярного строения

Всего получено оценок: 391.
Всего получено оценок: 391.
Все вещества состоят из атомов, которые объединяются в определенные структуры с помощью различных устойчивых связей. При этом структурная решетка физического тела может состоять, либо из отдельных однотипных групп атомов — молекул, либо из отдельных атомов. По типу связей различают вещества молекулярного и немолекулярного строения. Рассмотрим примеры веществ с молекулярным типом строения.
Строение вещества
Агрегатное состояние вещества (твердое, жидкое или газообразное) и особенности его строения определяются взаимодействием атомов и молекул, из которых состоят все вещества. Теория о молекулярном устройстве всех физических объектов подтвердилась многочисленными экспериментами. Современные приборы (электронные микроскопы) позволяют даже увидеть и сфотографировать отдельные молекулы и их расположение (структуру).
Древнегреческий философ Демокрит, живший более 2000 лет назад считается первым мыслителем, создавшим учение (теорию) о том, что весь наш мир построен из мельчайших. невидимых частичек — атомов. Слово атом имеет греческое происхождение (“атомос” — неделимый, неразрезаемый). Эта замечательная идея позднее была надолго забыта. Более тысячи лет безраздельно господствовало учение другого философа — Аристотеля, который отрицал существование атомов. Аристотель утверждал, что все вещества могут взаимно превращаться друг в друга, и любое тело можно делить до бесконечности. И Демокрит, и Аристотель строили свои предположения на основе общих, теоретических рассуждений. Только в начале ХIХ века на основе многочисленных опытов и экспериментов ученые (Гассенди, Ломоносов, Бойль, Мариотт, Дальтон и др.) окончательно пришли к общему мнению о реальности существования атомов и молекул.
Свойства веществ молекулярного строения
Для описания веществ со схожими свойствами выделяют два основных вида: вещества немолекулярного строения и вещества молекулярного строения. Вещества, состоящие из однотипных молекул, имеющих в своем составе один и тот же набор атомов, называются веществами молекулярного строения. Общими для этих веществ являются следующие свойства:
Примеры веществ молекулярного строения
К молекулярным веществам относятся:
Молекулярная кристаллическая решетка образована молекулами, которые соединены между собой слабыми силами межмолекулярного притяжения. Поэтому эти вещества летучи (их можно обнаружить по запаху), имеют низкие температуры плавления, малую твердость (хрупкие) и являются диэлектриками (практически не проводят электрический ток).
Чаще всего молекулярные вещества при нормальных условиях находятся в жидком или газообразном агрегатном состоянии. Некоторые молекулярные вещества могут быть в твердом виде, но их отличительными свойствами являются: легкоплавкость и растворимость в воде (если в узлах полярные молекулы). Примерами таких веществ могут служить: сахар, глюкоза, нафталин, CO2 (“сухой лед”).
Атомов в составе молекулы может быть от 2 штук до бесконечности. Одно из первых мест по количеству атомов занимает молекула ДНК (дезоксирибонуклеиновая — кислота). В одной молекуле ДНК содержится атомов:
Что мы узнали?
Итак, мы узнали, что к веществам с молекулярным строением относятся газообразные, жидкие и твердые вещества, молекулярная кристаллическая решетка которых образована молекулами, соединенными между собой слабыми силами межмолекулярного притяжения. Такие вещества летучи (обнаруживаются по запаху), имеют низкие температуры плавления, малую твердость (хрупкие) и являются диэлектриками (практически не проводят электрический ток).
Атомы и молекулы
Любые тела и предметы состоят из молекул — мелких частиц, на которые можно раздробить вещество физическими методами (например, растворением). Из этого вытекает определение молекулы: это самая мелкая частица вещества, сохраняющая его химические свойства.
Атомы — это мельчайшие частицы, сохраняющие свойства химического элемента, из них составляются молекулы. Атомы выделяются из молекул химическими методами.
Химические вещества могут быть газообразными, жидкими и твердыми. Частицы твердых веществ расположены ближе, а газов — дальше друг от друга, и они находятся в постоянном движении. Чем выше температура тела, тем быстрее движение молекул и атомов в нем, называемое броуновским, и тем больше расстояние между частицами. Внутри этого «бульона» постоянно действуют силы взаимного притяжения и отталкивания частиц, которые выражены тем сильнее, чем меньше разделяющее их расстояние.
Виды веществ
Вещества определяются как молекулярные и немолекулярные, в зависимости от того, из каких частиц они состоят. Разные типы частиц создают разные виды взаимосвязей, и это определяет физические и химические свойства соединений.
Имеющие молекулярное строение
Здесь связи между отдельными молекулами относительно слабые, поэтому легко разрываются при нагреве, причем тем легче, чем меньше молекулярная масса. Поэтому такие вещества плавятся при низких температурах и в нормальных условиях многие из них находятся в жидком или газообразном состоянии.
Это могут быть простые вещества: сера (S8), азот (N2), кислород (O2) и сложные, например, оксиды азота с разной валентностью (N2O, NO, N2O5, NO3), углекислый газ (CO2), серная кислота (H2SO4).
Самый известный пример такого рода — вода. Человеческое тело содержит около 65% воды. Даже шкала Цельсия привязана к ее плавлению (0°С) и кипению (100°С). В нормальных условиях это жидкость, но в природе встречается во всех трех агрегатных состояниях в виде снега или льда, воды и пара.
Электрическая полярность молекулы задает воде интересные особенности. Например, ее удельная теплоемкость настолько велика, что это делает ее одним из главных регуляторов климата Земли. Интересно, что наибольшей плотности она достигает не в виде льда, а в жидком состоянии, при 4 °C. Поэтому возле дна скапливается самая тяжелая вода, не достигающая замерзания, а более легкий твердый лед выталкивается наверх.
Еще один пример — йод. В нормальных условиях он имеет форму кристаллов, а при нагревании сразу переходит в газообразное состояние, что называется возгонкой.
Строящиеся из немолекулярных частиц
Целые классы соединений состоят не из молекул, а из атомов или ионов. Поскольку электрические связи разнозаряженных ионов или ковалентные атомные связи крепче, чем межмолекулярные, они разрушаются при нагреве гораздо труднее. Поэтому такие вещества, как правило, имеют твердую форму и высокие температуры плавления и кипения. Их определяют как вещества немолекулярного строения.
Примеры:
Таблица молекулярного и немолекулярного строения вещества:
| Строение вещества | Молекулярное | Немолекулярное |
| Мельчайшие структурные единицы | Молекулы | Ионы и атомы |
| Агрегатное состояние | Газообразное, жидкое, твердое | В основном, твердое |
| Температуры плавления и кипения | Низкие | Высокие |
Аморфные и кристаллические вещества
Твердые вещества могут быть аморфными или кристаллическими.
Кристаллические отличаются тем, что их структурные единицы располагаются в повторяющемся порядке, образуя кристаллические решетки.
Аморфные соединения имеют в своем составе длинные тяжелые молекулы, которые не помещаются в правильные структуры кристаллических решеток, и поэтому переход из твердого состояния в жидкое у них совершается постепенно, без четкой границы. То есть аморфные вещества не имеют точно определенной температуры плавления. Очень знакомый пример такого типа — пластилин, который используется в мягком, а не твердом или жидком состоянии. Также это различные пластмассы, смолы, стекло.
Пластичность и мягкость разогретого стекла дает возможность лепить из него, как из пластилина, только не руками, а инструментами. Стеклянная посуда, лампочки, трубки, оконное стекло — все это было бы невозможно сделать из кристаллических веществ. А как выручают человека полиэтиленовые бутылки и фасовочные пакетики!
Еще один близкий пример — сахарная карамель. Она при нагревании становится тягучей, мягкой, как и все аморфные вещества. А если дать карамели залежаться в сухом помещении несколько месяцев, ее поверхность покроется белым налетом маленьких кристаллов сахара. То есть некоторые аморфные вещества способны переходить в кристаллическую форму.
Типы кристаллических решеток
Разные виды частиц образуют разные кристаллические решетки. Существует 4 их типа:
Ионный тип кристалла
Это вид решетки, образуемый ионами — частицами, несущими на себе разноименные электрические заряды, чередующиеся в узлах решетки. Электроотрицательность анионов притягивает к себе положительно заряженные катионы, что придает решетке твердость. Поэтому такие соединения тугоплавки, зато хрупки, обладают хорошей растворимостью в воде и электропроводностью. Это основания, основные оксиды, органические и неорганические соли.
Пример такого кристалла — обычная поваренная соль, хлорид натрия. Его кубическая решетка сформирована катионами Na+ и анионами Cl-.
Атомная решетка
Этот вид кристаллов сформирован атомами, образующими между собой полярные и неполярные ковалентные связи. Такие связи очень прочны, поэтому эти вещества обладают высокой твердостью, тугоплавки и не растворяются в воде. В природе они мало распространены.
Характерный пример — углерод, имеющий две аллотропных формы, и обе — атомного типа.
Кристалл графита имеет слоистую структуру, атомы в слоях расположены по углам шестиугольника, расстояние между слоями значительно больше и межатомные связи слабее, чем внутри слоя. Поэтому кристалл хрупкий, легко расслаивается и крошится. Благодаря этому свойству, графит используется в карандашах или в виде графитовой смазки.
Алмаз — очень плотный кристалл кубической формы, среди природных минералов имеет наивысшую твердость. Образуется такая форма углерода из графита при очень высоких температуре и давлении.
Другие примеры: бор (B), германий (Ge), кремний (Si), оксид кремния (SiO2), карбид (B4C) и нитрид (BN) бора.
Состоящая из молекул
Такая решетка имеет в узлах молекулы. Силы межмолекулярного притяжения относительно слабее, и это определяет свойства веществ с молекулярной кристаллической решеткой — их кристаллы непрочные, плавятся при низких температурах, не электропроводны.
Примеры веществ с молекулярной кристаллической решеткой: полярной ковалентной связью обладает вода (H2O); а соединения неполярной ковалентной связью — твердый оксид углерода (CO2), сера (S8).
Очень интересно, что сера образует два вида кристаллов. В нормальных условиях кристаллы серы имеют интересную усечённо-ромбическую форму, а при 96 °C и выше вырастают длинные игольчатые кристаллы.
Также молекулярные кристаллы образуют многие из твердых органических соединений с достаточно сложной формулой: сахар, глюкоза.
Металлическая решетка
Эта решетка выделяется из общего ряда необычностью строения. Атомы металла, расположенные в узлах решетки, легко расстаются с внешними электронами, что превращает атом в катион, а свободно блуждающие электроны создают делокализованное электронное облако. Эта необычность определяет характерные особенности металлов: ковкость, пластичность, металлический блеск, электро- и теплопроводность.
Ионы более химически активны, чем электронейтральные атомы, этим объясняется способность металлов к поверхностному окислению. Окислы некоторых металлов, например, алюминия, образуют пленку, защищающую поверхность от контакта с кислородом воздуха. Такая особенность даже используется для защиты металлических изделий. Металлы, окислы которых образуют рыхлую структуру (например, железо), подвержены коррозии в гораздо большей степени. Примеры: железо (Fe), серебро (Ag), медь (Cu), алюминий (Al).
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Содержание:
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки
Неорганические и органические соединения отличаются по строению. Меньше веществ, образованных молекулами. Гораздо чаще встречается немолекулярные соединения. Частицы веществ могут быть упорядочены расположены в пространстве, образуют кристаллическую решетку. Тип структуры влияет на свойства различных химических соединений.
Молекулярное и немолекулярное строение веществ
Представления о существовании атомов возникли в древности. Греческое название переводится как «неделимые». Долгое время термины «атом», «корпускула», «молекула» были почти синонимами. Ясность внесли химики всего мира в 1860 году. Ученые приняли решение называть атомами мельчайшие частицы вещества. Они могут входить в состав молекул и немолекулярных структур.
Строение — это характеристика структурных единиц вещества, их расположение в пространстве (кристаллическая решетка).
Типы веществ по строению
Типы
Общие признаки
Тип кристаллической решетки
Вещества молекулярного строения.
Мельчайшие структурные единицы (частицы) — молекулы.
Вещества немолекулярного строения.
Мельчайшие структурные частицы — атомы или ионы.
Атомная, ионная или металлическая.
Неметаллы, их соединения — вещества преимущественно молекулярного строения. Водород, кислород, азот, хлор, моно- и диоксид углерода, аммиак состоят из молекул сравнительно небольшого размера. Состав отражают формулы Н2, О2, N2, Cl2, СО, СО2, NH3. Наиболее распространенное вещество молекулярного строения — вода (Н2О) (Рис. 1).
Агрегатное состояние при разных температурах отличается. В обычных условиях эти вещества являются газами. Вода при комнатной температуре — жидкость, при 0°С — превращается в лед, имеющий кристаллическое строение. При 100°С образуется газ (пар).
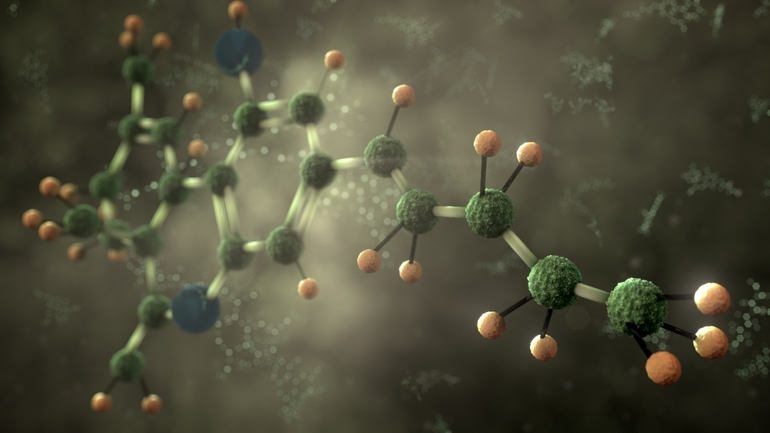
Сахар и другие твердые органические вещества тоже состоят из молекул. Состав глюкозы отражает формула С6Н12О6. На рис. 2 показано пространственное расположение атомов в молекуле.
Немолекулярных соединений в природе гораздо больше. К этой группе относятся инертные газы, алмаз, графит (аллотропные видоизменения, модификации углерода), минерал кварц, различные соли, металлы. Это преимущественно твердые вещества (при комнатной температуре). Исключение — ртуть, жидкий металл, затвердевающий лишь при –30°С. Среди веществ немолекулярного строения встречаются наиболее твердые и тугоплавкие, обладающие высокой тепло- и электропроводностью.
Кристаллические решетки: типы и примеры
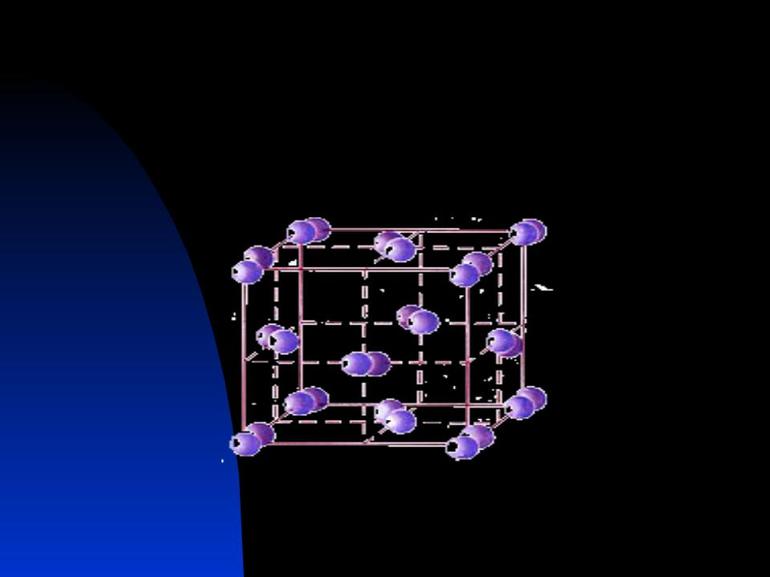
Структурные частицы природных и искусственно полученных веществ находятся в определенных точках пространства, на расстоянии друг от друга. Упорядоченное расположение называют кристаллической решеткой. В ее узлах находятся атомы, ионы или молекулы. На рисунках они обычно изображены кружочками. Черточками между ними условно обозначают химические связи.
Шаро-стержневые объемные модели тоже помогают лучше представить расположение структурных единиц в пространстве. Шарики символизируют частицы вещества, стержни между ними — химическую связь, как на рис. 3.
Вещества кристаллического строения широко распространены, имеют большое практическое значение. Они встречаются в природе, находят применение в промышленности, медицине, сельском хозяйстве, быту. (Рис. 4).
Рассмотрим особенности четырех основных типов кристаллической решетки.
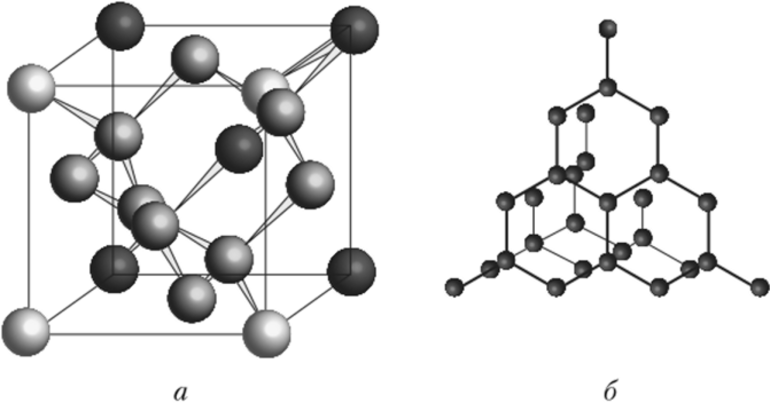
Атомная
Такие кристаллические структуры распространены среди простых веществ. В узлах находятся атомы. Примеры веществ: графит и алмаз (аллотропные видоизменения, модификации углерода), кремний.
Прочную атомную кристаллическую решетку также имеют горный хрусталь и кварц (минералы состоят из диоксида кремния). Отличие от простых веществ существенное — в узлах находятся атомы кремния и кислорода, т. е. разных элементов.
Вещества атомного строения обычно твердые (за исключением графита), нерастворимые в воде, тугоплавкие, являются изоляторами или полупроводниками.
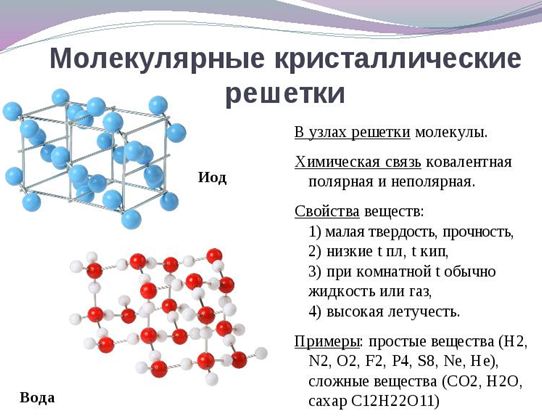
Молекулярная
В узлах кристаллической решетки — молекулы. Простые вещества с этим типом пространственного строения: S8 — кристаллическая сера, Р4 — белый фосфор, Br2 — бром, I2 — кристаллический йод. Н2О в виде льда, СО2 («сухой лед») — сложные вещества с молекулярной кристаллической решеткой.
Силы притяжения между структурными единицами относительно слабые, поэтому связи легко разрушаются. Например, йод возгоняется — переходит из твердого состояния в газообразное при комнатной температуре. (Рис. 5, 6).
Твердые органические соединения тоже имеют преимущественно молекулярную решетку. Это непрочные структуры, которые разрушаются при повышении температуры, растворении в воде.
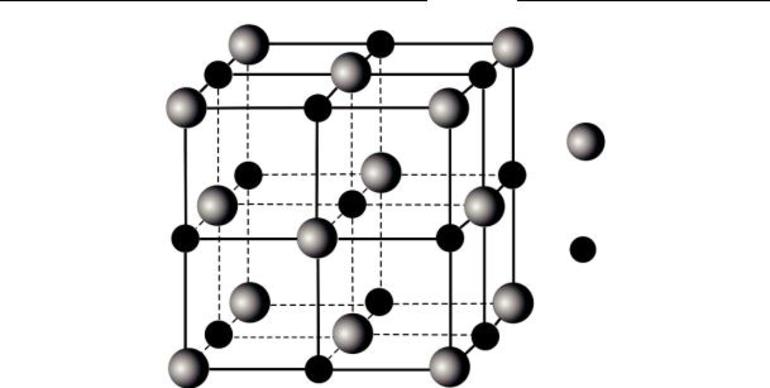
Ионная
В узлах расположены ионы — заряженные частицы. Классический пример вещества с этим типом кристаллической решеткой — поваренная соль или хлорид натрия. (Рис. 7).
Катионы — положительно заряженные частицы. В электрическом поле они перемещаются к отрицательному полюсу источника тока (катоду). Отрицательные ионы движутся к аноду, имеющему заряд «+».
Ионная решетка характерна для солей, оксидов и гидроксидов металлов I–III групп периодической системы, большой группы соединений металлических элемент из других групп. Такие вещества обычно твердые и тугоплавкие.
Ионы высвобождаются при расплавлении и растворении. Расплавы и растворы являются электролитами, проводниками электрического тока, более слабыми, по сравнению с металлами.
Металлическая
Есть значительные отличия от трех предыдущих типов кристаллического строения. В узлах расположены нейтральные атомы и катионы. Между ними беспорядочно движутся электроны, образующие так называемый «электронный газ». (Рис. 8).
Металлы, их сплавы — твердые вещества, имеющие металлический блеск. Они тугоплавкие, обладают высокой тепло- и электропроводностью.
Все известные соединения состоят из атомов, молекул либо ионов. Упорядоченное расположение структурных единиц в пространстве — кристаллическая решетка. Физические свойства веществ во многом определяются типом соединения частиц.
Труднее разрушается атомная, легче — молекулярная кристаллическая решетка. Чтобы «освободить» частицы в составе ионного кристалла, достаточно растворить или расплавить вещество. Особенностью металлической решетки является наличие «электронного газа», высокая электропроводность веществ.