Молекулярное строение это что такое
Урок №8. Вещества молекулярного и немолекулярного строения. Кристаллические решетки
Молекулярные вещества
Молекулярные вещества имеют низкие температуры плавления и кипения и находятся в стандартных условиях в твердом, жидком или газообразном состоянии.
Вода – самое известное и весьма распространенное вещество на нашей планете: поверхность Земли на 3 / 4 покрыта водой, человек на 65 % состоит из воды, без воды невозможна жизнь, так как в водном растворе протекают все клеточные процессы организма. Вода – молекулярное вещество. Это одно из немногих веществ, которое в природных условиях встречается в твердом, жидком и газообразном состояниях, и единственное вещество, для которого в каждом из этих состояний есть свое название. Особенностями строения воды вызваны ее необычные свойства. Например, при замерзании вода увеличивается в объеме, поэтому лед плавает в своем расплаве – жидкой воде, а наибольшая плотность воды наблюдается при 4 o С, поэтому зимой большие водоемы до дна не промерзают. На свойствах воды основана и сама шкала температур Цельсия (0 o – температура замерзания, 100 o – температура кипения). С причинами этих явлений и с химическими свойствами воды вы познакомитесь позже.
Немолекулярные вещества
Немолекулярные вещества находятся в стандартных условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и кипения.
Железо – серебристо-белый, блестящий, ковкий металл. Это немолекулярное вещество. Среди металлов железо занимает второе место после алюминия по распространенности в природе и первое место по значению для человечества. вместе с другим металлом – никелем – оно образует ядро нашей планеты. Чистое железо не имеет широкого практического применения. Знаменитая Кутубская колонна, расположенная в окрестностях Дели, высотой около семи метров и весом 6,5 т, имеющая возраст почти 2800 лет (она поставлена в IX в. до н. э.) – один из немногих примеров использования чистого железа (99,72 %); возможно, что именно чистотой материала и объясняется долговечность и коррозионная устойчивость этого сооружения.
Молекулярное строение это что такое
Ключевые слова конспекта: строение веществ, кристаллические решетки, электроотрицательность.
Молекулярное и немолекулярное строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Вещества при заданных условиях могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Свойства веществ зависят также и от характера химической связи между частицами, которые их образуют — молекулами, атомами и ионами. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, которые состоят из молекул, называются молекулярными. Связи между молекулами в таких веществах очень слабые, значительно слабее, чем между атомами в середине молекулы. Уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость, а затем в газ (сублимация газа). Температура плавления и кипения веществ, которые состоят из молекул, повышается с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (C, Si, Li, Na, K, Cu, Fe, W), среди них имеются металлы и неметаллы.
Простые вещества — неметаллы могут иметь молекулярное и атомное строение. Молекулярное строение при н. у. имеют газы (H2, N2, F2, Cl2, O3) либо твердые вещества (I2, P4, S8), а также единственная жидкость (Br2). Все эти вещества имеют молекулярное строение и обладают летучестью. В твердом состоянии они легкоплавкие и могут сублимироваться. Температуры кипения и плавления низкие.
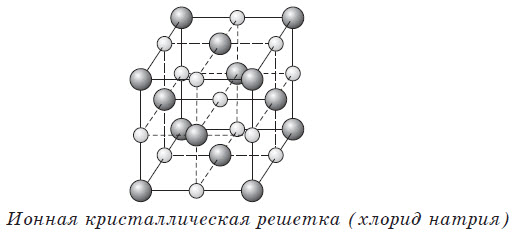
К веществам немолекулярного строения относятся ионные соединения. Такие структуры имеют большинство соединений металлов с неметаллами: все соли (NaCl, K2SO4), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, KOH). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Кристаллические решетки
Твердые вещества принято делить на кристаллические и аморфные.
Аморфные вещества не имеют четкой структуры, в них не существует закономерного расположения отдельных частиц. Следовательно, аморфные вещества не имеют и четкой температуры плавления. При нагревании они постепенно размягчаются и переходят в текучее состояние. К аморфным веществам относится большинство органических веществ (воск, стекло, полиэтилен, парафин, пластилин, смолы).
Кристаллические вещества характеризуются структурированным, упорядоченным расположением составляющих их частиц в строго определенных точках пространства, расположенных на определенном расстоянии друг от друга. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки расположения частиц, составляющих кристаллическую решетку, называют узлами решетки.
Тип кристаллической решетки определяется видом частиц, расположенных в ее узлах, и характером связи между этими частицами. Различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены прочными ковалентными связями. Примером вещества с таким типом кристаллической решетки может быть алмаз — аллотропное видоизменение углерода.
Молекулярными называют кристаллические решетки, в узлах которых расположены молекулы. Химические связи у этих молекул могут быть как полярными (HCl, H2O), так и неполярными (N2, O2).
Несмотря на то, что атомы в молекулах связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействия. Вещества с молекулярным типом решеток имеют низкую прочность, низкие температуры плавления, они летучи. Молекулярные кристаллические решетки имеют большинство органических соединений (нафталин, глюкоза, сахар).
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток расположены атомы и ионы (атомы металла переходят в ионы и отдают внешние электроны в общее пользование). Такая внутренняя структура металла определяет его характерные свойства: ковкость, пластичность, электро- и теплопроводность, металлический блеск.
Электроотрицательность
В основе образования химических связей лежит явление электроотрицателъности. В ходе химических взаимодействий одни атомы отдают электроны, другие их присоединяют.
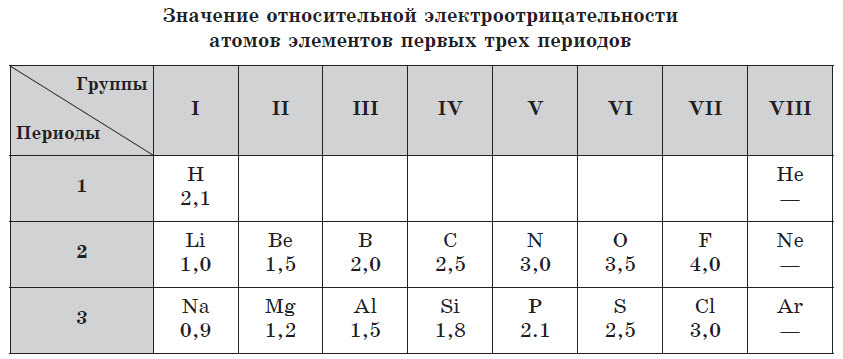
Электроотрицательность — это условная величина, характеризующая относительную способность атома приобретать отрицательный заряд.
Фактически электроотрицательность выражает способность атома оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
Электроотрицательность атома определяет характер его свойств: сильнее всего металлические свойства проявляются у элементов, атомы которых легко отдают электроны, а неметаллические — соответственно у элементов, атомы которых легко их присоединяют.
Абсолютные значения электроотрицательности элементов выражаются числами, затрудняющими их практическое применение для вычислений, поэтому в химии используют значения относительной электроотрицателъности. Условно за единицу принимают значение электроотрицательности лития (Li).
Чем меньше значение относительной элетроотрицательности, тем ярче выражены металлические свойства элемента. У всех металлов в периодической системе значение относительной электроотрицательности, как правило, меньше 2. У неметаллов это значение, как правило, превышает 2.
Электроотрицательность элементов также изменяется периодически: в периодах возрастает слева направо, а в главных подгруппах — снизу вверх.
При образовании химических связей электроны переходят или смещаются к атомам элементов, которые обладают большей электроотрицательностью.
Конспект урока «Строение веществ. Электроотрицательность».
Строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. По типу связи различают вещества молекулярного и немолекулярного строения.
Молекулярное строение веществ
Это вещества, состоящие из молекул. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (С, Si, Li, Na, К, Си, Fe, W), среди них есть металлы и неметаллы.
Немолекулярное строение веществ
К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl, K2S04), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, КОН). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Твердые вещества: кристаллические и аморфные
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки.
Ионные кристаллические решетки
Ионная кристаллическая решетка поваренной соли
Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомные кристаллические решетки
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
Атомная кристаллическая решетка алмаза
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С), они прочны и тверды, практически нерастворимы.
Молекулярные кристаллические решетки
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы.
Молекулярная кристаллическая решетка йода
Химические связи в этих молекулах могут быть и полярными (НСl, Н2O), и неполярными (N2, О2). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Металлические кристаллические решетки
Вещества с металлической связью имеют металлические кристаллические решетки.
Металлическая кристаллическая решетка
В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Кристаллические решетки. Строение вещества
Темы кодификатора ЕГЭ: Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
Молекулярно-кинетическая теория
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно изучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 о С она замерзает – переходит из жидкого состояния в твердое, и при 100 о С закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.
Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.
Пластичность – это способность вещества деформироваться без разрушения.
Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
Атомная кристаллическая решетка
Связь между частицами в атомных кристаллах: ковалентная полярная или неполярная.
В узлах кристалла с атомной кристаллической структурой расположены атомы.
Фазовое состояние атомных кристаллов при нормальных условиях: как правило, твердые вещества.
Физические свойства веществ с атомной кристаллической решеткой:
— прочность;
— тугоплавкость (высокая температура плавления);
— низкая электропроводность;
— низкая теплопроводность;
— химическая инертность (неактивные вещества);
— нерастворимость в растворителях.
Молекулярная кристаллическая решетка
Молекулярная кристаллическая решетка – это такая решетка, в узлах которой располагаются молекулы. Удерживают молекулы в кристалле слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса, водородные связи, или электростатическое притяжение). Соответственно, такую кристаллическую решетку, как правило, довольно легко разрушить. Вещества с молекулярной кристаллической решеткой – легкоплавкие, непрочные. Чем больше сила притяжения между молекулами, тем выше температура плавления вещества. Как правило, температуры плавления веществ с молекулярной кристаллической решеткой не выше 200-300К. Поэтому при нормальных условиях большинство веществ с молекулярной кристаллической решеткой существует в виде газов или жидкостей. Молекулярную кристаллическую решетку, как правило, образуют в твердом виде кислоты, оксиды неметаллов, прочие бинарные соединения неметаллов, простые вещества, образующие устойчивые молекулы (кислород О2, азот N2, вода H2O и др.), органические вещества. Как правило, это вещества с ковалентной полярной (реже неполярной) связью. Т.к. электроны задействованы в химических связях, вещества с молекулярной кристаллической решеткой – диэлектрики, плохо проводят тепло.
Связь между частицами в молекулярных кристаллах: межмолекулярные водородные связи, электростатические или межмолекулярные силы притяжения.
В узлах кристалла с молекулярной кристаллической структурой расположены молекулы.
Фазовое состояние молекулярных кристаллов при нормальных условиях: газы, жидкости и твердые вещества.
Физические свойства веществ с молекулярной кристаллической решеткой:
— легкоплавкость (низкая температура плавления):
— высокая сжимаемость;
— молекулярные кристаллы в твердом виде, а также в растворах и расплавах не проводят ток;
— фазовое состояние при нормальных условиях – газы, жидкости, твердые вещества;
— высокая летучесть;
— малая твердость.
Ионная кристаллическая решетка
Связь между частицами в ионных кристаллах: ионная химическая связь.
В узлах кристалла с ионной решеткой расположены ионы.
Фазовое состояние ионных кристаллов при нормальных условиях: как правило, твердые вещества.
Химические вещества с ионной кристаллической решеткой:
Физические свойства веществ с ионной кристаллической структурой:
— высокая температура плавления (тугоплавкость);
— растворы и расплавы ионных кристаллов – проводники тока;
— большинство соединений растворимы в полярных растворителях (вода);
— твердое фазовое состояние у большинства соединений при нормальных условиях.
Металлическая кристаллическая решетка
Связь между частицами : металлическая химическая связь.
В узлах кристалла с металлической решеткой расположены ионы металлов и атомы.
Фазовое состояние металлов при обычных условиях: как правило, твердые вещества (исключение — ртуть, жидкость при обычных условиях).
Химические вещества с металлической кристаллической решеткой — простые вещества-металлы.
Физические свойства веществ с металлической кристаллической решеткой:
— высокая тепло- и электропроводность;
— ковкость и пластичность;
— металлический блеск;
— металлы, как правило, нерастворимы в растворителях;
— большинство металлов – твердые вещества при нормальных условиях.
Сравнение свойств веществ с различными кристаллическими решетками
Тип кристаллической решетки (или отсутствие кристаллической решетки) позволяет оценить основные физические свойства вещества. Для примерного сравнения типичных физических свойств соединений с разными кристаллическими решетками очень удобно использовать химические вещества с характерными свойствами. Для молекулярной решетки это, например, углекислый газ, для атомной кристаллической решетки — алмаз, для металлической — медь, и для ионной кристаллической решетки — поваренная соль, хлорид натрия NaCl.
Сводная таблица по структурам простых веществ, образованных химическими элементами из главных подгрупп таблицы Менделеева (элементы побочных подгрупп являются металлами, следовательно, имеют металлическую кристаллическую решетку).
Итоговая таблица связи свойств веществ со строением: