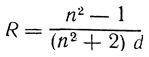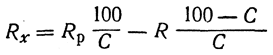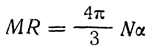Молярная рефракция что характеризует
Молекулярная рефракция



Рефракция света – изменение направления световых лучей в среде с переменным показателем преломления. Преломление света является частным случаем резкого изменения направления лучей на границе раздела двух сред с разными показателями преломления.
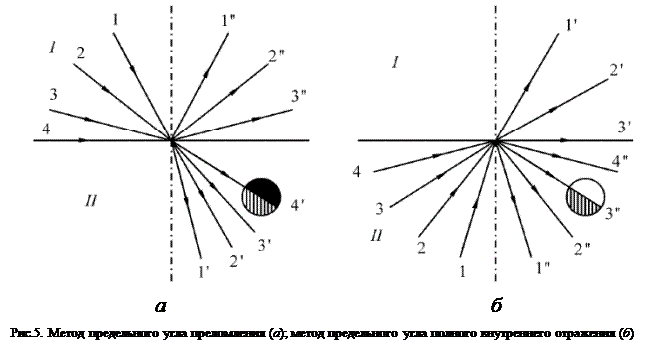
Причиной этих явлений с точки зрения классической физики является взаимодействие электрического поля световой волны с элементарными зарядами. Действующее на атом электрическое поле волны смещает внешний электрон из положения равновесия, и атом приобретает индуцированный дипольный момент
p=αE,
где α – поляризуемость атома (или молекулы), E – напряженность электрического поля падающей волны. Дипольный момент атома колеблется с частотой падающего света, и атом становится источником вторичных когерентных волн. Колебания электрона запаздывают по фазе относительно колебаний исходной световой волны, поэтому вторичные волны также излучаются с запаздыванием. Поле вторичных волн складывается с полем исходной световой волны, что и служит причиной замедления результирующей электромагнитной волны.
Классическая электронная теория позволяет связать показатель преломления вещества с микроскопическими характеристиками среды – плотностью и электронной поляризуемостью, зависящей от природы атомов или молекул и частоты света.
Через микроскопические характеристики выражают обычно не сам показатель преломления, а связанную с ним молекулярную рефракцию:
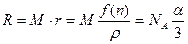
где R – молекулярная рефракция [см 3 /моль],
M – молекулярная масса [г/моль],
ρ – плотность [г/см 3 ],
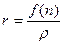
Молекулярная рефракция – это физическая величина, характеризующая поляризуемость молекулы, а точнее – 1/3 моля вещества. Ее измерение основано на измерении показателя преломления и плотности вещества.
Разные модели строения вещества приводят к несколько различным выражениям для функции f(n); чаще всего применяется формула Лоренц-Лорентца, согласно которой 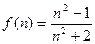
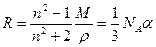
то есть является характеристикой химического соединения.
Значения R в видимой области спектра характеризуют поляризуемость электронных оболочек молекул вещества. Если при растворении не изменяется поляризуемость компонентов, то рефракция растворов слагается из Ri рефракции компонентов:
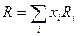
где xi – концентрация i-го компонента в мольных долях.
Правило аддитивности молекулярных рефракций растворов позволяет вычислить R растворенных твердых веществ. Более того, аддитивность молекулярной рефракции приблизительно соблюдается и для чистых соединений. Для ионных соединений она равна сумме ионных рефракций (см. табл.1 в Приложении).
Пример 1. Хлорид калия
Расчетная Rтеор(KCl) = R(K + ) + R(CI – ) = 2,2 + 8,7 = 10,90;
Молярная масса M(KCl) = 74,56 г/моль;
Плотность ρ(KCl)=1,985 г/см 3 ;
Показатель преломления для желтой линии D натрия при температуре 20 градусов по Цельсию nD 20 (KCl) = 1,490; тогда рассчитанная из эксперимента
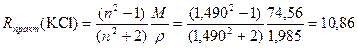
Получаем погрешность ΔR = 0,04 и относительную погрешность 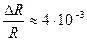
Молекулярная рефракция соединений с валентными связями может быть представлена в виде суммы атомных рефракций (см. табл.2 в Приложении).
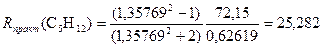
Получаем погрешность ΔR = 0,008 и относительную погрешность 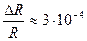
Фигурирующие в подобных расчетах атомные рефракции частично включают эффекты взаимного влияния атомов и не равны атомным рефракциям соответствующих простых веществ. Влияние структуры молекулы на молекулярную рефракцию учитывается путем введения различных значений атомных рефракций для одного и того же элемента в различных группировках (например, различные атомные рефракции для кислорода в эфирах, спиртах и карбоксильных соединениях (см. табл.2 в Приложении)) или путем применения групповых рефракций (например, групповые рефракции групп NO, N02, CN и т.д.), а также путем использования специальных инкрементов (т.е. приращений) для кратных связей (двойная связь С=С, тройная связь С≡С).
Вместо атомных и групповых рефракций часто применяются рефракции связей, причем молекулярная рефракция разлагается на слагаемые по числу и типам связей, которым условно приписывается и поляризуемость электронов, не участвующих в образовании связей (см. табл.3 в Приложении).
Пример 3.1-Бромпропан СН3–СН2–СН2–Br
Rтеор(C3H7Br) = 7R(C–H) + 2R(C–C) + R(C–Br) = 7∙1,70 + 2∙1,21 + 9,47 = 23,79;
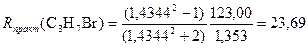
Получаем погрешность ΔR = 0,10 и относительную погрешность 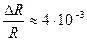
Пример 4.2-Бромпропан СН3–СНBr–СН3
Rтеор(C3H7Br) = 23,79 (т.к. число и качество связей такое же как и в 1-бромпропане);
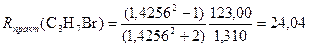
Получаем погрешность ΔR = 0,3 и относительную погрешность 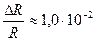
Нельзя сказать, что в какой-то схеме (по атомам или по связям) аддитивность выполняется лучше. Обе они приблизительно равнозначны в пределах границ применимости аддитивной схемы для молекулярной рефракции.
Пример 5.Бромоформ СНBr3
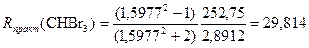
По атомам Rтеор(CHBr3) = R(C) + R(H) + 3R(Br) = 2,418 + 1,100 + 3 ∙ 8,865 = 30,113 (см. табл.2 в Приложении);
По связям Rтеор(CHBr3) = R(C–H) + 3R(C–Br) =1,70 + 3 ∙ 9,47 = 30,11(см. табл.3 в Приложении);
ΔR ≈ 0,3 и 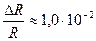
Иногда суммирование молекулярной рефракции по связям дает несколько лучшие результаты, чем суммирование по атомам.
Пример 6.Этиловый спирт СН3–CH2–OH
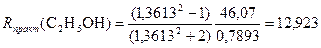
Rтеор(C2H5OH) = 2R(C) + 6R(H) + R(O в спиртовой группе) = 12,961 (см. табл.2 в Приложении);
Rтеор(C2H5OH) = 5R(C–H) + R(C–С) + R(C–O) + R(O–H) = 13,05 (см. табл.3 в Приложении);
Сопоставление экспериментального значения молекулярной рефракции с вычисленным по аддитивным схемам – один из простейших физических методов определения строения химических соединений. Этим методом может быть получено подтверждение брутто-формулы вещества и наличия определенных функциональных групп, (например, может быть получена информация о числе колец в молекуле, числе, природе и расположении кратных связей и т.д.). В некоторых случаях возможны также заключения о цис- или транс-конфигурации молекулы.
Молярная рефракция и установление строения молекул
Электронную поляризацию называют еще молярной (или мольной) рефракцией и обозначают буквой R.
Итак, при достаточно высоких частотах для неполярных веществ молярную рефракцию можно определить по формуле:

Изменение скорости света при переходе из одной среды в другую связано с взаимодействием света с электронами молекул. Следовательно, показатель преломления n связан с электронной поляризацией R.
На основании электромагнитной теории света Максвелл доказал, что для прозрачных неполярных веществ существует соотношение:
e = 
где n¥ – показатель преломления вещества при бесконечной длине волны, l ® ¥.
Подставим соотношение Максвелла в формулу (4.21). Получим следующее уравнение
R = 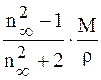
Поскольку R = Пэл = 
то 
Соотношение (4.24) называется формулой Лорентц – Лоренца. Оно связывает показатель преломления вещества n с электронной поляризуемостью a составляющих его частиц. Формула (4.24) получена в 1880 г. голландским физиком Х.А. Лоренцем и независимо от него датским физиком Л. Лоренцем. Формулу (4.23) удобно использовать для чистых веществ.
Показатель преломления n зависит от длины волны по формуле Коши:
где а – некоторая эмпирическая константа.
Следовательно, и рефракция является функцией длины волны, т.е. R = f (l).
Обычно, для определения рефракции достаточно пользоваться показателем преломления, соответствующим видимой области спектра. За стандарт была выбрана желтая линия в спектре натрия (для более точного определения показателя преломления используют натриевую лампу в качестве источника света). Длина волны, которой соответствует желтая линия Na, lD = 5893 A 0 = 589,3 нм. Показатель преломления соответственно nD.
Для неполярных веществ n слабо зависит от частоты (или длины волны).
Например, для бензола 
Для полярных веществ соотношение Максвелла не выполняется. Так, для воды 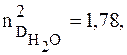

а R = 
т.е. молярная рефракция R равна объему всех молекул, содержащихся в одном моль вещества, и характеризует поляризуемость всех электронов, содержащихся в 1 моль вещества. В этом заключается физический смысл рефракции.
Размерность [R] = м 3 (в системе СИ), [R] =см 3 (в системе СГС).
Молярная рефракция R обладает целым рядом свойств, благодаря которым она получила широкое применение при решении вопросов, касающихся структуры вещества.
Рассмотрим свойства рефракции.
1. Рефракция практически не зависит от агрегатного состояния, от температуры, давления. Поэтому её можно рассматривать как некоторую константу, характерную для данного вещества.
2. Молярная рефракция является величиной аддитивной. Свойство это проявляется в том, что рефракция молекулы будет складываться из рефракций ионов, атомов, атомных групп, отдельных связей.
Таким образом, молярную рефракцию вещества можно рассчитать по формуле:
R = 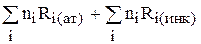
Ri(инк) – рефракция инкрементов, т.е. дополнительные слагаемые для двойной, тройной связей, циклов и т.д.;
ni – число атомов, связей, циклов.
Последний способ физически более обоснован, т.к. поляризуемое электронное облако принадлежит связи, а не отдельным атомам. Однако, оба метода обычно приводят практически к одинаковым результатам.
Значения рефракций отдельных атомов и связей были получены путем сопоставления опытных значений мольных рефракций, опреде-ленных по показателям преломления для разных молекул, содержащих данные атомы и связи.
3. Рефракция является величиной конститутивной, т.е. по величине R можно судить о структуре молекул.
Применение рефракции.С помощью значений рефракции можно решать многие задачи:
1. Вычисление электронной поляризуемости aэл и эффективного радиуса частицы (атома, молекулы). Используя формулу Лорентц – Лоренца (4.24) и соотношение aэл » r 3 можно записать:



Однако, значение для r, рассчитанное по формуле (4.28) верно лишь в первом приближении.
2. Рефракцию можно использовать для приблизительной оценки значения дипольного момента полярных молекул.
3. Уравнение R1,2 = х1R1 + х2R2 можно использовать для определения состава смеси и рефракции компонентов. По величине рефракции с очень большой степенью точности можно определить концентрацию растворов
х2 = 
4. Конститутивность рефракции применяют как простой способ проверки правильности предполагаемого строения молекул.
При определении структурной формулы вещества поступают следующим образом:
а) определяют 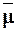
б) по формуле Лорентц – Лоренца считают R – опытное значение;
в) написав несколько структурных формул, отвечающих эмпирической формуле вещества, подсчитывают для каждой структуры значение рефракции, используя для этого табличные данные по Rат и Rсв;
г) сравнивают опытное значение рефракции Rоп и рассчитанное Rрасч. Правильной структурной формулой будет та, у которой Rоп ближе всего к Rрасч.
Молекулярная рефракция
Наиболее разработанными и наиболее важными для исследования органических веществ являются закономерности в изменениях показателя преломления в зависимости от состава и строения вещества. Показатель преломления является одной из констант, хорошо характеризующих чистоту и индивидуальность жидких органических веществ.
Весьма важным является то обстоятельство, что формула удельного лучепреломления, формула Лорентца—Лоренца
(где п — наблюденный показатель преломления, a d — плотность вещества при той же температуре), дает выражение удельной рефракции R, независимой от температуры, давления и агрегатного состояния вещества. Удельная рефракция является мерой действительного объема молекулы. Произведение R×M называется молекулярной рефракцией.
Исследования Ландольта, Брюля и Канноникова показали, что молекулярная рефракция органических веществ, так же как и молекулярный объем, может быть выражена суммой величин атомных рефракций, изменяющихся на определенную величину в зависимости от характера связей атомов Так, например, атомная рефракция углерода (для желтой линии D натрия), равная 2,418, при условии, что атом углерода связан с другими атомами лишь простыми связями, увеличивается на определенную величину, если этот атом связан с другим углеродным атомом кратной связью. При наличии в молекуле кратных связей к молекулярной рефракции, вычисленной из атомных рефракций, добавляют соответствующий инкремент на каждую кратную связь. Для ацетиленовой связи этот инкремент больше, чем для этиленовой.
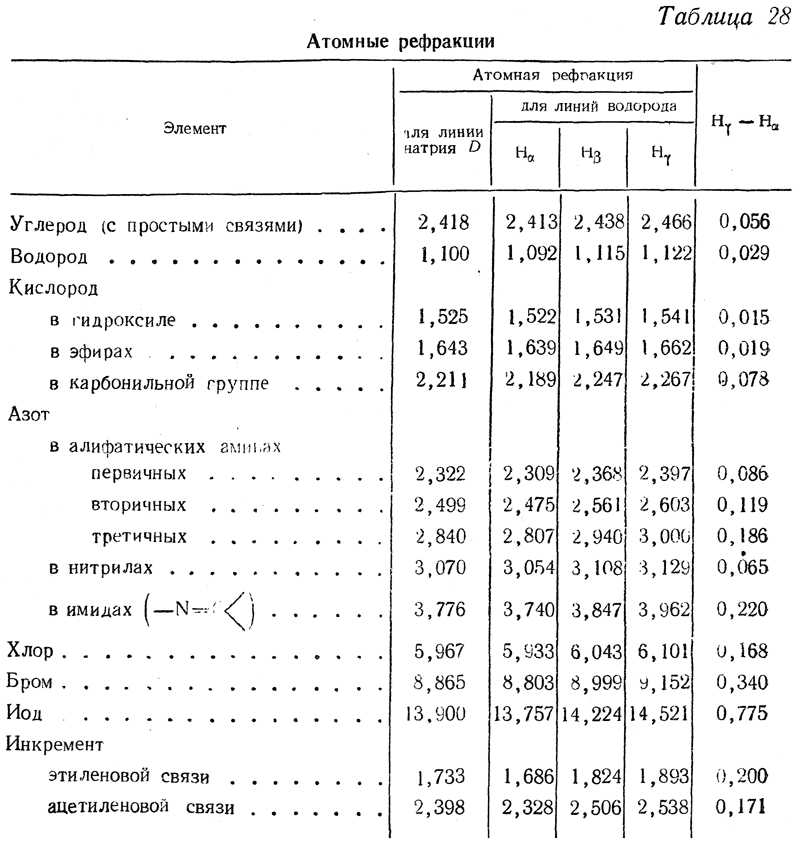
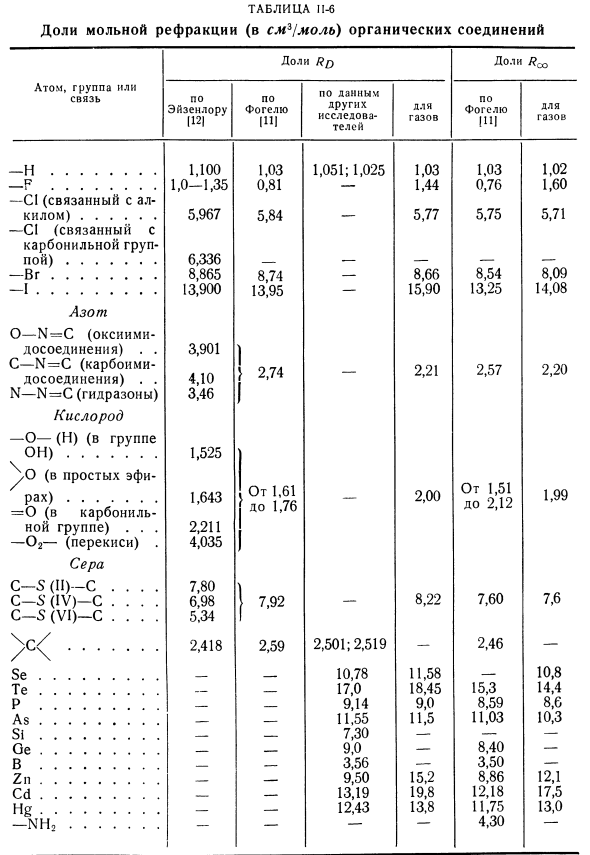
Чаще всего рефракция определяется для желтой линии D натрия; очень часто она определяется также для линий водорода Нα, Hβ и Нγ. В настоящее время имеется несколько систем величин атомных рефракций, созданных разными исследователями на основании экспериментальных данных. Наиболее распространена система Рота и Эйзенлора (табл. 28).
Величины атомных и групповых рефракций для линии D натрия по определениям других авторов приведены ниже:
Величина Нγ—Нα (см. табл. 28), называемая молекулярным светорассеянием или молекулярной дисперсией света, также является характерной величиной для определения состава и строения органических веществ.
Многие значения атомных рефракций остаются постоянными в органических соединениях разных классов. Поэтому сравнение найденной молекулярной рефракции соединения, состав и молекулярный вес которого известны, с молекулярной рефракцией, вычисленной из атомных рефракций, часто дает представление о строении соединения, а иногда позволяет решить, каким из известных изомеров принадлежат те или иные возможные формулы. Для этого достаточно измерить показатель преломления и плотность вещества. Часто величина молекулярной рефракции позволяет судить о чистоте соединения с известным строением.
Как показывает опыт, инкременты кратных связей не всегда сохраняют постоянные значения. Сравнительно небольшие изменения строения (перемещения двойных связей друг относительно друга) могут вызывать изменения этих инкрементов, называемые экзальтацией. Так, например, экзальтацию молекулярной рефракции вызывает присутствие в молекуле сопряженных кратных связей.
Таким образом, по наличию или отсутствию экзальтации можно судить о взаимном расположении кратных связей в молекуле.
Удельную и молекулярную рефракцию твердых веществ можно определять в растворах.
Для определения удельной рефракции пользуются соотношением
где Rx — искомая удельная рефракция растворенного вещества;
Умножив найденную удельную рефракцию твердого вещества на его молекулярный вес, находят молекулярную рефракцию.
Молекулярная рефракция является непосредственной мерой поляризуемости молекулы, т. е. подвижности зарядов под влиянием внешнего электрического поля (возбуждение светом, электрическим полем другой молекулы и т. д.).
Зависимость между поляризуемостью и молекулярной рефракцией выражается уравнением
Знание поляризуемости имеет самое существенное значение не только для характеристики строения молекулы, но и для понимания течения химических реакций.
Мольная рефракция




Мольная рефракция
Мольная рефракция. Отношение скорости распространения света в пустоте (w0)и скорости распространения в веществе (a») называется показателем преломления света, который можно определить как отношение синусоиды угла падения света к синусоиде преломления. Молярная рефракция определяется по формулам Лоренца и Лоренца*: Н Л2-1 м Л2 + 2 ′ п Где M-молекулярная масса. Р-плотность вещества. Чтобы быстро вычислить молярное значение преломления/, если вы знаете показатель преломления n, плотность p и молекулярную массу M света, вы можете использовать номограмму (рисунок I-1). Пример 11-5. Оптический показатель преломления(L) изопропилового спирта при 20°C составляет 1,377 (Р = 0,789 г <см *; м-60,1).
Для молекул, в которых атомы соединены ионными связями, отношение ионов суммируется. Людмила Фирмаль
Так что электронная поляризуемость может быть вычислена аддитивно путем суммирования составных частей (см. таблицу 1-15), молярная рефракция имеет согласный характер и может быть вычислена аналогично. Если связь ковалентна, то доля связи суммируется с атомом. Если связывание в молекуле частично ионное, частично ковалентное, то расчет усложняется[9]. Прежде всего, имеет практическое значение определение величины молярного преломления органического соединения с валентными связями. Другой автор предлагает различные значения коэффициента композиции для расчета сложения значений молярной рефракции (#o-преломление длины волны, соответствующей i-й спектральной линии натрия; это преломление, рассчитанное для бесконечно длинной световой волны).
Однако на практике наблюдаются некоторые отклонения в изомерах. Пример 11-6.Молярная рефракция гептана в случае строгого подчинения принципу аддитивности/?O (ST | c) должен быть одинаковым для всех изомеров. Проверьте это положение. Решение. Молярная рефракция по гептану рассчитывается суммированием фракций по Эйзенлору: 7 фракций углерода. 。 7♦2.418 = 16.926 16 водородных фракций. 。 16 * 1100 = 17 600 = 34.526 Экспериментальная рефракция морфептанов: Гептан 34.51 2.2-диметилпентан 34.61 2.3-диметилпентан 34.31 2, 4-диметилпентан 34.61 3.3-диметилпентан 34.32 2-Метилгексан 34.57 3-метилгексан 34.45 2.2.3-триметилбутан 34.39 В Примере I-6 отклонение различных изомеров невелико, но в других изомерах оно может быть значительно больше.
Как вы можете видеть, разница между экспериментальными значениями и расчетными значениями является значительной. Людмила Фирмаль
Смотрите также:
Возможно эти страницы вам будут полезны:
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института