Мониторинг в гинекологии что это
Обследования женщины
Диагностика гормональной функции яичников.Анализ на бесплодие.
Наиболее информативными методами контроля гормональной функции яичников являются ультразвуковой и гормональный мониторинг, а также измерение базальной температуры.
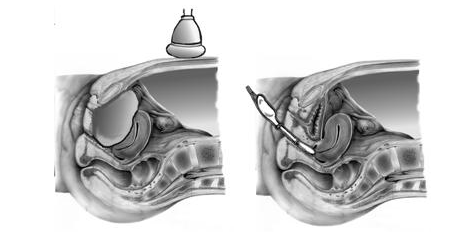
Ультразвуковой мониторинг — это наблюдение с помощью ультразвукового исследования (УЗИ) за изменениями, происходящими в яичниках и матке в течение менструального цикла. Ценность этого метода исследования состоит в том, что наряду с большой информативностью он совершенно безвреден и не вызывает неприятных ощущений.
В гинекологии практикуются два способа ультразвуковых исследований: через переднюю брюшную стенку (так называемый абдоминальный ультразвук) и через влагалище (вагинальный ультразвук).
Если первый способ требует наполненного мочевого пузыря, то второй вообще проводится без какой-либо предварительной подготовки.
Ультразвуковой мониторинг позволяет наблюдать за ростом фолликула в яичнике, овуляцией и развитием желтого тела. Перед овуляцией диаметр фолликула достигает 19-24 мм. После овуляции его размеры уменьшаются. Через 2-3 дня на месте лопнувшего фолликула образуется желтое тело. Все эти изменения хорошо видны на экране компьютера, подключенного к аппарату УЗИ.
Кроме наблюдения за изменениями в яичниках, УЗ-мониторинг дает возможность оценить циклические изменения в эндометрии. Толщина эндометрия в течение менструального цикла колеблется от 3 мм сразу после месячных до 12-15 мм перед началом нового цикла (перед менструацией). Кроме толщины эндометрия в течение менструального цикла меняется и структура эндометрия. Эти параметры также можно оценить с помощью УЗИ.
Гормональные исследования позволяют определить концентрацию различных гормонов в крови и оценить, таким образом, функцию не только яичников, но и других эндокринных желез (гипофиза, щитовидной железы, надпочечников), влияющих на репродуктивную способность как женского, так и мужского организма.
У мужчин кровь на гормоны можно брать в любой день. В связи с цикличностью процессов в организме женщины анализ крови на гормоны у них должен быть сделан в определенные дни менструального цикла. Чаще всего определяют так называемый базальный уровень ФСГ, ЛГ и эстрадиола (Е2). С этой цель забор крови на исследование проводиться в период со 2 по 5-й день менструального цикла. Для оценки полноценности II фазы менструального цикла кровь на Е2 и прогестерон берут на 20-23-й дни менструального цикла. Иногда для уточнения характера гормональных нарушений требуется проведение дополнительных, специальных гормональных проб.
Обращаем Ваше внимание на то, что кровь на гормоны должна быть сдана натощак в состоянии эмоциональной стабильности; обязателен половой покой накануне сдачи анализа. За 2 недели до исследования необходимо прекратить прием антибиотиков, антикоагулянтов, сульфаниламидных и антигистаминных препаратов, салицилатов и гормонов, если они не были специально назначены врачом, проводящим исследование.
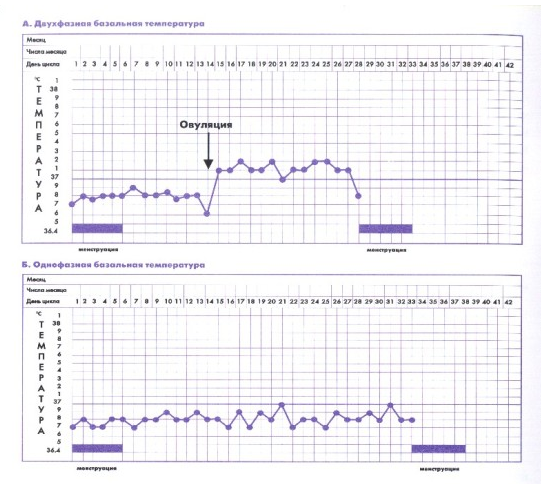
Базальная температура — это температура, измеряемая в прямой кишке при строгом соблюдении следующих условий измерения:
На основании полученных результатов строится график базальной температуры. Под влиянием гормона желтого тела (прогестерона) базальная температура в середине менструального цикла повышается на 0,4 градуса (до + 37° С и выше) и держится на этом уровне в течение 12-14 дней, снижаясь до + 36,6° С за 1-2 дня до месячных. Такая температурная кривая называется двухфазной и свидетельствует о нормальном овуляторном менструальном цикле. Если базальная температура в течение всего менструального цикла держится ниже + 37° С, ее называют однофазной (монофазной). Это, как правило, бывает при отсутствии овуляции.
В течение многих десятилетий измерение базальной температуры было, пожалуй, ведущим методом мониторинга гормональных процессов в женском организме. Однако, почти у 20 % женщин, несмотря на повышение базальной температуры во вторую фазу цикла, овуляция отсутствует, и наоборот — при монофазном графике базальной температуры овуляция, тем не менее, может происходить. Сегодня лабораторная техника позволяет получить точные количественные данные о концентрации гормонов в крови в течение нескольких часов. Существуют даже специальные диагностикумы, с помощью которых можно в домашних условиях, использую капельку мочи, определить пик ЛГ, а значит момент, наиболее благоприятный для наступления беременности. К сожалению, в нашей стране далеко не везде эти анализы можно сделать, да и стоят они дорого. Поэтому измерение базальной температуры продолжает использоваться очень широко, но относиться к результатам измерений необходимо критически.
В своей практике мы не раз встречались с женщинами, которые в течение нескольких лет ежедневно из месяца в месяц занимались измерением базальной температуры. В этом нет никакой необходимости и важной информации тоже нет.
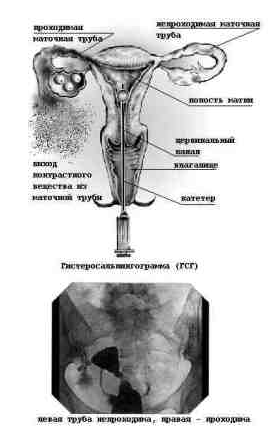
Исследование проходимости маточных труб и состояния полости матки гистеросальпингография
Наиболее распространенным методом исследования состояния полости матки и проходимости маточных труб является рентгеновская (от греч hystera — «матка» + salpinx — «маточная труба» + grapho — «рисовать, писать») — сокращенно ГСГ. Для того, чтобы получить рентгеновские снимки матки и маточных труб, их необходимо заполнить через цервикальный канал с помощью специального катетера рентгеноконтрастным раствором. Свободное поступление контрастного вещества в маточные трубы и истечение его в брюшную полость свидетельствуют о проходимости маточных труб. ГСГ позволяет также выявить полипы эндометрия, миому в полости матки и пороки развития матки.
В последние годы стало возможным проводить гистеросальпингографию под контролем УЗИ. Это исследование легче и безопаснее, чем рентгеновское, но менее точное.
Современным, самым информативным и точным, методом исследования цервикального канала, полости матки является гистероскопия. Для гистероскопии используются оптические системы, с помощью которых можно осмотреть и оценить состояние внутренних стенок шеечного канала и полости матки, а также провести прицельную биопсию эндометрия — то есть взять кусочек эндометрия для исследования под микроскопом. Это исследование называется гистологическим (греч. hystos — «ткань»).
Лапароскопия (греч. lapare — «живот» + skopeo — рассматривать, исследовать) — это операция, во время которой через микроразрезы на животе в брюшную полость вводятся специальные инструменты, оснащенные оптикой. Лапароскопия позволяет увидеть внутренние половые органы женщины и получить исчерпывающую информацию об их состоянии, в том числе оценить проходимость маточных труб, выявить заболевания, которые невозможно диагностировать с помощью ГСГ, например: эндометриоз. Кроме этого, важным преимуществом лапароскопии, является возможность проведения одномоментного хирургического лечения обнаруженной патологии: удаление кист яичника и миоматозных узлов, разъединение сращений и спаек, прижигание очагов эндометриоза и многое другое.
Перечисленные выше методы диагностики требуют специального предварительного обследования с целью исключения скрытых инфекций, течение которых может обостриться после этих процедур. Гистеросальпингография — амбулаторная процедура, в то время как гистероскопия и лапароскопия требуют непродолжительной госпитализации. Гистеросальпингография может проводиться без обезболивания, для гистеро и лапароскопии же нужен наркоз и требуется более тщательное предварительное обследование. Сроки проведения этих процедур зависят от поставленных задач.
Несмотря на то, что обследование проводится по поводу бесплодия, очень важно предохраняться от беременности в течение менструального цикла, во время которого планируется сделать это исследование.
Известны случаи, когда долгожданная беременность спонтанно наступала именно в том цикле, во время которого проводилось исследование и, если это был рентген, беременность приходилось прерывать. Важно помнить, что гистеросальпингография и гистеро-лапароскопия выполняются на голодный желудок (прием твердой пищи необходимо прекратить с 15 часов накануне), а кишечник должен быть очищен с помощью клизм.
Высокая частота трубного бесплодия и часто почти бессимптомное развитие заболевания требуют исследования проходимости маточных труб у всех бесплодных женщин.
Диагностика иммунологических факторов бесплодия
Наиболее простым методом диагностики иммунологических факторов бесплодия является так называемый посткоитальный тест (лат. post — после +coitus — половое сношение). При его выполнении под обычным микроскопом изучается слизь, взятая из канала шейки матки после полового акта. Наличие в шеечной слизи активно движущихся сперматозоидов свидетельствует об иммунологической совместимости. В случае несовместимости подвижных сперматозоидов нет вообще или есть единичные. Существуют и другие методы исследования, например: анализы крови или шеечной слизи на антиспермальные антитела. С их помощью можно не только определить наличие антител к сперме мужа, но и сделать количественную оценку их концентрации.
Что такое овуляция
У каждой женщины один раз в месяц происходит овуляция (от латинского ovulum – яйцо, ovulatio – вылупление) – В ходе овуляции созревшая яйцеклетка выходит из разорвавшегося фолликула в маточную трубу, в которой и происходит долгожданное (или неожиданное) оплодотворение. А теперь детали.
Зачем нужно определять овуляцию?
Как определить время, наиболее оптимальное для зачатия?
Яйцеклетка живет не более суток. Для оплодотворения ей необходимо время – 18-20 часов. Итого: если в течение 10 часов яйцеклетка не встретилась со сперматозоидами и не оплодотворилась, она погибает. Сперматозоиды живут в половых путях женщины до 5 суток (у молодых супружеских пар с идеальным здоровьем). Вывод: идеальное время для половой жизни во время и до овуляции, а не после.
Имеет ли смысл определять базальную (ректальную) температуру?
Исследование базальной температуры – самый дешевый и доступный метод исследования овуляции. Этим положительные свойства и ограничиваются: метод ненадежный, нестабильный и необъективный. Частота неправильной интерпретации (даже врачом) достигает 50%. Многовато для диагностического теста, на котором строится долгосрочная стратегия. Механизм изменения базальной температуры следующий: желтое тело после овуляции вырабатывает прогестерон, который влияет на какие-то скрытые от глаз механизмы в гипоталамусе, тот, в свою очередь, повышает общую температуру тела примерно на ½ градуса (0,4 минимум). Самое обидное: регистрируемое повышение температуры означает, что овуляция была как минимум вчера, а половой жизнью надо было жить 2 дня назад. Т.о. для планирования зачатия этот метод подходит хуже всех остальных.
Что касается качества желтого тела, то измерение прогестерона крови – объективно и надежно, по сравнению с измерением длины и амплитуды подъема температуры.
Имеет ли смысл исследовать овуляцию ультразвуковым исследованием (УЗИ?) В какие дни цикла это лучше делать?
Если у вас регулярный менструальный цикл (составляет в среднем 25-35 дней от первого дня одной менструации до первого дня следующей), то овуляция будет подтверждена в 9 случаях из 10. Экономически целесообразно обследоваться заочно (исследование крови на прогестерон, или мочевой тест на овуляцию). Если есть сомнения в своем гормональном здоровье, лучше начать ультразвуковой мониторинг сразу. Доминантный фолликул начинает расти на 7-й день цикла. Как правило, он достигает зрелости (диаметр 16-20 мм) на 14-15-й день. Раньше, принято было определять скорость роста фолликула, были соответствующие нормы скорости роста. На сегодня, в большинстве случаев это не требуется.
Зачем нужно обследовать кровь на прогестерон?
Прогестерон (лат. pro gestatio – для беременности)- гормон, необходимый для поддержания беременности. Прогестерон является основным гормоном, вырабатываем желтым телом яичника. Клетки, выстилающие фолликул быстро (за 1 сутки) перерождаются в клетки желтого тела. Желтое тело начинает вырабатывать гормон тотчас после овуляции, прогестерон достигает своего пика за 7 дней. Если женщина не беременеет, прогестерон снижается. Благодаря падению концентрации прогестерона приходит менструация. Исследование пика прогестерона в середине лютеиновой фазы (14 дней делим пополам, получаем через 7 дней после овуляции, или 7 дней до ментруации) говорит нам о нормально работающем желтом теле. Нормальное желтое тело означает нормальную овуляцию. Нормальная овуляция 2 менструальных цикла подряд говорит о нормальном функционировании всей эндокринной системы женщины, и является основанием для отказа от дальнейшего исследования гормонов.
Какой метод исследования овуляции самый надежный?
Единственным на 100% надежным доказательством произошедшей овуляции является наступившая клиническая беременность. Все остальное – наши (медиков) косвенные представления о ней. Вот примерный рейтинг методов диагностики овуляции с субъективными представлениями наших врачей об их надежности:
| Клиническая беременность | 100% |
| Наблюдение овуляции во время операции | 98% |
| Ультразвуковое подтверждение | 95% |
| Исследование крови на прогестерон в середине лютеиновой фазы | 95-98% |
| Исследование мочевого теста ЛГ | 75% |
| Исследование базальной температуры | 50-60% |
| Исследование тестов т.н. функциональной диагностики | 30-60% |
Какой метод исследований овуляции самый удобный?
Сразу напрашивается еще один вопрос- удобный для врача или для пациента? Это зависит от удаленности пациента от клиники. Если есть возможность исследовать кровь на прогестерон в хорошей лаборатории, сделайте это. Если лаборатории рядом нет, лучший метод исследования – мочевой тест ЛГ. Если есть сомнения в своем гормональном здоровье (нерегулярный цикл), лучший вариант – это ультразвуковой мониторинг овуляции.
Как часто бывает овуляция в норме?
Каждый месяц. 1-2 цикла в году яичники могут себе позволить «отдохнуть». Как правило, во время стресса (жара, холод, экзамены, переезд) природа включает охранный режим. Пика гормонов не происходит, овуляция отменяется. 9-10 циклов в году у женщины «овуляторные». Ближе к 40 годам и, особенно старше, овуляция встречается несколько реже.
Когда надо задуматься о проблемах с овуляцией?
Если Вы наблюдали овуляцию 2 цикла подряд, проблем с гормональным здоровьем у вас нет. Если 1 цикл овуляция была, другой нет, наблюдаем ее 3-й цикл, если она есть – все нормально. Нерегулярный менструальный цикл (цикл менее 25 или более 35) ассоциируется с патологией овуляции.
Когда надо стимулировать овуляцию?
В тех случаях, когда ее нет (ановуляция) или она редка (олигоовуляция). Перед стимуляцией врач должен выяснить ее причины. Различные эндокринные расстройства могут «догнать» вас во время беременности, вызвав выкидыш. Опухоли эндокринных органов здоровья тоже не добавляют. Диагностика эндокринных проблем будет рассматриваться в отдельных разделах.
Что такое недостаточность желтого тела?
Это недостаток выработки гормонов желтого тела. Диагностика этого состояния традиционно основывалась на измерении базальной температуры. Сегодня исследование крови на прогестерон является более достоверным методом диагностики. УЗИ так же может дать дополнительную информацию. Зачастую недостаточность желтого тела не является самостоятельным заболеванием. Она, как правило, является признаком «некачественной» овуляции.
Заключение.
Диагностика овуляции и проблем овуляции не является сложной задачей для опытного врача. Данный материал поможет вам говорить на одном языке с вашим доктором и сделать ваше общение более продуктивным и прийти с минимальными потерями к желанному результату – рождению желанного малыша. Мы всегда рады помочь!
Анализы на ЗППП — виды, особенности проведения, правила подготовки
ЗППП анализы — это отдельный вид лабораторных исследований, направленных на обнаружение инфекционных заболеваний, передающихся половым путем (ЗППП), в ходе проведения клинической диагностики.
К списку таких заболеваний традиционно относятся: ВИЧ (вирус иммунодефицита человека), генитальный герпес, гонорея, микоплазмоз, папилломавирусная инфекция, сифилис, трихомониаз, уреаплазмоз, хламидиоз, цитомегаловирус.
Показания
Необходимость проведения анализов на ЗППП возникает при наличии обоснованных подозрений заражения (половой контакт с носителем ЗППП), а также возникновении симптомов, которые могут свидетельствовать об инфицировании:
сыпь, зуд или покраснение кожи в генитальной области;
боль и жжение во время мочеиспускания;
примеси крови в моче;
генитальные выделения жёлтого или белого цвета с резким неприятным запахом;
болевой синдром в области половых органов или брюшной полости;
бесплодие или половые дисфункции (как часть комплексной диагностики).
Виды анализов ЗППП
Существует 4 основных анализа на ЗППП: мазок, бакпосев, ИФА, ПЦР. Выбор конкретного типа исследования делает врач, исходя из жалоб пациента и общей клинической картины.
Мазок
Исследуемый материал — верхний слой слизистой оболочки мочеиспускательного канала у мужчин или влагалища и цервикального канала у женщин. Отобранные образцы изучаются под микроскопом, а результат может быть получен в течение 30-60 минут.
Исследование позволяет выявить таких возбудителей ЗППП, как гарднереллы, гонококки, трихомонады, уреаплазмы, хламидии, а также ряд грибковых инфекций.
Недостатки: малоинформативно на начальных стадиях ЗППП.
Бакпосев
Исследуемый материал — кровь, моча, кал, слюна, генитальные выделения. Отобранные образцы помещаются в специальную питательную среду, способствующую активному размножению предполагаемого возбудителя для последующего его изучения. Результат может быть получен через 3-10 дней, в зависимости от особенностей анализа.
Исследование помогает не только установить наличие в организме конкретного возбудителя, но и определить его чувствительность к определённым группам антибиотиков. Бакпосев эффективен для обнаружения гарднерелл, гонококков, кандидоза, микоплазмоза, уреаплазмоза, трихомонад.
Недостатки: применим только к инфекциям, которые можно вырастить в питательных средах.
ИФА (иммуноферментный анализ)
Исследуемый материал — кровь, моча, урогенитальные соскобы. Суть анализа — обнаружение в образцах специальных защитных веществ-антител, которые всегда выделяются организмом в ответ на присутствие патогенного возбудителя. Результат может быть получен в течение суток.
Применяется для обнаружения практически любых возбудителей ЗППП, однако в силу высокой специфичности исследования требует постановки предварительного диагноза, то есть уточнения патогена, который должен выявить анализ.
Недостатки: исследования не всегда информативны на ранних стадиях ЗППП, поскольку на некоторые инфекции организм вырабатывает антитела не сразу.
ПЦР (полимеразная цепная реакция)
Исследуемый материал — кровь, моча, урогенитальные соскобы или выделения. Суть метода — выявление фрагментов нуклеиновой кислоты (ДНК) в исследуемом образце. Результат может быть получен через 3-4 часа.
Позволяет с абсолютной точностью обнаружить присутствие в организме любого возбудителя ЗППП, вне зависимости от стадии заболевания.
Недостатки: провести такой анализ можно не в каждой лаборатории.
Как подготовиться к сдаче анализов
Правила подготовки к сдаче анализов на ЗППП зависят от вида предстоящего исследования.
Общие рекомендации. Кровь и моча всегда сдаются утром натощак или минимум через 8 часов после употребления пищи. Приём лекарственных препаратов в период проведения анализов ЗППП — только по согласованию с врачом.
Мазок, посев. За 1-2 дня до сдачи образцов отказаться от половых контактов и гигиенических процедур с применением мыла или средств интимной гигиены (включая спринцевание у женщин).
ИФА. За 24 часа до сдачи материала отказаться от спиртного, а также обильного употребления жирной пищи. За час до сдачи образцов — воздержаться от курения.
ПЦР. При сдаче урогенитальных жидкостей (сперма, секрет предстательной железы и пр.) рекомендуется половое воздержание в течение 2-3 суток. Образцы слюны сдаются утром натощак, до выполнения любых гигиенических процедур по санации полости рта.
Интерпретация результатов
Правильно интерпретировать результаты анализов может только лечащий врач, с учётом истории болезни пациента, а также наличия у него других заболеваний. Самостоятельное трактование исследований на ЗППП по «советам из интернета» чревато неточностями и неверным пониманием фактического состояния больного.
Контролируемая индукция овуляции (КИО), контролируемая стимуляция яичников (КСЯ)
Контролируемая индукция овуляции (КИО), контролируемая стимуляция яичников (КСЯ)
Современные подходы к диагностике и лечению бесплодия основаны на знании фундаментальных основ физиологии репродуктивной системы женщины, предполагающие снижение репродуктивного потенциала и способности к зачатию с увеличением возраста. Известно, что уже с 27 лет начинается потеря ооцитов, пик которой приходится на 35-37 лет. В связи с этим, лечение бесплодия необходимо осуществлять с помощью современных методов, которые доказали свою эффективность в быстром и успешном достижении беременности.
Согласно рекомендациям ведущих профессиональных ассоциаций и международных организаций (ВОЗ, ESHRE, ASRM, УАРМ), при бесплодии следует немедленно приступать к обследованию и лечению пациентов в следующих случаях:
После постановки диагноза бесплодия период обследования, консервативного и оперативного лечения без использования методик вспомогательных репродуктивных технологий не должен превышать двух лет у пациенток до 35 лет и 1 года у пациенток после 35 лет.
Независимо от причины и степени повреждения репродуктивной системы, формирование бесплодия обусловлено наличием основной или сочетанием основных причин. К этим причинам можно отнести состояния, когда (см. Рис.1):
Рис.1 Причины, приводящие к бесплодию.
Определяют 2 типа бесплодия:
При обследовании бесплодной супружеской пары есть четкая цель:
К началу консервативного лечения бесплодия необходимо исключить тяжелую степень мужского фактора бесплодия и трубный фактор бесплодия, наличие которых требует применения методик вспомогательных репродуктивных технологий.
Эти методические рекомендации содержат новую информацию о применении традиционных индукторов овуляции, как кломифена цитрат, но главным образом направлены на обучение применения современных эффективных прямых индукторов овуляции на примере препарата рекомбинантного ФСГ Пурегон®.
Основные этапы фоликуло- и овогенеза. Селекция и развитие доминантного фолликула. Контролируемая стимуляция яичников (КСЯ).
Из заложенных в яичниках яйцеклеток половой зрелости остается около 1 млн., в течение жизни женщины овулируют около 400 фолликулов, другие подвергаются атрезии на разных стадиях своего развития.
Гормонально независимый этап развития фолликула начинается с перехода с примордиального в первичный фолликул и длится 120 суток. Развитие фолликулов на этом этапе обусловлен внутренне яичниковых факторами.
Количество фолликулов, которые «проснулись», а также доля фолликулов, подвергающихся атрезии, не зависит от индукторов овуляции и уровня гонадотропинов в крови. Ооциты из пула, которые начали расти, из них 30-70 фолликулов обречено или на атрезию, или на овуляцию. Механизмы атрезии и апоптоза обеспечивают выживание потенциально наиболее здоровых фолликулов и, возможно, селекцию наиболее генетически здоровых яйцеклеток.
После достижения частью селективных фолликулов фазы антральных, начинается гормонально зависимая фаза. Происходит селекция и рост доминантного фолликула, которая зависит от концентрации ФСГ и других гонадотропинов.
Таким образом, расход запаса фолликулов и ооцитов происходит по законам внутренне яичниковой регуляции и не зависит от применения индукторов овуляции. Индукторы овуляции влияют на уже зреющие фолликулы, дошедшие до стадии антральных, не затрагивая примордиальные. Индукторы овуляции не способствуют истощению фолликулярного резерва, снижению фертильности, приближению возраста менопаузы. Этапы фолликулогенеза и выбор доминантного фолликула можно представить в виде ряда последовательных фаз. В целом ряде аспектов фолликулогенеза тонкие механизмы этих процессов еще не изучены полностью и поэтому допустимы разные взгляды исследователей. Считается, что в естественном цикле уровень ФСГ начинает повышаться с середины лютеиновой фазы предыдущего менструального цикла. Затем, в естественном цикле, возможно, под действием ингибина В, выделяется лидирующий фолликул, происходит снижение концентрации ФСГ и оставшиеся фолликулы подвергаются атрезии. Остается один доминантный фолликул, чем обеспечивается моноовуляторний цикл (рис. 2). Период подъема ФСГ, в который селективный фолликул становится доминантным, называется «окном ФСГ».
Рисунок 2. Механизмы селекции фолликулов для монофоликулярного природного роста.
Если с помощью лекарственных препаратов вызвать значительный подъем концентрации ФСГ или обеспечить подъем гонадотропина без падения его концентрации, то несколько селективных фолликулов продолжат рост и произойдет множественный рост фолликулов и «суперовуляция».
Зрелыми считаются фолликулы, достигших диаметра 18 мм, поэтому стимуляцию яичников продолжают до достижения лидирующим фолликулом этого размера.
Фолликулы диаметром более 14 мм становятся чувствительными к ЛГ и в ответ на пикообразное повышение концентрации лютеинизирующего гормона могут лютеинизироваться.
Под действием подъема ЛГ или введение чХГ в фолликуле происходят изменения, ведущие к овуляции через 38-42 часа, а также происходит финальное созревание ооцита (завершение первого деления мейоза), что делает его готовым к оплодотворению. Для индукции финального созревания фолликулов используются препараты лХЧ или агонисты ГнРГ, вызывающие выброс эндогенного ЛГ.
Оценка овариального резерва и качества ооцитов
Чрезмерный отклик на стимуляцию:
По мере естественного расхода примордиальных фолликулов, фолликулярный резерв снижается с возрастом, приближаясь к критическому после 38 лет.
Кроме возраста, на состояние овариального резерва влияют следующие факторы:
Для оценки овариального резерва используется определение базальной концентрации ФСГ (на 2-3 д.м.ц.), а также число базальных (от 2 до 10 мм в диаметре) фолликулов на 2-3 д.м.ц. и общий объем яичников по данным УЗИ.
Выделяют следующие клинически значимые пределы концентраций ФСГ (на 2-3 д.м.ц.):
Другим практически значимым маркером фолликулярного резерва является определяемое по УЗИ на 2-3 д.м.ц. число антральных фолликулов от 2 до 10 мм в диаметре.
Низкий овариальный резерв предусматривается, если:
При гипоталамо-гипофизарной недостаточности (I тип бесплодия) эффективное применение только прямых индукторов овуляции (гонадотропинов), которые компенсируют их эндогенную недостаточность.
При недостаточности яичников (III тип) фолликулярный аппарат истощен (синдром преждевременного истощения яичников) или резистентный к действию гонадотропинов (синдром резистентных яичников). Любые методы стимуляции овуляции неэффективны. Беременность в этой ситуации возможна при использовании экстракорпорального оплодотворения донорских яйцеклеток.
Ановуляция часто встречается и при гиперпролактинемии. В этом случае, терапия первого выбора направлена на нормализацию уровня пролактина. Если овуляторный цикл не восстанавливается или беременность не наступает в течение 4-5 овуляторных циклов, то индукторы овуляции комбинируют с агонистами дофамина (бромкриптин, достинекс и др.).
Внутриматочная инсеминация (ВМИ):
Сочетание ВМИ с индукцией овуляции и ультразвуковым мониторингом овуляции значительно повышает эффективность лечения. Доказано, что индукция овуляции увеличивает шансы наступления беременности, даже если пациентка имеет естественные овуляторные циклы.
Оптимально вводить обработанную сперму в промежуток между 38 и 42 часами после инъекции хорионического гонадотропина (Прегнил®), который программирует овуляцию через 42-44 часа.
Внутриматочные инсеминации должны применяться только по показаниям, к которым относятся олигоспермия, цервикальный фактор, бесплодие неясного генеза, эякуляторноя дисфункция.
Недопустима тактика применения внутриматочных инсеминаций, как замена методов экстракорпорального оплодотворения (ЭКО) при наличии показаний к использованию методик ВРТ. Нецелесообразно у одной супружеской пары проведения более четырех циклов внутриматочных инсеминаций.
Для внутриматочной инсеминации должна использоваться фертильная сперма мужа или донора, содержащая более 10 млн. подвижных сперматозоидов в 1 мл (в нативном материале).
Другим критерием является наличие в материале, предназначенном для инсеминации не менее 4 млн. сперматозоидов нормальной морфологии, что соответствует критериям Крюгера.
Не допускается внутриматочное введение нативной спермы из-за возможного инфицирования матки, низкой эффективности такой процедуры, а также высокого риска развития токсического шока. Стандартная обработка спермы перед инсеминации включая двукратное отмывания от семенной плазмы путем центрифугирования в питательной среде и последующей флотации активной фракции сперматозоидов.
Перед инсеминацией необходимо провести подсчет подвижных сперматозоидов в образце подготовленной для инсеминации спермы. Пригодным для инсеминации можно считать образец, содержащий более 10 млн. подвижных сперматозоидов.
Бесплодие невыясненного генеза
Общие причины бесплодия
Эффективность индукции овуляции при этом виде бесплодия объясняют созреванием не одного, а 2-3 и более фолликулов, что повышает вероятность овуляции хотя бы одной качественной яйцеклетки и нормального развития эмбриона.
Если фертильность спермы находится на нижней границе нормы, то шансы наступления беременности повышают четкие рекомендации по ведению половых контактов. Для повышения вероятности наступления беременности и исключения возможного влияния цервикального фактора, при бесплодии неясного генеза целесообразно совмещать индукцию овуляции с внутриматочной инсеминации.
Противопоказания к индукции овуляции
Противопоказаниями к индукции овуляции являются состояния, при которых противопоказана беременность. Кроме того противопоказаниями являются непереносимость препаратов мочевых или рекомбинантных гонадотропинов, злокачественные новообразования (в частности в анамнезе), беременность, грудное вскармливание ребенка, маточные кровотечения неясной этиологии.
Не следует проводить индукцию овуляции в следующих случаях:
Препараты для индукции овуляции
В циклах контролируемой стимуляции яичников используется несколько классов препаратов, которыми достигаются следующая цель:
Для стимуляции роста и развития фолликулов используются прямые и непрямые индукторы.
Формы препаратов, содержащие 75 МЕ ФСГ или 100 МЕ ФСГ, из-за большой дозы в ампуле и невозможности деления дозы, больше предназначены для использования в программах ВРТ, где проводится КСЯ. При индукции монофолликулярного роста, когда наиболее важна точность и минимальная кратность дозы, целесообразнее использование Пурегон Пэн®. Минимальный «шаг» в 25 МО, позволяет индивидуально подобрать необходимую пациентке дозировку ФСГ. Пурегон Пэн® был создана специально для максимального удобства и комфорта женщин.
При индукции овуляции могут использоваться вспомогательные препараты:
На данных методических рекомендациях мы остановимся, главным образом на использовании кломифена цитрата и гонадотропинов.
Гонадотропины
Гонадотропины являются прямыми индукторами овуляции. Наиболее выраженное и селективное стимулирующее действие оказывает гормон ФСГ. Поэтому эволюция применения гонадотропинов шла от препаратов человеческого менопаузального гонадотропина (чМГ), содержащий смесь ФСГ и ЛГ в равном соотношении (по 75 МЕ), а также примеси ХГ, затем к препаратам мочевого ФСГ и, наконец, к препаратам чистого рекомбинантного ФСГ.
Мочевые гонадотропины получают путем очистки мочи женщин, находящихся в постменопаузе. Технологические ограничения позволяют добиться чистоты, которая не превышает 5%, остальные 95% препарата составляют примеси, в частности биологически активные. В состав препаратов входят кроме ФСГ, гормоны ЛГ и ХГ. В связи с прохождением через кислую среду мочи, биологическая активность ФСГ снижена, при этом возможны колебания содержания активного компонента в различных сериях препарата. Это приводит к не всегда прогнозируемому результату при применении препарата, повышенному риску многоплодия и синдрома гиперстимуляции яичников. Нельзя исключить инфицирование препарата. Поэтому, с появлением рекомбинантных гонадотропинов ряд компаний отказались от дальнейшего производства чМГ.
Рекомбинантный ФСГ был получен методом генной инженерии, путем внедрения генов альфа и бета субъединиц в структуру клеток китайского хомячка.
Это позволило получать чистый ФСГ, лишенный примесей, который имеет высокое постоянство активности.
Рекомбинантный ФСГ (Пурегон®) вводится внутримышечно или подкожно. Последний способ введения в область живота или бедра наиболее приемлемый с точки зрения безболезненности и биодоступности препарата. Для введения препарата используется ручка-инжектор Пурегон Пен®, которая:
Кломифена цитрат
Кломифена цитрат (клостилбегит, кломид, серофен и др.) относится к классу селективных модуляторов эстрогеновых рецепторов и является косвенным индуктором овуляции. За невысокой стоимости и простоте схемы применения кломифена цитрат является препаратом, который чаще всего используется для индукции овуляции.
Механизм действия кломифена цитрата обусловлен блокадой рецепторов эстрадиола в гипоталамусе, а возможно и в гипофизе, в связи с чем, по механизму отрицательной обратной связи усиливается выброс ГнРГ и усиливается продукция ЛГ и ФСГ, причем ЛГ в большей степени.
При использовании кломифена цитрата блокада рецепторов эстрадиола наблюдается не только в гипоталамусе, но и в других репродуктивных органах, что приводит к ряду нежелательных эффектов:
Сочетание факторов, снижающих вероятность зачатия, приводит к низкой частоте беременности (около 10%) при высокой частоте овуляции (около 70%).
После проведения индукции овуляции в одном цикле, до начала следующего менструального цикла кломифена цитрат циркулирует в крови и при повторном назначении КЦ в каждом менструальном цикле его концентрация в крови возрастает и аккумулируются нежелательные эффекты.
Длительным периодом полувыведения, а также существованием в препарате другого, неактивного транс-изомера объясняют такие эффекты КЦ, как онкогенность. Показано, что риск рака яичника при применении кломифена цитрата увеличивается в несколько раз. В связи с этим не рекомендуется назначать КЦ более 6 циклов за весь период жизни женщины.
Триггеры овуляции
Триггеры овуляции вводят по достижении фолликулом зрелости и используют во всех протоколах стимуляции, независимо от того, какие индукторы применялись. Наиболее распространено использование хорионического гонадотропина (ХГ, Прегнил® и др.), который по механизму действия совпадает с действием ЛГ, но длительнее циркулирует в крови.
Выбор методов индукции овуляции
Контролируемая стимуляция яичников (КСЯ). Используется для стимуляции множественного фолликулогенеза и получения многих ооцитов в программах ВРТ (ЭКО, ИКСИ, ДО).
При проведении индукции овуляции используется принцип дифференцированного выбора между препаратами ФСГ и кломифена цитратом. Мы предлагаем следующий алгоритм выбора метода лечения.
Если прогноз эффективности кломифена цитрата благоприятный, препарат используют в течение трех циклов стимуляции активной дозой 100 мг. При кломифен-резистентности или отсутствия беременности после 3 циклов, а также при начальном прогнозе низкой эффективности кломифена цитрата используют препараты ФСГ (Пурегон® 300 МЕ или 600 МЕ).
Следует учитывать, что у пациенток молодого возраста, которые не применяли кломифена цитрат и гонадотропины, вероятность овуляции на кломифена цитрат составляет около 70%, а частота наступления беременности от 10 до 15% на цикл лечения. При повторном использовании кломифена цитрата у нерезистентных пациенток вероятность беременности сохраняется постоянной в течение 3 попыток, затем прогрессивно уменьшается. При кломифен-резистентности вероятность беременности менее 5%. Всего с помощью кломифена цитрата при повторном использовании в течение 6 циклов могут забеременеть 50-65% пациенток в возрасте до 35 лет.
Использование гонадотропинов у молодых пациенток, не получавших ранее гонадотропины, а только применяли кломифена цитрат, приводит к овуляции в 90-95% случаев, наступление беременности в 25-35% на цикл стимуляции. При повторном использовании могут забеременеть до 90% пациенток (при отсутствии мужского и трубного факторов бесплодия).
После прогноза эффективности кломифена цитрата определяют тактику лечения, как показано на рис. 4.
Применять кломифена цитрата более чем в течение трех циклов нецелесообразно, учитывая прогрессирующее снижение шансов на наступление беременности.
Применение препаратов гонадотропинов не требует перерыва между циклами стимуляции за исключением случаев, когда перед индукцией используются оральные контрацептивы для достижения ребаунд-эффекта.
Протоколы индукции овуляции гонадотропинами
Мы предлагаем стандартный протокол стимуляции и короткий протокол (см. Приложение 2), с помощью которых можно следить за ходом лечения, учитывать данные УЗИ и дозы препаратов, что позволит прогнозировать ситуацию.
Разработанные протоколы индукции, доказали свою высокую эффективность, относительную безопасность и возможность применения у большинства пациенток. Поскольку поданные методические рекомендации рассчитаны на специалистов, которые приступают к применению гонадотропинов, мы остановимся более подробно именно на тех протоколах, из которых целесообразно начинать накопления опыта в области современных методов индукции овуляции.
Повышающий протокол минимальных доз, характеризуется максимальной безопасностью. Он базируется на стратегии назначения меньших доз с последующим повышением дозы у тех пациенток, у которых не было получено отклика на стартовую дозу.
Понижающий высокодозный протокол базируется на стратегии назначения больших стартовых доз с получением отклика у всех пациенток и последующим снижением дозы для тех из них, где число фолликулов, которые растут, превышает желаемое.
Базовый повышающий протокол «минимальных доз»
Данный протокол следует рассматривать как наиболее безопасный относительно риска многоплодия и развития синдрома гиперстимуляции яичников, а также наиболее эффективен в достижении монофоликулярного роста.
Для того, чтобы определить стартовую дозу ФСГ 50 или 100, на 2-3 день цикла, при стартовом УЗИ-мониторинге оценивают параметры овариального резерва (объем яичников, их структура, число антральных фолликулов), способного прогнозировать отклик яичников на стимуляцию. Обязательный анализ клинико-анамнестических данных пациентки, исследование уровня ФСГ в крови, взятой на 2-3 день одного из прошлых менструальных циклов. Основные критерии выбора стартовых доз представлены в Таблице 1.
Минидозовый протокол индукции овуляции. Протокол минимальных доз, схематично представлен на рис. 5.
Рис. 5. Минидозированный протокол индукции овуляции при адекватном отклике на стартовую дозу и росте 1-3 фолликулов. Пурегон® вводится ежедневно в постоянной дозе до достижения критериев зрелости фолликула.
Индукцию овуляции начинают с 2-3 д.м.ц. Проводят ультразвуковое исследование, подтверждающее отсутствие беременности, патологии органов малого таза. Назначают подкожно ежедневное введение рекомбинантного ФСГ в дозе 50 или 100 МЕ в течение 5-6 дней. После этих 5-6 дней происходит селекция фолликулов к дальнейшему росту, их диаметр меняется достаточно, чтобы увидеть динамику роста при контрольном УЗИ. Обращают внимание на число фолликулов, достигших диаметра 10 мм.
Если есть растущие фолликулы диаметром 10 мм и более и их число не превышает 4, продолжают введение гонадотропинов в той же дозе. При этом проводится УЗИ каждые 1-2 дня с целью мониторинга диаметра фолликулов, их количества, толщины эндометрия.
Как только диаметр лидирующего фолликула достиг 18 мм и толщина эндометрия при этом не менее 8 мм, считают, что полученный фолликул зрелый и зрелый эндометрий. В этот день возможно использование следующих вариантов ведения цикла:
Выбор той или иной тактики зависит от адекватности процессов роста фолликулов, которые происходили раньше, созревания эндометрия, дней индукции, дня менструального цикла. Как триггер овуляции вводится препарат ХГ (Прегнил®) внутримышечно в дозе 10 000 МЕ через 36-42 часа после введения Прегнила рекомендуется внутриматочная инсеминация или половой контакт, поскольку через 42-44 часа после инъекции произойдет овуляция. Нужно помнить, что половое воздержание у мужчины перед половым контактом или сдачей спермы должно быть в течение 3-5 дней.
Соответственно, при внутриматочной инсеминации Прегнил® вводят вечером, чтобы провести процедуру ВМИ в первой половине дня через 1,5 суток.
При естественном зачатии Прегнил® вводят в утреннее время, половой контакт рекомендуют в вечернее время через 1,5 суток.
При назначении ФСГ в дозе 50-100 МЕ овуляция достигается у 70-80% пациенток, имеющих нормальный овариальный резерв. У других 30-20% пациенток рост фолликулов на 5-6 день не отмечается и им требуется увеличение дозы. Тогда дозу увеличивают на 25 МЕ, затем вводят постоянную новую дозу 5-6 дней и проводят через 5-6 дней после повышения дозы новый УЗИ-мониторинг. Если отклик не отмечается, снова повышают дозу и т.д.
При регистрации роста фолликулов дозу р-ФСГ больше не увеличивают, вводят ФСГ ежедневно в достигнутой фиксированной дозе, проводят УЗИ мониторинг каждые 1-2 дня, ожидая достижения фолликулом и эндометрием критериев зрелости и т.д., как на рис. 5.
Понижающий высокодозный протокол
Понижающий протокол рекомендуется пациенткам, имеющих два и более из нижеперечисленных критериев:
Принципы ведения УЗИ-мониторинга, а также критерии введения триггеров овуляции те же, что и в минидозовом протоколе.
Комбинированные протоколы с другими препаратами
При необходимости применяют комбинированные протоколы, назначая индукторы овуляции на фоне препарата достинекс при гиперпролактинемии, или на фоне глюкокортикоидов при гиперандрогении. При этом обычно сопутствующее применение гормональных препаратов не вносит существенных изменений в тактике назначения гонадотропинов, например, при гиперпролактинемии или гиперандрогении. Часто используют протоколы с предыдущим назначением оральных контрацептивов (Марвелон®, Мерсилон®).
Применение оральных контрацептивов в цикле перед индукцией овуляции позволяет планировать стимуляцию в строго определенные врачом и удобные для пациентки дни, это особенно важно при напряженном графике работы супругов.
Возможно использование препаратов эстрадиола (Прогинова, Эстрофем), как индукторов роста эндометрия. Это целесообразно при прогнозируемой недостаточной толщине эндометрия. Например, если толщина эндометрия на момент достижения лидирующим фолликулом диаметра 14-16 мм не превышает 5-6 мм, назначают эстрадиол в дозах от 4 до 8 мг в сутки. При этом данную дозу эстрадиола не отменяют после введения триггера и продолжают в период поддержки лютеиновой фазы.
Преждевременная лютеинизация
По мере роста фолликула и увеличение концентрации эстрадиола создаются предпосылки для выброса гипофизом овуляторной порции ЛГ. Такой пик ЛГ, который состоялся до момента введения ХГ, называют преждевременным пиком ЛГ.
Для небольших фолликулов преждевременный пик ЛГ не имеет клинического значения, но в фолликулах диаметром более 14-15 мм повышение ЛГ может вызвать овуляторные изменения, преждевременное созревание ооцита, овуляцию или лютеинизацию.
У пациенток с повышенным риском преждевременной овуляции следует проводить ультразвуковой мониторинг ежедневно, как только размер фолликулов превысил 14-15 мм. При обнаружении признаков овуляции рекомендуется половой контакт в течение 4-6 часов или ВМИ. Ультразвуковые критерии овуляции представлены в разделе «Принципы ультразвукового мониторинга».
Возможно использование средств для домашнего мониторинга подъема ЛГ (Clearplan), и при регистрации положительного теста на фоне фолликулов диаметром более 15 мм пациентке рекомендуется коитус или внутриматочная инсеминация в ближайшие сутки и через день.
В ряде случаев для контроля за преждевременной овуляцией используют препараты аналогов ГнРГ. Проще и удобное использование антагонистов ГнРГ, например, Оргалутрана® (ганиреликс 0,25 мг). Антагонист ГнРГ предупреждает выброс эндогенного ЛГ и лютеинизацию. После достижения лидирующим фолликулом диаметра 14 мм Оргалутран® вводится подкожно ежедневно в дозе 0,25 мг, что приводит к блокаде гипофиза и предупреждения преждевременного пика ЛГ. Оргалутран® вводится до дня введения ХГ включительно. Доза гонадотропинов на период введения Оргалутрана® не меняется.
Триггеры овуляции и поддержка лютеиновой фазы
Как триггеры овуляции традиционно применяется хорионический гонадотропин (ХГ, Прегнил®).
Период полувыведения эндогенного ЛГ составляет около 2 часов. Это приводит к быстрому снижению концентрации после пика и последействие от введения агонистов ГнРГ минимальна. Поэтому такой триггер овуляции обычно используют при риске СГСЯ, когда нежелательна длительная стимулирующая ХГ на яичники.
После введения триггера овуляции и рекомендации половых контактов (или ВМИ), необходимо обеспечить полноценность гравидарной трансформации эндометрия в период имплантации в лютеиновую фазу. Поддержка начинается не ранее, чем через 44 часа после инъекции триггера. В настоящее время используется схема поддержки лютеиновой фазы, предусматривающая применение ХГ или препаратов прогестерона. Прегнил® (ХГ) назначается в дозе от 1500 до 5000 МЕ через каждые 2 дня 3-4 инъекции.
Поддержка лютеиновой фазы (ЛФ) после индукции овуляции проводится с использованием препаратов ХГ 1500 МЕ и прогестерона. При наступлении беременности и отсутствии симптомов угрозы прерывания от поддержки лютеиновой фазы постепенно отказываются после достижения срока 3 недель от овуляции.
Препараты прогестерона могут вводиться внутримышечно в виде 2,5% масляного раствора 1 мл, но такие ежедневные инъекции болезненны. В качестве альтернативного общепринятым является использование вагинальных форм микронизированного прогестерона в дозе 100-200 мг 2-3 раза в сутки. Такой путь введения обеспечивает максимальные концентрации в полости матки при меньшей системной циркуляции. Также используется аналог прогестерона для перорального применения (дидрогестерон) в дозе 10-20 мг 2 раза в сутки. Препараты ХГ, внутримышечно прогестерон, вагинальный микронизированный прогестерон и пероральное назначение дидрогестерона равноэффективно в сравнительных исследованиях.
Поддержка лютеиновой фазы целесообразна до установления клинической беременности и активной продукции хорионом хорионического гонадотропина. Поэтому после диагностики беременности на сроке 3 недели от овуляции дозы препаратов поддержки постепенно снижают, отказываясь от терапии в течение недели. Если беременность не наступила (тест на ХГ через 2 недели после овуляции отрицательный) или прервалась, препараты поддержки ЛФ отменяют.
Если присутствуют симптомы угрозы прерывания беременности, продолжают применение препаратов прогестерона или ХГ, переводя поддержку ЛФ в гормональную поддержку беременности.
Принципы ультразвукового мониторинга
Кроме ультразвукового мониторинга ранее применялся мониторинг сывороточного уровня эстрадиола, который отражал активность фолликулов, которые росли. В настоящее время большинство специалистов отказались от обязательного исследования уровня эстрадиола, поскольку современные протоколы стимуляции отличаются значительной вариабельностью, что влияет на стероидогенез в яичниках. Признано, что ультразвуковой мониторинг является более точным и достаточным.
Кратность и цель мониторингового ультразвукового исследования
Первое мониторинговое УЗИ проводится на 2-3 д.м.ц., то есть перед назначением индукторов овуляции.
Цель первого ультразвукового исследования.
Оценить возможность индукции овуляции.
Необходимыми условиями успешной индукции овуляции и проведение КСЯ являются следующие признаки:
Оценить состояние овариального резерва яичников с целью оптимального подбора стартовой дозы гонадотропинов.
Для этого оцениваются:
Связь между этим критериям и стартовой дозой ФСГ описан в разделе «Протоколы индукции овуляции».
Задача дальнейших УЗ-исследований:
После назначения триггера овуляции УЗ-мониторинг может быть закончен. Желательно убедиться в факте состоявшейся овуляции, для чего пациентку приглашают через 2 суток (48 часов) после введения ХГ и по данным УЗИ оценивают критерии овуляции и формирование желтых тел. Последние отличаются от фолликулярных кист утолщенной стенкой и гетерогенным содержимым.
При наличии зрелых фолликулов и введении 10000 МЕ ХГ, как правило через 38-42 часа наступает овуляция. Нельзя исключить лютеинизацию неовулированных фолликулов. Желательно проводить контрольное УЗИ, особенно в случаях, когда есть риск развития синдрома гиперстимуляции яичников (наблюдается рост более трех фолликулов). Тогда УЗИ через 2-4 дня после введения триггера овуляции позволяет точнее оценить тяжесть СГЯ, дать дополнительные рекомендации по лечению. В других случаях, если число фолликулов не превышало 3, от этого УЗИ можно удержаться и пригласить пациентку только через 2 недели для исследования крови на уровень бета-субъединицы ХГ. После коитуса или ВМИ назначается поддержка лютеиновой фазы.
Через 3-5 недель после овуляции подтверждается факт клинической внутриматочной беременности, исключается внематочная.
Через 5-6 недель после овуляции можно обнаружить сердцебиение плода и точно ответить на вопрос о количестве плодов.
Правила измерения фолликулов и эндометрия
При регистрации данных ультразвукового мониторинга в специальной карте отмечается число фолликулов, которые растут, диаметры всех крупных фолликулов, диаметр доминантного фолликула (лидера), дается характеристика когорте (однородная или нет), измеряется толщина эндометрия.
При выборе лидирующего фолликула и оценке его диаметра могут возникнуть трудности в ряде ситуаций. Например, при неоднородной когорте фолликулов, растущих при неправильной форме фолликула или утолщенном (двойном) контуре стенки фолликула.
При прогнозе скорости роста фолликулов и назначении следующего визита для ультразвукового мониторинга следует учитывать, что средняя скорость роста фолликулов, имеющих величину до 12-14 мм составляет 1 мм в сутки, затем скорость роста диаметра возрастает до 2 мм в сутки.
Осложнения: профилактика и лечение
Многоплодная беременность при проведении КИО и КСЯ
Все пациентки с многоплодной индуцированной беременностью относятся к группе риска невынашивания, гестозов, преждевременных родов, недоношенности новорожденных и др., поэтому должны наблюдаться в специализированных центрах, а роды разрешаться в клиниках, которые имеют отделения реанимации новорожденных.
Синдром гиперстимуляции яичников ( СГСЯ )
Одним из осложнений стимуляции овуляции является синдром гиперстимуляции яичников, который с большей вероятностью может развиться у пациенток, имеющих множественный рост фолликулов. Частота тяжелых форм СГСЯ составляет менее 1%. При монофолликулярной овуляции СГСЯ не наблюдается.
Фактором, который запускает и поддерживает функцию желтых тел является экзогенный или эндогенный ЛГ, ЧХГ. Поэтому при наступлении беременности и продукции хорионом ХГ течение СГСЯ поддерживается, если беременность не наступает, СГСЯ проходит, а при угрожающем течении СГСЯ показано прерывание беременности.
Ключевым патогенетическим звеном в развитии СГСЯ является повышенная проницаемость сосудов. Она приводит к выходу жидкости из сосудистого русла в висцеральные полости, гиповолемии и гемоконцентрации. В тяжелых случаях гиповолемия приводит к олигоурии, тахикардии, гипотензии. Гемоконцентрация грозит внутрисосудистым свертыванием и тромбоэмболией. Летальные исходы при СГСЯ вызваны тромбоэмболией легочной артерии, но в Украине они ни разу не регистрировались.
Клинически различные степени тяжести синдрома можно охарактеризовать следующим образом.
Стратегию ведения пациенток с риском СГСЯ или развитым синдромом можно представить следующим образом.
В случаях прогрессирующего напряженного асцита показан трансвагинальный или трансабдоминальный парацентез под УЗ контролем. Диуретики неэффективны для эвакуации жидкости из третьего пространства, в ряде случаев они могут усилить гиповолемию и привести к гиповолемическому шоку. Противопоказаниями к парацентезу является гемодинамичеськая нестабильность и внутрибрюшное кровотечение. Плевральная пункция с целью эвакуации накопившейся жидкости необходима при прогрессирующем гидротораксе и дыхательных нарушениях.
Показаниями к хирургическому лечению больных с СГСЯ является внутрибрюшное кровотечение при разрыве кист яичника, перекрут яичника, сопутствующая внематочная беременность. Хирургическое вмешательство при СГСЯ должно быть щадящим, проводить лапароскопическим доступом, а гемостатические меры направлены на сохранение яичниковой ткани. Большие размеры кист и яичников не могут служить основанием для их резекции.