Моноклональная гаммапатия неясного генеза что это такое
Моноклональная гаммапатия неясного генеза что это такое
Пациенты с доброкачественными моноклональными гаммапатиями не представляют никакого клинического симптома, а лишь биологические изменения сывороточных протеинов. В плазме этих лиц обнаруживается при электрофорезе один глобулин в большем количестве. Иммунохимические исследования показали, что речь идет о гомогенном, монотипном Ig, состояшем из одной тяжелой цепи и одной легкой цепи. Описывались случаи с компонентом IgG, IgA и IgM. He известны случаи доброкачественных моноклональных гаммапатии с IgE или IgD. В известных случаях наблюдается преобладание Ig с легкой цепью ламбда по отношению к каппа.
При доброкачественной моноклональной гаммапатии, моноклональный компонент существует в малом количестве (1—3 г/100 мл сыворотки), не сопровождается сокращением остальных Ig и не изменяется количественно в течение долгих периодов времени. Кроме этого, пациенты не представяют протеинурии Бене-Джонса (Вепсе-Jones).
Остальные лабораторные исследования нехарактерны. Гемограмма обычно нормальная. СОЭ может быть нормальной, но бывает и весьма ускоренной.
Исследование костного мозга показывает обычно слегка повышенное число плазмоцитов, но не превышающее 10—15% общего количества миэлоидных элементов.
Дифференциальная диагностика доброкачественных моноклональных гаммапатий производится в первую очередь с множественной миэломой в начальной фазе. Ritzmann и сотр. попытались определить клинические или биологические признаки, которые могут способствовать дифференциации этих двух заболеваний. Они обнаружили, что ни один из биологических тестов (количество IgM, отсутствие или наличие протеина Бене-Джонса, нормальное или пониженное количество остальных Ig) не может давать точное указание. Единственно верный метод дифференциации состоит в наблюдении больного в течение долгого времени.
При доброкачественной моноклональной гаммапатии, количество моноклонального компонента остается без изменений в течение нескольких лет, в то время как при множественной миэломе, патологический протеин представляет явный рост от одного анализа к другому.
Эволюция и прогноз доброкачественных моноклональных гаммапатий. Как показывает и самое название, доброкачественная моноклональная гаммапатия имеет обычно долгую эволюцию и хороший прогноз.
Однако в литературе по специальности отмечаются случаи, которые после многолетнего типично стационарного аспекта, эволюировали в дальнейшем как множественная миэлома. Отсюда вытекает необходимость для таких больных находиться под тщательным медицинским надзором в течение долгих периодов времени.
Лечение доброкачественных моноклональных гаммапатий. Пациенты с доброкачественной моноклональной гаммапатией не нуждаются в лечении. Однако существует необходимость тщательного медицинского надзора в течение долгих периодов и применения лечения при первых же признаках эволютивности, особенно в случае повышения количества компонента М.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Моноклональная гаммапатия неясного генеза (МГНГ)
, MD, Institute for Myeloma and Bone Cancer Research
Частота встречаемости моноклональной гаммапатии неясного генеза (МГНГ) повышается с возрастом (от 1% среди лиц до 25 лет до > 5% среди лиц старше 70 лет). МГНГ может быть ассоциирована с другими заболеваниями (см. таблицу Классификация плазмоклеточных заболеваний Классификация плазмоклеточных заболеваний Плазмоклеточные заболевания представляют собой разнородную группу заболеваний неизвестной этиологии, характеризующихся Чрезмерной пролиферацией одного клона В-клеток Наличием структурно и электрофоретически. Прочитайте дополнительные сведения ), при которых антитела синтезируют большое количество М-протеинов (моноклональных иммуноглобулиновых белков, которые могут состоять из тяжелых и легких цепей, или только из легких цепей) в ответ на длительное антигенное воздействие.
Подозрение на МГНГ, как правило, возникает при случайном выявлении М-протеина в крови или моче во время рутинного обследования. Характерен низкий уровень М-протеина в сыворотке крови ( 3 г/дл) или в моче ( 200 мг/24 часа). Дифференциальная диагностика с злокачественными плазмоклеточными заболеваниями основана на сохранении низкого уровня М-протеина, отсутствии литических костных поражений, анемии, почечной дисфункции. Из-за риска развития переломов, исходно необходимо обследовать кости скелета (т.е. провести обзорную рентгенографию черепа, длинных трубчатых костей, позвоночника, костей таза, ребер) и денситометрию. Для костного мозга характерен легкий плазмоцитоз ( 10% ядерных клеток).
Лечение моноклональной гаммапатии неясного генеза в Германии
Риск развития МГНГ увеличивается с возрастом и диагностируется у 3% населения старше 50 и у около 5% людей — старше 70 лет. При этом мужчины страдают МГНГ чаще чем женщины и риск развития заболевания возрастает, если у кровных родственников первой линии была диагностирована моноклональная гаммапатия неясного генеза.
Риск прогрессии МГНГ
При моноклональной гаммапатии неясного генеза с тяжелыми цепями иммуноглобулинов риск развития болезни во множественную миелому или в другую злокачественную лимфому составляет 1-1,5% в год, в то время как при МГНГ с легкими цепями — около 0,3% в год. Однако вероятность малигнизации МГНГ зависит также от индивидуальных отклонений, имеющихся у каждого отдельного пациента. Основными факторами риска малигнизации МГНГ являются:
Как правило, моноклональная гаммапатия неясного генеза не имеет симптомов и диагностируется в рамках рутинного контроля или при диагностике в Германии другого заболевания. Подробно о методах диагностики МГНГ читайте в статье «Диагностика моноклональной гаммапатии неясного генеза в Германии».
Терапия МГНГ
Пациентам с моноклональной гаммапатией неясного генеза терапия не показана, однако, при основном заболевании, связанном с патологическими иммуноглобулинами, терапия все же может быть рекомендована. Но в таком случае природа гаммапатии установлена и пациент должен получать терапию, соответствующую данному виду.
Моноклональная гаммапатия неясного генеза что это такое
Моноклональные гаммапатии (иммуноглобулинопатии, парапротеинемии) представляют собой неоднородную группу заболеваний, которые характеризуются моноклональной пролиферацией клеток В-лимфоидного ряда, секретирующих иммуноглобулины.
Основной отличительной особенностью этих заболеваний является продукция моноклонального иммуноглобулина (М-компонент, М-градиент, М-протеин, парапротеин), который определяется в сыворотке крови и/или моче.
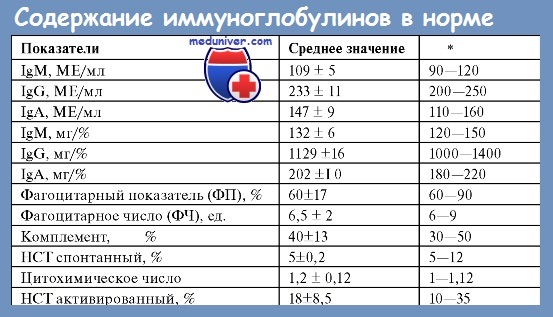
Основную часть (почти 80 %) всех иммуноглобулинов составляют IgG, которые обеспечивают все разнообразие антител к бактериям, их токсинам, вирусам и другим антигенам. Нормальные IgG представляют собой смесь из 4 подклассов: IgG1, IgG2, IgG3 и IgG4. Все типы IgG проникают через плаценту и обеспечивают пассивную иммунизацию плода. Соотношение IgG разных подклассов в парапротеине при множественной миеломе и моноклональных гаммапатиях неясного генеза не отличается от соотношения в нормальной сыворотке.
Иммуноглобулины класса А (около 20 % от всех иммуноглобулинов) содержатся в сыворотке крови, их много в секретах (кишечного и респираторного трактов, слюне, слезной жидкости, молоке). Они обладают противовирусной и антимикробной активностью, препятствуют проникновению микроорганизмов через слизистые оболочки. Иммуноглобулины класса М определяются преимущественно на поверхности В-лимфоцитов и играют основную роль на первом этапе иммунного ответа при бактериемии и вирусемии на ранних стадиях инфекции. Иммуноглобулины класса D содержатся в сыворотке в очень малых количествах (менее 1 %), их функция до сих пор неясна.
В малых количествах в сыворотке крови содержатся IgE, их содержание возрастает при аллергических заболеваниях и глистных инвазиях.
При электрофорезе нормальные иммуноглобулины, разнородные по своим свойствам, располагаются в зоне у, образуя полого поднимающееся плато на электрофореграмме или широкую полосу при иммунофиксации. Моноклональные иммуноглобулины, однородные по всем физико-химическим и биологическим параметрам, мигрируют преимущественно в зону у, редко в зону b и даже а, где образуют высокий пик или четко отграниченную полосу. До сих пор во многих странах используется метод электрофореза на ацетатцеллюлозе, который позволяет выявить наличие парапротеина, если его содержание в сыворотке превышает 7 г/л.
Моноклинальные гаммапатии [Radl J.]
| Категория моноклональных гаммапатий | Характер патологии | Концентрация моноклональных иммуноглобулинов в сыворотке крови |
| 1. В-клеточные злокачественные | а. Множественная миелома, макроглобулинемия Вальденстрема б. Плазмоцитома (солитарная: костная и экстрамедуллярная), лимфома, хронический лимфолей-коз, болезнь тяжелых цепей | Более 25 г/л Значительно менее 25 г/л |
| 2. В-клеточные доброкачественные | а. Моноклональные гаммапатии неясного генеза б. AL-амилоидоз (первичный амилоидоз) | Менее 25 г/л Менее 25 г/л |
| 3. Иммунодефицитные состояния с дисбалансом Т- и В-звеньев иммунной системы | а. Первичные (синдромы Wiskott—Oldrich, DiGeor-ga, Nezelof, тяжелого комбинированного иммунодефицита) б. Вторичные (возрастные, вызванные применением иммунодепрессантов, сопутствующие онкологическим заболеваниям нелимфоидной природы, как, например, рак толстой кишки, рак молочной железы, рак простаты, и др.) в. Перестройка иммунной системы после пересадки костного мозга г. Антигенная стимуляция в раннем онтогенезе (внутриутробная инфекция) | Менее 2,5 г/л Менее 2,5 г/л Менее 2,5 г/л Менее 2,5 г/л |
| 4. Гомогенный иммунный ответ | а. Бактериальные инфекции б. Аутоиммунные заболевания, такие как криогло-булинемия, системная красная волчанка, ревматоидный артрит и др. | Менее 2,5 г/л Менее 2,5 г/л |
С начала 70-х годов XX в. наиболее распространенным методом стал электрофорез в агарозе, который позволяет определить моноклональный иммуноглобулин в концентрации не менее 0,5 г/л в плазме крови, а в моче — 0,002 г/л. Для определения класса и типа иммуноглобулина применяется метод иммунофиксации с использованием моноспецифических антисывороток к тяжелым и легким цепям иммуноглобулинов. Количество парапротеина определяют методом денситометрии электрофореграмм.
Опухолевые клетки парапротеинемических гемобластозов сохраняют дифференцировку нормальных лимфоидных и плазматических клеток и способность к высокому уровню синтеза и секреции иммуноглобулина. Как при нормальном иммунном ответе, так и при патологии каждая плазматическая клетка может синтезировать и секретировать до 100 000 молекул антигенспецифического иммуноглобулина каждую минуту. На основании синтеза и секреции электрофоретически и иммунохимически гомогенного иммуноглобулина и соответствия его количества массе опухоли было показано, что малигнизированные плазматические клетки моноклональны, т. е. происходят из одного трансформировавшегося лимфоцита или плазматической клетки.
В норме внутриклеточный синтез Н- и L-цепей в клетках, продуцирующих антитела, хорошо сбалансирован. В ряде случаев в малигнизированных клонах нарушается баланс между синтезом Н- и L-цепей в сторону повышенной продукции последних. Моноклональные димеры и мономеры L-цепей, имея небольшую молекулярную массу, фильтруются почечными клубочками, затем частично подвергаются реабсорбции и катаболизму в почечных канальцах, а частично выделяются в мочу (белок БенсДжонса).
Структура Н-цепей, видимо, остается нормальной при множественной миеломе и макроглобулинемии Вальденстрема.
Злокачественные плазмоклеточные пролиферации, такие как множественная миелома, макроглобулинемия Вальденстрема, характеризуются продукцией моноклонального иммуноглобулина и определенной клинической симптоматикой. М-протеин в ряде случаев обнаруживают у практически здоровых людей. В таких случаях говорят о моноклональной гаммапатии неясного генеза (МГНГ, MGUS — monoclonal gammapaties of undetermined significance).
М-градиент можно обнаружить при некоторых синдромах и состояниях, сопровождающихся повышенной продукцией антител: при реконвалесценции после пневмонии, гепатита, а также при паразитарных инфекциях, циррозе печени, аллергических реакциях и аутоиммунных заболеваниях, после трансплантации костного мозга, при амилоидозе, саркоидозе и ряде других патологий.
Разные авторы предлагают более или менее подробные классификации моноклональных гаммапатии, но во всех классификациях выделены основные категории гаммапатии, предложенные J. Radl.
В 60—70-е годы XX в., когда использовалась методика электрофореза на ацетатцеллюлозе, моноклональную гаммапатию диагностировали у 0,7—1,2 % здорового населения. С начала 80-х годов после введения в практику более чувствительной методики — электрофореза в агаре, М-парапротеин стал выявляться у 5 % здорового населения в возрасте от 22 до 55 лет (при использовании в этой же группе электрофореза на ацетатцеллюлозе моноклональная гаммапатия зарегистрирована только у 0,33 %). Частота моноклональных гаммапатии увеличивается до 7—8 % в группе старше 55 лет и достигает 10 % в группе старше 80 лет, при этом у 80 % лиц с выявленным М-градиентом его концентрация в сыворотке очень низкая — менее 5 г/л.
По данным клиники Мэйо, из всех моноклональных гаммапатии в половине случаев выявляется моноклональные гаммапатии неясного генеза (МГНГ) (52%), у 12% больных — амилоидоз и у 33 % — злокачественные парапротеинемии: множественная миелома (19 %), вялотекущая миелома (5 %), солитарная плазмоцитома (3 %), макроглобулинемия Вальденстрема (3 %), другие типы лимфом с секрецией парапротеина (3 %). В 3 % случаев моноклональная гаммапатия сопровождает другие злокачественные опухоли.
Ключевым индикатором для диагноза злокачественной протеинпродуцирующей опухоли является высокая концентрация М-парапротеина в сыворотке крови.
Как показали исследования J. Moller-Petersen и Е. Schmidt, предположение о множественной миеломе оказалось правильным в 90 % случаев при концентрации М-парапротеина в сыворотке более 30 г/л, а предположение о МГНГ — в 90 % случаев при более низких показателях концентрации М-парапротеина.
Основные дифференциально-диагностические критерии для отличия моиоклональной гаммапатии неясного генеза от тлеющей миеломы и множественной миеломы
| Параметр | Моноклональная гаммапатия неясного генеза | Тлеющая миелома | Множественная миелома |
| М-компонент: IgG IgA | 30 г/л, стабильно > 10 г/л, но 30 г/л > 20 г/л | ||
| L-цепи в моче | 1 г/сут | > 1 г/сут | |
| Плазматические клетки в трепанате костного мозга | 10%, но 10% | ||
| Очаги поражения костей скелета при рентгенографии | Нет | Нет литических очагов поражения | Литические очаги или остеопороз |
| Магнитно-резонансное исследование позвоночника | Нет очагового поражения | Могут выявляться одиночные, небольших размеров очаги поражения | Множественные литические очаги или остеопороз |
| Уровень b2-микроглобулина | Нормальный | Нормальный | Высокий или нормальный |
| Пролиферативный индекс плазматических клеток | 1 % | ||
| Почечная недостаточность, гиперкальциемия, анемия, боли в костях, экстрамедуллярные поражения | Отсутствуют | Отсутствуют | Имеются |
Таким образом, чем выше уровень М-протеина в сыворотке крови, тем больше вероятность того, что у больного развилась злокачественная опухоль с секрецией парапротеина.
Вероятность развития злокачественной опухоли связана с длительностью существования моноклональной гаммапатии. R. Kyle и соавт. (клиника Мэйо) наблюдали большую группу пациентов с моноклональными гаммапатиями. При длительности наблюдения 10 лет злокачественная трансформация произошла у 16 % больных МГНГ, 20 лет — у 33 % и при длительности наблюдения 25 лет — у 40 % больных. Риск трансформации составляет 1—2 % в год. Моноклоанльные гаммапатии неясного генеза наиболее часто трансформируется в миелому (68 %), значительно реже у пациентов с моноклональными гаммапатиями неясного генеза (МГНГ) происходит трансформация в макроглобулинемию Вальденстрема (11 %) и лимфому (8 %), еще реже — в болезнь тяжелых цепей.
В большинстве случаев моноклональные гаммапатии неясного генеза не успеют подвергнуться злокачественной трансформации, так как у 80 % пациентов с моноклональными гаммапатиями концентрация М-парапротеина в сыворотке крови значительно ниже 30 г/л, а возраст абсолютного большинства лиц с выявленной парапротеинемией превышает 40 лет.
Класс иммоглобулина, выявляемый при моноклональных гаммапатиях неясного генеза (МГНГ), в значительной степени определяет тип возможной трансформации. Риск транформации в лимфому или макроглобулинемию Вальденстрема выше у пациентов с моноклональными гаммапатиями неясного генеза (МГНГ) и продукцией IgM, в то время как моноклональная гаммапатия неясного генеза (МГНГ) с продукцией IgA или IgG чаще трансформируется в множественную миелому, AL-амилоидоз или другие заболевания, сопровождающиеся плазмоклеточной пролиферацией.
Основной врачебной тактикой при моноклональной гаммапатии неясного генеза является наблюдение за пациентом — «наблюдай и жди». Наиболее часто моноклональная гаммапатия неясного генеза трансформируется в миелому, поэтому возникла необходимость в систематизации критериев, определяющих риск такой трансформации и алгоритм наблюдения. В таблице представлены критерии, позволяющие дифференцировать моноклональную гаммапатию неясного генеза от тлеющей миеломы, при которой также используется тактика «наблюдай и жди» и от множественной миеломы, требующей назначения химиотерапии.
Кроме задачи первичной дифференциальной диагностики, существует задача определения тактики ведения пациента и предсказания возможной трансформации моноклональной гаммапатии неясного генеза.
В последние годы ряд авторов предложили различные прогностические критерии, помогающие определить алгоритм наблюдения и необходимость начала лечения.
Исследователи из MD Anderson Cancer Center (США) при многофакторном статистическом анализе показали, что наиболее значимыми прогностическими факторами являются уровень парапротеина в сыворотке крови и наличие поражения позвоночника по данным магнитно-резонансной томографии (МРТ). Низкий риск трансформации был у больных с отсутствием изменений в позвоночнике по данным МРТ и уровнем парапротеина 30 г/л и менее, медиана наблюдения до прогрессирования составила 79 мес. В группу промежуточного риска были отнесены больные, имевшие либо изменения при МРТ, либо уровень парапротеина выше 30 г/л. Медиана времени до прогрессирования составила 30 мес. Высокий риск трансформации был в группе больных, имевших и изменения при МРТ и уровень парапротеина > 30 г/л; медиана до прогрессирования 17 мес.
Для больных промежуточной прогностической группы дополнительным прогностическим фактором явился тип парапротеина — IgA. При сочетании нормальной МРТ с отсутствием остальных факторов риска или наличием только одного из них медиана до прогрессирования составила 57 мес, а наличие изменений при МРТ в сочетании с одним или двумя прогностическими факторами уменьшило медиану до прогрессирования до 20 мес. Не все исследователи подтверждают неблагоприятное прогностическое значение IgA типа парапротеина.
В последние годы проводятся исследования, направленные на выявление цитогенетических изменений, которые могли бы предсказать близкую трансформацию моноклональной гаммапатии неясного генеза. Метод флюоресцентной гибридизации in situ (FISH) выявил реаранжировку 14q32 почти у половины пациентов с моноклональной гаммапатией неясного генеза, делецию хромосомы 13 обнаруживали в 2 раза реже, чем при множественной миеломе, a t(4;14) при моноклональной гаммапатии неясного генеза почти не встречалась (2 %). Корреляции этих цитогенетических изменений с клиническим течением при моноклональной гаммапатии неясного генеза выявить не удалось.
При обнаружении моноклональной гаммапатии неясного генеза и после подтверждения этого диагноза в соответствии с современными требованиями рекомендуется придерживаться следующего алгоритма наблюдения. При отсутствии жалоб у пациента в течение первого года проводят исследование уровня парапротеина каждые 3 мес и МРТ — через полгода. Если в течение 1 года нарастания уровня парапротеина и изменений при МРТ не выявлено, в дальнейшем исследование парапротеина производят 1 раз в 6— 12 мес, а МРТ — 1 раз в год.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Моноклональная гаммапатия неясного генеза что это такое
ММ — множественная миелома
ХЛЛ — хронический лимфолейкоз
MGUS — моноклональная гаммапатия неясного генеза
MW — макроглобулинемия Вальденстрема
Моноклональные гаммапатии (МКГП) характеризуются появлением в крови моноклональных иммуноглобулинов (Ig) или их фрагментов (парапротеинов), синтезируемых пулом аномальных В-лимфоцитов или чаще плазматических клеток костного мозга. Эти клетки происходят от одной родоначальной клетки и, таким образом, составляют единый клон (семью) клеток. Важнейшим признаком клональности этих клеток является продукция ими Ig одного класса, чаще G или A, с одним типом легких цепей (ЛЦ) — либо λ, либо κ, может отмечаться и гиперпродукция только ЛЦ — λ или κ.
Такие секретирующие клоны В-лимфоцитов или плазматических клеток называют «секретирующие лимфоплазмоклеточные дискразии (ЛПКД)», при этом МКГП (парапротеинемии) являются отличительным клиническим признаком этих дискразий.
Среди секретирующих вариантов ЛПКД к злокачественным неоплазиям относят множественную миелому (ММ), макроглобулинемию Вальденстрема (MW). Относительно более доброкачественными вариантами считают тлеющую миелому, хронический лимфолейкоз (ХЛЛ). Начальные стадии ЛПКД обозначают термином «моноклональная гаммапатия неясного генеза» (MGUS). MGUS привлекает в последние годы пристальное внимание клиницистов не только как предопухолевое клональное заболевание, практически всегда предшествующее развитию ММ и другим В-лимфоцитарным опухолям, но, что не менее важно, и как состояние, ассоциирующееся с заболеваниями терапевтического профиля, в частности болезнями почек. Поскольку повреждения тубулоинтерстициальной ткани и клубочков почек могут быть патогенетически связаны с моноклональным белком, который в большинстве случаев по объему отвечает критериям MGUS и, более того, представлен свободными ЛЦ Ig (FLC), то больных с MGUS в клинике внутренних болезней выявляют обычно нефрологи. Впервые R. Kyle и соавт. в 1978 г. ввели термин MGUS после того, как на основании большого клинического материала (1384 пациента) отметили, что пациенты с наличием в сыворотке крови небольшого количества моноклонального белка (М-протеина) в отсутствие симптомов имеют более высокий риск развития ММ, MW, AL-иммуноглобулинового амилоидоза [1]. В настоящее время установлено, что MGUS возникает примерно у 4,2% взрослых людей старше 50 лет, т. е. ее распространенность среди населения значительно выше, чем overt-плазма-В-лимфоцитарных неоплазм вместе взятых [2]. В течение многих лет MGUS может клинически не проявляться и не подвергаться злокачественной трансформации. Переход в миелому у пациентов с MGUS составляет примерно 1% новых случаев в год [3]. В настоящее время на новом методическом уровне показана возможность более детального прогнозирования дальнейшей злокачественной прогрессии этой начальной стадии ЛПКД.
Так, S. Rajkumar и соавт. [4] показали, что если уровень секреции моноклональных Ig не превышает 15 г/л и при этом секретируются IgG и не секретируются в избытке моноклональные свободные ЛЦ, то злокачественная трансформация в течение ближайших 20 лет произойдет лишь у 5% больных. Если наблюдается отклонение одного из представленных показателей (например, моноклональная секреция превышает 15 г/л или секретируются IgМ либо моноклональные свободные ЛЦ), то риск трансформации увеличивается в 5 раз, если двух показателей — то в 10 раз, отклонение же всех 3 показателей приведет через 20 лет к злокачественной трансформации в миелому у 58% носителей MGUS.
Из-за отсутствия высокочувствительных методов диагностики МКГП проблема MGUS длительно оставалась в тени проблемы ММ. В дальнейшем стали накапливаться данные о потенциальной патогенности моноклональных Ig и их фрагментов, составляющих основу MGUS, что обусловливает повреждение органов-мишеней с развитием прогрессирующей органной дисфункции. К заболеваниям, не принадлежащим к гематологическим опухолям, в ассоциации с олигосекреторной МКГП описаны иммуноглобулиновый AL/AH-амилоидоз, болезнь отложения моноклональных Ig и их фрагментов, чаще легких цепей (LCDD), криоглобулинемия I и II типов и другие заболевания почек — гломерулопатии и тубулопатии. Различают следующие варианты поражения почек при МКГП.
1. Болезни отложения: AL-амилоидоз; болезнь отложения ЛЦ (БОЛЦ); болезнь отложения ТЦ и ЛЦ; болезнь отложения ТЦ.
2. Иммуновоспалительные гломерулопатии: микротубулярный (иммунотактоидный) гломерулонефрит (ГН) с депозитами моноклональных Ig: ГН с неорганизованными моноклональными иммунными комплексами (различные морфологические варианты); зависимый от компонента С3-комплемента ГН (мезангиокапиллярный с плотными депозитами); ГН при MW; криоглобулинемический ГН.
Тубулопатии: синдром Фанкони, ассоциированный с внутрицитоплазматическими кристаллами ЛЦ; cast-нефропатия.
Перечень ассоциированных с MGUS почечных (и не только почечных, нередко системных) заболеваний все более расширяется, в связи с чем скрининговые обследования больных для выявления МКГП начинают рассматривать как обязательный в практике нефролога.
Несмотря на то что причины тканевой токсичности и тропности моноклональных белков к отдельным тканям и органам, например к почкам, недостаточно расшифрованы, накопленные к настоящему времени, главным образом в эксперименте, данные позволяют приблизиться к пониманию некоторых механизмов, лежащих в их основе. Показано, что моноклональные Ig различных классов в растворенном состоянии могут быть крайне нестабильными, при этом ЛЦ, реже — тяжелые цепи (ТЦ) способны образовывать агрегаты, в том числе в виде фибрилл, отложение которых в тканях и составляет сущность системного первичного иммуноглобулинового амилоидоза. Стало ясно, что AL/AH-амилоидоз может быть самостоятельным вариантом олигосекреторной плазмоклеточной дискразии с вовлечением многих органов или ассоциированным с любым другим типом секретирующих ЛПКД (ММ, MW и др.). Поскольку развитие AL/AH-амилоидоза исключительно связано с физико-химической нестабильностью самого амилоидогенного моноклонального Ig, то этот тип амилоидоза (AL/AH) правильнее считать ассоциированным состоянием, а не осложнением миеломы или другой ЛПКД.
По-видимому, имеют значение изотипы Л.Ц. При AL-амилоидозе только определенные изотипы амилоидогенны (AL-амилоидоз возникает у 12—15% больных ММ); большей амилоидогенностью обладает λ-изотип подгруппы VI, чем κ-ЛЦ. По нашим данным, λ-изотип выявляется у 70% из 150 больных AL-амилоидозом. Амилоидогенности способствуют мутации ЛЦ: структурные перестройки в мутантных молекулах ведут к дестабилизации вторичной структуры и в дальнейшем агрегации в фибриллы. Растворимые предшественники фибрилл обладают прямой клеточной токсичностью, реализуемой через механизмы окислительного стресса и апоптоза с участием р38-митогенактивированной протеинкиназы.
LCDD наиболее часто ассоциируется с моноклональными κ-ЛЦ (тип I и IV). Это конго-отрицательные депозиты, которые в почках локализованы преимущественно вдоль почечных базальных мембран (канальцевых и колбочковых), имеют вид аморфных (в отличие от фибрилл амилоида), электронно-плотных включений. Особенностью тканевого повреждения является накопление склеротической ткани (лобулярный склероз) в клубочках почек и других органах.
Обычно подозрение на наличие МКГП возникает при обнаружении признаков диспротеинемии по СОЭ или протеинурии переполнения (выраженная протеинурия при нормальных уровнях в сыворотке крови альбумина, обнаружение белка Бенс-Джонса). Применение в этом случае электрофоретических методов позволяет обнаружить аномальные фракции белков в крови и нередко моче. Проведение реакции иммунопреципитации с антителами к различным Ig дает возможность подтвердить моноклональный характер этих белковых фракций. Однако с помощью традиционных методов электрофореза выявляют лишь большое количество моноклонального Ig (не менее 500 мг/л). К более эффективным методам относится иммунофиксация, чувствительность которой составляет приблизительно 150 мг/л. Но возможности этого метода также существенно ограничены при диагностике олигосекреторных вариантов МКГП, таких как MGUS, включая первичные формы AL/AH-амилоидоза, который в 42% характеризуется МКГП только из свободных ЛЦ [5]. В целом методом иммунофиксации можно обнаружить лишь половину случаев MGUS (A.R. Bradwell, 2006).
Основные проблемы в диагностике MGUS связаны с трудностями выделения моноклональных белков среди поликлональных. Кроме того, независимо от типа основного моноклонального Ig аномальный клон лимфоплазматических клеток, как правило, синтезирует определенные количества свободных ЛЦ, которые принадлежат одному из типов — k или l, т. е. также характеризуются моноклональностью. Чтобы обнаружить свободные ЛЦ, нужно уметь отличать их от ЛЦ, связанных с ТЦ в составе интактных Ig. В настоящее время появился метод нефелометрического определения свободных ЛЦ, основанный на антителах к скрытым эпитопам Л.Ц. Метод лицензирован под названием Freelite. Важным достоинством метода является возможность проводить количественную оценку продукции ЛЦ. В результате сформулированы критерии абсолютной нормы продукции свободных ЛЦ, впервые появился чувствительный, технически несложный (нефелометрия) метод для мониторинга течения МКГП, в том числе олигосекреторных, сформулированы критерии молекулярной ремиссии ЛПКД.
Применение этого метода впервые позволило показать, что частота MGUS составляет 95% случаев всех МКГП [4]. В США метод включен в список скрининговых методов определения моноклональной секреции при первичном обращении больных наряду с традиционными общеклиническими методами исследования крови и мочи. Применение метода Freelite в рамках профилактических скрининговых программ показало, что МКГП и соответственно ЛПКД относятся к проблеме популяционного уровня, близкой по своей значимости к проблеме язвенной болезни, бронхиальной астмы и других широко распространенных заболеваний.
Изучение различных вариантов поражения почек, ассоциированных с МКГП, позволило рассматривать олигосекреторные МКГП как большую нефрологическую проблему.
Среди описанных в ассоциации с олигосекреторной МКГП форм поражения почек кроме AL/AH-амилоидоза и болезни отложения Ig наиболее известна тубулярная (цилиндровая) нефропатия, часто осложняющая течение множественной миеломы (у 50% больных), характеризующаяся образованием в просвете канальцев электронно-плотных цилиндров. Высокая продукция ЛЦ и соответственно их высокая концентрация в почечных канальцах в условиях резких колебаний содержания воды в процессе реабсорбции и изменений рН мочи являются факторами образования агрегатов ЛЦ в почечных канальцах. Большое значение в генезе цилиндровой нефропатии имеют также взаимодействие с белком Тамма—Хорсфалла, гиперкальциемия (вследствие остеолизиса, характерного для миеломы), инфекция мочевых путей, предшествующий интерстициальный фиброз. Агрегаты Л.Ц. и белка Тамма—Хорсфалла блокируют ток мочи, что приводит к острой почечной недостаточности. Эту форму нефропатии чаще всего именуют миеломной почкой.
Возможны и другие формы ассоциированной с MGUS тубулопатии. Хорошо известно, что ЛЦ способны подвергаться реабсорбции и кристаллизации в цитоплазме канальцевого эпителия с развитием различных дисфункций канальцев — парциальных или по типу синдрома Фанкони. Кристаллизация Л.Ц. является фактором трансформации канальцевого эпителия в клетки макрофагального ряда с развитием гистиоцитоза (рис. 1). Однако следует отметить, что такая кристаллизация происходит во многих тканях и связана с тем, что лизосомальный аппарат резидуальных макрофагов оказывается неспособным полностью лизировать ЛЦ. У пациентов в этом случае нередко развивается генерализованный гистиоцитоз. Способность канальцевого эпителия почек трансдифференцироваться в клетки макрофагального ряда хорошо известна, это свойство является важным механизмом фиброза в почках у больных с протеинурией. Способность к трансдифференциации, по-видимому, связана с единством происхождения канальцевого эпителия и макрофагов из одного и того же эмбрионального листка — мезодермы.

Высокая частота поражения канальцев с развитием острой почечной недостаточности у больных миеломой позволила многим исследователям использовать термин канальцевая «нефротоксичность ЛЦ». Однако в настоящее время накоплено достаточно данных о более широком спектре патологических эффектов ЛЦ, часто без канальцевой нефротоксичности и без развития ургентных состояний. Поэтому более правильно применять термин «патогенность ЛЦ».
Как и при амилоидной, при неамилоидной депозиции ЛЦ (БОЛЦ) в почках поражаются клубочки, в связи с чем нередко (у 40% больных) наблюдают развитие протеинурии нефротического уровня, как это бывает при амилоидозе [6]. Однако можно предположить, что амилоидный тип депозиции ЛЦ позволяет «замыкать» агрессивную биохимическую активность ЛЦ внутри амилоида, в результате чего при амилоидозе почечная недостаточность развивается позже, чем при БОЛЦ. В отличие от амилоидоза при БОЛЦ образуются гранулярные депозиты с генерализованным поражением базальных мембран — внутриклубочковых и перитубулярных. Уремия у пациентов с БОЛЦ развивается в среднем в течение 3 лет, а через 5 лет уремию диагностируют почти у 2/3 больных [6]. Как и амилоидоз, БОЛЦ является системным заболеванием с поражением сердца (у 21% больных), печени (у 19%), селезенки (у 8%), периферической нервной системы (у 8%). Следовательно, болезнь представляет собой общетерапевтическую проблему и, по-видимому, распространена более широко, чем принято считать, ввиду высокой частоты выявления MGUS в популяции, а также экспериментальных данных, свидетельствующих, что моноклональные ЛЦ реализуют свои патогенные свойства в 85% случаев [7, 8].
Как показано ранее для моноклональных Ig [9], патологические эффекты ЛЦ связаны с исходными свойствами самих ЛЦ. В настоящее время имеются надежные экспериментальные данные о различных эффектах разных типов Л.Ц. Так, по свидетельству J. Teng и соавт. [9], амилоидогенные ЛЦ подвергаются эндоцитозу мезангиальными клетками с последующим слиянием нагруженных ЛЦ эндосомальных вакуолей и лизосом. При этом мезангиоцит приобретает молекулярные маркеры (CD68) макрофагов. Но именно внутримакрофагальное взаимодействие различных белков — предшественников амилоида с лизосомальными ферментами приводит к синтезу ускоряющей амилоидоз субстанции, которая служит главным фактором активации амилоидогенеза в тканях. Установлено, что ЛЦ при БОЛЦ не подвергаются эндоцитозу и остаются фиксированными на мембране мезангиоцита (рис. 2). При этом мезангиоцит экспрессирует молекулярные маркеры (α-гладкомышечный актин и др.), характерные для миофибробласта, и становится продуцентом внеклеточного матрикса (фиброза) в почке, что при БОЛЦ сочетается с синтезом тенасцина, закрепляющего необратимость фиброза почки.

В некоторых случаях эндоцитоз ЛЦ завершается образованием параллельных рядов микротубулярных структур в цитоплазме мезангиоцита, которые в отличие от амилоидной фибриллы, имеющей толщину 10 нм, характеризуются бо́льшим диаметром (30—40 нм) и не обладают свойством двойного лучепреломления. Клинические проявления этого так называемого иммунотактоидного, или микротубулярного, нефрита напоминают проявления обычно тяжелых мезангиальных форм ГН (выраженная протеинурия, эритроцитурия, артериальная гипертония, нередко почечная недостаточность). Уже в дебюте иммунотактоидный ГН отличается неблагоприятным течением с возможностью быстрого формирования «полулуний».
Существует еще одна своеобразная форма гломерулопатии, ассоциированная с MGUS, — фибриллярная нефропатия. Однако при фибриллярной нефропатии молекулярной основой фибрилл, близких по электронно-микроскопической структуре амилоиду, но не обладающих двойным лучепреломлением при окраске конго красным, являются поликлональные IgG, по-видимому, в соединении с коллагеном. Поликлональность Ig, который подвергается отложению, указывает на очень сложный патогенез в данном случае, при этом роль МКГП остается невыясненной.
Обсуждая механизмы поражения почек при МКГП, следует также обратить внимание, что моноклональные Ig могут быть и факторами иммунной агрессии. Ярким примером этого механизма является криоглобулинемический васкулит, при котором криоглобулинемия служит прогностическим фактором развития МКГП. Аутоиммунные патогенные свойства криоглобулинов формируются и проявляются клинически задолго до развития моноклональной В-клеточной опухоли. Тем не менее наличие моноклонального компонента в составе криоглобулина помогает обосновать подходы к лечению этой патологии, в частности анти-CD20-агентами (ритуксимаб).
Кроме того, существуют многочисленные описания различных морфологических форм ГН, ассоциированных с MGUS, — мезангиопролиферативного, мезангиокапиллярного, мембранозного. Связь нефрита с MGUS доказывается в этих случаях отложением в структурах почки (клубочках) моноклональных иммунных комплексов, идентичных Ig в составе МКГП.
Однако на примере мезангиокапиллярного ГН показано, что причинно-следственная ассоциация нефрита с МКГП не всегда сопровождается отложением моноклональных Ig в клубочках. Моноклональные Ig, в первую очередь ЛЦ, могут взаимодействовать с антигенными детерминантами С3-конвертазы, что блокирует механизмы элиминации активированных компонентов комплемента и запускает альтернативный путь активации комплемента с реализацией эффекторных механизмов мембраноатакующего комплекса. В этом случае в биоптате почки обнаруживают только депозиты комплемента, но не выявляют моноклональные Ig. При этом для доказательства связи нефрита с МКГП необходимо использовать нестандартные методы протеомного анализа. В частности, для получения собственно депозитов компонента С3-комплемента необходимо использовать лазерную микродиссекцию (под контролем микроскопа) с последующим анализом полученного материала методом матриксной лазерной десорбции/ионизации (MALDI-TOF), способной идентифицировать разные белки в материалах неизвестного состава. Имеются наблюдения, в которых применение комбинации этих методов позволяло выявлять ассоциацию моноклональных ЛЦ с компонентами депозитов С3-комплемента. Все описанные наблюдения такой ассоциации МКГП и нефрита демонстрировали на светооптическом и электронно-микроскопическом уровне мезангиокапиллярный нефрит с электронно-плотными депозитами.
Таким образом, в настоящее время хорошо обосновано, что МКГП являются важнейшим прогностически значимым фактором развития заболеваний почек, в том числе Г.Н. Выявление связи нефропатии с олигосекреторной гаммапатией имеет принципиальное значение, так как лечение таких больных обусловливает необходимость применения особых схем химиотерапии, направленных на элиминацию патологического клона лимфоцитов или плазмоцитов. Без элиминации этого клона органное поражение будет рецидивировать с развитием органной недостаточности. Принципы такой терапии в настоящее время хорошо отработаны на примере AL-амилоидоза, показали свою эффективность и относительно низкую токсичность.
Следует также напомнить, что проблема МКГП пока недостаточно исследована в кардиологии и других областях клинической медицины.