Моноклональные антитела и гибридомы что это такое
Моноклональные антитела: исследования и применение
Когда в организм попадает чужеродный белок или бактерия, запускается система защиты – иммунный ответ. Это В-лимфоциты, которые начинают синтезировать белки, узнающие какой-либо участок чужеродного белка. А моноклональные антитела – это антитела, вырабатываемые иммунными клетками, принадлежащими к одному клеточному клону. Они узнают один конкретный участок патогена, известный нам, и воздействуют на него. То есть это не смесь антител, которые вырабатывает организм множеством В-клеток в ответ на патоген, а только один конкретный вид, способный узнавать один конкретный эпитоп, например участок домена определенного клеточного рецептора.
Открытие моноклональных антител
Моноклональные антитела были открыты в 1975 году Жоржем Кёлером и Сезаром Мильштейном. Они опубликовали статью, посвященную разработке гибридомного метода. Ученые смогли слить B-лимфоциты, синтезирующие антитела, с клетками миеломы (раковыми клетками) с использованием полиэтиленгликоля или вируса Сендай. Таким образом ученые получили гибридому, обладающую свойствами как раковой клетки (способность делиться большое количество раз), так и B-лимфоцитов (синтез антител). А дальше определенными многостадийными этапами селекции они отделили клетки, синтезирующие необходимое антитело.
Основой для создания терапевтических моноклональных антител являются иммуноглобулины подкласса G1 человека, поскольку этот вид антител обладает рядом преимуществ, одно из которых – наибольший период полувыведения из крови. После введения в организм иммуноглобулины подкласса G1 живут вплоть до трех недель. Это очень важно, ведь для терапии самое главное – чтобы лекарство находилось в организме пациента как можно дольше.
Соответственно, все антитела гуманизируют, чтобы организм человека их не отторгал. Несмотря на существование общих систем лечения, бывают ситуации, когда ученым необходимо искать новый подход к лечению патологии. Все индивидуально. Например, для конкретного человека полученное антитело может являться аллергическим агентом или в организме возникает устойчивость к нему. При таких проблемах на помощь могут прийти системы получения антител в растениях, поскольку за неделю-две можно получить желаемые антитела, что гораздо больше времени займет на системах с животной клеткой. Мы знаем последовательность, кодирующую определенное антитело, затем создаем конструкцию и инфильтрируем ее в растение с помощью агробактерии.
Табак и антитела
Свои исследования мы проводим на растении Nicotiana benthamiana (австралийский табак). Поскольку большое количество растительных патогенов способно заразить его, оно широко используется в вирусологии, благодаря чему хорошо изучены и разработаны различные векторные системы продукции целевых белков на основе вирусов растений.
В наших исследованиях мы используем векторы на основе вирусов растений. Один из них – это вирус табачной мозаики (ВТМ), широко известный и полностью изученный, а другой – это Х-вирус картофеля (ХВК). Мы используем их, чтобы доставлять гены, кодирующие антитела, в растительную клетку. После чего растительная клетка синтезирует с этих векторов белки, которые собираются в растении в полноразмерные антитела. Затем мы выделяем их на специальных колонках, которые используют во всех методах очистки антител.
Важно понимать, что стадия очистки антител, полученных в растениях, не отличается от тех, которые используют на животных клетках. В принципе, получение моноклональных антител в животных клетках и растениях сопоставимо по времени – разница в биобезопасности. Препараты, которые получают в животных клетках, могут заразить человека вирусами животных или прионами.
Человек не может заразиться от растений. Во-первых, для нас их вирусы не опасны. Во-вторых, растениям не нужны питательные среды, которые имеют риск внесения контаминации разными агентами, опасными для человека. Это главные тезисы, которыми мы оперируем, защищая нашу теорию о том, что растения прекрасно подходят для синтеза антител. Но даже если принимать во внимание, что использование моноклональных антител не дойдет до терапии, все же они широко применяются в различных видах диагностики. Помимо медицины, антитела используются также в молекулярной биологии как способ детекции целевого белка и в химии как способ очистки или выделения также белка или полисахарида.
Применение моноклональных антител в борьбе с раком
До недавнего времени мы работали только с аналогом трастузумаба – антитела, предназначенного для лечения HER2-позитивного рака молочной железы. Оно узнает четвертый домен этого рецептора и взаимодействует только с ним, останавливая пролиферацию клеток.
Однако хорошо известны случаи приобретения устойчивости к трастузумабу (коммерческое название – герцептин) у пациентов. Он продается в аптеках и используется в терапии рака молочной железы во всем мире. Решая эту проблему, ученые разработали еще одно антитело к этому рецептору, но взаимодействующее со вторым доменом – доменом димеризации. Его назвали пертузумаб (коммерческое название – перьета). И мы поставили перед собой задачу синтезировать это антитело. Суть терапии заключалась в том, что перьету добавляли к герцептину и их использование помогало избежать устойчивости рака только к герцептину. Только так они замедляли рост ракового образования и пролиферации клеток.
Мы озадачились темой получения пертузумаба в растениях. Для начала мы зашли в общедоступный сервис, который называется Drug Bank. В нем размещена база данных всех известных препаратов, последовательности аминокислот тех белков, которые используются в различных медицинских направлениях. В том числе в Drug Bank мы нашли последовательности пертузумаба (перьеты). Осталось лишь адаптировать ее под синтез в растении, используя интернет-ресурс для оптимизации кодонного состава. Конечно, нуклеотидная последовательность будет разной для растительной клетки и для животной, но в результате мы получаем одну и ту же аминокислотную последовательность. После того как мы получили оптимизированную нуклеотидную последовательность, мы синтезировали нуклеотидный код и вставили в вектора, которые в дальнейшем использовали для синтеза антител в растении.
Перспективы исследования моноклональных антител
Иногда возникают такие ситуации, как, например, с вирусом Эбола: патоген стремительно распространяется, заражая людей и подводя их к смерти. Что касается тестирования препаратов на людях, то известно, что во время вспышки геморрагической лихорадки Эбола в Западной Африке была острая необходимость победить болезнь как можно раньше. И в этом случае сработали антитела, которые частично получали в растениях. Это ZMapp. Его смогли использовать в качестве лекарственного средства и ввели семи больным, хотя его безопасность ранее не была проверена в тестировании на людях. У пяти пациентов состояние значительно улучшилось, и болезнь отступила. Сейчас, после удачной экстренной помощи больным, были начаты систематические исследования биобезопасности и эффективности лечения (фазы I/II) препаратом ZMapp. Хотелось бы, чтобы возможность использовать антитела, полученные в растениях, возникала не при подобных обстоятельствах. Поэтому мы будем продолжать работать над тем, чтобы полностью избавиться от сомнений в использовании антител, синтезированных в растительной клетке.
Автор – кандидат биологических наук, научный сотрудник лаборатории генетического контроля устойчивости к стрессам Института общей генетики им. Н. И. Вавилова РАН.
Краткая история открытия и применения антител
Больше 100 лет понадобилось ученым, чтобы разобраться в строении и свойствах антител и научиться их использовать при лечении различных заболеваний.
Авторы
Редакторы
Антитело — это молекула, без которой невозможно представить современную науку и медицину. Она играет ключевую роль как во многих методиках экспериментальной науки, так и при диагностике различных заболеваний. Лекарства на основе антител изменили облик фарминдустрии и продолжают будоражить мир всё новыми и новыми перспективами. Между тем, эта область знаний проделала сложный и увлекательный путь, в котором рука об руку шли фундаментальная и прикладная науки, над которой работали гениальные исследователи и где совершались воистину великие открытия. Мы расскажем об основных вехах изучения антител, а также об их применении в медицине и науке. Данная статья открывает цикл работ, посвященных моноклональным антителам.
Терапевтические антитела
Спецпроект об антителах, истории их изучения, методах работы с ними, а также о применении антител в современной медицине и биотехнологии.
Партнер спецпроекта — Департамент вычислительной биологии одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Глава 1. Краткая история открытия антител: от XIX века до наших дней
Начало: история разработки сыворотки против дифтерии
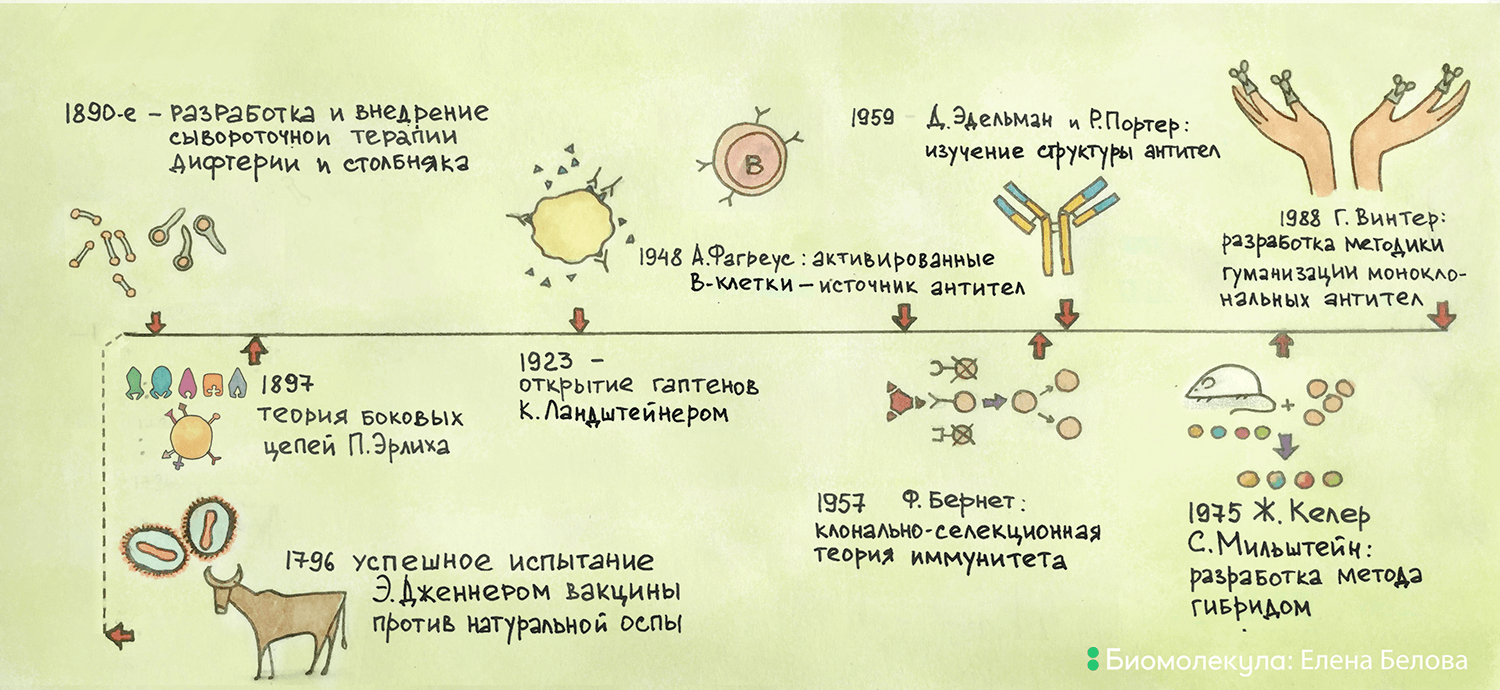
Ко второй половине XIX века в зарождающейся науке иммунологии накопилось достаточно данных об иммунизации — способности организма противостоять возбудителю заболевания при повторной встрече с ним. Знаковую роль здесь сыграла разработка Эдвардом Дженнером и широкое распространение первой эффективной вакцины против натуральной оспы в конце XVIII — начале XIX веков. Дженнер использовал содержимое пустул больных коровьей оспой, неопасной для людей, для получения иммунитета против натуральной оспы (рис. 1). Вкратце с этой историей можно познакомиться на сайте «История медицины».
Рисунок 1. Основные вехи истории открытия и применения антител.
Со временем пришло понимание, что вещества иммунизированного организма, помогающие ему не заболеть при повторном контакте с возбудителем заболевания, содержатся в жидкой части крови — сыворотке. Сыворотку можно вводить в организм, никогда с возбудителем не контактировавший, и добиваться его защиты на некоторое время, а также вылечить уже больной организм!
В 1888 году Эмиль Ру и Александр Йерсен открыли растворимый токсин дифтерийной палочки. Иммунизация лабораторных животных данным токсином приводила к образованию вещества, обезвреживающего его — так называемого антитоксина, который составлял действующую основу сыворотки. Важным моментом стало понимание того, что иммунный ответ направлен не на микроорганизм в целом, а на его часть — будь то растворимое секретируемое вещество или элемент структуры. Позднее термин «токсин» сменился на более широкий термин «антиген», а «антитоксин» — на «антитело».
В 1890 году вышел в свет совместный труд немецкого врача-исследователя Эмиля Адольфа фон Беринга (рис. 2) и японского исследователя-микробиолога Китасато Сибасабуро «О развитии иммунитета против дифтерии и столбняка у животных», в котором они показали, что сыворотка крови кроликов, инфицированных столбнячной палочкой, способна защитить мышей от живых столбнячных бацилл и столбнячного токсина. Через неделю Беринг опубликовал статью об аналогичных защитных свойствах сыворотки крови морских свинок, иммунизированных инактивированными возбудителями дифтерии и дифтерийным токсином. Свою работу Беринг завершил довольно громким заявлением: «Таким образом, возможность лечения даже самых тяжелых заболеваний больше не может быть проигнорирована».
Рисунок 2. Фотопортрет Эмиля Беринга (1854–1917).
Приведенные выводы вызвали общественный резонанс. Столбняк — заболевание с контактным путем передачи и высокой летальностью — являлся в то время частой причиной смерти детей и военнослужащих (к слову, бóльшую обеспокоенность вызывало последнее, несмотря на факты и статистику). Вопрос дифтерии также стоял достаточно остро. Отсутствие эффективных методов ее лечения приводило к тому, что практически каждый двадцатый ребенок в Европе и США умирал от этой болезни.
В январе 1892 года Беринг начал первое исследование антидифтерийной сыворотки на людях. Старт был дан в рождественскую ночь 1891 года, когда маленькой умирающей девочке в хирургическом отделении Берлинского детского госпиталя Бергманна произвели первую инъекцию спасительной сыворотки.
Технология, однако, имела ограниченный потенциал для проведения больших исследований, повысить который Берингу удалось в сотрудничестве с Паулем Эрлихом. Для получения сыворотки ученые начали использовать вместо кроликов более крупных животных (лошадей), благодаря чему удавалось получать бóльшее количество сыворотки. Кроме того, методика иммунизации стандартизовали и, соответственно, она стала пригодной для проведения клинических исследований.
В первых крупных наблюдениях, опубликованных в 1894 году, приведены результаты по лечению «чудо-сывороткой» 220 детей, из которых выжили целых 77% — невиданная для тех лет цифра. Если лечение начиналось в первые два дня, то выживаемость стремилась к 100%, если же на шестой день — успех ожидался лишь в 50% случаев. Совершенствуя сыворотку, Берингу удалось снизить смертность до 1–5% в случае своевременной диагностики заболевания.
Беринг считал свою сыворотку абсолютно безвредной, но, к сожалению, это было не совсем так. В 1896 году здоровому ребенку, который имел контакт с домработницей, заболевшей дифтерией, с профилактической целью была введена сыворотка. В ответ на это у мальчика развился анафилактический шок, и ребенка спасти не удалось. Волей судьбы, отец мальчика оказался известным патологоанатомом, который позднее задокументировал этот первый летальный случай, связанный с введением сыворотки.
Середина: селективная теория «боковых цепей» Пауля Эрлиха
В 1896 г. Грубер и Дархэм открыли феномен агглютинации бактерий, а в 1897 г. Крауз описал реакцию преципитации (образования комплекса) между антигеном и антителом, что дало возможность качественно и количественно изучать реакцию «антиген—антитело». Этим занялся Пауль Эрлих, выдающийся немецкий ученый, врач, микробиолог, один из основоположников иммунологии и химиотерапии (рис. 3). Эрлих разработал принцип количественного определения антител и антигенов методом титрования, что сейчас является необходимым условием стандартизации, а также заложил основы понимания специфичности взаимодействия антиген—антитело. Кроме того, в своей работе 1897 года «Измерение активности дифтерийной сыворотки и её теоретические основы» Пауль Эрлих впервые озвучил гипотезу образования антител, получившую название теории «боковых цепей» (рис. 4) [2].
Рисунок 3. Фотопортрет Пауля Эрлиха (1854–1915).
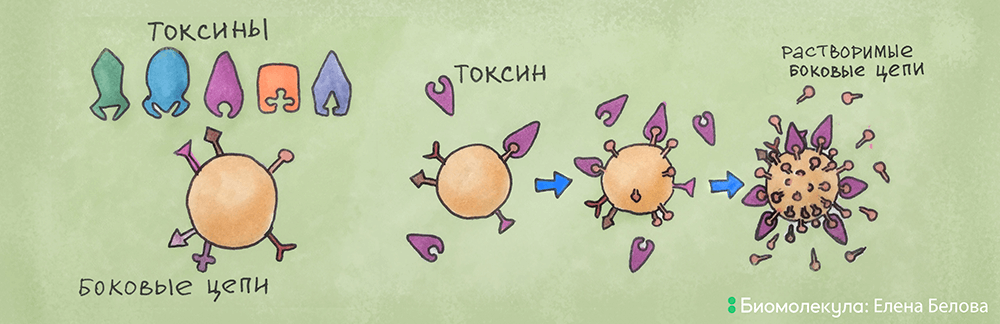
Эрлих полагал, что антитело — это особый вид молекул, расположенных в виде рецепторов («боковых цепей») на поверхности клеток. Боковые цепи благодаря своей особой конфигурации, комплементарной (то есть полностью соответствующей ей) молекуле антигена, способны взаимодействовать с ней по принципу «ключ—замок», причем необратимым способом. Это взаимодействие специфическое, а на поверхности клеток исходно существует некий репертуар таких «боковых цепей». Антиген же способен отбирать специфичные ему рецепторы, которые далее открепляются от поверхности клетки, циркулируют в крови в поиске «своего» антигена и в конечном счете инактивируют его.
Простая и лаконичная теория Эрлиха быстро была подхвачена научными кругами, надолго определив вектор иммунологической мысли. Тем не менее через пару десятилетий в ней обнаружили бреши. Неразрешенные вопросы в первую очередь касались специфичности образующихся антител, так как со временем обнаружили, что антитела вырабатываются не только против возбудителей заболеваний, но и против безвредных веществ, в том числе собственных молекул организма и даже небольших химических соединений.
Рисунок 4. Теория «боковых цепей». На иммунной клетке присутствует репертуар боковых цепей, с которыми взаимодействует токсин по принципу «ключ—замок». Данное взаимодействие приводит к синтезу большого количества боковых цепей определенной специфичности, которые открепляются от поверхности в виде растворимых боковых цепей, циркулируют по кровотоку и нейтрализуют токсин.
Большой вклад в изучение репертуара антигенов внес Карл Ландштейнер. В начале ХХ века он показал существование антител к собственным антигенам организма — белкам на поверхности эритроцитов — и таким образом открыл существование групп крови, за что был удостоен Нобелевской премии (1930) [3]. А в 1923 году Карл Ландштейнер открыл гаптены — класс низкомолекулярных соединений, иммунный ответ на которые не вырабатывается. Если же такое соединение связывалось с собственными белками организма (например, альбумином в крови или рецепторами на поверхности клеток), то на подобный комплекс начинали образовываться антитела.
Выработки антител можно было достичь и к откровенно «искусственным» соединениям, встреча с которым в природе полностью исключена — так, Ландштейнер получил антитела к динитрофенилу. Стало понятно, что о предсуществовании хоть и разнообразного, но заведомо ограниченного репертуара антител не могло идти и речи. Интуитивно понятным становилось предположение, что живой организм способен каким-то образом «прочитывать» структуру антигена и далее синтезировать комплементарные ему антитела. Заметим, что структуру молекулы ДНК расшифровали лишь в 1953 году, а центральную догму молекулярной биологии «ДНК → РНК → белок» Фрэнсис Крик предложил только в 1958 году, поэтому развитие иммунологии до этого времени было заторможено незнанием принципа синтеза белковой молекулы. Считалось, что белки синтезируются на белковой матрице (что, конечно, оказалось совсем не так), и что уникальность матрицы определяет уникальность первичной структуры синтезируемого белка. Сходным образом должен был происходить и синтез антител, в процессе которого в качестве матрицы выступал антиген: антитела синтезировались прямо на его поверхности — аминокислоты сшивались в цепочку, комплементарную конформации антигена. Подобные представления о происхождении специфичности антител носили название матричных теорий.
Позднее получили данные, свидетельствующие в пользу того, что антитела имеют довольно схожую белковую природу. Компромисс был достигнут в теории Лайнуса Полинга и Дэна Кемпбелла. Они полагали, что до встречи с антигеном в организме синтезируются «протоантитела» в виде коротких белковых цепочек. После контакта с антигеном эти цепочки приобретают специфичность и далее сшиваются с помощью дисульфидных связей в двухвалентное антитело.
Конец: клонально-селекционная теория
Матричные теории ничего не говорили о продукции антител. Тем временем науке стали известны некоторые фенóмены, которые трудно объяснялись матричными теориями, такие как иммунологическая память (способность при повторном контакте с антигеном отвечать более быстрым, сильным и специфичным образованием антител) и иммунологическая толерантность (способности не реагировать на собственные антигены). Все эти феномены предполагали наличие более тонкого механизма, чем логичные и механистические матричные теории.
В 1948 году шведская исследовательница Астрид Фагреус показала, что источником антител являются активированные В-лимфоциты — плазматические клетки [4], а спустя год, в 1949 году, австралийский вирусолог Фрэнк Бёрнет (рис. 5) совместно с Фрэнком Феннером издал монографию «Продукция антител», где впервые выдвинул гипотезу непрямой матрицы. Согласно ей, антигены способны изменять структуру РНК (наиболее вероятную матрицу для синтеза белка) в антиген-продуцирующих клетках, что приводит к синтезу специфических антител. В теории было немало «белых пятен» — например, оставался абсолютно неясен механизм изменения структуры РНК.
Рисунок 5. Фотопортрет Фрэнка Бёрнета (1899–1985).
В 1955 году Нильс Ерне выдвинул так называемую теорию естественного отбора [5]. Продолжая традиции Эрлиха, Нильс Ерне считал, что в организме действительно синтезируется полный набор антител, но не в большом количестве. Антитела эти свободно циркулируют по организму, создавая «естественный фон». Задача антител — специфически связываться с антигенами и доставлять их клеткам-продуцентам антител, которые далее в большом количестве начинают воспроизводить высокоспецифичные антитела.
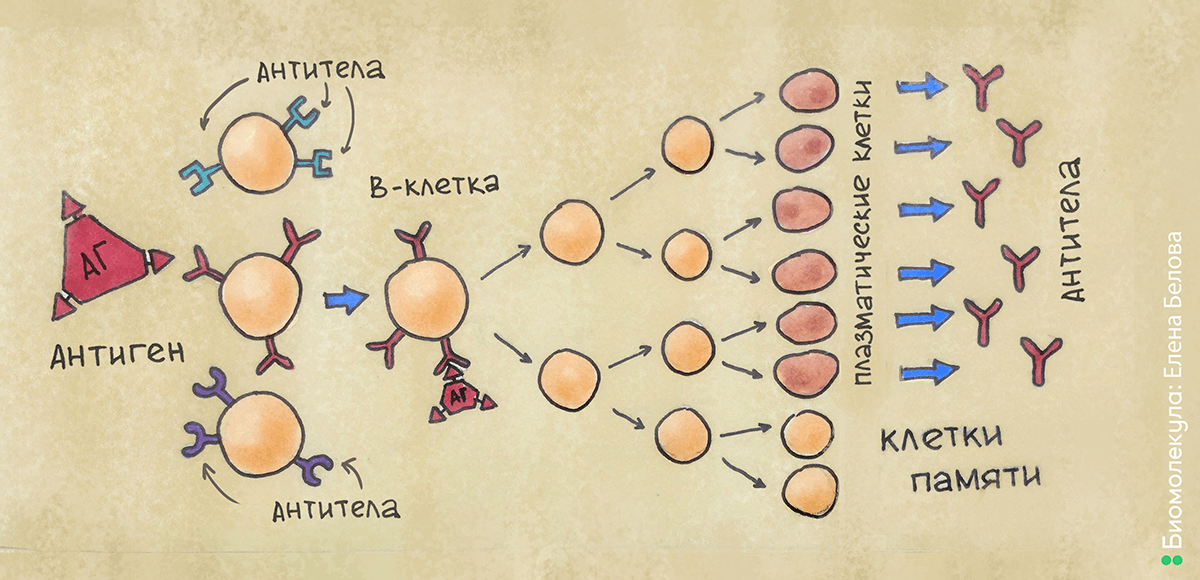
Под влиянием теории Ерне, в 1957 году Фрэнк Бёрнет сформулировал клонально-селективную теорию [6], [7]. Согласно ей, на мембране антитело-продуцирующих клеток в виде рецепторов располагаются предшественники антител, причем одной и той же специфичности. Попадая в организм, антиген распознается специфическим рецептором на поверхности антитело-продуцирующей клетки, которая начинает очень интенсивно делиться, образуя клон из фактически одинаковых клеток (принцип «клональности»). После созревания клетки-клоны начинают вырабатывать антитела, сходные по структуре с рецептором на поверхности клетки-родоначальницы клона. В организме образуется не один такой клон — происходит постоянный отбор наиболее «успешных» клонов, повышается специфичность вырабатываемых антител (принцип «селекции») (рис. 6). Как это часто бывает, оригинальная теория была принята не сразу и не всеми — потребовались годы накопления подтверждающих данных. Одним из неоспоримых доказательств явилась разработанная позже технология получения моноклональных антител — метод гибридом.
Рисунок 6. Клонально-селекционная теория. Попадающий в организм антиген связывается с подходящим по структуре рецептором на поверхности В-клетки. В-клетка активируется и многократно делится, формируя клон. Далее, после созревания, клетки начинают вырабатывать антитела, сходные по структуре с рецептором, — таким образом, они способны связываться с антигеном и нейтрализовать его.
Глава 2. Разработка метода гибридом: Нобелевская премия, проблемы с патентованием и гнев Маргарет Тэтчер
Иммунологические технологии сулили прямо-таки баснословные перспективы для науки и практики. Но для реального появления этих технологий требовалось научиться получать высокоспецифичные антитела в больших количествах. Путем иммунизации животных очищенными антигенами можно достичь определенного успеха, повысив специфичность получаемых антител. Однако в ответ на введение даже одного антигена в организме образуется целый спектр антител с разной степенью специфичности и прочности связывания с антигеном. Иммуногенностью в антигене обладают так называемые детерминантные группы, которых в антигенах белковой природы может быть до 15. Но даже для одной детерминантной группы в организме вырабатываются, как правило, различные антитела. В соответствии с основным постулатом клонально-селекционной теории, основа данного разнообразия антител кроется в разнообразии образующихся антитело-продуцирующих клеток. Бесспорно, наличие такого разнообразия — это огромный плюс: в ходе иммунного ответа организм может выбрать синтез самых эффективных антител.
Для того чтобы получить идентичные высокоспецифичные антитела, необходимо отобрать нужный клон антитело-продуцирующих клеток и культивировать его в лабораторных условиях. В итоге мы получим моноклональные («из одного клона») антитела. Одной из практических сложностей на пути к получению моноклональных антител таким способом является конечный срок жизни клеток, производящих антитела. Чтобы получить постоянный источник моноклональных антител, нужно каким-то образом «обессмертить» их.
Неожиданно на помощь пришли опухоли, а именно плазмоцитомы. Такие опухоли происходят из антитело-продуцирующих клеток (плазмоцитов) и способны синтезировать моноклональные антитела. У плазмоцитом по сравнению с обычными антитело-продуцирующими клетками есть огромное преимущество — они бессмертны, а значит их можно культивировать в лаборатории практически неограниченное время, «наращивать» необходимое количество, хранить, делиться этой культурой с другими исследователями, прививать животным и т.д.
Но есть у плазмоцитом и существенный недостаток — мы не можем модулировать специфичность вырабатываемых антител путем иммунизации необходимыми нам антигенами. Можно собирать коллекции плазмоцитом, проверяя специфичность антител, но с учетом разнообразия антигенов и еще бóльшего разнообразия необходимых антител, занятие это крайне неблагодарное.
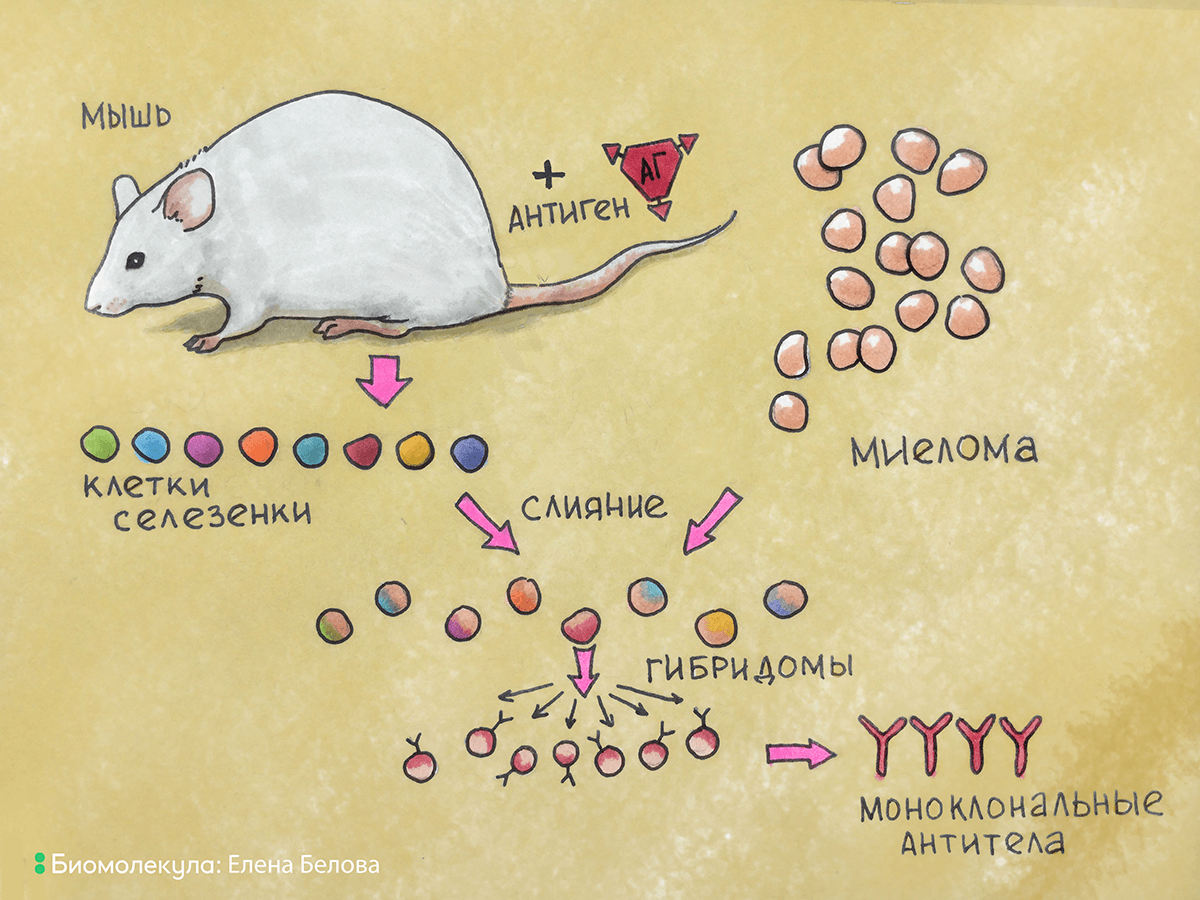
Как же совместить преимущества бессмертности культуры плазмоцитомы и индуцированной специфичности антитело-продуцирующей клетки? Слить их вместе! Слияние (гибридизация) соматических клеток в то время было известным и широко используемым исследователями методом. При слиянии клеток вначале образовывались двуядерные гибриды, при последующих же делениях хромосомы клеток смешивались и образовывали единое ядро. Так образовывались истинные гибриды, или гибридомы (рис. 7). Подробнее о методах получения гибридом рассказано в статье «Клеточные технологии» спецпроекта «12 методов биологии в картинках» [8].
Рисунок 7. Общая схема получения гибридомы. Из селезенки иммунизированной мыши выделяют антитело-продуцирующие клетки, которые сливают с клетками миеломы. В результате слияния образуются гибридомы, которые культивируют в специальной среде для селекции клеток гибридом, продуцирующих антитела.
Технологию производства гибридом, синтезирующих моноклональные антитела, разработали Сезар Мильштейн и Жорж Келер (рис. 8) в 1970-х годах. О том, как это происходит, можно прочитать в статье Гарри Израилевича Абелева «Моноклональные антитела» [9].
Рисунок 8. Фотопортреты Жоржа Келера (1946–1995) и Сезара Мильштейна (1927–2002).
Технология получения гибридом не была запатентована, и метод беспрепятственно и быстро распространился по многим лабораториям мира, катализировав развитие иммунологической отрасли. Метод гибридом положил начало целому семейству иммунологических технологий, о которых мы рассказывали в статье «Иммунологические технологии» спецпроекта «12 биологических методов в картинках» [10]. К слову, это был не просто отказ от патентования, а оплошность, причем с довольно громкими, в том числе и политическими, последствиями.
В то время в Великобритании поиском потенциальных биомедицинских продуктов для патентования занималась организация Medical Research Council (MRC), при этом не имеющая права патентовать сама; патентованием заведовала другая организация — National Research Development Corporation (NRDC).
В июле 1975 года Тони Викерс, агент MRC, приметил крайне заманчивую для коммерциализации технологию Мильштейна и попросил последнего отправить ему неопубликованный вариант статьи с описанием метода, в это время ожидавшей рецензии в журнале Nature. Викерс немедленно передал заявку в NRDC с вопросом о возможности получения патента, однако организация ничего не ответила. В августе 1975 г. в Nature вышла статья Мильштейна и Келера [11], и лишь в октябре 1976 года NRDC удостоила авторов ответом, в котором говорилось, что методика получения гибридом не может быть запатентована, так как была ранее опубликована в научном журнале.
Неспособность NRDC запатентовать технику Келера и Мильштейна стала предметом крупных споров в конце 1970-х годов. Подлила масла в огонь непростая экономико-политическая обстановка в Великобритании. Одним из самых яростных критиков отказа патентной организации стала Маргарет Тэтчер, химик по образованию, избранная премьер-министром в 1979 году. Гнев «железной леди» был многократно усилен известием о патентовании Хилари Копровски (главы американской компании «Вистар»), Карло Кроче и Вальтером Герхардом моноклональных антител против опухолевых антигенов, а позднее — антител против антигенов вируса гриппа. Это были первые патенты на технологию получения моноклональных антител. Не радовал английское правительство и тот факт, что в патентах компании «Вистар» моноклональные антитела были созданы с использованием линии клеток миеломы X63, которую в сентябре 1976 года Хилари Копровски предоставил сам Мильштейн.
Предоставление линии клеток соответствовало традиции многих ученых того времени. Немногочисленные требования к адресатам заключались лишь в том, чтобы они указывали в публикациях источник культур, спрашивали разрешение в том случае, если собирались передавать культуру третьим лицам, и отказывались патентовать какие-либо продукты, получаемые из культур этих клеток. И, как показала практика, в особенности последнее требование оказалось трудно выполнимо потому, что не было оформлено юридически.
Так или иначе, Мильштейн не испытывал горьких разочарований и однажды сказал докучавшему его журналисту: «Нет, я не был несчастен, Маргарет Тэтчер — была». Как и многие ученые того времени, Мильштейн рассматривал патентование со здоровой долей брезгливости и считал, что исполнил свой долг, отправив неопубликованную статью Викерсу в июле 1975 года. Позднее Мильштейн признался, что отсутствие патента было благословением, которое помогло ему плодотворно и свободно трудиться и делиться своими научными результатами. Как настоящий ученый, Мильштейн предпочитал не думать о том, что наличие патента сделало бы его миллионером. А в 1984 году труды Келера и Мильштейна отметили Нобелевской премией с формулировкой «за открытие и разработку принципов выработки моноклональных антител с помощью гибридом» [12].
Глава 3. Антитела на страже здоровья: применение в лабораторной и медицинской диагностике
Более века врачи и ученые работали над тем, чтобы сделать из антител «магическую пулю» — высокочувствительный, точный и эффективный препарат для лечения пациентов. Осуществлению этой мечты способствовало открытие и получение моноклональных антител, которые точечно взаимодействуют с заданным антигеном. Некоторые препараты на основе моноклональных антител смогли стать настоящим золотым стандартом лечения.
Однако лечение — не единственное, для чего моноклональные антитела могут использоваться на практике. Сегодня существует множество биодиагностических методов, использующих в качестве инструмента моноклональные антитела.
Проточная цитофлуориметрия
Проточная цитометрия — важная методика, которая позволяет получать комплексную информацию о множестве клеток за раз. С помощью этого метода можно узнать размер клетки, содержание ДНК или РНК и многие другие параметры. И если в прошлом проточные цитометры себе могли позволить только крупные академические центры, то сейчас такое оборудование есть уже во многих больницах общего профиля. Современные проточные цитометры стали намного меньше, дешевле и удобнее в использовании. «Биомолекула» подробно рассказывала об этой технологии в статье «Проточная цитофлуориметрия» спецпроекта «12 биологических методов в картинках» [13].
Немного объясним суть методики. Суспензия клеток предварительно метится моноклональными антителами, сшитыми со светящейся меткой, и помещается в поток жидкости, пропускаемый через проточную ячейку. Исследуемые клетки выстраиваются в цепочку и в таком порядке пересекают пучок световых (обычно лазерных) лучей, служащих для анализа каждой отдельно взятой клетки. Исходящий свет фокусируют при помощи оптической системы, а затем раскладывают на определенные компоненты. Полученные световые сигналы преобразуют в электрические импульсы и анализируют при помощи специального программного обеспечения. Таким образом, результат цитометрического анализа — определение состояния каждой клетки в образце с возможностью разделить образец на популяции клеток.
Спектр применения данной методики необычайно широк: ее используют в иммунологии, онкологии, цитологии, гематологии, фармакологии, сельском хозяйстве. В 1990-х годах, благодаря этому методу, осуществили сортировку индивидуальных хромосом, тетраном (гибридных гибридом, которые производят бифункциональные антитела) и др. Огромный толчок развитию проточной цитометрии дало открытие гибридомной технологии и, как следствие, получение моноклональных антител к большому количеству антигенов как на поверхности клеток, так и в цитоплазме. Большинство клинических применений проточной цитометрии осуществляется именно с помощью моноклональных антител. Так, получены коммерчески доступные антитела, которые позволяют определять поверхностные антигены лейкоцитов человека. Такие моноклональные антитела применяют для определения опухолей, лейкемий, диагностирования различных аутоиммунных заболеваний, исследования активации клеток иммунной системы: лимфоцитов, натуральных киллеров, моноцитов/макрофагов и др. [14].
Также важным шагом для изучения клеток стало получение моноклональных антител к различным фосфоэпитопам, поскольку информация о фосфорилировании белка нередко позволяет установить его функцию. Впервые фосфорилин-зависимые поликлональные антитела получили в 1981 году. Сейчас же наличие аналогичных, но моноклональных антител обеспечивает более эффективное изучение функционирования клеток. Также сейчас коммерчески доступны антитела, меченные различными флуоресцентными белками. Это позволяет исследователю использовать их таким образом, чтобы на меньшем объёме образцов получать о них максимальную информацию.
Иммуногистохимия
Еще одним важным диагностическим методом, в котором используются моноклональные антитела, является иммуногистохимия. На всех тканях, в том числе и опухолевых, содержатся молекулы, служащие мáркерами той или иной ткани или популяции клеток. Окрашивание среза ткани моноклональными антителами позволяет определить тип опухоли и подобрать необходимое лечение. Так же, как и в случае проточной цитометрии, метод гибридом позволил исследователям получить моноклональные антитела к различным тканевым и опухолеассоциированным антигенам, что способствовало широкому распространению метода иммуногистохимии. В XX веке иммуногистохимический анализ стали применять в диагностике онкологических заболеваний. Сегодня такой анализ зачастую является обязательным для подтверждения первичного диагноза, особенно если лечение требует использования дорогостоящих лекарств. И хотя иммуногистохимия существует около 50 лет, до сих пор данную процедуру довольно сложно стандартизировать. Поэтому крайне важным в этой методике является использование моноклональных антител, которые обладают низкой вероятностью перекрестного взаимодействия с другими белками и возникновения неспецифических сигналов.
Глава 4. Фармацевтическая «аллея славы»: как антитела заняли лидирующие позиции на рынке лекарственных препаратов
В 1985 году, спустя всего лишь год после вручения Келеру и Мильштейну Нобелевской премии за разработку методики получения моноклональных антител, FDA одобрило самое первое лекарство на основе мышиного моноклонального антитела — муромонаб, или OKT3 [15]. Свое название оно получило от сокращения его изначального длинного названия — MURine MONoclonal AntiBody targeting CD3, что переводится как «мышиное моноклональное антитело, распознающее CD3». Антитело взаимодействовало с особой молекулой CD3 на поверхности T-лимфоцитов, которая важна в том числе и для развития реакции отторжения трансплантированного органа (например, почки). Соответственно, блокируя CD3, можно добиться лучшего приживания органа в организме реципиента. Однако впоследствие у этого препарата выявилось множество побочных эффектов, которые были вызваны ответом иммунной системы пациента на чужеродные мышиные белки, поступающие в организм человека вместе с препаратом [16]. Поэтому следующим шагом стало получение моноклональных антител с сохранением наименьшего количества чужеродного для человека мышиного материала в препарате.
Сейчас практически все препараты основаны на так называемых химерных или гуманизированных антителах. В химерных антителах участки, которые непосредственно распознают антиген, имеют мышиное происхождение, а остальная (и бóльшая) часть антитела — человеческое. А в гуманизированных антителах доля мышиного материала еще меньше, и поэтому они еще реже вызывают негативные реакции со стороны организма пациента.
Помимо моноклональных, существуют также и другие типы антител [10]. Рассмотрим их поподробнее.
Лидирующие позиции на рынке пока остаются за классическими моноклональными антителами. По данным 2014 года, из 47 препаратов на основе моноклональных антител, одобренных и продаваемых на тот момент в США и Европе, 31 является полноразмерным моноклональным антителом [23]. Один препарат — это биспецифическое антитело, три — конъюгированные антитела, три — Fab-антитела и девять — Fc-слитые белки (табл. 1). Скорее всего, связано это с тем, что оптимизировать получение и функционирование генетически инженерных конструктов довольно сложно, хотя с каждым годом количество таких препаратов продолжает увеличиваться.
Известно, что по состоянию на 31 октября 2016 года на рынках США и Европы существует уже 71 препарат на основе моноклональных антител [25]. Также в 2010 году одобрили 10 новых препаратов для использования на территориях США и Европы. По состоянию на 1 декабря 2017 года девять терапевтических моноклональных антител проходят регуляционные тестирования, и сведения об их использовании станут известны в конце 2018 года. Также в конце 2018 года представят заявки на получение торговой лицензии еще 12 новых препаратов, из которых четыре предназначаются для лечения онкологических заболеваний.
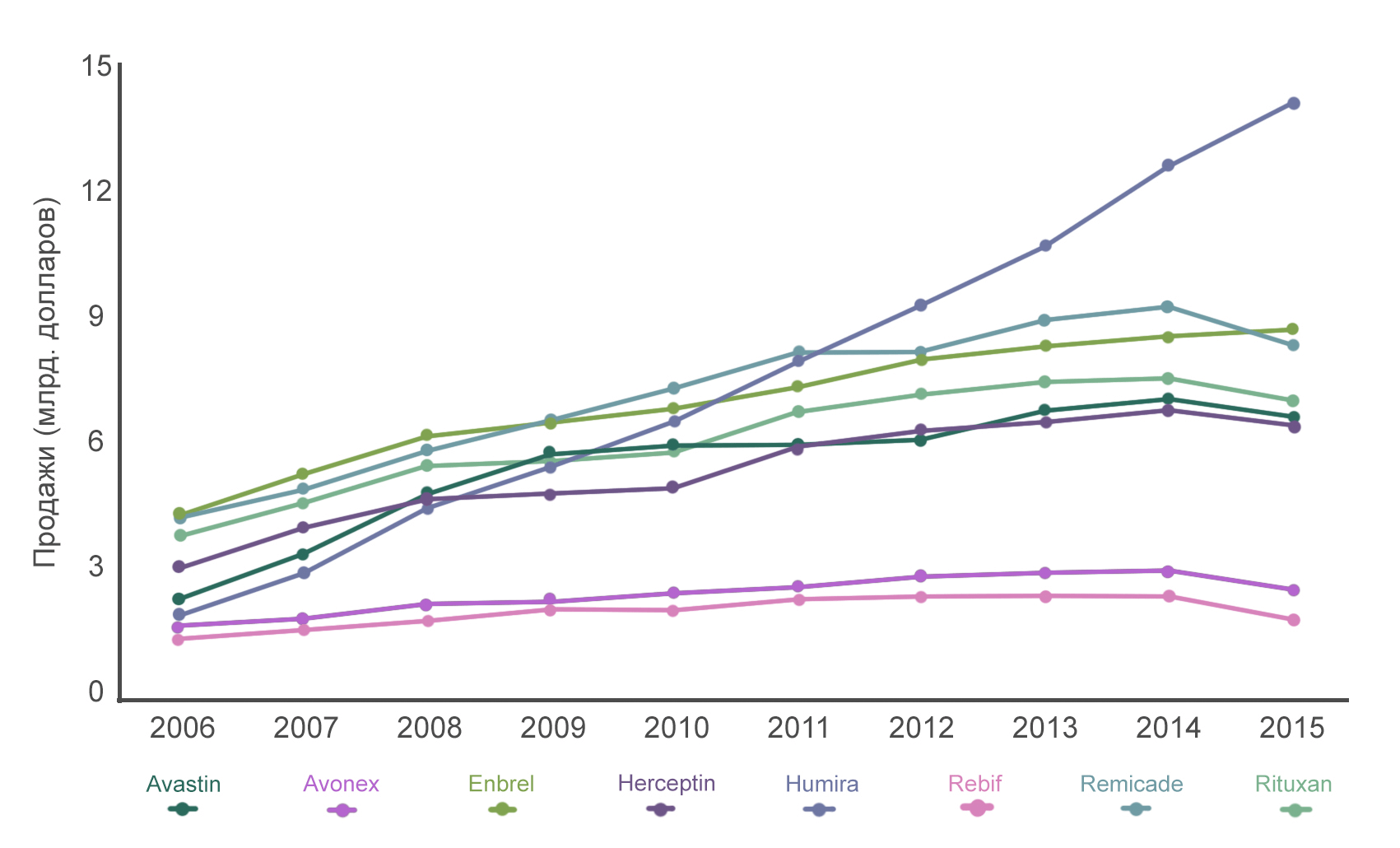
Humira, Remicade, Enbrel, Rituxan, Avastin и Herceptin являются шестью самыми продаваемыми препаратами на основе моноклональных антител (рис. 9). Расскажем поподробнее про каждый из них.
Классические методы лечения неходжкинской лимфомы, такие как химиотерапия и радиационная терапия, обладают высокой токсичностью, а также низкопецифичны в отношении опухоли, так как уничтожают большое количество здоровых клеток. Тогда как терапия антителами более избирательна и менее разрушительна для организма [27]. Получение ритуксимаба, менее агрессивного и более щадящего препарата, стало важной вехой развития медицины и позволило вывести лечение онкологических пациентов на качественно новый уровень. Именно поэтому в 1997 году ритуксимаб одобрили для лечения B-клеточной неходжкинской лимфомы, а в 2010 — в качестве поддерживающей терапии после первичного лечения фолликулярной лимфомы. Ритуксимаб находится в перечне основных лекарственных средств ВОЗ, в списке наиболее важных лекарств, необходимых в базовой системе здравоохранения. Для некоторых заболеваний (таких как гранулематоз с полиангитом и микроскопический полиангит) лечение ритуксимабом является единственным одобренным FDA. Ритуксимаб также активно используется в лечении ревматоидного артрита в комбинации с метотрексатом, что у половины пациентов приводит к улучшению симптомов в течение полугода. Если же пациенты принимают только метотрексат, то улучшение наблюдается лишь у 18%. «Авастин» (бевацизумаб) — моноклональное антитело, блокирующее работу эндотелиального фактора роста A (VEGF-A). В 1989 году Наполеон Феррара, молекулярный биолог, работавший в лаборатории корпорации Genentech, обнаружил молекулу VEGF (Vascular endothelial growth factor) — белок, который способствует росту сети кровеносных сосудов (ангиогенезу). В 1993 году Феррара показал, что блокирование работы VEGF специфическими моноклональными антителами приводит к резкому замедлению роста различных опухолей. Его исследования подтверждали ранее предложенную гипотезу Иуды Фолькмана, в которой говорилось, что остановка ангиогенеза может быть эффективным путем борьбы с опухолями, поскольку они начинают получать меньше питательных веществ и погибают. Стало понятно, что необходимо получить препарат, который будет блокировать молекулу VEGF. Это привело бы к ингибированию разрастания сети кровеносных сосудов вокруг опухоли, и та, не получая достаточного кровоснабжения, перестанет расти и метастазировать.
И вот, интенсивная работа исследователей принесла свои плоды — было получено несколько моноклональных антител, распознающих фактор VEGF-A. Каждое из этих антител связывалось с различными участками, или, говоря научным языком, эпитопами, молекулы VEGF-A [28], [29]. Но лишь одно антитело оказалось способным распознавать и нейтрализовывать все изоформы этой молекулы. На его основе и был разработан препарат бевацизумаб — первый клинически используемый ингибитор роста кровеносных сосудов. Важность и революционность данного препарата заключается в том, что до его получения не существовало лекарств, нацеленных на прямую борьбу с ангиогенезом. В 1997 году начали проводить первые клинические испытания «Авастина» (торговое название бевацизумаба), а в 2004 году в США было получено одобрение для использования этого препарата в комбинированной терапии по лечению метастатического рака толстой кишки.
Позже «Авастин» стали использовать для лечения и других опухолей. Добавление его к стандартной химиотерапии 5-фторурацилом увеличивает продолжительность жизни пациентов. Также применение «Авастина» совместно с 5-фторурацилом существенно удлиняет промежуток времени, в течение которого опухоль увеличивается до первоначальных размеров. И, самое главное, «Авастин» совместно со стандартной химиотерапией уменьшает размеры самой опухоли: 45% против 35%. «Герцептин» (трастузумаб) — это антитело, которое связывается с молекулой Her2/neu и блокирует ее. Если Her2/neu присутствует на клетках в избыточном количестве, это зачастую приводит к развитию рака молочной железы.
Возникает закономерный вопрос — почему рынок моноклональных антител столь популярен и быстро развивается? Дело в том, что сейчас антитела — одни из самых удобных и эффективных инструментов для решения различных биомедицинских проблем. Антитела, как правило, хорошо переносятся организмом человека и обладают высокой специфичностью к антигену, что снижает риск неожиданных осложнений в клинических испытаниях. Зачастую для многих фармацевтических задач моноклональные антитела являются первыми кандидатами на получение продукта, который можно относительно быстро проверить в клинических испытаниях. Если предварительные исследования клинической эффективности успешны, то такой инновационный препарат можно быстро коммерциализировать и вывести на рынок.
Также в целом происходит глобальный рост фармацевтического рынка, глобальный рост населения, а в странах с развитой экономикой наблюдается повышение уровня жизни — все эти факторы обеспечивают повышенный спрос на новые биопрепараты. В современных условиях существует запрос на получение большого количества относительно недорогих в производстве противоревматоидных и противоастматических средств, и с этой задачей как нельзя лучше могут справиться моноклональные антитела. С каждым годом биофармацевтическая промышленность растет и развивается, при этом появляется всё больше возможностей для облегчения и корректировки течения многих заболеваний, в том числе при помощи моноклональных антител.
В России самой успешной компанией, занимающейся производством и выпуском препаратов на основе моноклональных антител, является BIOCAD. Уже сейчас компания выпускает около 20 лекарственных препаратов, предназначенных для лечения различных злокачественных опухолей, среди которых есть аналоги трастузумаба и бевацизумаба. Более 40 препаратов находится на стадии разработки, два из них планируют зарегистрировать в 2018 году (один из препаратов будет биоаналогом самого продаваемого aдалимумаба). BIOCAD первой из российских компаний стал лидером продаж препаратов, предназначенных для терапии онкологических заболеваний. По данным аудита фармацевтического рынка России, проводимого аналитической компанией IMS Health за январь–декабрь 2017 года, биотехнологическая компания BIOCAD второй год подряд удерживает лидерство в сегменте бюджетных закупок в рублях в конечных ценах (учитывались сведения по всем препаратам), а также впервые возглавила рейтинг поставщиков в сегменте государственных закупок противоопухолевых препаратов как в рамках программы 7ВЗН, так и вне ее.
7ВЗН — это программа «Семь высокозатратных нозологий», которая обеспечивает лекарствами людей с редкими заболеваниям. Доля BIOCAD в госзакупках лекарственных средств в 2017 году составила 4,2% при выручке 15,66 млрд рублей. В тройку лидеров вошли также NOVARTIS и Sanofi-Aventis с показателями 3,5% и 3,2%, соответственно. Список замыкает АО «Генериум», вторая российская компания, попавшая в топ-10 фармацевтических компаний, поставщиков лекарственных средств в государственные лечебные учреждения. В сегменте противоопухолевых препаратов BIOCAD удерживает 14,2% без учета 7ВЗН и 18,9% с учетом программы.
Итак, теперь мы знаем, что моноклональные антитела — это настоящая «магия» во флаконе. Без них было бы сложно, а иногда и невозможно, вылечить или улучшить течение множества заболеваний, в том числе онкологических и аутоиммунных. Прошло примерно 50 лет с момента разработки технологии гибридом, и за это время было получено большое количество жизненно важных препаратов. Огромный спрос на моноклональные антитела показывает, насколько востребованными и эффективными являются эти лекарства. В последующих статьях цикла будет рассказано, как биотехнологи «улучшают» работу моноклональных антител, какие из современных препаратов созданы на их основе и как работает BIOCAD — успешная отечественная компания по разработке и производству моноклональных антител.
Нам кажется, что в рамках совместного с «Биомолекулой» спецпроекта читателям будет интересно познакомиться с нюансами гуманизации антител и процессом поиска мишеней под конкретную нозологию.
Вполне возможно, вы уже знаете, что на основании ретроспективного анализа большинства известных моноклональных препаратов наша компания сформулировала современные требования к непатентуемым коммерческим наименованиям, которые были рассмотрены и приняты на заседании ВОЗ.
Раскрывая эту тему, постараемся описать различные виды антител и их уникальных vhh-представителей, коснуться вопроса иммуногенности и уже через него выйти к теме необходимости/желательности гуманизации. А также рассказать о пространственной структуре антител и о том, какие сложности с сохранением структуры поджидают исследователей при внесении мутаций.
Материал предоставлен партнёром — Департаментом вычислительной биологии компании BIOCAD