Монооксид углерода что это такое
Монооксид углерода
Монооксид углерода
| Монооксид углерода | |
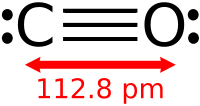 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Монооксид углерода |
| Химическая формула | CO |
| Отн. молек. масса | 28.0101 а. е. м. |
| Молярная масса | 28.0101 г/моль |
| Физические свойства | |
| Плотность вещества | 0,00125 (при 0°C) г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −205 °C |
| Температура кипения | −191,5 °C |
| Энтальпия (ст. усл.) | −110,52 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0.0026 г/100 мл |
| Классификация | |
| номер CAS | [630-08-0] |
Монооксид углерода (лат. Carbon monoxide ; другие названия — уга́рный газ, окись углерода, моноокись углерода, оксид углерода (II)) — бесцветный газ без вкуса и запаха. Химическая формула CO.
Содержание
Строение молекулы
Молекула CO, так же, как и изоэлектронная ей молекула азота, имеет тройную связь. Так как эти молекулы сходны по строению, то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой :C≡O:, причём третья связь образована по донорно-акцепторному механизму, где углерод является акцептором электронной пары, а кислород — донором.
Согласно методу молекулярных орбиталей электронная конфигурация невозбуждённой молекулы CO σ 2 Oσ 2 zπ 4 x, yσ 2 C. Тройная связь образована σ—связью, образованной за счёт σz электронной пары, а электроны дважды вырожденного уровня πx, y соответствуют двум σ—связям. Электроны на несвязывающих σC—орбитали и σO—орбитали соответствуют двум электронным парам, одна из которых локализована у атома углерода, другая — у атома кислорода.
Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13Å).
История открытия
Монооксид углерода был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем. То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крукшэнк. Моноксид углерода вне атмосферы Земли впервые был обнаружен бельгийским ученым М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК спектре Солнца.
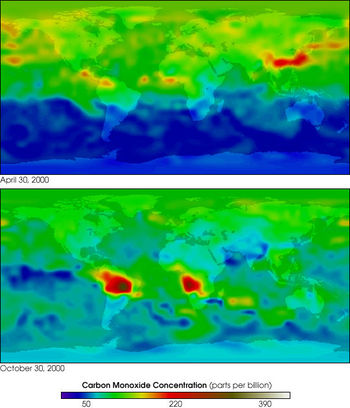
Монооксид углерода в атмосфере Земли
Различают природные и антропогенные источники поступления в атмосферу Земли. В естественных условиях, на поверхности Земли, CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров. Монооксид углерода образуется в почве как биологическим путём (выделение живыми организмами), так и небиологическим. Экспериментально доказано выделение монооксида углерода за счёт обычных в почвах фенольных соединений, содержащих группы OCH3 или OH в орто- или пара-положениях по отношению к первой гидроксильной группе.
Общий баланс продуцирования небиологического CO и его окисления микроорганизмами зависит от конкретных экологических условий, в первую очередь от влажности и значения pH. Например, из аридных почв монооксид углерода выделяется непосредственно в атмосферу, создавая таким образом локальные максимумы концентрации этого газа.
В атмосфере СО является продуктом цепочек реакций с участием метана и других углеводородов (в первую очередь, изопрена).
Основным антропогенным источником CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Оксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления CO в CO2). В прошлом значительную долю антропогенного поступления CO в атмосферу обеспечивал светильный газ, использовавшийся для освещения помещений в XIX веке. По составу он примерно соответствовал водяному газу, то есть содержал до 45 % монооксида углерода. В настоящее время в коммунальной сфере этот газ вытеснен гораздо менее токсичным природным газом (низшие представители гомологического ряда алканов — пропан и др.)
Поступление CO от природных и антропогенных источников примерно одинаково.
Монооксид углерода в атмосфере находится в быстром круговороте: среднее время его пребывания составляет около 0,1 года, окисляясь гидроксилом до диоксида углерода.
Получение
Промышленный способ
1. Образуется при горении углерода или соединений на его основе (например, бензина) в условиях недостатка кислорода:
2. или при восстановлении диоксида углерода раскалённым углём:
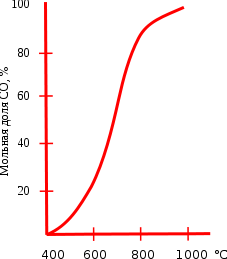
Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400°C равновесие практически полностью сдвинуто влево, а при температуре выше 1000°C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому монооксид углерода при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
3. Смеси монооксида углерода с другими веществами получают при пропускании воздуха, водяного пара и т. п. сквозь слой раскалённого кокса, каменного или бурого угля и т. п. (см. генераторный газ, водяной газ, смешанный газ, синтез-газ).
Лабораторный способ
1. Разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5. Схема реакции:
Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:
2. Нагревание смеси щавелевой и концентрированной серной кислот. Реакция идёт по уравнению:
Выделяющийся совместно с CO диоксид углерода можно удалить, пропустив смесь через баритовую воду.
3. Нагревание смеси гексацианоферрата (II) калия с концентрированной серной кислотой. Реакция идёт по уравнению:
Физиологическое действие, токсичность
Опытами на молодых крысах выяснено, что 0,02-процентная концентрация CO в воздухе замедляет их рост и снижает активность по сравнению с контрольной группой. Интересно то, что крысы, живущие в атмосфере с повышенным содержанием CO, предпочитали воде и раствору глюкозы спиртовой раствор в качестве питья (в отличие от контрольной группы, особи в которой предпочитали воду).
Помощь при отравлении монооксидом углерода: пострадавшего следует вынести на свежий воздух, полезно также кратковременное вдыхание паров нашатырного спирта.
TLV (предельная пороговая концентрация, США): 25 ПДКр.з. по Гигиеническим нормативам ГН 2.2.5.1313—03 составляет 20 мг/м³
Защита от монооксида углерода
Свойства
Монооксид углерода представляет собой бесцветный газ без вкуса и запаха. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
| Стандартная энергия Гиббса образования ΔG | −137,14 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 197,54 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 29,11 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHпл | 0,838 кДж/моль |
| Энтальпия кипения ΔHкип | 6,04 кДж/моль |
| Критическая температура tкрит | −140,23°C |
| Критическое давление Pкрит | 3,499 МПа |
| Критическая плотность ρкрит | 0,301 г/см 3 |
Основными типами химических реакций, в которых участвует монооксид углерода, являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах (так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже).
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830°C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции:
до 830°С смещено вправо, выше 830°C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Монооксид углерода горит синим пламенем (температура начала реакции 700°C) на воздухе:
Температура горения CO может достигать 2100°C, она является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления.
Монооксид углерода реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42°C, кипения +16°C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200°C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
Монооксид углерода реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
Получены также аналогичные селеноксид COSe и теллуроксид COTe.
C переходными металлами образует очень летучие, горючие и ядовитые соединения — карбонилы, такие как Cr(CO)6, Ni(CO)4, Mn2CO10, Co2(CO)9 и др.
Как указано выше, монооксид углерода незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако с расплавами щелочей вступает в реакцию:
Интересна реакция монооксида углерода с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (оксид тория ThO2) по уравнению:
Определение монооксида углерода
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
Эта реакция очень чувствительная. Стандартный раствор 1 грамма хлорида палладия на литр воды.
Количественное определение монооксида углерода основано на иодометрической реакции:
Применение
См. также
Литература
Ссылки
Полезное
Смотреть что такое «Монооксид углерода» в других словарях:
МОНООКСИД УГЛЕРОДА — (угарный газ, СО), бесцветный, лишенный запаха ядовитый газ, который образуется при неполном сгорании ископаемых топлив; он присутствует, например, в составе угольного газа и выхлопных газов автомобилей. Ядовитое действие угарного газа… … Научно-технический энциклопедический словарь
Углерода окись — Монооксид углерода Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
Углерода оксид — со Монооксид углерода, относящийся к классу опасности IV Источник: ГОСТ Р 51206 98: Автотранспортные средства. Содержание вредных веществ в воздухе салона и кабины. Нормы и методы опреде … Словарь-справочник терминов нормативно-технической документации
УГЛЕРОДА ОКСИД — (монооксид углерода, угарный газ) СО, мол. м. 28,01; газ без цвета и запаха. Связь в молекуле СО тройная, длина связи 0,113 HM, энергия диссоциации 1071,78 кДж/моль, 0,4 … Химическая энциклопедия
УГЛЕРОДА СЕМЕЙСТВО — ПОДГРУППА IVA. СЕМЕЙСТВО УГЛЕРОДА КРЕМНИЯ УГЛЕРОД, КРЕМНИЙ, ГЕРМАНИЙ, ОЛОВО, СВИНЕЦ Характерная для подгруппы IIIA особенность постепенного перехода от легкого неметаллического элемента к тяжелому типичному металлу наблюдается и в этой подгруппе … Энциклопедия Кольера
Углерода оксид — Известно три оксида углерода: Монооксид углерода CO Диоксид углерода CO2 Диоксид триуглерода C3O2 … Википедия
Моноксид углерода — Монооксид углерода Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
Моноокись углерода — Монооксид углерода Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
Окись углерода — Монооксид углерода Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
Оксид углерода (II) — Монооксид углерода Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
Монооксид углерода – физиология, токсикология, неотложная помощь

Образуется при горении углерода или соединений на его основе в условиях недостатка кислорода: 2С + О2 —> 2СО или при восстановлении диоксида углерода раскаленным углем: СО2 + С 2СО. Эта реакция часто происходит при печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли).
Благодаря такой хорошей теплотворной способности СО является компонентом разных технических газовых смесей (например, генераторного газа), используемых в том числе для отопления. В смеси с воздухом взрывоопасен.
СО реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором: СО + Сl2 —> СOСl2. Реакция является экзотермической, и в присутствии катализатора (активированного угля) она идет уже при комнатной температуре. В результате реакции образуется фосген — высокотоксичное вещество.
Источники СО в атмосфере
В атмосферу СО попадает в составе вулканических и болотных газов в результате вспышки лесных и степных пожаров, выделения микроорганизмами, растениями, животными и человеком. Из поверхностных слоев океанов в год выделяется 220 * 10х6 тонн СО в результате фоторазложения красных, сине-зеленых и др. водорослей, продуктов жизнедеятельности планктона. Естественный уровень содержания оксида углерода в атмосферном воздухе — 0,01—0,9 мг/м3.
Угарный газ попадает в атмосферу от промышленных предприятий, в первую очередь металлургии. В металлургических процессах при выплавке 1 млн тонн стали образуется 320—400 тонн СО. Большое количество СО образуется в нефтяной промышленности и на химических предприятиях (крекинг нефти, производство формалина, углеводородов, аммиака и др.).
Высокая концентрация СО может иметь место в угольных шахтах и на углеподающих трассах, поскольку СО образуется при самоокислении угля. СО также образуется при неполном сгорании топлива в печах и двигателях внутреннего сгорания.
В результате деятельности человека в атмосферу ежегодно поступает 350—600 млн тонн угарного газа. В настоящее время около 56—62 % этого количества приходится на долю автотранспорта (содержание оксида углерода в выхлопных газах может достигать 12 %).
Основной путь превращения СО в атмосфере – окисление гидроксилом до диоксида углерода: СО + Н2О —> СО2 + Н2.
Немаловажным источником СО является табачный дым. В плохо вентилируемом прокуренном помещении насыщение крови СО у присутствующих может достигать 10 % и даже 14 %. Курение кальяна более опасно в плане возможности отравления СО, чем курение трубки или сигарет, поскольку он в этом случае поступает в организм в более высокой концентрации.
В среднем при выкуривании одной сигареты концентрация карбоксигемоглобина в крови достигает 4—6,5 %. У курильщиков кальяна зарегистрирован уровень карбоксигемоглобина в крови в пределах 24,0-31,1 %.
Физиологическое значение
СО является нормальным метаболитом организма человека. Эндогенный СО образуется в организме в процессе действия фермента гемоксигеназы на гем (гемзависимая продукция), является продуктом разрушения гемоглобина и миоглобина, а также других гемсодержащих белков (цитохромов, цитохромоксидазы, каталазы).
Продукция СО в организме человека составляет в среднем 16,4 мкмоль/ч, достигая 500 мкмоль (12 мл) в сутки. Этот процесс вызывает образование в крови человека небольшого количества карбоксигемоглобина, даже если человек не курит и дышит не атмосферным воздухом, а чистым кислородом или смесью азота с кислородом.
Содержание карбоксигемоглобина в крови в норме колеблется в пределах 1—2 % от всех видов гемоглобина и в среднем составляет 1,6 %. При патологических состояниях, сопровождающихся активацией гемолиза, продукция СО в организме значительно возрастает.
Гемнезависимая продукция эндогенного СО происходит в результате ферментативного и аутоокисления фенолов, фотоокисления органических химических соединений, индуцируемого аскорбатом и ионами железа перекисного окисления липидов.
Активаторы липидной пероксидации (фенобарбитал, дифенилгидантоин, прогестерон) способствуют увеличению продукции эндогенного СО. Напротив, применение антиоксидантов (альфа-токоферола, десферала) угнетает его гемнезависимое образование.
Продукция СО происходит в нейронах головного мозга, клетках легких, печени, селезенки, почек и крови, однако количество образующегося эндогенного СО при гемнезависимом пути продукции несравнимо меньше, чем при работе гемоксигеназы. Высокая активность гемоксигеназы имеет место в селезенке, где и происходит наиболее активное образование эндогенного СО.
До 80 % образующегося в организме СО связывается гемоглобином, образуя карбоксигемоглобин. Часть СО выводится из организма через легкие, а часть подвергается окислению до углекислого газа с участием цитохромоксидазы.
Данные о влиянии СО на организм человека в настоящее время еще противоречивы. Например, установлено, что гипоксическая стимуляция активности гемоксигеназы в сердце с последующим увеличением продукции эндогенного СО приводит к снижению тонуса коронарных сосудов и увеличению кровоснабжения миокарда.
Показано, что СО оказывал защитное действие на кардиомиоциты изолированных сердец животных в условиях моделирования ишемии-реперфузии. Экзогенный СО также уменьшал тяжесть реперфузионных повреждений в моделях острого инфаркта миокарда у мышей.
С другой стороны, в одном из последних продолжительных исследований (Framingham Offspring Study) обнаружено, что повышенный уровень эндогенного СО в организме ассоциирован со значительным увеличением риска развития сердечно-сосудистых заболеваний.
Феномен индуцируемой СО вазорелаксации был впервые описан в 1984 г. McGrath и Smith на коронарных артериях крыс. Очень скоро было установлено, что этот эффект не обусловлен активностью эндотелия. Установлено, что СО способствует релаксации артерии хвоста, грудного отдела аорты кролика, сонных артерий собаки, коронарных мезентериальных и бедренных артерий свиней и морских свинок, печеночных вен крысы и многих других кровеносных сосудов. Однако многие сосуды оказались не чувствительными к СО модуляции. Данные о влиянии СО на тонус легочных сосудов у разных авторов часто противоположны.
В ранних исследованиях, проводившихся на свиньях, было обнаружено, что создание концентрации СО в крови в пределах 160—185 ppm приводило к активации агрегации тромбоцитов. При повышении концентрации СО до 420 ppm с помощью электронной микроскопии была выявлена адгезия изменивших форму тромбоцитов на поверхности артериального эндотелия.
Но в более поздних работах было показано значительное ингибирование тромбоцитарной агрегации под влиянием СО. Эффект реализовывался через увеличение продукции оксида азота (NО) и образования циклического гуанозинмонофосфата.
Вдыхание СО ведет в первую очередь к гемической гипоксии через образование карбоксигемоглобина и снижение кислородной емкости крови, однако парадоксально, что ингаляция СО в концентрации 0,1% обусловливает уменьшение тяжести легочной ишемии, угнетает гипоксическую индукцию ингибитора активации плазминогена, благодаря чему снижает отложение фибрина и активность воспалительного процесса в легких.
Синтез сурфактанта пневмоцитами 2-го типа в организме человека угнетается под влиянием как экзогенного, так и эндогенного СО.
Вслед за появившимися в 1993 году первыми данными о том, что эндогенный СО является нормальным нейротрансмиттером в организме человека, а также одним из трех эндогенных газов, которые в норме модулируют течение воспалительных реакций в организме (два других — оксид азота и сероводород), СО привлек значительное внимание клиницистов и исследователей как важный биологический регулятор.
Было показано, что во многих тканях все три вышеупомянутых газа являются противовоспалительными веществами, вазодилататорами, а также вызывают ангиогенез, СО — через активацию выработки сосудистого эндотелиального фактора роста.
Основная его функция — создание новых кровеносных сосудов в эмбриональном развитии или после травмы, усиление роста мышц после физических упражнений, обеспечение коллатерального кровообращения (создание новых сосудов при блокировании уже имеющихся). Но повышенная активность сосудистого фактора роста может привести к возникновению и росту опухолей.
Таким образом, в настоящее время СО рассматривают в качестве одной из сигнальных молекул, которая принимает участие в регуляции сосудистого тонуса, процессах гемореологии, нейротрансмиссии. Ведутся исследования, посвященные определению роли СО в процессах воспаления.
Статистика и источники отравления СО
Отравление СО составляет наиболее часто регистрируемую интоксикацию ядовитыми газами. В Великобритании ежегодно около 50 человек погибают в результате интоксикации СО при ежегодной констатации 1000-1100 отравлений СО. В США от отравления СО ежегодно погибает около 500 человек, а количество случаев интоксикации СО превышает 15 000.
Большинство случайных отравлений СО не имеют профессионального характера. Они обусловлены неполным сгоранием топлива в неисправных печах, отсутствием адекватной тяги и малыми размерами помещения. Профессиональные отравления встречаются намного реже и вызваны вдыханием выхлопных газов, нахождением в зоне пожаров и взрывов. При больших пожарах случаи массовых отравлений СО встречаются практически всегда.
Источниками интенсивного образования СО являются: газовые водонагреватели, керосиновые печи и обогреватели, древесноугольные грили, снабжаемые пропаном печи, бензиновые и дизельные электрогенераторы, заправляющиеся пропаном автопогрузчики, бензопилы, тягачи и буксировщики, лодочные моторы, устройства для распыления красок, лаков, растворителей и др.
Риску отравления СО подвержены: дети, едущие в крытых грузовиках в конце их кузова, рабочие целлюлозных мельниц, сталелитейных цехов, работающие у коксовых печей, рабочие, занятые на производстве формальдегида, работающие в зоне пожара, работающие в закрытых помещениях газо- и электросварщики, находящиеся вблизи работающих лодочных моторов.
В мегаполисах до 80 % присутствующего в воздухе СО обусловлено работой автотранспорта. Его выделяется особенно много, когда в двигатель подают избыточное количество топлива, чтобы, например, завести его на холоде. Поэтому автомобили, работающие при низких температурах (а также при торможении в пробках и дальнейшем движении транспортного потока в зимнее время года), выделяют значительные количества СО.
Ниже приводится информация о содержании СО в воздухе или других газовых смесях, которые могут вдыхать современные жители.
Содержание СО в газах, образующихся и выделяющихся в процессе промышленного производства, следующее:
Токсикология монооксида углерода
Механизм токсического действия СО на организм включает:
Наибольшее количество работ, затрагивающих аспекты токсикологии СО, посвящено повреждающему эффекту гемической гипоксии при образовании большого количества карбоксигемоглобина (НbСО): HbO2 + CO —> HbCO + O2.
Образование НbСО происходит очень быстро, поскольку сродство гемоглобина к СО в 250 раз больше, чем сродство к кислороду. Скорость образования НbСО зависит от его содержания во вдыхаемом воздухе. Например, наличие 1 объема СО в 1500 объемах вдыхаемого воздуха определяет образование 50% НbСО.
Растворы карбоксигемоглобина ярко-красного цвета, их спектр поглощения характеризуется максимумами при длине волны 570 и 539 нм. Вследствие этого при отравлении СО кожные покровы пострадавших могут приобретать розоватый оттенок. Врачи описывают наличие гиперемии или эритемы.
Если скорость образования НbСО возрастает в геометрической прогрессии, то обратная реакция (высвобождение гемоглобина, отделение его от СО) имеет линейную зависимость. Расщепление карбоксигемоглобина на Нb и СО происходит в 10 000 раз медленнее, чем расщепление оксигемоглобина на Нb и O2.
Скорость замещения НbСО НbO2 зависит исключительно от количества кислорода, находящегося во вдыхаемой газовой смеси. Период полураспада НbСО составляет:
В клинических условиях независимо от тяжести состояния пациента и количества вдыхаемого им кислорода через 12 часов после прекращения контакта с СО концентрация НbСО в крови не превышает нормальные показатели.
Тяжесть состояния пациента будет определяться не только тяжестью гипоксических повреждений, полученных в период наличия гемической гипоксии, но также формированием гипоксии биоэнергетической, в основе которой находится митохондриальная дисфункция.
Помимо гемоглобина и миоглобина, СО блокирует гем других белков, принимающих участие в тканевом дыхании, а именно цитохром-С-оксидазы, цитохрома С, цитохрома а3, цитохрома Р450, каталазы, пероксидазы. Сродство к СО у этих белков значительно меньше, чем у гемоглобина, однако и высвобождение их из связи с СО происходит значительно медленнее — в течение 48—72 часов.
Соответственно, в этот период может быть серьезно снижена энергопродукция и имеется высокий риск развития или усугубления тяжести гипоксической энцефалопатии, а также расстройств сердечной деятельности.
Результаты пульсоксиметрического исследования и электрохимические исследования парциального давления газов крови в условиях острого отравления СО малоинформативны и не отражают тяжести гипоксемии и гипоксии.
Гипоксия имеет смешанный характер, включая гемический и гистотоксический компоненты. Хотя подавляющее количество кислорода в гипо- и нормобарических условиях транспортируются в организме с помощью НbO2 и между показателями РaO2 и SpO2 имеется определенная нелинейная зависимость, в условиях отравления СО по причине того, что объемное содержание кислорода в плазме крови может оставаться вполне нормальным, у пациентов могут регистрироваться нормальные показатели РaO2 и SpO2.
Клиническая картина отравления СО
С учетом того, что к гипоксии наиболее чувствительны нейроны головного мозга, клиническая симптоматика при отравлении СО прежде всего проявляется нарушением функций ЦНС. Второе место занимают расстройства со стороны сердечно-сосудистой системы.
Наиболее чувствительны к действию СО новорожденные, дети, беременные, лица пожилого и старческого возраста, особенно с сопутствующей патологией сердечно-сосудистой системы.
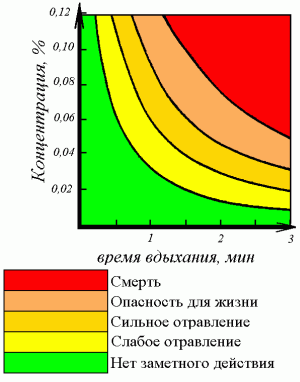
Для отравления легкой степени характерны: головная боль, ощущение пульсации в височной области, головокружение, ухудшение остроты зрения, умеренное оглушение, тошнота, слезотечение. Наблюдаются: покраснение кожных покровов (значительно чаще отмечают не распространенную гиперемию, а легкий румянец), тахикардия, артериальная гипертензия, боли в грудной клетке, сухой кашель.
Для отравления средней степени тяжести помимо указанных выше симптомов характерны усугубление тяжести оглушения, состояние сомноленции, возможно появление парезов.
При тяжелом отравлении отмечаются: синкопе, развитие сопора и гипоксической комы, мышечная атония (чаще) или гипертония с гиперрефлексией (реже), судороги, ослабление пальпебральных, корнеальных рефлексов, фотореакций, появление миоза, сменяющегося двусторонним мидриазом или анизокорией, нарушается ритм дыхания, имеют место нарушения сердечного ритма, артериальная гипотензия, румянец сменяется цианозом.
Выделяют еще и молниеносную форму отравления СО. Она развивается, когда концентрация СО во вдыхаемом воздухе составляет 0,5—1,0 % или превышает это значение. При этом SaCO быстро достигает 80 %. Пострадавший быстро впадает в кому с остановкой дыхания, сочетающуюся с декомпенсированным шоком.
Осложнениями являются гипоксический отек головного мозга и гипоксическая энцефалопатия с стойким неврологическим дефицитом, гипоксемический отек легких, инфаркт миокарда и острая недостаточность системного кровообращения, рабдомиолиз, миоглобинурия и острое повреждение почек.
Врачи давно знакомы с клиникой интоксикации СО. На протяжении многих лет были описаны многочисленные клинические формы, такие как цефалгическая, психозоподобная, судорожная, пьяная, висцеральная, легочная (протекающая с отеком легких), желудочно-кишечная, рабдомиолизная и др.
Неотложная помощь и интенсивная терапия
После проведения оценки состояния пострадавшего согласно алгоритму ABCDE (A (airway) — проходимость дыхательных путей; В (breathing) — эффективность дыхания; С (circulation) — эффективность системного кровообращения; D (disability) — нарушение функции сознания; Е (exposure) — дополнительная информация) пострадавший должен быть выведен или вынесен из зоны воздействия токсичного газа.
При наличии симптоматики остановки эффективного кровообращения следует начать реанимационную акцию с последовательностью действий САВ.
При отсутствии признаков клинической смерти немедленно начать оксигенотерапию или ИВЛ с применением кислорода. Пациентам, находящимся в состоянии сопора и комы, необходимо инструментально обеспечить проходимость дыхательных путей.
Выполнить катетеризацию периферической вены и начать инфузию плазмозамещающих растворов (физиологический раствор, раствор Рингера, раствор Рингера лактат, раствор лактасол и др.) со скоростью 1,5—2,0 мл в минуту.
При наличии глюкометра определить уровень гликемии. Не использовать растворы глюкозы при отсутствии гипогликемического состояния. Не использовать глюкокортикостероиды. При необходимости инотропной поддержки применить инфузии добутамина, допамина или адреналина.
При наличии специальных диагностических приборов немедленно определить содержание в крови карбоксигемоглобина. Если пострадавший эвакуирован из зоны действия токсических газов незамедлительно, то содержание карбоксигемоглобина в крови, не превышающее 8 %, укажет на то, что нарушение функции сознания, скорее всего, не связано с токсическим действием СО. Однако всегда следует учитывать возможность неточности функционирования прибора.
В качестве антидота, способствующего ускорению диссоциации карбоксигемоглобина и высвобождению гемоглобина, ввести пострадавшему внутривенно 60 мг ацизола.
При наличии судорог или психомоторного возбуждения после предварительного введения 0,3— 0,5 мл атропина сульфата использовать внутривенно диазепам 10—20 мг или тиопентал натрия 1 мг/кг массы тела.
При наличии сукцинат-содержащих антигипоксантов (реамберина, мексидола, цитофлавина) использовать их как можно раньше.
Госпитализировать пациента в центр (отделение), имеющий возможности проведения интенсивной терапии с ИВЛ. Пациентов, находящихся в крайне тяжелом состоянии, с нестабильностью гемодинамики, проблемами обеспечения проходимости дыхательных путей не следует пытаться доставить в центр, имеющий возможность проведения гипербарической оксигенации, если возможна более быстрая доставка в отделение, где умеют проводить длительную ИВЛ.
У пациентов, находящихся в состоянии глубокого оглушения, сопора, комы, нужно также учитывать необходимость обеспечения немедленной нейровизуализации.
В отделении интенсивной терапии пациентам, находящимся в состоянии сопора и комы, должна быть выполнена интубация трахеи. ИВЛ с применением 100% кислорода проводится в течение 6 часов.
Рекомендуется прогнозировать продолжительность необходимости применения 100% O2 из расчета, что в условиях оксигенотерапии с использованием 100% O2 период полураспада НbСО составляет в среднем 1 час. При неосложненных отравлениях СО продолжительность оксигенотерапии хорошо соответствует динамике снижения концентрации НbСО в крови.
Терапию 100% кислородом следует проводить до снижения концентрации НbСО до 10 %. У пациентов, имеющих патологию легких или сердечно-сосудистой системы, требуется продолжение оксигенотерапии с использованием 100% O2 до снижения концентрации НbСО в крови до 2 %.
Высокие показатели пульсоксиметрии не являются маркером снижения тяжести гипоксических повреждений и улучшения состояния пациента.
Пациентов с уровнем НbСО в крови 40 % и выше, а также пациентов с прогрессирующей недостаточностью функций ЦНС или сердечно-сосудистой системы, если это возможно, следует подвергнуть гипербарической оксигенотерапии.
Пациенты с отсутствием положительного эффекта от 4-часовой оксигенотерапии с применением 100% O2 также, если это возможно, должны быть направлены в отделение гипербарической оксигенации (ГБО).
Беременным необходимо проводить ГБО уже при концентрации НbСО в крови 15 %.
Гипербарическая оксигенация значительно и достоверно способствует ускорению разрушения СО и выведению его из организма. Период полураспада НbСО может быть сокращен до 15—23 минут. Наиболее распространенным режимом ГБО является использование 100% O2 под давлением 2,4—3 атм в течение 90—120 минут.
При описании отдельных клинических случаев отмечают значительное и быстрое регрессирование неврологических расстройств, отека головного мозга и восстановление активности цитохромоксидазы. Однако в систематизированных обзорах четких преимуществ ГБО не показано, поэтому руководства для ее применения у пациентов с отравлением СО до сих пор не разработаны.
Наиболее часто показаниями к проведению ГБО называют наличие комы (98 %), синкопе (77 %), признаков ишемии миокарда по данным ЭКГ (91 %), очаговой неврологической симптоматики (94 %) и нарушений, выявленных при нейропсихиатрическом тестировании (91 %). 92 % специалистов по ГБО используют ее у пациентов с головной болью, тошнотой и при уровне НbСО в крови 40 % и выше.
Необходимо ЭКГ-мониторирование. У пациентов с атеросклеротическим поражением сердца имеется высокий риск внезапной остановки кровообращения уже при наличии в крови 20 % НbСО. У этих же больных уже при начальном уровне НbСО в крови 15 % и выше на ЭКГ часто обнаруживаются признаки ишемии миокарда и острого инфаркта миокарда.
Все пострадавшие нуждаются в исследовании состояния глазного дна и проведении ядерно-магнитно-резонансной компьютерной томографии головного мозга.
У пациентов с признаками отека головного мозга при проведении интенсивной терапии используются непрерывный мониторинг показателей АД, положение на койке с приподнятым головным концом, быстрая инфузия маннитола и ИВЛ в режиме гипервентиляции с целевым РаСO2 30 мм рт.ст. в течение 6-12 часов.
Необходимо обязательно провести исследование кислотно-основного статуса организма, если концентрация НbСО достигает 25 %.
Не следует применять ощелачивающую терапию, если pH плазмы крови превышает 7,15. Метаболический ацидоз имеет гипоксическое происхождение и регрессирует в процессе проведения оксигенотерапии.
Если во время пожара пациент помимо СО вдыхал другие токсические продукты горения и у него обнаружена метгемоглобинемия, необходимо использовать внутривенно тиосульфат натрия до 12 500 мг в сутки.
При наличии признаков рабдомиолиза с помощью инфузионной терапии и применения диуретиков следует обеспечить темп мочеотделения не менее чем 150 мл в час. При отсутствии эффекта от форсированного диуреза и развитии острой почечной недостаточности проводят заместительную почечную терапию.