Морфология лейкоцитов крови что это значит
Как расшифровать лейкоцитарную формулу?
Лейкоцитарная формула, микроскопия лейкоцитов, пять фракций лейкоцитов, дифференцировка лейкоцитов — в назначениях врача можно встретить много названий одного и того же. Где ее найти и как расшифровать?
Что такое лейкоциты?
Лейкоциты (белые клетки крови) — это большая группа клеток крови. Их основная цель — защита организма от инфекций. Все лейкоциты — это часть иммунитета, они участвуют в аллергических, аутоиммунных, опухолевых процессах. Каждый тип лейкоцитов выполняет свою роль и важен для организма.
Общий анализ крови без лейкоцитарной формулы говорит только об общем содержании лейкоцитов и не позволяет выявить за счет какого типа лейкоцитов идет повышение (лейкоцитоз) или снижение (лейкопения) белых клеток крови. Лейкоцитарная формула определяет пять типов лейкоцитов и оценивается в развернутом общем анализе крови. Чтобы расшифровать лейкоцитарную формулу нужно оценить содержание каждого типа лейкоцитов и их соотношение между собой.
Лейкоцитарную формулу подсчитывает автоматический анализатор крови. Принимая содержание всех лейкоцитов за 100%, он выдает процент (%) содержания каждого типа белых клеток крови. Также автоматически измеряет их содержание в объеме крови (на литр). Иногда требуется “ручной подсчет” и визуальная оценка мазка крови под микроскопом. Например, когда лейкоцитарная формула изменена, есть странные или незрелые клетки, есть признаки анемии или снижения тромбоцитов в общем анализе крови. В этом случае можно увидеть только процентное соотношение лейкоцитарной формулы.
Гранулоциты — ударные силы
Самая большая часть лейкоцитов представлена клетками гранулоцитами. Свое название они получили из-за наличия включений (гранул). Гранулы содержат химические иммунные вещества. В лейкоцитарной формуле можно увидеть три вида гранулоцитов: нейтрофилы, эозинофилы, базофилы. Они различаются особенностями строения ядра и окраски гранул разными красителями. Гранулоциты важны в развитии воспаления и иммунной защите организма. Они способны к поглощению и перевариванию белков и химических веществ. Все гранулоциты созревают в костном мозге, сохраняя там запас зрелых клеток на 3-4 дня. В крови гранулоциты циркулируют не больше 6 часов, уходя в ткани, где и выполняют свою функцию.
Нейтрофилы составляют наибольшее количество циркулирующих в крови лейкоцитов. Ежедневно в кровоток поступает 10 10 нейтрофилов. Нейтрофилез (увеличение количества нейтрофилов в крови) — показатель бактериальной инфекции. Чем тяжелее инфекция, тем больше нейтрофилов выходит на борьбу. Из-за их низкой продолжительности жизни (около 4-х дней) в кровь начинают поступать более юные, еще не созревшие формы клеток (палочкоядерные, метамиелоциты и другие). Врачи называют это “сдвигом лейкоцитарной формулы влево”. Когда нейтрофилов в крови очень мало (нейтропения), организм не защищен от инфекций.
Эозинофилы в крови составляют не более 5% от общего количества лейкоцитов. Их концентрация колеблется в течение суток из-за воздействия гормонов надпочечников. Утром она максимальная. Накапливаются они в подслизистом слое желудочно-кишечного тракта. Эозинофилия (повышение эозинофлов в крови) возникает при паразитарных инфекциях, аллергических и аутоиммунных процессах.
Базофилы составляют наименьшее количество лейкоцитов в крови (менее 1%) и участвуют в аллергических реакциях, выделяя гистамин. Это вещество виновно в спазме бронхов, зуде, отеке, покраснении. В зависимости от того, куда базофилы попали, будут проявления аллергических реакций: приступ бронхиальной астмы, сыпь на коже, крапивница, отек Квинке (отек гортани).
Моноциты — тканевые охотники
Второе звено лейкоцитов — моноциты. В костном мозге, образовавшись за 5 дней, они не формируют запас. В крови моноциты составляют около 10% массы лейкоцитов, быстро уходя в ткани. Тканевые макрофаги, а именно так уже будут называться моноциты, преимущественно содержатся в печени, селезенке, легких. Их продолжительность жизни очень большая (60 дней). Они главные охотники иммунной системы, т.к. поглощают и перерабатывают тысячи чужеродных белков, делая из них доступные иммунным клеткам антигены.
Моноцитоз (повышение моноцитов в крови) связан с хроническими инфекциями, а также с инфекциями, возбудители которых прячутся в клетках организма (вирусы, хламидии, микоплазмы).
Лимфоциты — надежные защитники
Переработанные моноцитами-макрофагами и другими иммунными клетками антигены привлекают лимфоциты. Лимфоциты обеспечивают приобретенный иммунитет, производя антитела и клетки-памяти для защиты от повторной инфекции.
Лимфоциты образуются в костном мозге, циркулируют как в крови, так и в лимфатической системе. Важными органами созревания клеток являются тимус (вилочковая железа) и лимфоузлы. Лимфоциты выполняют разную иммунную работу, представляя вторую по численности группу лейкоцитов. Есть особенное исследование крови (иммунофенотипирование) позволяющее определить разные виды лимфоцитов. Это бывает важно при заболеваниях иммунной системы, ВИЧ-инфекции и др.
В лейкоцитарной формуле важны как повышение лимфоцитов (лимфоцитоз) — больше характерен для вирусных инфекций, так и лимфопения (снижение их количества). Нехватка лимфоцитов снижает защитные силы организма и наблюдается при иммунодефицитах (в том числе ВИЧ-инфекции).
В лаборатории Lab4U можно сдать со скидкой 50%:
Морфология лейкоцитов крови что это значит
Клинический анализ крови – лабораторное исследование с оценкой количественных и качественных характеристик всех классов форменных элементов крови, включающее цитологическое исследование мазка периферической крови для подсчета процентного содержания разновидностей лейкоцитов и определение скорости оседания эритроцитов.
Общий анализ крови (ОАК), гемограмма, КАК, развернутый анализ крови.
Complete Blood Count (CBC), Hemogram, CBC with White Blood Cell Differential Count, Peripheral Blood Smear, Blood Film Examination.
Какой биоматериал можно использовать для исследования?
Венозная кровь, капиллярная кровь.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Клинический анализ крови выполняется для диагностики количественных и качественных изменений форменных элементов – клеток крови: эритроцитов, лейкоцитов и тромбоцитов. Их изменения могут быть обусловлены нарушениями процесса кроветворения, но чаще всего носят реактивный характер – отражают реакцию кроветворения на другие патологические состояния и заболевания. Поэтому клинический анализ крови является одним из наиболее распространенных рутинных исследований и используется врачами различных специальностей, ему отводится ведущая роль в первичном диагностическом поиске.
Для исследования может использоваться как венозная, так и капиллярная кровь, при этом использование венозной крови предпочтительнее. Взятие производится при помощи вакуумной системы, чаще всего из вен на локтевом сгибе. В специальной пробирке – вакутейнере уже содержится антикоагулянт (ЭДТА), который препятствует свертыванию крови. Объем набранной в вакутейнер крови должен соответствовать отметке на нём – так достигается необходимая концентрация антикоагулянта, что препятствует формированию микросгустков и, как следствие, неправильному подсчету количества клеточных элементов и искажению их морфологической структуры.
В настоящее время клинический анализ крови чаще всего выполняется на гематологическом анализаторе – высокотехнологичном приборе, способном определять и автоматически рассчитывать более 30 характеристик крови, в том числе осуществлять подсчет форменных элементов, включая основные популяции лейкоцитов. Принцип работы гематологических анализаторов основан на прохождении суспензии клеток через чувствительный элемент – лазерный луч или электрический ток. Каждая клетка преломляет лазер или меняет сопротивление электрического тока, эти изменения пропорциональны размеру клетки, на чем и основано их различение анализатором.
При наличии отклонений по результатам исследования на гематологическом анализаторе врач лабораторной диагностики производит морфологическое изучение мазка крови. В данное исследование микроскопия мазка включена изначально. Для визуального подсчета форменных элементов одну-две капли крови капают на предметное стекло, другим стеклом одним движением размазывают её тонким слоем и фиксируют специальными веществами. Затем мазки окрашиваются красителями для удобства различения и визуализации клеток и изучаются врачом под микроскопом. Традиционно подсчет проводят на сто клеток и полученные цифры записывают в процентах. Зная общее количество лейкоцитов, проценты можно пересчитать в абсолютные значения, которые гораздо более объективно отражают состояние лейкоцитарной популяции.
Параметры, определяемые в исследовании
Эритроциты – наиболее многочисленные клетки крови, их основной функцией является транспорт кислорода, который они выполняют с помощью содержащегося в них специального белка – гемоглобина. Гематологический анализатор определяет количество эритроцитов, содержание гемоглобина, гематокрит и рассчитывает на основании этого ряд характеристик – так называемых эритроцитарных индексов.
Эритроциты (RBC, Red Blood Cell) – безъядерные клетки, образуются в костном мозге из ретикулоцитов, имеют форму двояковогнутого диска, что позволяет достичь максимально возможную площадь поверхности для связывания кислорода. Эритроциты имеют диаметр 7-10 микрометров, они эластичны, легко могут менять форму для безопасного прохождения по мельчайшим сосудам – капиллярам. В мазке крови выглядят как бледно-красные круглые элементы с просветлением в центре. Единица измерения – 10 12 в литре (триллионов клеток в литре).
Гемоглобин (HGB) – белок, основной компонент эритроцита, обладает сродством к кислороду, благодаря чему обеспечивается транспортная функция эритроцитов. Насыщенный кислородом гемоглобин придает эритроцитам и крови в целом красный цвет.
Гематокрит (HCT) – характеризует соотношение объема эритроцитов и плазмы. Это расчетный параметр – гематологический анализатор рассчитывает объем эритроцитов из их количества и среднего объема одной клетки (MCV).
Средний объем эритроцита (MCV, Mean Corpuscular Volume) – рассчитывается анализатором путем деления суммы клеточных объемов на количество эритроцитов. Может иметь нормальное значение при наличии в крови одновременно микроцитоза и макроцитоза. В таких ситуациях следует обращать внимание на параметр RDW. Единица измерения – фемтолитр.
Среднее содержание гемоглобина в эритроците (MCH, Mean Corpuscular Hemoglobin) – отражает степень насыщения эритроцита гемоглобином. Рассчитывается путем деления концентрации гемоглобина на количество эритроцитов.
Средняя концентрация гемоглобина в эритроците (MCHC, Mean Corpuscular Hemoglobin Concentration) также характеризует насыщение эритроцита гемоглобином. Рассчитывается путем деления гемоглобина на гематокрит.
Распределение эритроцитов по объему (RDW, Red Cell Distribution Width) – характеризует степень вариабельности объема эритроцитов – анизоцитоз. При наличии в крови популяции эритроцитов с измененным, но достаточно однородным размером значения RDW могут оставаться в норме. При выраженных различиях в объеме эритроцитов, когда MCV, характеризующий средний объем всех клеток нормален, RDW будет повышен.
Тромбоциты (PLT, Platelet) – форменные элементы крови, участвующие в остановке кровотечений путем формирования тромбов. Не являются клетками, представляют собой осколки цитоплазмы мегакариоцитов костного мозга. Диаметр 2-4 мкм.
Средний объем тромбоцитов (MPV, Mean Platelet Volume) – объем тромбоцитов уменьшается по мере старения клеток, поэтому увеличение данного параметра свидетельствует о преобладании в популяции молодых тромбоцитов.
Распределение тромбоцитов по объему (PDW, Platelet Distribution Width) – характеризует вариабельность размеров тромбоцитов.
Лейкоциты (WBC, White Blood Cell) – гетерогенная популяция ядросодержащих клеток крови, основной функцией которых является защита организма от чужеродных агентов. К лейкоцитам относятся клетки гранулоцитарного (эозинофилы, базофилы, нейтрофилы), моноцитарного и лимфоидного (Т- и В-лимфоциты) рядов. Современные анализаторы могут дифференцировать основные пять типов лейкоцитов, однако микроскопия мазка по-прежнему остается наиболее точным методом оценки лейкоцитарной популяции, так как позволяет не только определить количество разных лейкоцитов, но и выявить изменения в их морфологии, а также обнаружить атипичные клетки.
Процентное соотношение разных видов лейкоцитов в мазке крови называется лейкоцитарной формулой. Окраска мазков крови позволяет дифференцировать 5 типов лейкоцитов за счет разного окрашивания ядер и внутриклеточного пространства (цитоплазмы):
Вышеперечисленные типы лейкоцитов встречаются в мазке периферической крови в норме. При некоторых заболеваниях в кровь из костного мозга могут выходить клетки, которых в норме в мазке быть не должно: например, бласты – морфологический субстрат острого лейкоза. В заключении к исследованию обязательно указываются количество и по возможности морфологические особенности атипичных клеток.
Помимо подсчета лейкоцитов, при микроскопии оцениваются морфологические характеристики эритроцитов – их размер, форма. Эти параметры важны в диагностике различных приобретенных и врождённых анемий.
Скорость оседания эритроцитов. Тест основан на способности эритроцитов оседать под действием силы тяжести в крови, лишенной возможности свертываемости. В норме эритроциты оседают медленно, ускорение этого процесса происходит при агглютинации – слипании эритроцитов друг с другом, что приводит к увеличению массы оседающих частиц. Обычные эритроциты имеют на мембране отрицательный заряд, способствующий их отталкиванию друг от друга. При инфекционно-воспалительных, аутоиммунных и некоторых опухолевых (особенно парапротеинемических гемобластозах) заболеваниях происходит изменение белкового состава плазмы в сторону повышения содержания белков (например, иммуноглобулинов). Все белковые молекулы снижают мембранный заряд эритроцитов, способствуя их склеиванию между собой и увеличению скорости оседания. Тест проводится в течение часа, высоту полученного осадка измеряют в миллиметрах.
Для чего используется исследование?
Когда назначается исследование?
Морфология лейкоцитов крови что это значит
Лейкоциты. Общая характеристика элементов белой крови
Лейкоциты (греческое leukos – белый, kytos – вместилище) – одна из трех разновидностей форменных элементов крови позвоночных животных и человека.
Представление о лейкоцитах сформировалось более 100 лет назад одновременно с возникновением учения о крови и кроветворении, получило развитие в трудах Р. Вирхова (1955), И.И. Мечникова (1883), А.А. Максимова (1902), А.А. Заварзина (1945) и других отечественных и зарубежных исследователей.
Лейкоциты, в отличие от эритроцитов, это ядросодержащие клетки, структурная организация которых идентична другим клеткам нашего организма. Лейкоцитарная клетка ограничена цитоплазматической мембраной, в цитоплазме содержатся митохондрии, лизосомы с набором гидролитических ферментов и биологическиактивных соединений, имеется аппарат Гольджи, система эндоплазматического ретикулума, белоксинтезирующая система, представленная рибосомами и полирибосомами, и другие органоиды. Размеры лейкоцитов варьируют от 4 до 20 мкм. Продолжительность жизни также весьма вариабельна и составляет от 4–5 дней до 20 дней для элементов гранулоцито-моноцитарного ряда, а для лимфоцитов 100–200 дней. Количество лейкоцитов в периферической крови здорового взрослого человека колеблется от 4×10 9 /л до 9×10 9 /л.
Количество лейкоцитов у новорожденных уже в течение первых суток достигает 10×10 9 /л – 30×10 9 /л, а затем несколько уменьшается и со второй недели жизни составляет в среднем 10×10 9 /л – 12×10 9 /л. Однако следует отметить, что согласно данным многочисленных авторов содержание лейкоцитов в периферической крови в течение первых лет жизни, а по некоторым данным и до 10–15 лет, может быть значительно выше аналогичного показателя крови здорового взрослого человека (таблица).
Прежде чем остановиться на морфофункциональных особенностях отдельных видов лейкоцитов, необходимо рассмотреть гистогенез элементов белой крови в костном мозге, поскольку именно четкие представления о гистогенезе позволят не только хорошо усвоить вопросы физиологии белой крови, но и современные принципы классификации лейкозов, их гематологическую характеристику.
Как известно, лейкоциты позвоночных животных и человека образуются в специальных кроветворных органах: в период эмбрионального развития такими органами являются желточный мешок, печень, селезенка и костный мозг. Во взрослом организме лейкоциты образуются в костном мозге, а лимфоциты, кроме того, в селезенке, вилочковой железе и лимфатических узлах.
В костном мозге имеется две неравнозначные группы клеток: клетки ретикулярной стромы и клетки кроветворной ткани костного мозга с их производными – зрелыми клетками крови. К клеточным элементам ретиулярной стромы относят фибробласты, остеобласты, жировые клетки, эндотелиальные клетки. Указанные клетки объединяют собирательным названием «ретикулярные клетки».
Возрастная динамика количества лейкоцитов и лейкоцитарной формулы у детей
В настоящее время четко определена гистогенетическая независимость системы кроветворной стромы и кроветворных клеток. Ретикулярные клетки имеют самостоятельные стволовые клетки, способные дифференцироваться во все клеточные элементы.
Классификация лейкоцитов. Морфологические и функциональные особенности отдельных видов лейкоцитов
Существующая в настоящее время классификация лейкоцитарных элементов является морфофункциональной и отражает уровень современных знаний по физиологии лейкоцитов.
Все морфологически идентифицируемые лейкоцитарные элементы можно разделить на две группы с учетом одной из основных функциональных характеристик клеток – способности к делению. Так, различают две подгруппы клеток – пролиферирующих и утративших способность к пролиферации (сюда входят и лейкоциты, покинувшие органы кроветворения – циркулирующие в крови и перешедшие в ткани). Циркулирующие в кровотоке лейкоциты подразделяютя на два функциональных пула: а) свободно циркулирующие в крови, б) клетки, занимающие краевое положение в сосудах и не участвующие в циркуляции, – секвестрированные, или депонированные, лейкоциты.
С учетом морфологических особенностей (наличие зернистости и гранул) все лейкоцитарные элементы делятся на две большие группы: гранулоциты и агранулоциты.
Свойства лейкоцитов
1. Все виды лейкоцитов в большей или меньшей степени обладают способностью к амебовидному движению, что обеспечивает миграцию лейкоцитов в ткани через сосудистую стенку. Этот процесс называется диапедезом. Он определяет защитную функцию лейкоитов. 50 % лейкоцитов за пределами сосудистого русла находятся в межклеточном пространстве, а 30 % – в костном мозге.
2. Лейкоциты обладают положительным хемотаксисом по отношению к бактериальным токсинам, продуктам распада бактерий и дегенерирующим клеткам организма, комплексам антиген – антитело.
3. Одним из важных свойств лейкоцитов является способность к фагоцитозу и пиноциозу.
4. Лейкоциты обеспечивают механизмы резистентности за счет лизосомальных ферментов, в частности протеаз, пептидаз, диастазы, дезоксирибонуклеазы, липаз, поступающих в окружающие ткани при жировой дегенерации лейкоцитов. Бактерицидные свойства лейкоцитов обеспечиваются и освобождением лизоцима, катионных белков, лактоферрина, активных форм кислорода.
5. Лейкоциты являются регуляторами коагуляционного потенциала крови. Это свойство лейкоцитов обусловлено содержанием в них активаторов и проактиваторов плазминогена, а также наличием в лизосомах фибринолитическиактивных протеаз, которые могут расщеплять фибрин без участия плазминогена. Вышеуказанные факторы обеспечивают создание альтернативного механизма фибринолиза наряду с плазминовой фибринолитической системой, что играет важную роль в деблокировании сосудистого русла при ДВС-синдроме.
6. Лейкоциты участвуют в развитии синдрома системного воспалительного ответа, лихорадки, регуляции лейкопоэза за счет образования цитокинов с дистантным действием.
7. Лейкоциты обеспечивают индукцию и развитие специфических иммунологических механизмов защиты, а также аллергических реакций гуморального и клеточного типов.
Гемопоэз и его регуляция
Кровь является исключительнореактогенной системой, характеризующейся разнообразными изменениями клеточного состава, а также растворимых компонентов в ответ на действие патогенных факторов.
Система крови представляет собой производное мезенхимы и включает следующие основные компоненты: кровь и лимфу, органы кроветворения и иммунопоэза, а также клетки крови, эмигрирующие в соединительную ткань, и эпителиальные ткани. Естественно, чрезвычайно важная роль в регуляции гомеостаза периферической крови отводится органам кроветворения, в частности костному мозгу, где в условиях нормы имеют место сохранение динамического равновесия между процессами гемопоэза и распада клеток, а также определенная стадийность дифференцировки элементов миелоидного, лимфоидного, эритроцитарного и мегакариоцитарного рядов.
В процессе раннего эмбрионального периода жизни (около 2-х недель очаги системы гемостаза формируются в желточном мешке, где пролифирируют и дифференцируются участки мезенхимы, мезодермальных клеток).
Основными местами гемопоэза, начиная с 11-й недели гестации и прежде всего второго триместра, являются печень и селезенка. Гемопоэз смещается из печени и селезенки в мозговые полости костей лишь с 3-го триместра гестации и остается в этих структурах к моменту рождения ребенка. В течение юности и зрелого возраста места гемопоэза постепенно смещаются из трубчатых костей скелета в плоские кости (череп, позвонки, грудина, ребра, таз), которые становятся основными местами гемопоэза у взрослых людей.
Основные гемопоэтические факторы роста включают группы гормонов и цитокинов, продуцируемых в значительной мере стромальными клетками микроокружения.
В последние годы достигнуты определенные успехи в унификации представлений о характере и механизмах процессов гемопоэза в костном мозге, роли цитокинов в гистогенезе элементов крови.
Ежедневно у человека обновляется около 100 млрд форменных элементов периферической крови. В гемопоэтической ткани костного мозга гранулоциты и их предшественники составляют около 60 %, эритроидные предшественники – 20 %, лимфо- и моноциты – около 10 %, а недифференцированные и разрушающиеся клетки – также около 10 %.
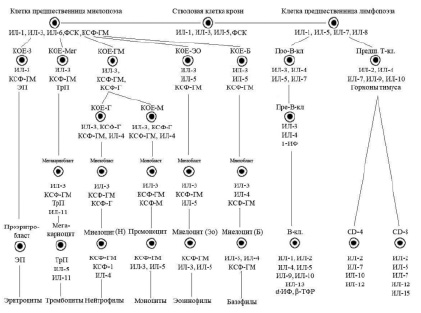
Согласно унитарной теории кроветворения, сформулированной А.А. Максимовым, источником всех линий кроветворения в костном мозге являются «родоначальные клетки». Длительное время не существовало единой терминологии для их обозначения. В настоящее время используют термин «плюрипотентные стволовые клетки» (ППСК), трансформирующиеся в костном мозге в мультипотентные стволовые клетки.
Современная схема гемопоэза была разработана А.И. Воробьевым совместно с И.Л. Чертковым (1973), которая в основном используется в настоящее время с различными дополнениями и модификациями.
Кроветворная ткань является динамичной, постоянно обновляющейся системой, в связи с этим знание кинетики гемопоэза необходимо для понимания патогенеза заболеваний различной этиологии. Гемопоэтические клетки отличаются большим разнообразием структуры и функции, обеспечивающим в процессе их созревания самые различные биологические процессы, такие, как транспорт О2, гемостаз, фагоцитоз, иммунитет.
В настоящее время очевидно наличие шести классов дифференцировки клеток периферической крови (схема), причем первые два класса клеток включают плюрипотентные и мультипотентные клетки костного мозга, морфологически не распознаваемые элементы. К III классу относят коммитированные унипотентные клетки-предшественницы, к IV классу относятся бласты – ядросодержащие клетки эритроцитарного, лимфоидного, миелоидного и мегакариоцитарного рядов, V класс – это созревающие клетки. Часть клеток миелоидного ряда (юные и палочкоядерные) уже содержатся в периферической крови, а VI класс – это зрелые клетки крови и костного мозга.
Касаясь более детальной характеристики гемопоэтических клеток костного мозга, следует отметить, что ППСК, являющиеся источником образования клеток крови, составляют 0,01 % от всех ядросодержащих клеток костного мозга. Однако этого количества достаточно для восстановления гемопоэза в случаях аплазии и гипоплазии костного мозга. Ранее считалось, что клетки крови происходят из гемоцитобласта – производного гемогистиобласта.
ППСК – морфологически не распознаваемая клетка, условно относится к I классу кроветворения, маркерной молекулой этих клеток является CD34, экспрессируемая и эндотелиоцитами сосудов. ППСК относится к категории самоподдерживающихся клеток, способных к митотическому делению до 100 раз в течение своей жизни. Всего у человека примерно 4–400×105 стволовых клеток крови, некоторые из них выходят из костного мозга и обнаруживаются в крови.
Упрощенная схема регуляции кроветворения (Алмазов В.А., 1999): ФСК – фактор стволовой клетки, КОЕ – колониеобразующая единица, ИЛ – интелейкин, КСФ – колониестимулирующий фактор, ИФ – интерферон, ТФР – трансформирующий фактор роста, ЭП – эритропоэтин, ТрП – тромбопоэтин
Миграция стволовых клеток усиливается при нарушениях гомеостаза, в частности при гипоксиях, радиации, химиотерапии и других стрессорных воздествиях, находится под контролем хемокина CXCL-12, синтезируемого остеокластами, эндотелиальными клетками, клетками стромы. Регуляторами миграции стволовых клеток являются также КСФ-Г и ИЛ-1. Стволовые клетки в покоящемся состоянии выполняют две основные функции: 1) самоподдержание за счет низкого уровня пролиферативной активности; 2) дифференцировку в сторону образования коммитированных предшественников.
Дальнейшая дифференцировка ППСК обеспечивается различными специфическими и неспецифическими механизмами. Различают локальные и длиннодистантные механизмы регуляции. Локальные механизмы регуляции обеспечиваются за счет тканевого, микрососудистого, нервного компонентов и распространяются преимущественно на I и II классы клеток кроветворения в костном мозге. Тканевый компонент регуляции гемопоэза включает межклеточное взаимодействие, а также продукцию клетками соединительной ткани, моноцитарно-макрофагальной, мегакариоцитарной линий, эндотелием различных цитокинов с ростстимулирующим действием. Микрососудистый и нервный компоненты обеспечивают соответственно оксигенацию и трофику стромы и паренхиматозных элементов, а также выход в кровоток форменных элементов.
Начиная с коммитированных клеток костного мозга, в регуляции гемопоэза доминируют длиннодистантные механизмы, обеспечиваемые различными цитокинами, системой «кейлоны – антикейлоны», гормонами.
Касаясь динамики гемопоэза в костном мозге, следует отметить, что вслед за классом ППСК возникает образование мультипотентной полустволовой клетки, или клетки – предшественницы лимфопоэза, под влиянием фактора стволовой клетки (ФСК), ИЛ-1, ИЛ-6. Параллельно происходит образование из полипотентной стволовой клетки мультипотентной полустволовой клетки – предшественницы миелопоэза под влиянием ряда цитокинов: ФСК, ИЛ-1, ИЛ-3, ИЛ-6, КСФ-Г.
Третьим классом недифференцированных клеток гемопоэза костного мозга являются коммитированные, или унипотентные, клетки. Для лимфоидного ряда – это про-Т- и про-В-лимфоциты, а для миелоидного ряда – это колониеобразующие клетки эозинофильного и базофильного рядов (КОЕ-Эо, КОЕ-Б), нейтрофильного ряда (КОЕ-Г), моноцитарного ряда (КОЕ-М), а также эритроцитарного (КОЕ-Э) и мегакариоцитарного (КОЕ-Мег) рядов.
Гемопоэтические клетки III класса – короткоживущие, интенсивно пролиферирующие, идентифицируемые клетки. Регуляторами их пролиферации и дифференцировки являются цитокины и «специфические» гемопоэтины.
Последними пролиферирующими клетками гемопоэтического ряда являются клетки IV класса – бласты – морфологически и гистохимически распознаваемые элементы (миелобласты, лимфобласты, монобласты, эритробласты). V класс дифференцировки включает созревающие клеточные элементы (для миелоидного ряда это промиелоцит, миелоцит, метамиелоцит, палочкоядерные лейкоциты; для лимфоидного ряда – пре- и про-В- и Т-лимфоциты, протоплазмоциты; для эритроцитарного ряда – пронормоцит, базофильный, полихроматофильный, оксифильный нормоцит, ретикулоцит.
VI класс включает в себя зрелые клетки костного мозга и периферической крови.
Касаясь кинетики гемопоэза, следует отметить, что для делящихся клеток-предшественниц митотический цикл, помимо митоза, включает фазу G1, во время которой происходит подготовка гемопоэтических клеток к синтезу ДНК, а далее S-фазу, характеризующуюся удвоением количества ДНК, и фазу G2, включающую период подготовки к митотическому делению. Продолжительность митотического цикла для морфологическинераспознаваемых клеток-предшественников составляет в среднем около 20 часов.
Относительно регуляции гемопоэза необходимо отметить по крайней мере два его варианта – конститутивный и индуцированный гемопоэз. Конститутивный гемопоэз регулируется цитокинами и межклеточным взаимодействием, а осуществляется в особых зонах скопления стволовых клеток. Часть стволовых клеток, медленно размножаясь, мигрирует в другие зоны костного мозга, где и дифференцируется.
Индуцированный гемопоэз возможен при нарушениях гомеостаза при различных стрессорных воздействиях (гипоксия, интоксикация, ионизирующая радиация) и регулируется в основном КСФ-Г, ИЛ-1, ФСК.
Согласно данным литературы, важнейшими стимуляторами пролиферации и дифференцировки клеток гранулоцитарного и моноцитарного рядов оказываются колониестимулирующие факторы (КСФ). Последние являются пептидами, продуцируемыми у человека моноцитарно-макрофагальными клетками крови различных тканей, в частности костного мозга, а также лимфоцитами, эндотелиальными клетками, фибробластами, тучными клетками на фоне антигенной стимуляции. Наиболее изучены мульти-КСФ (ИЛ-3), гранулоцитарно-макрофагальный КСФ (КСФ-ГМ), макрофагальный КСФ (КСФ-М), гранулоцитарный КСФ (КСФ-Г). Усиление лейкопоэза возникает под влиянием провоспалительных цитокинов: ИЛ-1, ИЛ-6, ИЛ-8, а также под влиянием ряда медиаторов воспаления, в частности лейкотриенов В4, С4, ФСК, вырабатываемого клетками микроокружения стволовых клеток. Универсальными стимуляторами гранулоцитарно-моноцитарного лейкопоэза являются гормоны адаптации: катехоламины, глюкокортикоиды, реализующие свои эффекты на костный мозг через усиление образования КСФ и интерлейкинов. К числу стимуляторов лейкопоэза относятся витамин В12, аскорбиновая кислота, фолиевая кислота, железо. Подавление костно-мозгового кроветворения возможно под влиянием ряда медиаторов воспаления, таких, как простагландины Е1, Е2, ИЛ-10, ИЛ-13, ФНО-α, трансформирующий фактор роста бета (ТФР-β), а также лактоферрина и кислого изоферритина.
Регуляция пролиферации и дифференцировки лимфоцитов находится под влиянием цитокинов, интенсивно образующихся на фоне воздействия различных антигенов инфекционной и неинфекционной природы лимфоцитами и моноцитами, в частности ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-7, бластогенного и митогенного факторов. Классическими ингибиторами лимфопоэза являются гормоны адаптации: АКТГ, глюкокортикоиды, индуцирующие развитие реакции апоптоза и цитолиза в лимфоидной ткани.
В настоящее время очевидна определяющая роль цитокинов в регуляции костно-мозгового кроветворения, в частности ФСК, КСФ-Г, КСФ-М, КСФ-ГМ, а также ИЛ-3 или мульти-КСФ, регулирующих дифференцировку и созревание практически всех ростков кроветворения. К настоящему моменту для многих цитокинов определены структура и биологические свойства.
Далее приведены особенности биологических эффектов некоторых из указанных цитокинов, влияющих на процессы роста и дифференцировки гемопоэтических клеток костного мозга.
Фактор стволовых клеток (ФСК). ФСК – ростовой фактор для гемопоэтических стволовых клеток, образование которого детерминируется геном 12-й хромосомы (q22-q24). Биологическая активность ФСК проявляется в виде растворимой и мембранно-связанной форм. Трансмембранный белок состоит из 273 аминокислотных остатков, растворимая форма представлена нековалентно-связанным димером.
Рецептор ФСК, c-kit, обозначается как CD117, его связывание с ФСК приводит через ряд промежуточных реакций к активации протеинкиназы С и yak2/STAT пути клеточной активации [20]. ФСК интенсивно синтезируется в разных тканях плода, а в постнатальном периоде в фибробластах, эндотелиоцитах, недифференцированных стромальных клетках.
В организме человека ФСК оказывает интенсивное стимулирующее влияние на тучные клетки, пролиферацию предшественников Т- и В-лимфоцитов, интраэпителиальных γδ-лимфоцитов.
ФСК стимулирует CD34+ стволовые клетки человека и в сочетании с ИЛ-3, КСФ-Г, КСФ-ГМ усиливает формирование гранулоцитарно-макрофогальных и эритроцитарных колоний, предшественников тучных клеток.
Fit-3-лиганд. Другим стимулятором гемопоэза в костном мозге является Fit-3-лиганд, взаимодействующий с тирозинкиназными рецепторами. Подобно ФСК и КСФ-М, Fit-3-лиганд продуцируется стромальными клетками, клетками эндотелия и Т-лимфоцитами, а его рецептор экспрессируется на ранних гемопоэтических клетках – предшественницах миеломоноцитарного ряда и на пре-В-лимфоцитах.
Эффекты fit-3-лиганда на костно-мозговые клетки усиливаются цитокинами ИЛ-3 и КСФ-ГМ. Комбинация ФСК и Fit-3-лиганда значительно усиливает пролиферацию костно-мозговых стволовых клеток. Рекомбинантный fit-3-лиганд стимулирует пролиферацию CD34+ стволовых клеток костного мозга человека, а также ранних гемопоэтических клеток-предшественниц. Однако его эффекты слабее, чем у ФСК-ГМ.
Гранулоцитарный колониестимулирующий фактор (КСФ-Г). Образование КСФ-Г детерминируется геном хромосомы 17 у человека (С17, q11-q21). Зрелый цитокин имеет глобулярную структуру с ММ 18,6 кДа, синтезируется моноцитами, фибробластами, эндотелием, стромальными клетками, а далее поступает в системный кровоток и в костный мозг. Рецепторы цитокина экспрессируются на клетках миеломоноцитарного ростка кроветворения от миелобластов до зрелых гранулоцитов, а также на некоторых клетках моноцитарного ростка. Продукция КСФ-Г стимулируется вовлечением провоспалительных цитокинов ИЛ-1, ФНО, бактериальных эндотоксинов. Биологическое действие КСФ-Г связано с ускорением пролиферации и созревания ранних предшественников гранулоцитов, усилением фагоцитарной активности нейтрофилов, их кислородзависимого киллинга и антителонезависимой цитотоксичности, продукцией зрелыми нейтрофилами ИЛ-8 и активацией хемотаксиса под влиянием ИЛ-8.
КСФ-Г после стимулирующего влияния на гемопоэз в условиях воспаления, инфекции, оказывает активирующее влияние на продукцию ИЛ-4, ИЛ-10, стимулирует Th2, усиливает гуморальное звено иммунитета, обеспечивает антибактериальную защиту организма.
Макрофагальный колониестимулирующий фактор (КСФ-М). Макрофагальный колониестимулирующий фактор КСФ-М продуцируется стромальными клетками костного мозга, фибробластами, моноцитами, макрофагами, гепатоцитами, эндотелием, гладкомышечными клетками. КСФ-М кодируется геном, расположенным на коротком плече первой хромосомы в зоне р13-р21, а также на 5-й хромосоме(CD q33). Мономер КСФ-М состоит из 256 аминокислот, существует в виде растворимой и мембранно-связанной формы. КСФ-М увеличивает экспрессию антигенов МНС II на макрофагах, усиливает их цитотоксичность.
Рецепторы M-CSF относятся к семейству рецепторов ростовых факторов, кодируются протоонкогеном c-fmg, экспрессируются на всех клетках моноцитарного ряда, гладкомышечных клетках и на трофобласте.
Ген КСФ-М во многих клетках экспрессируется конститутивно, усиление синтеза цитокина возникает под влиянием ИЛ-10, ФНО-α, КСФ-ГМ, прогестероном, ИЛ-4.
КСФ-М стимулирует пролиферацию, дифференцировку клеток – предшественниц моноцитарного ряда, вызывает развитие моноцитоза, тромбоцитопении, иногда нейтропении, повышает противоопухолевую антителозависимую цитотоксичность моноцитов и антибактериальную активность клеток моноцитарно-макрофагального ряда.
Гранулоцитарно-макрофагальный колониестимулирующий фактор (КСФ-ГМ). КСФ-ГМ – ростовой фактор, он синтезируется в условиях нормы в незначительных количествах, а при воспалении различного генеза интенсивность синтеза возрастает под влиянием бактериальных эндотоксинов, провоспалительных цитокинов.
Зрелый КСФ-ГМ имеет ММ 14,5 кДа, состоит из 127 аминокислотных остатков. Интенсивное гликозилирование КСФ-ГМ в процессе синтеза приводит к увеличению его ММ и синтетической биологической активности.
Рецепторы КСФ-ГМ обладают высокой аффинностью связывания лиганда.
После связывания КСФ-ГМ с рецепторами активируется МАР-киназа, Scr-киназа и фосфатидилинозитол-3-зависимая киназа, киназа Jak-2.
Биологическая активность КСФ-ГМ направлена на стимуляцию и дифференцировку миеломоноцитарных предшественников гемопоэза, колоний мегакариоцитов, а также на усиление функциональной активности нейтрофилов, эозинофилов, моноцитов за счет стимуляции хемотаксиса, адгезии, продукции активных форм кислорода.
КСФ-ГМ вызвает усиление антигенпрезентирующей функции моноцитов, цитотоксичности моноцитов в отношении опухолевых клеток.