Мотилиум или итоприд что лучше
Могла ли желчь в желудке, при остром гастрите ещё больше травмировать слизистую? Что лучше, Мотилиум, Итомед или Ганатон?
Здравствуйте! 27 дней назад, перепутав соусы, я случайно макнула ролл в уксус 6%. Лечение назначили на 5 день, и только с 6-го сказали соблюдать диету. На 11 сутки сделали ФДГС, в заключении «Катаральный эзофагит н/3. Диффузный поверхностный гастрит. Дуодено-гастральный рефлюкс»(фото прикладываю) назначили только Омепразол и Алмагель.
Только с 17 суток после случившегося я стала принимать ОмезДСР, т.е. в составе Домперидон по 30 мг 2 р/д, и на 19 сутки, т.е. через пару дней перешла на Мотилиум, получается по 10 мг Домперидола 3 р/д. Таким образом принимала дней 13 Домперидон с вчерашнего дня перешла на Ганатон, это уже 14 дней приема такого рода препаратов. Как долго можно принимать эти препараты? Они правда при приёме более 5-7 дней могут привести к кистозному перерождению молочных желез? И какой из препаратов (Мотилиум, Итомед, Ганатон) лучше препятствует обратному забросу желчи, и регулируют сокративость сфинктеров пищевода и ДПК?
Так же дня три назад по назначению стала принимать Урсосан, после него как мне кажется начало появляться улучшение. В связи с чем вопрос. Не могла ли эта желчь за те 23 дня, пока я его не приниамала, привести к ещё бОльшим поражениям? Например эрозиям, язвам и т.д? Ведь до начала его приема вся симптоматика (дисфагия, першение, жжение в пищеводе и желудке), даже при приеме воды сохранялась, и только сейчас более менее похоже на заживление. Хоть все-равно жжёт, и словно сухо внутри и треснет вот вот, постоянно хочется обволакивать препаратами вроде Малокса. Неужели эта желчь в желудке все это время не давала слизистой заживать? А может и вовсе все хуже стало из-за неё, и она её еще больше за это время трпвмировала?
На сервисе СпросиВрача доступна консультация гастроэнтеролога по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!
Мария, спасибо! У меня уже приём Домперидона в совокурности составил 13 дней(( Ганатон не подойдет вместо Итомеда? Его можно продолжать пить после такого длительного приёма Домперидона?
У меня после приема Урсосана болит ниже правых ребер, переживаю, не травмирует ли препарат слизистую ДПК? У меня именно там часто жгучая боль. ведь капсула именно там растворяется? По заключению ФДГМ в ДПК все в норме?
По поводу желчи, просто ведь и так получается был ожог, а тут ещё и она воздействовала всё это время((
Мария, все верно, извините! Я перепутала. УЗИ прикрепила тоже. Только мне его делали через 2 часа примеро после приёма пищи.
Да, мне в предыдущие дни показалось, что после Урорсосана становится лучше, но сегодня примерно через минут 10-15 после приема, стало жжечь немного слева, и сильнее справа, почему-то мне кажется, что это в районе ДПК, а т.к. капсула Урсосана именно там рассасывается, переживаю вдруг кислота в составе препарата действует на слизистую ДПК и желудка? В связи с этим просила посмотреть в заключении ФДГС сомтояние ДПК.
Функциональные расстройства кишечника и желчевыводящих путей. Лечебные подходы, выбор спазмолитика

Рассмотрены виды функциональных расстройств кишечника и билиарного тракта, общие клинические проявлениям при разных формах таких расстройств, алгоритм диагностики и подходы к лечению пациентов с применением спазмолитиков.
Types of functional dysfunctions of bowels and biliary have been reviewed, general clinic preparations for different forms of such dysfunctions, diagnostic algorithm and approaches to treatment with antispasmodic agents application.
К функциональным расстройствам органов пищеварения относятся различные устойчивые комбинации хронических или рецидивирующих гастроинтестинальных симптомов, не объяснимых на сегодняшний день структурной, органической или известной биохимической патологией.
Согласно рекомендациям Римского консенсуса III (2006 г.) к функциональным расстройствам кишечника и билиарного тракта относят [1]:
I. Функциональные кишечные нарушения:
II. Дисфункциональные расстройства билиарного тракта:
По характеру моторных расстройств билиарного тракта их подразделяют на гиперфункциональные и гипофункциональные.
Общими клиническими проявлениями при разных формах функциональных расстройств желчевыводящей системы и кишечника являются: абдоминальные боли, метеоризм, изменения частоты и характера стула.
В регуляции двигательной активности кишечника и билиарной системы принимают участие парасимпатический и симпатический отделы вегетативной нервной системы, обеспечивающие их сбалансированное влияние с последующей передачей импульсов на интрамуральные сплетения.
Сокращение гладкой мускулатуры желудочно-кишечного тракта (ЖКТ) возникает при стимуляции ацетилхолином мускариновых рецепторов на поверхности мышечной клетки. Это приводит к открытию натриевых каналов и входу Na + в клетку. Появившаяся деполяризация клетки, в свою очередь, способствует открытию кальциевых каналов и входу Са 2+ в клетку. Увеличившийся внутриклеточный уровень Са 2+ способствует фосфорилированию миозина и, соответственно, сокращению мышцы. В зависимости от интенсивности сигнала может возникнуть мышечный спазм, который формирует боль.
В свою очередь симпатические импульсы содействуют выходу К + из клетки и Са 2+ из кальциевого депо, закрытию кальциевых каналов и расслаблению мышцы [2, 3].
Таким образом, учитывая тот факт, что в формировании боли при билиарной дисфункции и функциональных расстройствах кишечника лежит чрезмерное сокращение гладкой мускулатуры, в купировании их основное место должны занимать антиспастические средства.
В настоящее время для купирования боли используют релаксанты гладкой мускулатуры, которые включают в себя следующие группы:
1. Миотропные спазмолитики:
2. Нейротропные спазмолитики (блокируют процесс передачи нервных импульсов в вегетативных ганглиях и нервных окончаниях, стимулирующих гладкомышечные клетки):
3. Прокинетики — группа препаратов, нормализующих моторную активность ЖКТ; усиливают пропульсивную активность верхних отделов ЖКТ за счет антагонизма с дофаминовыми рецепторами (метоклопромид, домперидон (Мотилиум) и итоприд (Ганатон), который помимо блокады дофаминовых рецепторов ингибирует активность холинэстеразы, подавляя разрушение ацетилхолина, расширяя зону регуляции).
4. Универсальные модуляторы моторики ЖКТ (блокаторы µ-, δ-рецепторов и активаторы κ-рецепторов) — тримебутин (Тримедат).
Таким образом, в основе функциональных расстройств ЖКТ лежат расстройства моторики, а представленная выше группа препаратов так или иначе влияет на тонико-перистальтическую активность, причем спектр этих влияний очень разнообразный и нередко, используя их, мы сталкиваемся с эффектами, нежелательными в данной конкретной ситуации. Так, нейротропные спазмолитики имеют широкий спектр «побочных» эффектов, ограничивающих их длительное применение, а у отдельных категорий больных их применение вообще нецелесообразно. Основным недостатком миотропных спазмолитиков являются отсутствие селективности и возможность развития гипомоторной дискинезии и гипотонии всего сфинктерного аппарата ЖКТ [4].
Подводя итог всего вышеизложенного, можно констатировать, что на сегодняшний день мы располагаем большим арсеналом препаратов, действующих на разные патогенетические звенья спазма гладкой мускулатуры, формирующие боль. Наша задача состоит в том, чтобы выбрать наиболее адекватный спазмолитик, свести к минимуму побочные эффекты, максимально быстро купировать боль, ограничить, не допустить ее возврата.
Почему боль является главным проявлением, определяющим выбор препарата? Потому что она нередко является единственным симптомом, свидетельствующим о функциональном расстройстве, а остальные проявления требуют доказательного обследования.
Как же выбрать наиболее рациональный препарат для лечения? Мы предлагаем следующий алгоритм выбора препарата:
I. В зависимости от степени выраженности и зоны распространения спазмолитического эффекта (табл. 1).
II. В зависимости от сочетания зон спазма:
а) желудок + мочеполовая сфера;
б) пищевод, желудок + кишечник;
в) пищевод + мочевой пузырь;
г) желчевыводящие пути + мочеточники (почки);
д) желчевыводящие пути;
е) кишечник (без определенной локализации);
ж) кишечник (правые отделы);
з) кишечник + сфинктер Одди;
и) «спастическая дискинезия» + патология предстательной железы;
к) спастическая дискинезия + пожилой и старческий возраст.
III. В зависимости от интенсивности боли (острая — парентеральный вариант введения препарата).
IV. В зависимости от возраста.
V. В зависимости от издержек использования спазмолитиков:
а) «стирание» симптоматики;
б) распространение зон действия;
в) отрицательные эффекты при сочетании с другими фармпрепаратами;
г) вариант исходного состояния вегетативной нервной системы.
Предложенный алгоритм выбора препарата не является догмой — он только показывает ориентиры, которые помогают в выборе. Выбрав и начав лечение, мы оцениваем эффективность:
Но главным в лечении является диагностика «клинической ситуации», которая позволяет говорить либо об органической патологии и вторичном характере функциональных расстройств, либо о функциональной патологии (рис.).
Таким образом, диагностика функциональной патологии на сегодняшний день является диагностикой исключения органической патологии. Установив это, мы оцениваем характер функциональных расстройств и определяем комплекс расстройств в целом.
Мы решили представить результаты лечения 60 больных препаратом Дицетел: 30 из них страдали синдромом раздраженного кишечника (по 10 — вариант с запором, вариант с диареей, болями и вздутием живота). Возраст больных от 18 до 60 лет; преобладали женщины — 2:1. Диарейный синдром характеризовали отсутствием диареи ночью; позывы к стулу возникали утром, после завтрака, стулу предшествовали боли «спастического» характера, которые проходили после стула. Запоры носили постоянный характер (у 8), у 2 больных — периодический. Вариант СРК с болями и вздутием у 7 больных носил постоянный характер, у 3 — характер приступообразного вздутия.
Исследование исключало органическую патологию (ирригоскопия, колоноскопия). Контролем за моторикой явилась: электромиография, «карболеновая проба» в динамике. Лечение Дицетелом проводили на протяжении 4 недель в суточной дозе 150 мг. Если эффект оценивали как недостаточный, доза могла быть увеличена до 300 мг/сутки; если не удавалось справиться с диареей, то лечение дополнялось Смектой; если не удавалось справиться с запором, то назначали Форлакс. Эффективность лечения оценивалась по динамике клинических симптомов, по скорости и полноте купирования болей.
Результаты лечения
На фоне проводимой терапии Дицетелом в течение 2 недель общая эффективность составила 63% (при этом боли купированы полностью у всех больных). Запоры, в основном, были купированы на дозе 150 мг/сутки — у 77% больных, у 5 больных потребовалось увеличение дозы Дицетела до 300 мг/сутки и у одного больного потребовалось назначение Форлакса. При варианте с диареей эффект составил 74%, у 5 больных (15%) потребовалось назначение Смекты, хотя общее количество послаблений уменьшилось до 1–2 раз в сутки; у 1 больного исчезли императивные позывы, хотя утренний (жидкий, полуоформленный) стул сохранился. При изучении «карболеновой пробы» было зарегистрировано удлинение времени пассажа по кишечнику с 14,3 часа до 18,1 часа. В группе больных с болями и метеоризмом в течение первых двух недель лечения достигнуто уменьшение степени вздутия и болей у 63% больных и только увеличение дозы Дицетела до 300 мг/сутки привело к регрессии симптоматики у 83% больных; 17% больных нуждались в лекарственной коррекции дисбиоза, и только после этого был достигнут полный эффект у 87% больных (4 больных сохранили умеренную степень вздутия живота, постоянную или приступообразную).
Таким образом, использование Дицетела для лечения больных СРК (разные варианты) в дозе 150 мг/сутки оказалось эффективным у 63% больных, увеличение дозы препарата до 300 мг/сутки позволило добиться эффекта в целом у 77% больных; у 17% больных потребовался сочетанный вариант лечения (Смекта у больных с послаблением; Форлакс — у больных с запором и Бактисубтил — у больных с вздутием и болями).
У 2 больных (6%) достаточный эффект получен не был, и мы рассмотрели их в плане более сложного генеза функциональных расстройств, хотя боли значительно уменьшились.
Вторую группу составили 30 больных в возрасте от 20 до 74 лет с различными дискинезиями желчевыводящих путей. 10 больных имели гипокинетическую дискинезию желчного пузыря (ГДЖП), 10 — дисфункцию сфинктера Одди 3-го типа (ДСО), 10 — гиперкинетическую дискинезию желчного пузыря (ГрДЖП). Средний возраст больных составил 54,6 года. Мужчин было — 3, женщин — 27.
Все пациенты предъявляли жалобы на боли различного характера, диспепсические проявления и кишечные расстройства. Боли локализовывались, в основном, в правом подреберье, не иррадиировали, провоцировались едой, интенсивность была умеренной.
Результаты изучения диспепсического синдрома и характер стула представлены в табл. 2.
Как видно из таблицы, диспепсические проявления регистрировались у 70% больных (с разной частотой в разных группах, максимально у больных с гипокинезией желчного пузыря и ДСО) и практически у половины больных фиксировались те или иные нарушения стула.
Рандомизированные в группы больные получали монотерапию Дицетелом в суточной дозе 50 мг × 3 раза. Общая продолжительность лечения составила 20 дней.
Результаты лечения
В целом положительный эффект в отношении диспепсического синдрома достигнут у 80% больных.
Нормализация работы кишечника и при запорах (6 больных), и при полосах (5 больных) наступила к 10–14 дню лечения у всех больных.
Среди побочных эффектов — у 2 пациентов наблюдали усиление болей в верхних отделах живота — в одном случае в начале лечения, а в другом на 6–9 дни лечения, что послужило причиной отмены препарата.
Таким образом, положительный эффект в отношении болевого синдрома получен в 83% случаев, диспепсического — в 80% случаев и синдрома кишечной дисфункции — в 100% случаев.
Было оценено также влияние Дицетела на состояние желчного пузыря, при этом отмечено преимущественное влияние препарата на гипертонус желчного пузыря и восстановление нормокинезии у 80% больных, что, по всей вероятности, связано с восстановлением градиента давления и нормализацией опорожнения желчного пузыря в связи с этим.
При оценке влияния Дицетела на функциональную патологию кишечника (СРК) и дискинезию желчевыводящих путей на основании проводимого исследования следует отметить эффект у 80% больных. Это хороший показатель, при этом фиксируется небольшое количество «побочных» эффектов, что связано, по всей вероятности, с селективным эффектом его действия, реализующимся только на уровне кишечника. Недостаточность эффекта у отдельной категории больных может быть усилена дозой (максимальные дозы не использовались) или сочетанным вариантом лечения на отдельные симптомы кишечной диспепсии.
Отсутствие эффекта у небольшой части больных (6–10%) связано, скорее всего, с нарушением других регулирующих систем (опиодных, вегетативной нервной системы, гормональной системы), которые подлежат использованию в случаях неуспеха лечения.
Заключение
В настоящем сообщении представлены данные о функциональных расстройствах кишечника и желчевыводящих путей, а также лекарственные препараты, влияющие на тонус и сократительную способность ЖКТ. На основании собственных данных предложен алгоритм выбора препарата, влияющего на дисфункциональные расстройства и результаты лечения больных с разными вариантами СРК и дисфункциональными расстройствами желчевыводящих путей (всего 60 больных). В лечении использован представитель миотропных спазмолитиков — селективный блокатор кальциевых каналов Дицетел. Показана высокая эффективность препарата в лечении (83% — эффективность в лечении СРК и 80% — в лечении функциональных расстройств желчевыводящих путей).
Селективность препарата обеспечила небольшое количество побочных эффектов (3,3%). В отношении дисфункции кишечника препарат обладает прямым спазмолитическим эффектом, в отношении дисфункции желчевыводящих путей — преимущественно непрямым эффектом, связанным с уменьшением внутрипросветного давления в кишечнике, восстановлением градиента давления и пассажа желчи. Препарат может быть рекомендован для лечения указанных расстройств.
Литература
О. Н. Минушкин, доктор медицинских наук, профессор
ФГБУ УНМЦ Управления делами Президента РФ, Москва
Щербинина М.Б. Итомед®: рациональное лечение дискинезий желудочно-кишечного тракта // Поликлиника. 2012. № 4. С.52–54.
Итомед®: рациональное лечение дискинезий желудочно-кишечного тракта
М.Б. Щербинина, д.м.н., профессор, заместитель директора ГУ «Институт гастроэнтерологии АМН Украины», г. Днепропетровск
Дискинезии (нарушения моторики) желудочно-кишечного тракта (ЖКТ) часто выступают ведущим патогенетическим фактором, сопровождая развитие многих распространенных гастроэнтерологических заболеваний [1, 2]. Так, первичное нарушение моторики ЖКТ имеет место при различных дискинезиях пищевода (диффузный и сегментарный эзофагоспазм, кардиоспазм), гастроэзофагеальной рефлюксной болезни (ГЭРБ), функциональной диспепсии (ФД) и дискинезии двенадцатиперстной кишки, желчевыводящих путей и сфинктера Одди, синдроме раздраженного кишечника (СРК). Прогрессирование дискинезии любого отдела пищеварительной системы неизбежно приводит к изменению секреции, переваривания, всасывания, состояния микрофлоры (дисбиоз), активности иммунной системы и др.
Регуляция моторики ЖКТ является многоуровневой. Состояние ЦНС, общий психоэмоциональный фон человека оказывают влияние на вегетативную нервную систему, изменяя активность гладкой мускулатуры и желез слизистой оболочки пищеварительной системы. Гуморальная регуляция осуществляется как на системном уровне, так и за счет выработки разнообразных интестинальных гормонов, взаимодействующих с автономной нервной системой ЖКТ. Местная регуляция моторики ЖКТ осуществляется благодаря наличию в гладкой мускулатуре клеток — водителей ритма. В гладких миоцитах кишечника содержатся различные рецепторы: холинергические, дофаминовые, опиатные, 5-НТ4-рецепторы и др. Помимо этого, регуляцию моторики осуществляют несколько медиаторов (простагландины, кинины, оксид азота, гистамин и др.). Такой совокупностью влияний достигается согласованность работы различных отделов ЖКТ, что превращает его в единый «пищеварительный конвейер». В то же время поражение одного отдела ЖКТ вследствие разрушений этих взаимосвязей приводит к вовлечению в процесс и других.
Поиск средств, нормализующих моторную деятельность пищеварительного тракта, постоянно привлекает внимание врачей. В настоящее время средства, воздействующие на моторную активность ЖКТ и препятствующие антиперистальтическим сокращениям гладкой мускулатуры, объединены в группу прокинетиков. Одним из современных препаратов этой группы является Итомед® («ПРО.МЕД.ЦСПрага а.о.», Чешская Республика).
Активное действующее вещество Итомеда представлено итоприда гидрохлоридом, обладающим комбинированным механизмом действия. Препарат проявляет свойства антагониста периферических D2-допаминовых рецепторов и блокатора ацетилхолинэстеразы. Блокирование D2-рецепторов способствует увеличению активности аденилатциклазы и уровня цАМФ в гладких мышцах пищевода, желудка, двенадцатиперстной кишки с повышением двигательной активности этих отделов. Одновременно препарат активирует освобождение и обеспечивает увеличение периода полураспада эндогенного ацетилхолина, пролонгируя его влияние, что, в свою очередь, сопровождается повышением перистальтической активности тонкого и толстого кишечника. Кроме того, благодаря взаимодействию с D2-дофаминовыми хеморецепторами триггерной зоны Итомед® оказывает противорвотный эффект.
Итомед® быстро и практически полностью всасывается в ЖКТ. Его относительная биодоступность составляет 60 %, что обусловлено метаболическими изменениями при первом прохождении через печень под действием флавинзависимой монооксигеназы. Пища не оказывает влияния на биодоступность препарата.
К существенным достоинствам Итомеда относят минимальную способность проникать через гематоэнцефалический барьер в головной мозг, поэтому у него отсутствуют центральные экстрапирамидные и нейроэндокринные побочные эффекты. Немаловажным является также то, что метаболизм препарата позволяет избежать нежелательного лекарственного взаимодействия при сочетании с другими лекарственными средствами, метаболизм которых связан с ферментами системы цитохрома Р450.
Итомед® назначается внутрь до еды по 1 таблетке (50 мг) 3 раза в день. Средняя суточная доза составляет 150 мг. Рекомендованный курс лечения 2-3 недели. У пожилых пациентов дозу снижают. Если препарат не был принят вовремя, то в дальнейшем его следует принимать через равные промежутки времени.
Итоприда гидрохлорид появился в арсенале врачей в 1995 г. На сегодняшний день накоплен достаточно большой позитивный опыт его применения при широком диапазоне заболеваний, указанных выше. Рассмотрим наиболее интересные практические результаты его применения.
Однако, хотя последними исследованиями подтверждено положительное влияние метоклопрамида на тонус НПС, применение препарата при ГЭРБ ограничено значительным количеством побочных эффектов, возрастающим при длительной терапии, таких как выраженные экстрапирамидные нарушения, сонливость, заторможенность и др. [5]. Что касается домперидона, было показано, что он практически не действует на зону НПС [б], поэтому ведение ГЭРБ с его помощью нецелесообразно. Сходные результаты были получены и по частичному агонисту 5-НТ4-рецепторов тегасероду [7]. Авторы публикации пришли к выводу, что тегасерод не оказывает влияния на моторику пищевода и параметры гастроэзофагеального рефлюкса. Рассматривая сложившуюся ситуацию, J. de Caestecker назвал прокинетики лекарствами, не исполнившими при ГЭРБ своих обещаний [6]. Однако исследования, проведенные с итопридом, позволяют вернуться к вопросу применения прокинетиков при ГЭРБ.
В пилотном проспективном рандомизированном открытом исследовании показано влияние итоприда на заброс желудочного содержимого у пациентов со средней степенью тяжести ГЭРБ [8]. Под наблюдением находились 26 пациентов с ГЭРБ, подтвержденной 24-часовой рН-метрией. Длительность исследования составила 30 дней. Сравнивалась эффективность итоприда в дозах 150 мг (1-я группа, 13 пациентов) в сутки и 300 мг (2-я группа, 13 пациентов) в сутки. По результатам показателей 24-часовой рН-метрии до и после лечения, оценки клинических симптомов у пациентов, получавших суточную дозировку 300 мг/сутки, было достоверно меньше время с рН в пищеводе менее 4 (в процентах и в абсолютном выражении), был ниже индекс De Meester. Серьезных побочных эффектов по оценке биохимических показателей крови и уровня пролактина не отмечалось в обеих группах пациентов. Таким образом, терапия итопридом в суточной дозировке 300 мг эффективна в снижении патологических рефлюксов у пациентов с ГЭРБ и имеет потенциал эффективности при лечении этого заболевания.
У 30-40 % населения в странах Западной Европы и России выявляется диспепсия. Считают, что на ФД приходится большая часть случаев (60-67 %) из этого количества. ФД выявляется у каждого третьего пациента на приеме у гастроэнтеролога [9]. Эффективность итоприда у пациентов с ФД изучалась в рандомизированном двойном слепом плацебо-контролируемом исследовании [10]. Сравнивалась эффективность итоприда в дозах 50 мг (1-я группа, 135 пациентов), 100 мг (2-я группа, 1 35 пациентов), 200 мг (3-я группа, 135 пациентов) 3 раза в сутки или плацебо (4-я группа, 142 пациента). Через 8 недель исчезновение симптомов или выраженное улучшение отметили 41 % участников в группе плацебо и 57, 59 и 64 % пациентов в группе итоприда соответственно дозам 150, 300 и 600 мг в сутки (р
Перспективы применения нового прокинетика с двойным механизмом действия в терапии гастроэзофагеальной рефлюксной болезни
И.В. Маев, А.А. Самсонов, А.Н. Одинцова, Е.В. Белявцева, М.Г. Задорова
ГОУ ВПО РГМУ Росздрава, Москва Обсуждаются проблема развития гастроэзофагеальной рефлюксной болезни (ГЭРБ) и тактика ее лечения с учетом основных патогенетических механизмов. На сегодняшний день ведущим направлением в лечении ГЭРБ является кислотосупрессивная терапия, в частности, с использованием ингибиторов протонной помпы (ИПП). Однако с учетом того, что даже самые эффективные ИПП не влияют на первопричину болезни – нарушение двигательной функции пищеварительного тракта, при лечении больных ГЭРБ дополнительно показано использование лекарственных средств, обладающих прокинетическим эффектом на верхние отделы желудочно-кишечного тракта. Препаратом нового поколения прокинетиков является итоприда гидрохлорид (Ганатон) – антагонист дофаминовых D2-рецепторов и блокатор ацетилхолинестеразы. Особенности фармакодинамики и фармакокинетики Ганатона позволяют применять его у больных ГЭРБ в режиме длительной противорецидивной терапии как в комбинации с ИПП, так и в виде монотерапии.
Ключевые слова: гастроэзофагеальная рефлюксная болезнь, нижний пищеводный сфинктер, дуодено-гастральный рефлюкс, прокинетики, итоприда гидрохлорид, ингибиторы протонной помпы
В развитии многих распространенных гастроэнтерологических заболеваний, в первую очередь гастроэзофагеальной рефлюксной болезни (ГЭРБ), важную роль играют нарушения двигательной функции пищеварительного тракта. В основе развития ГЭРБ лежит нарушение моторно-эвакуаторной функции органов эзофагогастродуоденальной зоны, приводящее к систематическим, длительным забросам в пищевод желудочного и дуоденального содержимого, являющегося повреждающим агрессивным агентом для слизистой оболочки пищевода.
Патогенетические механизмы развития ГЭРБ
Считается, что ГЭРБ развивается как результат дисбаланса между агрессивным воздействием забрасываемых компонентов и трехступенчатой системой защиты пищевода, включающей противорефлюксные барьеры, механизмы очищения от кислоты и тканевую резистентность [1–3]. Компоненты, определяющие повреждающие свойства забрасываемых веществ, представлены соляной кислотой, пепсином, солями желчных кислот (связанными и свободными) и панкреатическими ферментами. Повреждение пищевода определяется значением рН желудочного содержимого. Если значение рН нейтральное или щелочное, как у пациентов после гастрэктомии или с атрофическим гастритом, повреждающими агентами являются свободные соли желчных кислот и ферменты поджелудочной железы. Вместе с тем ионы водорода являются основным повреждающим агентом рефлюктата, причем их способность оказывать повреждающее действие зависит и от времени воздействия, и от концентрации, т. е. от рН [2, 4].
Антирефлюксные барьеры, представляющие первую ступень трехступенчатой защиты пищевода, включают нижний пищеводный сфинктер (НПС), интраабдоминальный сегмент пищевода, диафрагмальные ножки, диафрагмально-пищеводную связку, розетку слизистой оболочки и острый угол Гиса [5]. Большое значение придается снижению базального давления в области НПС [6]. НПС и диафрагма – главные структуры, ответственные за создание высокого давления (от 10 до 30 мм рт. ст.) в желудочно-пищеводном переходе. Эта зона предотвращает рефлюкс, поскольку отделяет две смежные зоны низкого давления: в полости желудка (на 5 мм рт. ст.выше атмосферного давления) и в полости пищевода (на 5 мм рт. ст. ниже атмосферного давления). Тоническое давление, создаваемое гладкой циркулярной мышцей НПС, усиливается при сокращении ножек диафрагмы во время вдоха и выдоха и в моменты, когда повышается внутрижелудочное давление, например при чихании, кашле, наклоне туловища [5]. В покое тоническое сокращение НПС поддерживается кроме внутренностного тонуса его мышцы холинергическими возбуждающими нейронами. Краткое расслабление НПС при проглатывании пищи сопровождается перистальтической волной, которая закрывает и очищает просвет пищевода.
Как у здоровых людей, так и при ГЭРБ наблюдается такое явление, как преходящее, транзиторное расслабление НПС [7, 8], которое вызывается чаще всего растяжением стенок желудка при приеме пищи для уменьшения внутрижелудочного давления путем сброса воздуха из газового пузыря желудка (отрыжка воздухом). При этом кроме отрыжки воздухом (часто при расслаблении НПС) возникновение рефлюкса желудочного содержимого объясняется тем, что преходящие расслабления НПС сохраняются в зоне высокого давления так же длительно (около 20 секунд), как и расслабления НПС, инициированные глотанием, но при этом не возникает очищающей просвет пищевода перистальтической волны [9]. У больных ГЭРБ описанные явления отмечаются часто, длительно [10] и являются причиной появления симптомов заболевания (изжоги, отрыжки, срыгивания).
В целом при ГЭРБ описаны три основные ситуации, когда возникает патологический рефлюкс: при преходящем расслаблении НПС, недостаточной функции НПС и вследствие повышенного внутрибрюшного давления.
Причина частого преходящего расслабления НПС при ГЭРБ остается неясной. Вместе с тем все большее число исследователей склоняются к мнению о взаимосвязи патологии запирательного механизма НПС при ГЭРБ с нарушенной моторной активностью желудка, его замедленным опорожнением, приводящим к растяжению стенок органа, или с повышенной чувствительностью к нормальному растяжению желудка, в т. ч. на фоне воспалительного процесса в стенке желудка [11–14]. По мнению Трухманова А.С., с патофизиологической точки зрения ГЭРБ является кислотозависимым заболеванием, развивающимся на фоне первичного нарушения двигательной функции верхних отделов пищеварительного тракта [11]. Более того, ряд авторов утверждают, что нарушение моторной функции желудка может быть важным, если не главным, фактором возникновения и развития ГЭРБ [13, 15–17]. Особое внимание уделяется таким нарушениям моторики желудка и 12-перстной кишки, как желудочные дисритмии, сопровождающиеся замедленной эвакуацией из проксимальных отделов желудка, нарушения антродуоденальной координации и дуодено-гастральный рефлюкс (ДГР) [18–21]. Примечательно, что для антродуоденальной дискоординации характерными симптомами являются изжога, отрыжка кислым, горьким, срыгивание пищи, т. е. характерные симптомы ГЭРБ.
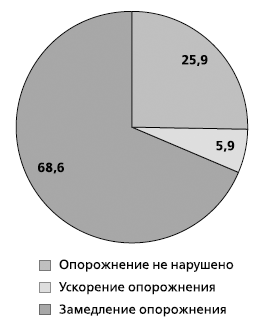
При изучении нами моторной активности желудка и 12-перстной кишки методом динамической гастросцинтиграфии у 204 пациентов с ГЭРБ выявлено значительное преобладание (68,6%) случаев замедленной желудочной эвакуации (рис. 1). Причем при III степени ГЭРБ по классификации Savary–Miller данный тип дисмоторики наблюдался в 100% случаев.
Рис. 1. Частота выявления нарушений эвакуаторной
функции желудка у больных ГЭРБ
(данные динамической гастросцинтиграфики) (%)
Периферическая компьютерная электрогастроэнтерография (ПКЭГЭГ) в 76% случаев выявила изменения по типу функциональной дискоординации моторики желудка и 12-перстной кишки. Причем до приема пищи 23,2% пациентов демонстрировали сниженную электрическую активность желудка при нормальных показателях моторной активности 12-перстной кишки с последующей нормализацией моторики желудка после приема пищи. У 45,8% больных натощак обнаружена повышенная электрическая активность 12-перстной кишки с нормализацией моторной активности после пищевой стимуляции при неизмененных показателях электрической активности желудка, т. е. транзиторная гиперкинезия 12-перстной кишки. В 31% случаев были выявлены пониженные показатели электрической активности 12-перстной кишки натощак, которые нормализовались после пищевой стимуляции с одновременным отсутствием каких-либо изменений электрической активности на частотах желудка. Характерно, что во всех трех случаях, но с разной частотой, наблюдался ДГР, который значительно чаще (93%) регистрировался у пациентов со вторым вариантом дисмоторики.
В целом частота выявления ДГР у всех больных ГЭРБ методом ПКЭГЭГ составила 82,4%, возрастая прямо пропорционально степени тяжести болезни (рис. 2). Это подтверждает данные о том, что с ростом степени тяжести ГЭРБ растет и число смешанных рефлюксов (содержимое желудка + содержимое 12-перстной кишки). Такая закономерность не может не учитываться, т. к. именно смешанные рефлюксы в большом числе случаев приводят к такому грозному осложнению ГЭРБ, как пищевод Барретта (появление в пищеводе цилиндроклеточной метаплазии плоского эпителия с угрозой развития в дальнейшем аденокарциномы).
Рис. 2. Частота выявления ДГР
у пациентов ГЭРБ методом ПКЭГЭГ
Также важную роль в патогенезе ГЭРБ играет нарушение моторики самого пищевода, включающее изменение силы и продолжительности перистальтических сокращений, повышение или снижение тонуса его сфинктеров. В патогенезе ГЭРБ имеют значение ослабление перистальтики пищевода, которое приводит к замедлению его опорожнения и снижению сократительной способности стенок пищевода при рефлюксе; снижение давления НПС; избыточная релаксация и деструктуризация его антирефлюксной функции [2].
Немаловажная роль в возникновении моторных нарушений пищевода и желудка, лежащих в основе развития ГЭРБ, отводится дисбалансу парасимпатического и симпатического звеньев нервной регуляции органов желудочно-кишечного тракта (ЖКТ) и как следствие его – нарушению перистальтической активности. Вегетативная регуляция моторно-эвакуаторной активности органов эзофагогастродуоденальной зоны осуществляется с участием основных рецепторов (холинергических, адренергических, дофаминергических, серотониновых, мотилиновых, холецистокининовых) и важнейших мессенджеров, включая гастроинтестинальные гормоны, стимулирующие (ацетилхолин, мотилин, гастрин, серотонин, инсулин, субстанция Р) и тормозящие, угнетающие моторную активность (дофамин, секретин, холецистокинин, оксид азота, глюкагон, соматостатин, энкефалины, вазоактивный интестинальный пептид). Одним из важнейших мессенджеров, оказывающих угнетающее влияние на гладкомышечные элементы желудка, является дофамин, секретируемый в отдельных участках желудочной стенки и действующий через специализированные, здесь же расположенные дофаминовые рецепторы. Дисбаланс координирующего действия стимуляторов и ингибиторов моторики органов пищеварительного тракта, выражающийся, к примеру, в избыточной дофаминовой активности, приводит к гипомоторной дискинезии пищевода, желудка, 12-перстной кишки вплоть до появления некоординированных сокращений, антордуоденальной дискоординации, функциональному гастро- и дуоденостазу. При этом часто наблюдается параллельное снижение давления в НПС, развиваются недостаточность кардии и патологический гастроэзофагеальный рефлюкс.
Определенное значение в развитии моторных нарушений, лежащих в основе патогенеза ГЭРБ, имеют влияние на моторику некоторых компонентов пищи (жиров, шоколада, цитрусовых, томатов, кофе, алкоголя и др.), а также прием медикаментозных средств (холинолитиков, β-адреноблокаторов, антагонистов кальция и доноров оксида азота – нитратов) и курение.
К органическим причинам, приводящим к развитию ГЭРБ, относят рефлюкс при грыже пищеводного отверстия диафрагмы, связанный с исчезновением угла Гиса – важного анатомического элемента запирательного механизма кардии [2].
Все вышесказанное указывает на то, что нарушение моторной активности верхних отделов ЖКТ в патогенезе ГЭРБ является определяющим фактором, который создает условия для контакта агрессивного содержимого желудка со слизистой оболочкой пищевода, возникновения морфологических изменений и клинических проявлений болезни.
Тактика лечения ГЭРБ
Вместе с тем на сегодняшний день ведущим направлением в лечении ГЭРБ является устранение закисления в пищеводе путем блокады кислотной продукции, осуществляемой обкладочными железами желудка с помощью ингибиторов протонной помпы (ИПП); связывания агрессивных компонентов желудочного содержимого; создания препятствия для контакта последних со слизистой оболочкой пищевода (путем применения антацидов, альгинатов).
Следует сказать, что данный подход к лечению ГЭРБ продиктован, с одной стороны, реальными успехами в купировании не только клинических, но и морфологических проявлений болезни, предотвращением осложнений, а при длительной поддерживающей кислотосупрессивной терапии – и стабилизацией состояния на нормальных показателях закисления пищевода. С другой стороны, до последнего времени в арсенале терапевта, гастроэнтеролога отсутствовали эффективные и безопасные средства для коррекции моторных расстройств у больных ГЭРБ, которые бы позволяли осуществлять достаточно длительный контроль моторики, не вызывая побочных эффектов, свойственных имеющимся на фармакологическом рынке прокинетикам.
В связи с этим на сегодняшний день препаратами выбора в лечении ГЭРБ, эффективно подавляющими кислотную секрецию в желудке, являются ИПП, особенно последнего поколения (пантопразол, рабепразол). При эрозивных формах болезни они становятся обязательным компонентом.
Однако следует иметь в виду, что даже самые эффективные на сегодняшний день ИПП не влияют на первопричину болезни – нарушенную функцию запирательного механизма кардии, моторику желудка и 12-перстной кишки, поэтому после прекращения их приема у большей части больных сравнительно быстро возникает рецидив заболевания. В ряде случаев ИПП не устраняют некоторые симптомы, чаще всего ассоциируемые с нарушением моторики пищевода и желудка, гиперчувствительностью желудка к растяжению. В подобных случаях при лечении больных ГЭРБ дополнительно показано использование прокинетиков.
Разбирая особенности средств, обладающих прокинетическим эффектом на верхние отделы ЖКТ, необходимо отдельно остановиться на следующих препаратах:
Опыт применения перечисленных прокинетиков при ГЭРБ, особенно таких препаратов, как метоклопрамид, домперидон и цизаприд, как в нашей стране, так и за рубежом достаточно велик, однако из-за большого спектра побочных эффектов, вызываемых препаратами прежних поколений, и кратковременности их действия целесообразность применения последних нередко ставилась под сомнение [25, 26].
Ганатон в лечении ГЭРБ
Препаратом нового поколения прокинетиков, хорошо зарекомендовавшим себя (по данным нескольких мета-анализов) при лечении ГЭРБ и функциональной диспепсии, зарегистрированным за рубежом, а с 2007 г. и в России, является итоприда гидрохлорид – Ганатон (от “gastric natural tone” – восстанавливающий нормальный тонус желудка). Это новый препарат с комбинированным механизмом действия, являющийся антагонистом дофаминовых D2-рецепторов и блокатором ацетилхолинестеразы. Итоприда гидрохлорид активизирует высвобождение ацетилхолина, одновременно препятствуя его деградации. Он обладает минимальной способностью проникать через гематоэнцефалический барьер, не влияет на продолжительность интервала Q-T и не взаимодействует с лекарственными средствами, метаболизирующимися ферментами системы цитохрома Р450, в т. ч. ИПП, часто применяемыми в лечении ГЭРБ и функциональной диспепсии. Итоприда гидрохлорид оказывает выраженное противорвотное действие, усиливает пропульсивную моторику желудка и ускоряет его опорожнение.
Открытые клинические исследования итоприда гидрохлорида в США, Японии, Германии, Индии и других странах показали высокую клиническую эффективность препарата у больных функциональной диспепсией, хроническим гастритом, диабетическим гастропарезом и ГЭРБ. Препарат отличает хорошая переносимость и отсутствие значимых побочных эффектов. У пациентов с функциональной диспепсией и диабетическим гастропарезом итоприд эффективно стимулирует сократительную способность желудка, ускоряет его опорожнение, устраняет антродуоденальную дискоординацию [27–29].
При использовании итоприда гидрохлорида в составе комбинированной терапии с ИПП у пациентов с ГЭРБ обнаружено, что данный прокинетик достоверно усиливает сократительную активность НПС, что подтверждается увеличением давления в его области, а также усиливает моторную активность желудка, ускоряет желудочную эвакуацию и нормализует нарушенную гастродуоденальную координацию [30]. Важной положительной стороной использования итоприда при ГЭРБ является не только быстрый и стойкий клинический эффект, но и возможность его длительного применения без развития каких-либо значимых побочных эффектов. Так, Inoue K. и соавт. (1999), применяя итоприд по 50 мг 3 раза в сутки в течение 7 недель у больных хроническим гастритом с явлениями рефлюкс-эзофагита, получили хороший клинический эффект: исчезновение жалоб у 67% пациентов с изжогой в отсутствие побочных эффектов [31].
Имеется и отечественный положительный опыт использования Ганатона для лечения больных ГЭРБ. Так, Минушкин О.Н. и Лощинина Ю.Н. (2008) проводили лечение больных ГЭРБ 0–I стадии рецидивирующего течения препаратом Ганатон (в режиме монотерапии) в стандартной дозе (50 мг 3 раза в сутки) в течение 25 дней. На фоне монотерапии Ганатоном изжога была полностью купирована к концу первой недели у 90% больных, а эпителизация эрозий пищевода после полного курса лечения зарегистрирована у всех пациентов с эрозивной формой ГЭРБ. Зарегистрирована также положительная динамика вегетативного статуса и показателей качества жизни пациентов по шкале SF-36 (Short-Form Health Survey).
Таким образом, с появлением на отечественном рынке эффективного и безопасного прокинетика итоприда гидрохлорида (Ганатона) открываются новые возможности проведения полноценной патогенетической терапии ГЭРБ, включая коррекцию моторных расстройств пищевода, желудка и 12-перстной кишки, восстановление их нормальной миоэлектрической активности и взаимной координации.
Применение Ганатона у больных ГЭРБ возможно как в режиме монотерапии при легких формах болезни, так и в составе комбинированного с ИПП лечения.
По-видимому, с учетом особенностей фармакодинамики и фармакокинетики препарата Ганатон возможно его применение у больных ГЭРБ в режиме длительной противорецидивной терапии и в комбинации с ИПП, и в режиме монотерапии. При этом не исключена коррекция стандартных доз обеих составляющих в сторону уменьшения.

_550.gif)
.gif)
.gif)