Мпб микробиология что это
мясопептонный бульон
Смотреть что такое «мясопептонный бульон» в других словарях:
мясопептонный бульон — (МПБ) жидкая питательная среда для культивирования микроорганизмов, состоящая из мясной воды и пептона (1 2%); служит основой многих других жидких питательных сред … Большой медицинский словарь
бульон питательный — мясной отвар, питательная среда, применяемая для культивирования микроорганизмов, участвующих в деградации белков. В зависимости от добавок различают, напр., глицериновый Б., нитратный Б., лактозный Б., наибольшее распространение имеет… … Словарь микробиологии
ПИТАТЕЛЬНЫЕ СРЕДЫ — ПИТАТЕЛЬНЫЕ СРЕДЫ, искусственные среды того или иного состава, предназначенные для культивирования микробов и простейших в лабораторных условиях. Впервые были введены для изолирования отдельных видов бактерий Р. Кохом в 1881 году, что создало… … Большая медицинская энциклопедия
Пита́тельные сре́ды — субстраты, состоящие из компонентов, обеспечивающих необходимые условия для культивирования микроорганизмов или накопления продуктов их жизнедеятельности. Питательные среды различаются по назначению, консистенции и составу. По назначению их… … Медицинская энциклопедия
Питательная среда — Питательная среда вещество или смесь веществ, применяемая для культивирования макро и микроорганизмов. Существует множество стандартных биологических питательных сред. Содержание 1 Требования, предъявляемые к средам 2 Классификация … Википедия
Бактерии — под именем бактерий в науке известны мельчайшие, микроскопической величины организмы, принадлежащие к растительному царству. По своей организации, по своим морфологическим особенностям, Б. ближе всего стоят к так называемым циановым или… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
СПИСОК СОКРАЩЕНИЙ — Аг антиген АЕ антитоксическая или антигенная единица антибактер. антибактериальный Ат антитело АТФ аденозинтрифосфорная кислота бактер. бактериальный бактериол бактериологический бактериоскоп. бактериоскопический БАС бактерицидная активность… … Словарь микробиологии
Брюшной тиф — Не следует путать с сыпным тифом. Брюшной тиф … Википедия
Абдоминальный тиф — Брюшной тиф Файл:Salmonella typhi.jpg МКБ 10 A01.0 МКБ 9 002 Тиф брюшной острая антропонозная бактериа … Википедия
Вейнберга среда — (М. В. Вейнберг, 1868 1940, микробиолог) 1) полужидкая питательная среда, применяемая для культивирования патогенных анаэробов, представляющая собой мясопептонный бульон, содержащий 1% агара и 0,2% глюкозы; 2) (син. среда обогащения Vf) жидкая… … Большой медицинский словарь
Питательная среда
Содержание:
Питательные среды
Виды питательных сред
По составу питательные среды делят на:
По целевому назначению питательные среды делят на:
По физическому состоянию питательные среды делят на:
Культура бактерии Xanthomonas axonopodis
Селективная питательная среда [5]
Требование к питательным средам
Для культивирования микроорганизмов используют различные по составу питательные среды. Но все они должны соответствовать ряду общих требований:
Потребность в сере удовлетворяются сульфатами. В фосфоре – солями фосфорной кислоты. Все необходимые металлы и прочие элементы – в форме катионов или анионов неорганических солей. В частности, источник магния – сульфат магния (MgSO4), натрия – хлорид натрия или поваренная соль (NaCl), кальция – хлорид кальция (CaCl2) или карбонат кальция (CaCO3).
Использование питательных сред
Питательные среды используются для:
Мпб микробиология что это
Питательные среды
Питательные среды являются основой микробиологической работы, и их качество нередко определяет результаты всего исследования. Среды должны создавать оптимальные (наилучшие) условия для жизнедеятельности микробов.
Требования, предъявляемые к средам
Среды должны соответствовать следующим требованиям:
Внимание! Микроорганизмы, как все живые существа, нуждаются в большом количестве воды.
Чтобы во время роста микроорганизмов кислые или щелочные продукты их жизнедеятельности не изменили рН, среды должны обладать буферностью, т. е. содержать вещества, нейтрализующие продукты; обмена;
3) быть изотоничными для микробной клетки; т. е. осмотическое давление в среде должно быть таким же, как внутри клетки. Для большинства микроорганизмов оптимальна среда, соответствующая 0,5% раствору натрия хлорида;
4) быть стерильными, так как посторонние микробы препятствуют росту изучаемого микроба, определению его свойств и изменяют свойства среды (состав, рН и др.);
5) плотные среды должны быть влажными и иметь оптимальную для микроорганизмов консистенцию;
7) быть по возможности унифицированным, т. е. содержать постоянные количества отдельных ингредиентов. Так, среды для культивирования большинства патогенных бактерий должны содержать 0,8-1,2 г/л аминного азота NH2, т. е. суммарного азота аминогрупп аминокислот и низших полипептидов; 2,5-3,0 г/л общего азота N; 0,5% хлоридов в пересчете на натрия хлорид; 1% пептона.
Классификация сред
Потребность в питательных веществах и свойствах среды у разных видов микроорганизмов неодинакова. Это исключает возможность создания универсальной среды. Кроме того, на выбор той или иной среды влияют цели исследования.
В настоящее время предложено огромное количество сред* в основу классификации которых положены следующие признаки.
1. Исходные компоненты. По исходным компонентам различают натуральные и синтетические среды. Натуральные среды готовят из продуктов животного и растительного происхождения. В настоящее; время разработаны среды, в которых ценные пищевые продукты (мясо и др.) заменены непищевыми: костной и рыбной мукой, кормовыми дрожжами, сгустками крови и др. Несмотря на то что состав питательных сред из натуральных продуктов очень сложен и меняется в зависимости от исходного сырья, эти среды нашли широкое применение. Синтетические среды готовят из определенных химически чистых органических и неорганических соединений, взятых в точно указанных концентрациях и растворенных в дважды дистиллированной воде. Важное преимущество этих сред в том, что состав их постоянен (известно, сколько и какие вещества в них входят), поэтому эти среды легко воспроизводимы.
2. Консистенция (степень плотности). Среды бывают жидкие, плотные и полужидкие. Плотные и полужидкие среды готовят из жидких, к которым для получения среды нужной консистенции прибавляют обычно агар-агар или желатин.
Кроме того, в качестве плотных сред применяют свернутую сыворотку крови, свернутые яйца, картофель, среды с селикагелем.
3. Состав. Среды делят на простые и сложные. К первым относят мясопептонный бульон (МПБ), мясопептонный агар (МПА), бульон и агар Хоттингера, питательный желатин и пептонную воду. Сложные среды готовят, прибавляя к простым средам кровь, сыворотку, углеводы и другие вещества, необходимые для размножения того или иного микроорганизма.
4. Назначение: а) основные (общеупотребительные) среды служат для культивирования большинства патогенных микробов. Это вышеупомянутые МПА, МПБ, бульон и агар Хоттингера, пептонная вода;
в) элективные (избирательные) среды служат для выделения определенного вида микробов, росту которых они благоприятствуют, задерживая или подавляя рост сопутствующих микроорганизмов. Так, соли желчных кислот, подавляя рост кишечной палочки, делают среду элективной для возбудителя брюшного тифа. Среды становятся элективными при добавлении к ним определенных антибиотиков, солей, изменении рН.
Жидкие элективные среды называют средами накопления. Примером такой среды служит пептонная вода с рН 8,0. При таком рН на ней активно размножается холерный вибрион, а другие микроорганизмы не растут;
г) дифференциально-диагностические среды позволяют отличить (дифференцировать) один вид микробов от другого по ферментативной активности, например среды Гисса с углеводами и индикатором. При росте микроорганизмов, расщепляющих углеводы, изменяется цвет среды;
Рецепты приготовления некоторых сред приведены в конце следующего раздела и во второй части учебника.
Контрольные вопросы
1. Каким требованиям должны удовлетворять питательные среды?
2. Как классифицируют среды по исходным компонентам?
3. Какие вещества служат для уплотнения сред?
4. Какие среды являются простыми или общеупотребительными и для чего их применяют?
5. Какие среды называют сложными, что служит их основой?
6. Какие среды позволяют получить преимущественный рост одних микробов при одновременном подавлении других?
7. На каких средах изучают ферментативную активность микробов?
Задание
Заполните форму, указав на какие группы подразделяют среды.
Приготовление сред
Посуда для приготовления сред не должна содержать посторонних веществ, например щелочей, выделяемых некоторыми сортами стекла, или окислов железа, которые могут попасть в среду при варке ее в ржавых кастрюлях. Лучше всего пользоваться стеклянной, эмалированной или алюминиевой посудой. Большие количества среды (десятки и сотни литров) готовят в специальных варочных котлах или реакторах (рис. 14). Перед употреблением посуду необходимо тщательно вымыть, прополоскать и высушить. Новую стеклянную посуду предварительно кипятят 30 мин в 1-2% растворе хлороводородной кислоты или погружают в этот раствор на ночь, после чего в течение часа прополаскивают в проточной воде.
Рис. 14. Общий вид реактора
Исходным сырьем для приготовления большинства сред служат продукты животного или растительного происхождения: мясо и его заменители, молоко, яйца, картофель, соя, кукуруза, дрожжи и др.
Основные питательные бульоны готовят на мясной воде или на различных переварах, полученных при кислотном или ферментативном гидролизе исходного сырья. Бульоны из переваров в 5-10 раз экономичнее, чем из мясной воды. Среды на переварах богаче аминокислотами, следовательно, питательнее; обладают большей буферностью, т. е. имеют более стабильную величину рН. Кроме того, перевары можно готовить из заменителей мяса (сгустков крови, плаценты, казеина и т. д.).
В настоящее время снабжение лабораторий мясной водой и переварами централизованно. Чаще пользуются панкреатическим переваром Хоттингера, гидролизатами казеина или кормовых дрожжей. Из этих полуфабрикатов по определенным рецептам готовят необходимые среды.
Этапы приготовления сред: 1) варка; 2) установление оптимальной величины рН; 3) осветление; 4) фильтрация; 5) разлив; 6) стерилизация; 7) контроль.
Варят среды на открытом огне, водяной бане, в автоклаве или варочных котлах, подогреваемых паром.
Установление рН сред ориентировочно производят с помощью индикаторных бумажек. Для точного определения рН пользуются потенциометром, применяя стеклянные электроды в соответствии с инструкцией или компаратором (аппарат Михаэлиса), состоящим из штатива с гнездами для пробирок (рис. 15) и набора стандартов определенного рН. При приготовлении сред пользуются обычно индикатором метанитрофенолом, изменяющим свой цвет в диапазоне 6,8-8,4.
Цвет жидкостей в пробирках сравнивают в проходящем свете, закрыв заднюю прорезь прибора фильтром (матовым или синим, если жидкости интенсивно желтые). рН испытуемого раствора соответствует рН стандарта, с цветом которого совпадает его цвет.
При стерилизации рН сред снижается на 0,2, поэтому для получения среды с рН 7,2-7,4 ее сначала готовят с рН 7,4-7,6.
Осветление сред производят, если при варке они мутнеют или темнеют. Для осветления в среду, подогретую до 50° С, вливают белок куриного яйца, взбитый с двойным количеством воды, перемешивают и кипятят. Свертываясь, белок увлекает в осадок взвешенные в среде частицы. Таким же способом можно вместо яичного белка использовать сыворотку крови (20-30 мл на 1 л среды).
Фильтрацию агаровых сред можно заменить отстаиванием. Среду наливают в высокий цилиндрический сосуд и расплавляют в автоклаве. При медленном остывании среды в выключенном приборе взвешенные в ней частицы оседают на дно. На следующий день агаровый сгусток извлекают из сосуда (для этого сосуд ненадолго помещают в горячую воду) и отрезают ножом нижнюю часть со скопившимся осадком. Верхнюю часть растапливают и разливают в соответствующие емкости.
Разливают среды в пробирки (по 3-5 мл или по 10 мл), флаконы, колбы, матрацы и бутылки не более чем на 2 /3 емкости, так как при стерилизации могут намокнуть пробки и среды утратят стерильность.
Среды, которые стерилизуют при температуре выше 100° С, разливают в чистую сухую посуду. Среды, стерилизуемые при более низкой температуре, обязательно разливают в стерильную посуду.
Разливают среды с помощью воронки, на конец которой надета резиновая трубка с зажимом Мора. Для мерного разлива применяют мензурки, бюретки, дозаторы, шприцы-пипетки и т. п. (рис. 16).
Посуду со средой обычно закрывают ватно-марлевыми пробками, поверх которых надевают бумажные колпачки. Важно, чтобы при разливе среда не смачивала края посуды, иначе к ним могут прилипнуть пробки. К каждому сосуду обязательно прикрепляют этикетку с названием среды и датой ее приготовления.
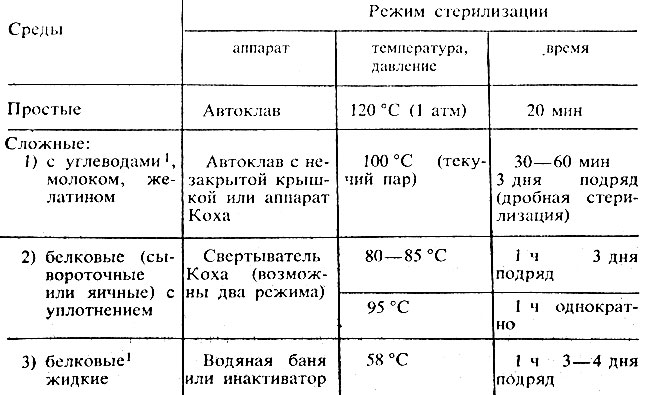
Стерилизация. Режим стерилизации зависит от состава среды и указан в ее рецепте. Примерная схема режима стерилизации сред приведена в табл. 8.
Таблица 8. Режим стерилизации сред
1 ( Жидкие среды с углеводами, белками или витаминами лучше стерилизовать с помощью бактериальных фильтров.)
Контроль готовых сред: а) для контроля стерильности среды ставят в термостат на 2 сут, после чего просматривают. Если на средах не появятся признаки роста, их считают стерильными и передают для химического контроля по нескольку образцов каждой серии; б) химический контроль: окончательно устанавливают рН, содержание общего и аминного азота, пептона, хлоридов (их количество должно соответствовать указанному в рецепте).
Хранят среды при комнатной температуре в шкафах, желательно специально для них предназначенных. Некоторые среды, например, среды с кровью и витаминами, хранят в холодильнике.
Рецепты приготовления простых (основных) сред и изотонического раствора натрия хлорида
Изотонический раствор натрия хлорида. К 1 л дистиллированной воды добавляют 9 г натрия хлорида. Раствор фильтруют, устанавливают заданный рН и, если нужно, стерилизуют при 120° С в течение 30 мин.
Мясопептонный бульон (МПБ). К мясной воде прибавляют 1% пептона и 0,5% х. ч. натрия хлорида, кипятят на слабом огне 10-15 мин для растворения веществ, устанавливают нужный рН и снова кипятят 30-40 мин до выпадения осадка. Фильтруют, доливают до первоначального объема водой и стерилизуют 20 мин при 120° С.
Бульон Хоттинтера. Перевар Хоттингера разводят водой в 5-6 раз в зависимости от того, какое количество аминного азота он содержит и какое его количество должно быть в бульоне (указано в паспорте перевара и рецепте среды). Например, для приготовления среды с 1,2 г/л аминного азота перевар, содержащий 9,0. г/л, надо развести в 7 5 раз (9,0:1,2). К разведенному перевару прибавляют 0,5% натрия хлорида и кипятят на слабом огне до растворения соли, В остывшей среде устанавливают рН, фильтруют, разливают и стерилизуют 20 мин при
Мясопептонный агар (МПА). К готовому бульону (до стерилизации или после нее) добавляют 2-3% измельченного агар-агара и кипятят, помешивая, на слабом огне до полного расплавления агара. МПА можно варить в автоклаве или аппарате Коха. Готовую среду, если нужно, осветляют, фильтруют и стерилизуют 20 мин при 120° С.
Полужидкий агар содержит 0,4-0,5% агар-агара.
Питательный желатин. К готовому бульону прибавляют 10-15% желатина, подогревают ДО его расплавления (не кипятят!), разливают в стерильную посуду и стерилизуют текучим паром.
Рецепты приготовления сложных сред
Среды с кровью готовят из стерильных простых сред, добавляя в асептических условиях (лучше в боксе) от в до 30% (обычно 5%) стерильной дефибринированной крови. Агаровые среды перед этим растапливают и остужают до 45° С. Определяют температуру среды, поднося сосуд к шее у угла нижней челюсти. При нужной температуре должно быть терпимое ощущение горячего, но не ожога. После добавления крови, пока среда не застыла, содержимое сосуда тщательно перемешивают и разливают в чашки или пробирки.
Среды с сывороткой крови готовят так же, как среды с кровью. К основным средам добавляют 10-20% сыворотки, не содержащей консерванта и предварительно инактивированной при 56° С в течение 30 мин на водяной бане или в инактиваторе. При инактивации разрушается вещество (комплемент), губительно действующее на микробы.
Среды с желчью. К простым средам добавляют желчь в количестве 10-40% объема среды, устанавливают нужный рН и стерилизуют 20 мин при 120° С. Можно стерильную желчь добавить к стерильной среде в асептических условиях.
Внимание! Пользоваться средой, в которой нет конденсата, нельзя. Ее следует снова растопить на водяной бане и скосить.
Сухие среды
Контрольные вопросы
1. Каким должен быть рН сред для культивирования большинства патогенных микробов перед стерилизацией и почему?
2. При какой температуре плавятся и застывают агаровые среды?
3. Как должна быть подготовлена посуда, в которую разливают среды с углеводами и белками?
Задание
1. Приготовьте МПБ, МПА, бульон и агар Хоттингера с рН 7,2-7,4, разлейте во флаконы и пробирки; простерилизуйте.
2. Приготовьте из сухих порошков среды Гисса, разлейте в пробирки по 4-5 мл и простерилизуйте.
3. Приготовьте агар с кровью и разлейте его в чашки Петри.
4. Приготовьте из сухих порошков среды Эндо, ЭМС, Плоскирева и разлейте их в чашки Петри.
5. Приготовьте скошенный агар.
Методы посевов
Важным этапом бактериологического исследования является посев. В зависимости от цели исследования, характера посевного материала и среды используют разные методы посева. Все они включают обязательную Цель: оградить посев от посторонних микробов. Поэтому работать следует быстро, но без резких движений, усиливающих колебания воздуха. Во время посевов нельзя разговаривать. Посевы лучше делать в боксе.
Внимание! Не забывайте выполнять правила личной безопасности при работе с заразным материалом.
При посеве в жидкую среду посевной материал растирают на стенке пробирки над жидкостью и смывают средой.
При посеве на жидкие среды тампоном его погружают в среду и 3-5 с ополаскивают в ней. При посеве на плотную среду материал втирают в ее поверхность, вращая тампон, после чего тампон обеззараживают (помещают в пробирку, в которой он был доставлен в лабораторию, и автоклавируют).
Внимание! Следите, чтобы среда не вылилась и не смочила пробку.
При посеве на скошенный агар материал обычно растирают на поверхности среды зигзагообразными движениями снизу вверх, начиная от границы конденсата.
При посеве на плотные среды, разлитые в пробирки столбиком, петлей с посевным материалом прокалывают столбик, производя так называемый посев «уколом».
После посева петлю извлекают из пробирки, края пробирок обжигают и, проведя пробки через пламя горелки, закрывают пробирки, после чего прокаливают петлю.
Посев жидкого материала можно производить стерильными пипетками (пастеровскими или градуированными). После посева пипетки погружают в дезинфицирующую жидкость.
Посевы во флаконы, матрацы и бутыли производят примерно так, как в пробирки, только сначала набирают материал (петлей или в пипетку), а потом открывают сосуд со средой.
Сосуды с засеянной культурой надписывают и ставят в термостат.
Посев на пробирки с чашки Петри. Изучив характер роста культуры на чашке, со стороны дна отмечают восковым карандашом нужный для посева участок. Чашку с посевным материалом ставят перед собой крышкой вверх. Левой рукой приоткрывают крышку и вводят под нее обожженную петлю. Остудив петлю, набирают посевной, материал с отмеченного участка. Вынимают петлю, закрывают чашку и в левую руку берут пробирку со средой. Посев производят так же, как с пробирки в пробирку. После посева чашку поворачивают вверх дном.
Левой рукой слегка приоткрывают крышку, держа ее большим и указательным пальцем. Петлей, пипеткой или стеклянной палочкой наносят на поверхность среды посевной материал, после чего тщательно втирают его круговыми движениями шпателя до тех пор, пока шпатель не перестанет свободно скользить по поверхности среды, левой рукой при этом придерживают крышку и одновременно вращают чашку. По окончании посева шпатель вынимают из чашки и закрывают крышку. Стеклянный шпатель помещают в дезинфицирующий раствор, а металлический прокаливают в пламени горелки.
Посев петлей. Небольшое количество посевного материала (иногда его предварительно эмульгируют в стерильном изотоническом растворе или бульоне) втирают петлей в поверхность среды у края чашки, несколько раз проводя петлей из стороны в сторону. Затем у того места, где закончились штрихи, агар прокалывают петлей, снимая избыток посевного материала. Оставшийся на петле посевной материал зигзагообразными движениями распределяют по всей поверхности среды. По окончании посева закрывают чашку и прожигают петлю.
Посев петлей на секторы. Чашку со стороны дна расчерчивают на секторы. Посев производят зигзагообразными движениями от края чашки к центру. Необходимо следить, чтобы штрихи не заходили на соседний сектор.
Посев тампоном. Тампон с посевным материалом вносят в слегка приоткрытую чашку и круговыми движениями втирают его содержимое в поверхность среды, вращая при этом тампон и чашку.
Посев газоном. Примерно 1 мл (20 капель) жидкой культуры (если культура с плотной среды, ее эмульгируют в стерильном изотоническом растворе или бульоне) наносят на поверхность агара и тщательно распределяют жидкость по поверхности среды. Чашку слегка наклоняют и пипеткой отсасывают избыток культуры, выливая ее в дезинфицирующий раствор. Туда же помещают пипетку.
Посев в толщу агара. Культуру, выращенную на жидкой среде, или эмульгированный материал вносят в сосуд с расплавленным и остуженным до 45° С агаром, перемешивают и выливают в стерильную чашку Петри. Можно внести посевной материал в пустую чашку и залить 15-20 мл остуженного до 45° С агара. Для перемешивания содержимого чашки ее слегка покачивают и вращают. Чашки оставляют на столе до застывания среды.
Засеянные чашки подписывают со стороны дна и помещают в термостат дном вверх.
Контрольные вопросы
1. Нужны ли асептические условия во время посева? Обоснуйте ответ.
2. Как нужно обработать рабочее место по окончании посевов?
Методы культивирования
Для успешного культивирования, помимо правильно подобранных сред и правильно произведенного посева, необходимы оптимальные условия: температура, влажность, аэрация (снабжение воздухом). Как правило, подходящие условия удается создать, тщательно воспроизведя условия природной обстановки.
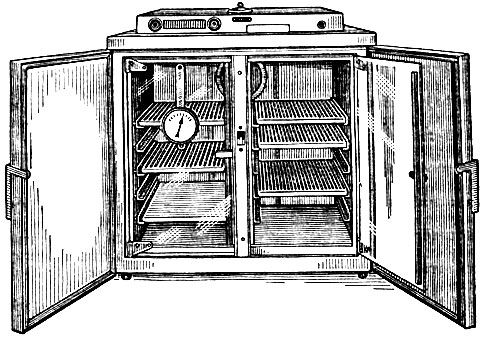
Температура. Оптимальную температуру для культивирования большинства патогенных микроорганизмов (37° С) создают в термостате (рис. 17). Это прибор с двойными стенками, между которыми находится воздух или вода, подогреваемые электричеством. Он снабжен терморегулятором, автоматически поддерживающим нужную температуру, и термометром для контроля за температурой.
Рис. 17. Термостат
Пробирки с посевами в штативах, проволочных сетках или банках устанавливают на полках термостата. Чашки в термостате должны стоять вверх дном. Чтобы воздух в термостате свободно циркулировал и нагрев был равномерным, полки в термостате делают с прорезями и плотно не загружают. Чтобы не охладить культуры, термостат не оставляют надолго открытым.
Лаборант обязан ежедневно регистрировать температуру в термостате и поддерживать чистоту в приборе, а при неисправности вызвать мастера.
Внимание! Следует избегать попадания прямых солнечных лучей, действующих на культуры губительно.
Сроки культивирования. Большинство патогенных микробов культивируют 18-24 ч, но есть виды, растущие медленно (до 4-6 нед). Чтобы сохранить в них влагу, ватные пробки после посева заменяют стерильными резиновыми или надевают на них резиновые колпачки.
Внимание! Резиновые пробки стерилизуют в автоклаве завернутыми в бумагу.
Аэрация. По потребности микробов в свободном кислороде их делят на аэробы и анаэробы. Обе группы требуют различных условий культивирования.
Поступление кислорода, необходимого для культивирования аэробов и факультативных анаэробов, осуществляется при пассивной и активной аэрации.
Культивирование анаэробов сложнее, чем аэробов, так как их необходимо лишить доступа свободного кислорода воздуха. Для этого удаляют воздух из питательной среды различными способами.
Культивирование актиномицетов, грибов, микоплазм, L-форм, спирохет и простейших. Культивирование этих микроорганизмов принципиально сходно с культивированием бактерий. Для них разработаны специальные среды и подобраны режимы, соответствующие их потребностям.
Культивирование риккетсий и вирусов. Риккетсии и вирусы являются облигатными паразитами, т. е. могут развиваться только в живых клетках. Их культивируют в культурах тканей, организме экспериментальных животных, развивающихся куриных эмбрионах.
Методы выделения чистых культур микроорганизмов
Чистой культурой называют скопление микробов одного вида на плотной или в жидкой питательной среде.
Этапы выделения чистой культуры:
Можно получить изолированные колонии при посеве петлей. Для этого исследуемый материал эмульгируют в бульоне или изотоническом растворе натрия хлорида.
Внимание! Пересевать можно только изолированные колонии.
При выделении чистой культуры из мочи, промывных вод желудка и других жидкостей их предварительно центрифугируют в асептических условиях и засевают осадок. Дальнейшее выделение чистой культуры производят обычным способом.
Для выделения чистой культуры широко применяют элективные среды.
Изучение выделенных культур
Изучение морфологии, подвижности, тинкториальных свойств (см. главу 3), характера роста на средах (культуральные свойства), ферментативной активности и ряда других особенностей выделенного микроба позволяет установить его таксономическое положение, т. е. классифицировать микроорганизм: определить его род, вид, тип, подтип, разновидность. Это называется идентификацией. Идентификация микроорганизмов очень важна при диагностике инфекций, установлении источников и путей ее передачи и в ряде других научно-практических исследований.
Культуральные свойства
На плотных средах микроорганизмы в зависимости от количества посевного материала образуют или сплошной налет («газон»), или изолированные колонии. Культуры бывают грубые и нежные, прозрачные и непрозрачные, с поверхностью матовой, блестящей, гладкой, шероховатой, сухой, бугристой.
Колонии могут быть крупные (4-5 мм в диаметре и больше), средние (2-4 мм), мелкие (1-2 мм) и карликовые (меньше 1 мм). Они различаются по форме, расположению на поверхности среды (выпуклые, плоские, куполообразные, вдавленные, круглые, розеткообразные), форме краев (ровные, волнистые, изрезанные).
В жидких средах микроорганизмы могут образовывать равномерную муть, давать осадок (зернистый, пылевидный, хлопьевидный) или пленку (нежную, грубую, морщинистую).
Культуральные свойства определяют, изучая характер роста культуры простым глазом, с помощью лупы, под малым увеличением микроскопа или пользуясь стереоскопическим микроскопом. Величину и форму колоний, форму краев и прозрачность изучают в проходящем свете, рассматривая чашки со стороны дна. В отраженном свете (со стороны крышки) определяют характер поверхности, окраску. Консистенцию определяют прикосновением петли.
Морфологические свойства
Ферментативная активность
Ферментативная активность микроорганизмов богата и разнообразна. По ней можно установить не только видовую и типовую принадлежность микроба, но и определить его варианты (так называемые биовары). Рассмотрим основные ферментативные свойства и их качественное определение.
Молоко при росте микробов, сбраживающих лактозу, свертывается.
Помимо указанных сред, способность микроорганизмов расщеплять различные питательные субстраты определяют с помощью бумажных дисков, пропитанных определенными реактивами (системы индикаторные бумажные «СИБ»). Эти диски опускают в пробирки с исследуемой культурой и уже через 3 ч инкубации в термостате при 37° С по изменению цвета дисков судят о разложении углеводов, аминокислот, белков и т. д.
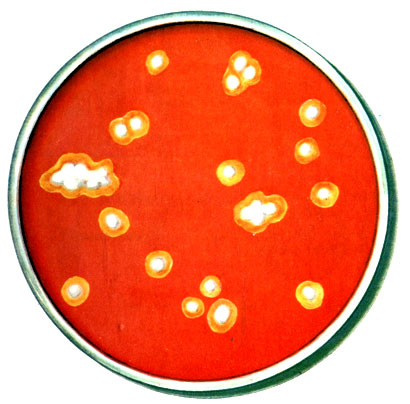
Гемолитические свойства (способность разрушать эритроциты) изучают на средах с кровью. Жидкие среды при этом становятся прозрачными, а на плотных средах вокруг колонии появляется прозрачная зона (рис. 20). При образовании метгемоглобина среда зеленеет.
Рис. 20. Гемолиз вокруг колоний, растущих на агаре с кровью
Сохранение культур
Выделенные и изученные культуры (штаммы), представляющие ценность для науки или производства, хранят в музеях живых культур. Общесоюзный музей находится в Государственном НИИ стандартизации и контроля медицинских биологических препаратов им. Л. А. Тарасевича (ГИСК).
Восстановление высушенных культур. Сильно нагревают кончик ампулы в пламени горелки и прикасаются к нему ватным тампоном, слегка * смоченным холодной водой, чтобы на стекле образовались микротрещины, через которые воздух медленно просочится внутрь ампулы. При этом, проходя через разогретые края трещин, воздух стерилизуется.
* ( При избытке воды на тампоне она может попасть в ампулу и нарушить стерильность культуры: ее засосет через образовавшиеся микротрещины, так как в ампуле вакуум.)
Внимание! Не забывайте, что в запаянной ампуле вакуум. Если воздух в нее попадает сразу через большое отверстие, может распылиться находящаяся в ампуле культура и произойти ее выброс.
Дав войти воздуху, быстро пинцетом надламывают и удаляют верхушку ампулы. Слегка обжигают отверстие и стерильной пастеровской пипеткой или шприцем вносят в ампулу растворитель (бульон или изотонический раствор). Перемешивают содержимое ампулы и засевают на среды. Рост восстановленных культур в первых посевах может быть замедлен.
Длительно сохранять культуры можно также в жидком азоте (-196° С) в специальных приборах.
Контрольные вопросы
1. Что входит в понятие «бактериологическое исследование»?
2. Какой должна быть культура для такого исследования?
3. Что такое колония микробов, культура, штамм, клон?
4. Что входит в понятие «культуральные свойства микробов»?
Задание
1. Изучите и опишите несколько колоний. Пересейте их на скошенный агар и на сектор.
3. Пересейте культуру со скошенного агара на бульон и на дифференциально-диагностические среды. Изучите и запишите в протокол характер роста культуры на этих средах и ее ферментативные свойства.