Мрнк вакцины что это вакцины
Что необходимо знать о мРНК-вакцинах: 5 позиций
В результате беспрецедентной скорости в разработке новых вакцин, миру были представлены первые клинически одобренные мРНК-вакцины
В результате беспрецедентной скорости в разработке новых вакцин, миру были представлены первые клинически одобренные мРНК-вакцины для борьбы с пандемией Covid-19 – одна из них произведена Pfizer и BioNTech, другая – компанией Moderna. Испытания показали эффективность этих вакцин на уровне не менее чем 94%.
1. Технология мРНК вакцин не так молода, как кажется
Классический механизм работы вакцин (например, против полиомиелита и гриппа) заключается в презентации иммунной системе инактивированных частиц вируса. Другие вакцины (например, против гепатита B) используют отдельно взятый белок, являющийся частью инфекционного агента, чтобы вызвать схожий иммунный ответ.
мРНК-вакцины работают по другому принципу, «обманывая» иммунную систему таким образом, что РНК (в основном матричная мРНК) кодирует белок, который продуцируется в клетке путем трансляции и представляется иммунной системе; он действует как антиген. Иммунная система учится избирательно бороться с клетками, экспрессирующими такие антигены, такими как клетки-хозяева, инфицированные вирусами, или опухолевые клетки.
Хотя вакцины от Pfizer/BioNTech и Moderna – первые препараты, одобренные в клинической практике, сама технология мРНК-вакцин существует относительно давно. Первые испытания в онкологии с использованием схожих технологий берут свое начало еще в 2011 году.
2. мРНК-вакцины не изменяют ДНК
Существуют абсолютно необоснованные опасения, что мРНК-вакцины способны изменять ДНК. На самом же деле мРНК не входит в ядро клетки, а после своего введения биодеградирует в течение нескольких дней. Именно поэтому для формирования полноценного иммунного ответа необходимо 2 инъекции препарата.
3. мРНК-вакцины имеют высокую специфичность
Вирус SARS-CoV-2 имеет достаточно сложную структуру и его различные части стимулируют иммунную систему на образование нейтрализующих антител, которые не всегда способны эффективно элиминировать инфекцию. мРНК-вакцины стимулируют иммунный ответ к спайк-белку вируса, являющегося только частью вирусной мембраны.
4. Разработчики и эксперты не «срезали углы» во время клинических испытаний
Испытания вакцин начались с доклинической фазы, проводимой на животных, а затем постепенно переходили на 1-ую, 2-ую и 3-ю фазы. Например, 3-я фаза вакцины от Pfizer/BioNTech включает более 40 000 человек, исследования эффективности и безопасности будут продлжаться следующие 2 года.
Основные проблемы, связанные с использованием вакцины, обычно возникают в первые 2 месяца. Тем не менее, не исключены редкие побочные эффекты на больших выборках в миллионы людей, поэтому за вакцинированными необходимо пристальное наблюдение, особенно с учетом инновационной природы технологии.
5. Вакцина запускает воспалительные реакции
Частично вакцина работает путем индуцирования локальных иммунных реакций, поэтому воспалительные признаки в месте инъекции и небольшой дискомфорт в первые дни – вполне нормальное явление.
Мрнк вакцины что это вакцины
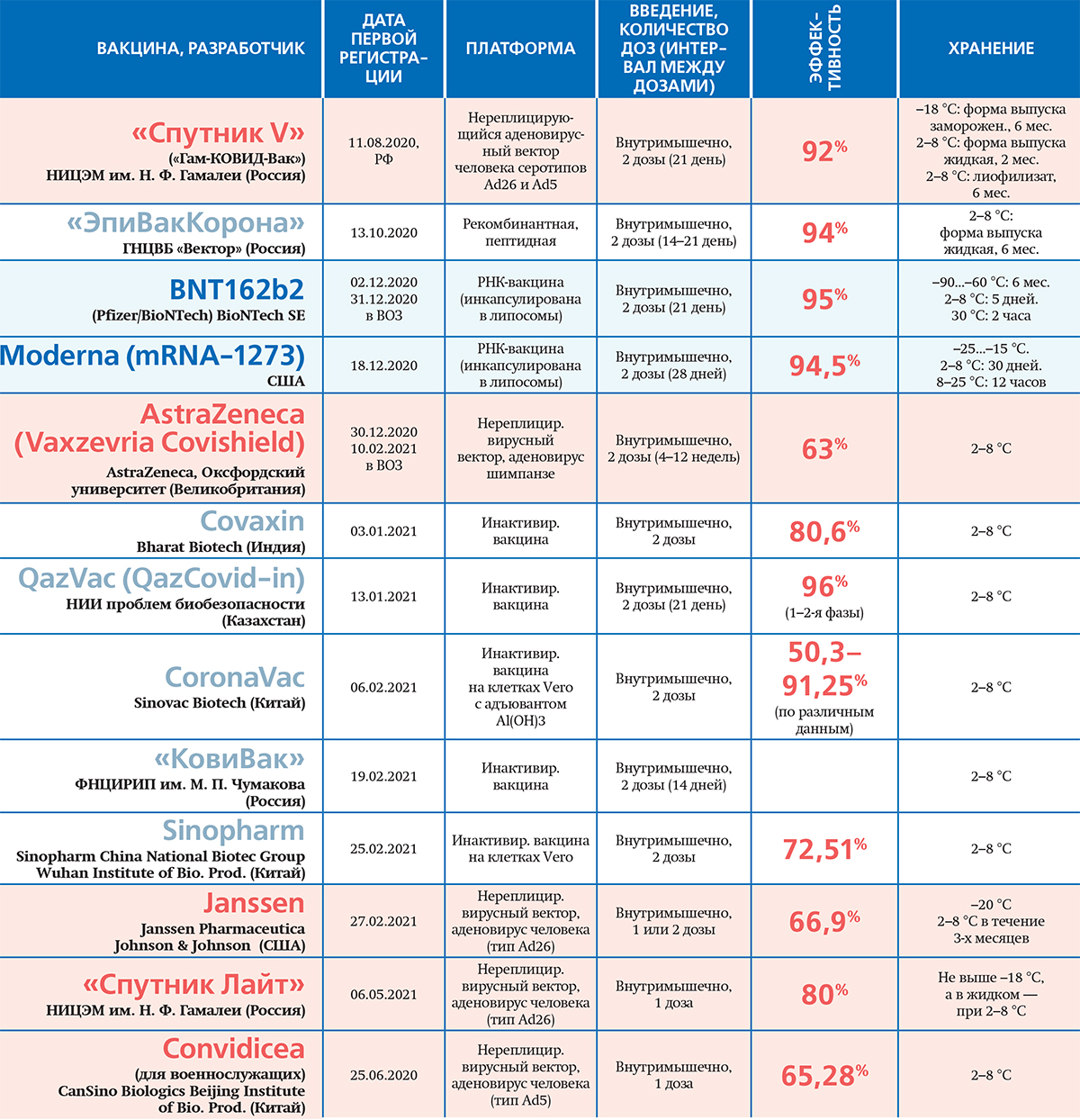
Пандемия продолжается, а мнения о вакцинации в обществе остаются неоднозначными. Многие опасаются нежелательных эффектов, хоть и отсроченных. Людей волнует, достаточно ли изучены преимущества и возможные побочные действия. Обзор зарегистрированных вакцин против COVID-19 для «МВ» сделал директор Центра экспертиз и испытаний в здравоохранении Дмитрий Гринько.
Генные, или мРНК-вакцины
BioNTech и Pfizer. Вакцина BNT162b2 (BioNTech/Pfizer) первой была зарегистрирована в ЕС. В ее основе находится матричная РНК, кодирующая ген шпилечного (спайкового) S-белка коронавируса.
Преимуществом генных вакцин является то, что в организм человека вводится чистый препарат матричной РНК, которая сама по себе безопасна. Иммунный ответ при этом формируется именно на тот антиген (S-белок), который закодирован в эту мРНК. Он приводит к появлению как нейтрализующих антител, связывающих и подавляющих вирусные частицы, так и цитотоксических Т-лимфоцитов, уничтожающих зараженные клетки и, следовательно, препятствующих распространению вирусной инфекции.
Недостатком мРНК-вакцин можно назвать то, что ранее эта технология не использовалась в здравоохранении для массовой вакцинации. Конечно, с научной точки зрения BNT162b2 безопасна, однако требуются длительные наблюдения за ее фактической безопасностью и эффективностью. Кроме того, липидные наночастицы в составе вакцины могут служить аллергенами и обладать токсичностью, особенно при передозировке. Значительным недостатком также является сверхнизкая температура хранения (-70 °С), что существенно затрудняет ее транспортировку и применение.
Moderna. Вакцина mRNA-1273 по своему составу очень похожа на BioNTech/Pfizer. В ходе клинических исследований участники, по данным производителя и контрольных органов, хорошо переносили прививку. Поствакцинальная реакция была мягкой и непродолжительной. У 9,7 % человек, привитых mRNA-1273, отмечалась общая слабость. Небольшая часть участников исследований испытала аллергическую реакцию, а в единичных случаях — даже паралич лицевого нерва. Однако пока однозначно не доказана непосредственная связь этой реакции с прививкой.
Векторные вакцины
AstraZeneca. Вакцина AZD1222 британско-шведской компании AstraZeneca представляет собой векторную вакцину на основе аденовируса шимпанзе ChAdOx1, несущего ген S-белка коронавируса. Она вызывала у пациентов типичные реакции: болезненность на месте укола, головную и мышечную боль. При этом поствакцинальные реакции у пожилых проявлялись реже и протекали мягче.
Преимущество всех векторных вакцин — они эффективно формируют гуморальный и клеточный иммунитет, поскольку вектор, попадая в клетку, воспринимается организмом как «активный вирус».
Как и в случае мРНК-вакцин, недостаток векторных в том, что ранее эта технология не использовалась в здравоохранении для массовой вакцинации. И опять же, несмотря на продемонстрированную безопасность, необходимо дальнейшее продолжительное наблюдение. Есть вероятность, что у человека уже есть иммунитет против аденовирусов, вызывающих другие заболевания. Он может снизить эффективность вакцины или даже привести к иммунологической реакции.
Именно поэтому AstraZeneca в качестве вектора использовала аденовирус шимпанзе, отличный от аденовирусов человека, что, по мнению ученых, должно снизить риски иммунологических реакций. Вместе с тем при первой иммунизации может выработаться иммунитет против вектора, что способно снизить эффективность при ревакцинациях.
«Спутник V». Первая в мире зарегистрированная векторная вакцина на основе новой технологической платформы — аденовирусов человека Ad26 и Ad5, несущих ген S-белка коронавируса. Разработана в российском НИЦЭМ им. Н. Ф. Гамалеи.
Эффективность вакцины «Спутник V» против тяжелых случаев заболевания COVID-19 составляет 100 %.
Как и в случае с вакциной AstraZeneca, существует шанс, что у пациента уже есть иммунитет против аденовирусов человека. Именно поэтому в состав «Спутника V» входят 2 компонента на основе разных аденовирусов. И шансы на то, что иммунитет есть против обоих векторов, минимальны, а значит хотя бы один из компонентов вакцины сработает в полную силу.
Johnson&Johnson. Главное преимущество вакцины Janssen американской корпорации Johnson & Johnson — однодозное введение. Подавляющее большинство вакцин, которые сейчас разрабатываются и применяются, подразумевают 2 инъекции. Первая приводит к выработке иммунитета, а вторая «закрепляет» и усиливает его. Считается, что иммунитет против COVID-19 после вакцинации сохранится в течение одного года, но пока эти данные неточные.
Другие
«ЭпиВакКорона». Разработана ГНЦВБ «Вектор» Роспотребнадзора России. В ее состав входят 3 синтетических пептида (фрагменты белка 8 коронавируса), которые соединены с крупным белком-носителем и адсорбированы на гидроксиде алюминия (в качестве белка-носителя выступает вирусный нуклеокапсидный белок, соединенный с белком кишечной палочки, способным связывать мальтозу).
Вакцина позиционируется как ареактогенная, то есть не вызывающая сильные побочные иммунологические реакции. Может применяться для пациентов всех возрастов, в том числе страдающих аллергией, а также для реиммунизации.
Однако пептиды в составе «ЭпиВакКороны» вызывают иммунный ответ только на малую часть вируса. Причем на неструктурный белок 8, а не поверхностный шпилечный S-белок, что не приводит к образованию нейтрализующих антител.
«Ковивак». Вакцина, созданная ФНЦИРИП им. М. П. Чумакова РАН, выполнена по традиционной технологии, когда вирус выращивается в биореакторах на клетках Vero, собирается и инактивируется, чтобы он уже не мог вызывать заболевание. Клинические исследования третьей фазы на данный момент не завершены, и полных данных об эффективности и безопасности вакцины нет.
Известно, что наличие целого «убитого» вируса обеспечивает наиболее комплексный иммунный ответ на все вирусные белки. В то же время при производстве вакцины есть риски загрязнения ксеногенным материалом (остатки клеток Vero). Кроме того, из-за сложного состава вакцина может вызывать менее предсказуемый иммунный ответ, сильно отличающийся у пациентов.
Сейчас высказываются опасения, что со временем из-за мутаций изменится структура вирусных белков и они станут менее уязвимыми к антителам. Однако все перечисленные вакцины вырабатывают иммунный ответ на многие вирусные эпитопы, а значит иммунная система в любом случае узнает коронавирус. Таким образом, вакцины сохранят свою эффективность.
Вакцинация без мифов

Человечеству не удалось справиться с распространением COVID-19 с помощью одних только противоэпидемических мер. Ученые считают, что пандемия не остановится до тех пор, пока большая часть населения планеты (более 80%) не приобретет иммунитет к возбудителям этой инфекции, второй год циркулирующей в человеческой популяции. Добиться как личного, так и коллективного иммунитета можно двумя путями: либо переболеть, либо вакцинироваться. А учитывая, что риск умереть от этой болезни в случае тяжелого течения составляет примерно 1 к 30, то выбор очевиден. Тем более что за невероятно короткое время удалось создать много эффективно действующих вакцин, разработанных на самых разных технологических платформах.
Об авторе
Сергей Викторович Нетесов — член-корреспондент РАН, доктор биологических наук, заведующий лабораторией бионанотехнологии, микробиологии и вирусологии факультета естественных наук Новосибирского государственного университета. Автор более 150 публикаций в международно цитируемых журналах и более 10 монографий. Дважды лауреат Премии Правительства России в области биомедицинских наук.
Считается, что история вакцин начинается с британского врача Эдварда Дженнера и французского микробиолога Луи Пастера — изобретателей живых и инактивированных вакцин. Однако на самом деле идея имитировать инфекцию в целях профилактики родилась более тысячи лет назад в Китае и Индии, где стали заражать здоровых людей возбудителем натуральной оспы. Риск умереть в результате такой процедуры был в 20–30 раз меньше, чем от спонтанной инфекции.
Заслуга же Дженнера состоит в том, что он предложил вакцинировать людей не возбудителем человеческой болезни, а подобным, но безопасным для них агентом, вызывающим коровью оспу. К этому решению врач пришел благодаря наблюдениям, что доярки не болеют оспой. После успешных экспериментов такая вакцинация стала общепризнанной. Утверждение появившихся уже тогда антивакцинаторов, что таким образом люди превратятся в коров, не смогло этому помешать.
На французской гравюре (1800 г.) изображен новый процесс вакцинации с использованием возбудителя «коровьей оспы» (вверху). Английская гравюра Д. Гиллрэя (1802 г.) отражает скептицизм, который первоначально встречала осповакцинация (внизу). По: (Fenner et al., 1988. P. 269). With permission from World Health Organization
Французский химик и микробиолог Луи Пастер стал изобретателем инактивированной вакцины. До 1895 г. Фото П. Надара. Public domain
Следующий шаг сделал спустя почти сотню лет Пастер, который предложил «убивать» или ослаблять возбудителя инфекции перед вакцинацией. А поскольку он был по образованию химиком, а не врачом, то ему противостояли, и довольно мощно, уже сами медики. Но разработанная им для крупного рогатого скота вакцина от сибирской язвы резко снизила заболеваемость и смертность животных и ухаживающих за ними людей, а прививка от бешенства спасла множество человеческих жизней в разных странах. И антивакцинаторы затихли.
Очередным прорывом в противовирусных вакцинных технологиях стало создание так называемых субъединичных белковых вакцин, которые содержат не весь вирус, а только его белки, необходимые для стимуляции иммунитета. Первая такая вакцина была разработана против вируса гепатита В, поскольку оказалось невозможным получить достаточное количество инактивированной вакцины против этой болезни.
В первой субъединичной белковой вакцине против гепатита В использовался оболочечный вирусный белок HBsAg, выделенный из плазмы хронически инфицированных доноров. Но очень скоро выяснилось, что необходимой для этого донорской крови не хватает. И вот в 1979 г. в США с помощью генной инженерии был впервые получен рекомбинантный белок HBsAg. Его продуцентами стали генно-модифицированные клетки дрожжей, в которые был встроен ген, кодирующий вирусный белок.
Новую технологию было легко масштабировать, а стоимость препарата была значительно меньше по сравнению с плазменной вакциной (которая к тому же могла содержать возбудителей и других болезней). Эта рекомбинантная белковая вакцина более пяти лет тестировалась FDA (Food and Drug Administration, USA) перед тем, как прийти на смену плазменной. Она защищает от заражения на срок не менее 30 лет, и сегодня ею прививают всех новорожденных практически во всех странах мира.
Применение генно-инженерных технологий для создания вакцин обернулось колоссальным успехом. Через 20 с лишним лет с использованием аналогичного подхода были разработаны вакцины против папилломавирусной инфекции, которые сейчас применяются в более чем 90 странах мира. Основные компоненты таких вакцин — поверхностные белки — нарабатывают в клетках эукариот, высших организмов с оформленным ядром, к которым относятся и дрожжи. Это связано с тем, что вирусные белки должны быть гликозилированы, чтобы сформировать правильную структуру и вызывать «правильный» иммунный ответ, а в клетках бактерий, которые чаще всего используют в биотехнологическом производстве, соответствующие механизмы отсутствуют.
Пандемия, вызванная коронавирусом SARS-CoV-2, буквально всколыхнувшая весь мир в начале 2020 г., не оставила времени для размышлений. Стало ясно, что для того, чтобы максимально быстро получить вакцину, необходимы разработки сразу в нескольких направлениях.
На этой упрощенной схеме показан процесс инфицирования клетки SARS-CoV-2. Коронавирусы, включая SARS-CoV-2, относятся к РНК-вирусам: в качестве «наследственной» молекулы у них выступает не ДНК, а РНК (эта нуклеиновая кислота может непосредственно служить матрицей для синтеза белков). Когда SARS-CoV-2 попадает в клетку благодаря взаимодействию своего поверхностного белка-шипа S с клеточным рецептором ACE2 (а также рецептором TMPRSS2), он с помощью клеточных рибосом производит фермент полимеразу, необходимую для копирования своей РНК. На следующем этапе в клетке синтезируется множество копий вирусной РНК, а рибосомы по матрице этой РНК синтезируют разнообразные вирусные белки. Далее с использованием других клеточных органелл — эндоплазматического ретикулума и аппарата Гольджи (ЭРиГ) — происходит сборка вирусных нуклеокапсидов, а затем и самих частиц вируса. Часть вирусных белков «презентируется» на поверхности клеточной мембраны. Клетки иммунной системы организма, распознавшие чужеродные белки-антигены, могут уничтожить как сами вирусные частицы, так и зараженную клетку, если она не успеет закончить жизнь апоптозом (клеточным «самоубийством»)
Почему мы считаем COVID-19 опаснее гриппа? Потому что смертность от гриппа в среднем составляет примерно 0,02% от числа заболевших, а от новой коронавирусной инфекции она как минимум в 100 раз выше.
В целом данные по смертности от COVID-19 очень разнятся для разных стран и разных периодов пандемии. С чем это связано? В Италии в 2020 г. на эту инфекцию списывали все смерти в больницах с положительным диагнозом на SARS-CoV-2 — независимо от того, умирал пациент от дыхательной недостаточности или от других причин. В результате формально смертность от COVID-19 составляла 6%. В России же в 2020 г. «считали» наоборот, и реальная смертность занижалась.
Вверху: полная подтвержденная смертность от COVID-19 (число смертей на 1 млн человек) по разным странам мира на 1 сентября 2021 г. (Из-за проблем с тестированием болезни и определения причины смерти это число может не соответствовать истинному числу смертей от этой инфекции). Внизу: число новых ежедневных подтвержденных случаев смерти от COVID-19 (на 1 млн человек) на 1 сентября 2021 г. Показатель рассчитывается как скользящее среднее за неделю. Источник данных: Johns Hopkins University SCCE COVID-19 Data. © Our World in Data
В качестве причин более половины дополнительных смертей указаны болезни системы кровообращения (БСК). А виновником около четверти всех случаев «прибавочной» смертности оказался COVID-19. Однако во многих случаях он же указывался в свидетельствах о смерти одновременно с теми же БСК. Очевидно, что именно коронавирус стал «катализатором» развития основного заболевания, и это относится к болезням не только сердечно-сосудистой, но и дыхательной системы.
Таким образом, реальная летальность от коронавируса в Москве за первые 4 месяца 2020 г. составила 2% от официально заболевших, если брать во внимание лишь те случаи, где он являлся единственной причиной, и 3,8% — если учитывать его в качестве не только основного, но и сопутствующего заболевания.
Векторный транспорт
«Классические» инактивированные вакцины против COVID-19 разработаны, испытываются и уже применяются во многих странах мира (Индии, Китае, Казахстане, России, Франции, Турции, Иране и др.). При их производстве высокоочищенные препараты коронавируса инактивируют (как правило, бета-пропиолактоном — высокоактивным алкилирующим агентом, или формальдегидом), а в качестве стимулятора иммунного ответа (адъюванта) добавляют гидроокись алюминия. Основная трудность — для производства такой вакцины необходим высокопатогенный живой вирус в больших количествах, который можно получить в условиях биологической безопасности — BSL-2 или даже BSL-3, подразумевающей помещения со сложными инженерными системами для фильтрации воздуха и дезактивации всех отходов, недешевое оборудование и обязательные защитные костюмы для персонала в течение всего рабочего дня.
Инактивированные вакцины производятся по разным технологиям уже более ста лет, и фактически они представляют собой цельные вирусные частицы, но как бы «зашитые» химическими скрепками без возможности раскрыться. Поэтому в результате иммунизации антитела на их внутренние белки чаще всего не образуются. При грамотном производстве такие вакцины дают при введении минимум побочных реакций, но далеко не всегда — полноценный и долговременный иммунитет.
К примеру, так и не удалось получить эффективные инактивированные вакцины против паротита, ВИЧ-инфекции, гепатита С и вируса герпеса, а для вируса кори инактивированная вакцина оказалась очень дорогой. Что касается коронавируса SARS-CoV-2, то эффективность инактивированных вакцин оказалась существенно ниже по сравнению с векторными и мРНК-вакцинами, о которых пойдет речь ниже (70–80 против 90–95%). Так что минимум побочных реакций у вакцины — это хорошо, но более важна ее эффективность.
Уже несколько десятков лет у разработчиков вакцин были в запасе еще два новаторских подхода. Развивались они давно, но из-за консерватизма контролирующих органов до 2020 г. эти разработки оставались на стадии клинических испытаний.
Во-первых, это векторные вакцины, работы над которым ведутся с 1980-х гг. В этом случае в генетический материал непатогенного вируса вставляют ген основного иммуногенного белка патогена, и этот «гибрид» (непатогенный и чаще всего неспособный размножаться в организме человека) используют для вакцинации.
Когда такой рекомбинантный вирус попадает в клетки, информация с вирусного генома «считывается» в виде матричной РНК, по которой в клетке синтезируются вирусные белки, включая тот самый встроенный иммуногенный белок патогена. Далее этот белок, как при обычной инфекции, встраивается в клеточную мембрану, имитируя ситуацию заражения организма инфекционным агентом, не утратившим способность к размножению. Организм реагирует на такой экспонированный на клетке белок формированием иммунного ответа.
В качестве векторов-переносчиков генов иммуногенных вирусных белков испытывались разные вирусы: осповакцины, кори, аденовирусы, везикулярного стоматита, желтой лихорадки, альфа- и флавивирусы и др. Еще до 2020 г. ряд таких кандидатных вакцин дошел до клинических испытаний 1–2-й фазы, показав свою перспективность, но дальше этого дело не пошло. Кстати сказать, в 1990-е гг. несколько кандидатных вакцин были разработаны в новосибирском ГНЦ вирусологии и биотехнологии «Вектор», но контролирующие органы тогдашнего российского Минздрава не пустили их дальше первых двух фаз клинических испытаний, мотивируя это тем, что таких вакцин раньше не было. Но ведь и до Пастера не было инактивированных вакцин!
Слово о «Спутнике»
Ярким примером векторных вакцин может служить российский «Спутник V». Эта двухкомпонентная вакцина сконструирована на основе двух разных серотипов человеческого аденовируса — 26 и 5. Для выработки иммунного ответа на коронавирус в геном каждого из штаммов были вставлены ДНК-копии гена, кодирующего основной коронавирусный белок оболочки S. Он вставлен таким образом, чтобы в инфицированных клетках синтезировалась матричная РНК, кодирующая именно этот белок.
На этой упрощенной схеме показан принцип действия аденовирусной вакцины против SARS-CoV-2. Аденовирусы относятся к ДНК-вирусам. Генно-инженерный аденовирус, входящий в состав рекомбинантной вакцины от COVID-19, содержит в своем геноме фрагмент ДНК, который кодирует часть поверхностного белка-шипа S коронавируса. При попадании в клетку весь вирусный нуклеокапсид забрасывается в клеточное ядро. Однако из-за генетических дефектов аденовирусная ДНК не может там копироваться, как в случае полноценной вирусной частицы. В результате с этой ДНК считывается лишь матричная РНК, по которой в цитоплазме синтезируются коронавирусный и аденовирусные белки. Далее эти белки презентируются на поверхности клетки, где клетки иммунной системы распознают их так же, как в случае заражения коронавирусом или аденовирусом. При этом клетки, зараженные вакцинным вирусом, погибают, как и при реальной инфекции
Почему использовались два вектора-переносчика? Это связано с тем, что только живые аттенуированные (на основе ослабленных возбудителей) вакцины, да и то не все, обеспечивают хороший иммунный ответ после единственной инъекции. А инактивированные и субъединичные дают надежный иммунный ответ только после двух или трех инъекций. «Спутник V» сделан на основе двух серотипов аденовируса, чтобы сформировавшийся иммунитет к аденовирусным антигенам первой компоненты не мешал формированию усиленного иммунного ответа на вирусный белок при второй инъекции.
Белок-шип S коронавируса SARS-CoV-2 состоит из трех мономеров (показаны разным цветом). Верхняя часть белка (слева) связывается с клеточным рецептором АПФ2 человека, который коронавирус использует для проникновения в клетку. © 5-HT2AR. Public Domain Dedication
Еще одна особенность векторных вакцин, о которой уже упоминалось: сами вирусные носители не размножаются в организме человека. Для этого, к примеру, у аденовируса удаляют часть генов из области Е (так называемых ранних генов), отвечающей за его копирование и «маскировку» от иммунной системы. Такой дефектный вирус не может вызвать у вакцинированного аденовирусную инфекцию: он лишь некоторое время производит целевой продукт и часть своих белков, после чего погибает.
Поэтому и размножать его приходится в специальных клеточных культурах, в геномах которых имеются недостающие аденовирусные гены.
Как создается аденовирусная векторная вакцина? Из генома аденовируса вырезаются фрагменты (области E1 и E3), которые позволяют ему размножаться и обходить иммунную систему. Такой вирус называется нереплицирующимся, т. е. неспособным копировать сам себя. Далее на место гена E1 встраивается искусственно синтезированный ген, кодирующий чужеродный белок-антиген. Получается конструкция, состоящая из неразмножающегося аденовируса, которая способна производить белки-мишени, но не способна скрыть свое присутствие в инфицированной клетке от внимания иммунной системы.
«Спутник V» зарегистрирован более чем в 60 странах мира и применяется, помимо России, в таких государствах, как Аргентина, Венгрия, Сан-Марино, Алжир и другие. В случае его регистрации в Европейском медицинском агентстве соответствующие сертификаты о вакцинации будут действовать и в странах ЕС.
Все применяемые ныне векторные вакцины, как и «Спутник V», создавались на базе аденовирусов. Вместе с тем шли работы и по созданию вакцин против COVID-19 на основе вирусов кори, осповакцины, гриппа и других векторов, но большинство из них не показало хорошего защитного эффекта. Российский «Спутник V» по всем характеристикам сейчас считается одной из лучших векторных вакцин. И хотя поствакцинальные реакции на него довольно существенные, он формирует сильный иммунитет.
Один из часто возникающих вопросов в отношении всех векторных вакцин: можно ли использовать их для ревакцинации, ведь в организме формируется иммунитет и против самих вирусных носителей? Точный ответ на него могут дать только результаты испытаний. Но согласно предварительным данным, такие вакцины можно применять для повторной вакцинации уже через полгода. И пусть с меньшей эффективностью, но зато и без существенных поствакцинальных реакций.
К середине 2021 г. для вакцинации стали применяться четыре векторных вакцины — все на основе разных дефектных аденовирусов с встроенным полным геномом поверхностного S-белка исходного варианта нынешнего коронавируса SARS-CoV-2:
Результаты клинических испытаний вакцины «Спутник V» опубликованы в двух статьях во всемирно известном научном журнале The Lancet, который основан в 1823 г. и является вторым по цитируемости общемедицинским журналом мира после New England Journal of Medicine (Logunov, Dolzhikova, Zubkova et al., 2020; Logunov, Dolzhikova, Shcheblyakov et al., 2021). И хотя придирчивые читатели задали в комментариях к этим публикациям непростые вопросы, авторы на большинство из них достойно, на мой взгляд, ответили. А подобные дискуссии в этом журнале не редкость.
Суть — в пузырьках
Помимо векторных вакцин, усилия ученых направлены на создание так называемых мРНК-вакцин. В случае их применения в организм попадает не генетический материал вирусов, а лишь матричная РНК — готовая основа для синтеза патогенного вирусного белка, который должен вызывать иммунный ответ. Для доставки в наши клетки такая мРНК «пакуется» в специально разработанные липидные пузырьки.
Американская компания Moderna была основана десять лет назад для разработки именно этого типа вакцин. К 2020 г. она создала уже восемь кандидатных вакцин против целого ряда респираторных вирусных инфекций. Как минимум три из них еще несколько лет назад прошли первые фазы клинических испытаний на добровольцах.
Механизм работы вакцины, созданной в Moderna против SARS-CoV-2, примерно такой же, как у векторных, только проще. Она состоит из липидных пузырьков, заполненных раствором, который содержит молекулы матричной РНК, кодирующей все тот же коронавирусный белок S. При введении в мышечную ткань эти пузырьки сливаются с мембраной клеток, и мРНК высвобождается. А далее все происходит, как описано выше для векторных вакцин. Иначе говоря, иммуногенная часть этой вакцины аналогична той, что и у применяющихся сейчас векторных.
Эти клетки лабораторной культуры Vero CCL81CCL-81, полученные из эпителия почки африканской зеленой мартышки, инфицированы вирусными частицами SARS-CoV-2 (отмечены бежевым цветом). Щупальцевидные выступы, отходящие от зараженных клеток, прикрепляются к соседним клеткам и служат своего рода «мостом» для передачи вирусной инфекции. Сканирующая микроскопия. © NIAID
Другую популярную мРНК-вакцину разработала крупнейшая американская транснациональная компания Pfizer совместно с небольшой германской фирмой BioNTech. Она действует по тому же принципу, однако ее мРНК сконструирована немного по-другому, имеются отличия и в составе липидных пузырьков.
Эти вакцины требуют ввода двух инъекций одним и тем же препаратом. Эффективность их весьма высока — более 90%, и сейчас они — самые массовые в производстве и применении. Преимущества мРНК-вакцин очевидны. Во-первых, при их использовании в организме не возникает иммунных реакций на «сопутствующие» компоненты самой вакцины, как в случае векторных. Во-вторых, при необходимости разработки вакцины против другого возбудителя нужно просто заменить одну матричную РНК на другую.
Это очень перспективный подход к конструированию вакцин. Недостаток у подобных вакцин один: их надо хранить и перевозить при достаточно низких температурах. Правда, им страдает и ряд векторных вакцин.
Вакцина и организм
Общее воздействие на организм человека как векторных, так и мРНК-вакцин нетрудно оценить.
Как известно, в нашем организме примерно 30 трлн (30×10 12 ) клеток. В одной дозе векторной вакцины «Спутник V», согласно инструкции, 10 11 вирусных частиц. Таким образом, одна доза вакцины может, в принципе, заразить одну клетку из 300, т. е. 0,3% от общего числа. Фактически эта цифра будет на один-два порядка меньше, потому что на одной эпителиальной клетке имеются десятки рецепторов для аденовируса. Заметим, что в случае инактивированных вакцин число вводимых в организм вирусных частиц имеет близкий порядок — 10–50 млрд, так что рассуждение о большем вреде векторных вакцин в сравнении с инактивированными не обосновано.
Что касается мРНК-вакцин, то на сайте компании Pfizer не указано количество молекул матричной РНК в дозе вакцины, поэтому нельзя оценить, сколько их попадает в организм в результате одной инъекции. Но, исходя из логических соображений, доля клеток, куда проникла молекула мРНК, вряд ли превышает такую же долю для аденовирусов в случае векторных вакцин.
У некоторых векторных аденовирусных вакцин против COVID-19 была выявлена очень редкая побочная реакция в виде тромбообразования. В ряде случаев она привела даже к смертельным исходам, что вызвало серьезные беспокойства у населения. Такие осложнения были зафиксированы у 5–10 человек среди миллиона привитых вакциной Oxford / AstraZeneca и у 1–2 человек из миллиона привитых вакциной Johnson & Johnson, в которой используется в качестве носителя аденовирус 26-го серотипа, как и в первом компоненте «Спутника V». В отношении самого «Спутника V» подобной информации нет.
В нескольких препринтах, посвященных выяснению причин этих весьма серьезных осложнений, были выдвинуты три возможные причины: попадание основного содержимого шприца не в мышцу, а в крупный кровеносный сосуд; редкая генетическая особенность; повышенная свертываемость крови в день инъекции. Но все это пока рабочие гипотезы, которые проверяются. В любом случае вероятность этого осложнения при применении той же вакцины Johnson & Johnson сопоставима со смертью в собственной ванне — события, безусловно, крайне редкого.
Еще один вопрос, который иногда задают, касается феномена антителозависимого усиления инфекции. Как известно, обычно антитела способствуют фагоцитированию («заглатыванию») вируса иммунными клетками, что препятствует его размножению. Однако в некоторых случаях благодаря связыванию вирусной частицы с субоптимальными антителами вирус после проникновения в иммунные клетки не деградирует, а, напротив, начитает активно размножаться. Это вызывает гибель иммунных клеток и, соответственно, усиление инфекции.
Такой феномен достоверно зафиксирован, к примеру, в отношении лихорадки денге: при перенесении человеком заболевания, вызванного одним из серотипов этого вируса, в случае заражения вирусом другого серотипа болезнь проходит намного тяжелее и доля смертельных случаев резко возрастает. То же самое наблюдалось при создании и применении первых вакцин против лихорадки денге, а также против малярии.
Предполагалось, что такое явление может наблюдаться и в случае коронавирусных инфекций, поэтому при разработке всех вакцин его учитывали и пытались отслеживать. К счастью, в случае COVID-19 подобных осложнений до сих не выявлено, как при заболевании, так и при вакцинации (Halstead, Katzelnick, 2020).
Мир вакцинируется
Благодаря огромному «спросу» к 21 августа 2021 г. на стадии доклинических испытаний находилось уже 75 кандидатных вакцин. В клинических испытаниях на добровольцах участвовали 99 вакцинных препаратов, при этом треть из них — на завершающей, 3-й фазе. И уже больше десятка вакцин было в ряде стран разрешено для применения полностью либо ограниченно.
Вакцинация от COVID-19 в России стартовала в Москве 5 декабря 2020 г., а спустя 10 дней Минздрав РФ объявил о начале вакцинации во всех регионах. К 18 декабря 2020 г. первые прививки от коронавирусной инфекции сделали более 1,1 млн человек в четырех странах мира, включая США, Китай и Великобританию. © Our World in Data
Все ведущие вакцины в мире до сих пор испытываются в рамках 3-й фазы клинических испытаний с участием десятков тысяч человек, которые закончатся не ранее осени 2021 г. Но если бы их не начали применять уже полгода назад, то число смертей от коронавирусной инфекции было бы в несколько раз больше.
Наиболее масштабно производятся мРНК-вакцина компании Pfizer и векторная вакцина компании Johnson & Johnson. В шестерку самых массовых вошли также китайские инактивированные вакцины Sinovac и Sinopharm, векторная вакцина компании AstraZeneca и мРНК-вакцина компании Moderna. Затем — с большим отрывом — идет отечественный «Спутник V».
Число доз вакцин от COVID-19 (на 100 человек), которые получило население разных стран мира, на 31 августа 2021 г. Так как некоторые вакцины требуют двукратного введения, число введенных доз может превышать 100. © Our World in Data
При вакцинации зарубежными вакцинами ни в одном случае не требуется определение титров антител. Противопоказания минимальны: ими служат только тяжелая текущая инфекция и сильная аллергическая реакция на первый компонент вакцины. Наиболее безопасными на сегодняшний момент считаются инактивированные и мРНК-вакцины, которые можно использовать и для беременных женщин. А недавно была доказана безвредность для беременных женщин и некоторых векторных вакцин (Shimabukuro, Kim, Myers, 2021).
По степени охвата вакцинированием все государства можно разделить на группы. В первой группе окажутся те страны, где более половины населения получили хотя бы одну дозу вакцины, во второй — где было вакцинировано более 25%. В России к середине августа хотя бы одну дозу получило около четверти всего населения.

Доля людей в некоторых странах мира, полностью или частично вакцинированных против COVID-19, на 31 августа 2021 г. © Our World in Data
Для того, чтобы в сентябре полноценную прививку сделали 60% россиян (такой показатель нужен для обеспечения минимального коллективного иммунитета, необходимого для окончания пандемии), требуется привить в шесть раз больше человек, чем это было сделано за первое полугодие 2021 г. А, к примеру, для прекращения пандемии при распространении коронавирусного варианта дельта нужно, согласно прогнозу ВОЗ, вакцинировать около 80% населения (Abu-Raddad et al., 2021). До такого показателя Россия до конца 2021 г. не дойдет без кардинального — на порядок — ускорения темпов вакцинации.
В странах, где продолжают соблюдаться противоэпидемические меры, а доля вакцинированных приближается к 60% (Великобритания, Израиль и др.), заболеваемость к июню 2021 г. упала до минимального уровня с начала года. Что касается ее июльского подъема в США и Великобритании (в первую очередь из-за распространения вирусного варианта дельта), то директор Центров по контролю и профилактике заболеваний в США Р. Валенски назвала его «в основном эпидемией непривитых». Однако нужно отметить, что вариант дельта в несколько раз более заразный, чем прежние, и в принципе способен «пробивать» иммунитет у некоторых давно вакцинированных людей.
В России на начало лета новой коронавирусной инфекцией переболело, по данным санкт-петербургских исследователей, около 30% населения (Barchuk et al., 2021). В это время у нас началась мощная третья волна заболеваемости COVID-9. Причин этому несколько: от пренебрежения противоэпидемическими мерами, включая защитные маски, и проведения масштабных публичных мероприятий до массового заноса из Индии варианта дельты. При этом одна из самых значимых причин — низкий уровень вакцинирования населения. И если мы кардинально не изменим ситуацию с вакцинацией и противоэпидемическими мерами, то у нас будут и четвертая, и пятая, и шестая волны.
Главное — это не просто издавать приказы, а тщательно отслеживать и контролировать их выполнение. Ведь, к примеру, вакцин у нас откровенно не хватает: «Спутник V» пока производится в недостаточном количестве, а ее первый компонент в качестве однокомпонентной вакцины «Спутник Лайт» лишь недавно был разрешен к использованию для пожилых людей. И в этом отношении совершенно непонятен призыв к ревакцинации, в то время как около трех четвертей населения не вакцинировано вообще.
Подводя итоги, можно сказать, что на сегодняшний день уже есть более-менее безопасные вакцины с эффективной защитой от этой инфекции.
За векторными вакцинами — будущее для здоровых людей, потому что разработать их можно быстро, они дают сильный иммунитет и относительно дешевы. Производство таких вакцин легко масштабировать, их проще перевозить и хранить. Но и поствакцинальные реакции на них есть. И в этом смысле самыми перспективными являются вакцины на основе мРНК, как наиболее очищенные и минимизированные по составу, а также числу и тяжести побочных реакций. Производство этих вакцин также можно масштабировать, однако они существенно дороже, а перевозить и хранить их надо при низких (до минус 70°С) температурах.
Нельзя забывать и о классических инактивированных вакцинах, которые сейчас массово выпускаются в Индии и Китае и начали производиться в России и Казахстане.
Но окончательно сравнить все вакцины против COVID-19 можно будет только после финальных оценок их реального защитного эффекта, побочных реакций и безопасности, которые будут сделаны на основе анализа заболеваемости на больших выборках из вакцинированных и невакцинированных людей. Публикации подобных результатов ожидаются в начале 2022 г.
Безусловно, защитный эффект от любых вакцин может утрачиваться со временем, поэтому вакцинации от COVID-19 станут, скорее всего, регулярными — раз в 2–3 года, а то и чаще. И SARS-CoV-2, по-видимому, войдет в нашу жизнь так же, как в нее вошли вирусы гриппа, «обычные» коронавирусы и другие возбудители ОРВИ.
Литература
1. Abu-Raddad L. J., Chemaitelly H., Butt A. A. Effectiveness of the BNT162b2 Covid-19 Vaccine against the B.1.1.7 and B.1.351 Variants // NEJM. 2021. V. 385. № 2. P. 187–189. DOI: 10.1056/NEJMc2104974.
2. Halstead S. B., Katzelnick L. COVID-19 Vaccines: Should We Fear ADE? // The Journal of Infectious Diseases. 2020. V. 222. P. 1946–1950.
3. Logunov D. Y., Dolzhikova I. V., Zubkova O. V., et al. Safety and Immunogenicity of an rAd26 and rAd5 Vector-based Heterologous Prime-boost COVID-19 Vaccine in Two Formulations: Two open, Non-randomised Phase 1/2 Studies from Russia // The Lancet. 2020. V. 396. P. 887–897.
4. Logunov D. Y., Dolzhikova I. V., Shcheblyakov D. V., et al. Safety and Immunogenicity of an rAd26 and rAd5 Vector-based Heterologous Prime-boost COVID-19 Vaccine in Two Formulations: Two open, Non-randomised Phase 1/2 Studies from Russia // The Lancet. 2021. V. 397. P. 671–681.
5. Shimabukuro T. T., Kim S. Y., Myers T. R., et al. Preliminary Findings of mRNA Covid-19 Vaccine Safety in Pregnant Persons // NEJM. 2021. V. 384. P. 2273–2282.










