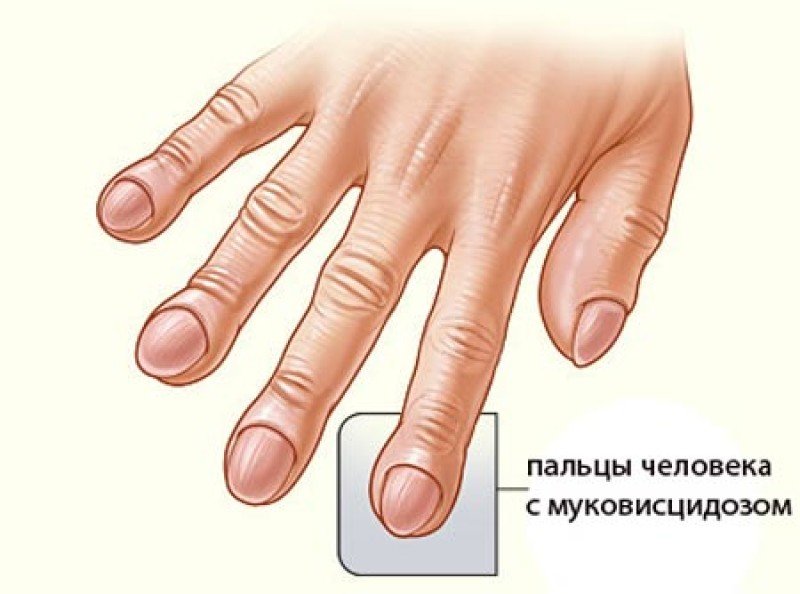
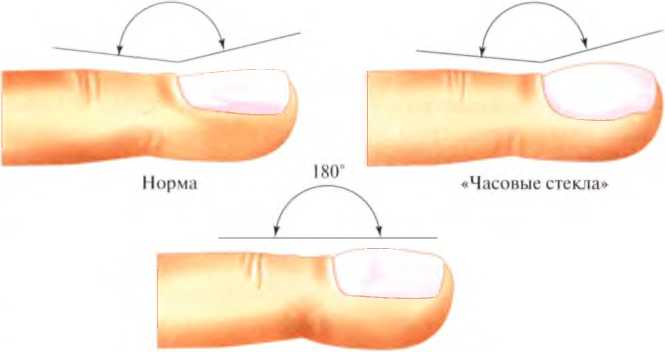
Муковисцидоз что это за болезнь у новорожденных
Муковисцидоз: проявления, диагностика, лечение и помощь
Время чтения: 7 мин.
Оно поражает все органы, выделяющие слизь: бронхолегочную систему, поджелудочную железу, печень, железы кишечника, потовые, слюнные и половые железы. При муковисцидозе железы производят вязкий секрет, который не дает внутренним органам полноценно функционировать. Особенно поражаются печень, поджелудочная железа, кишечный тракт и бронхолегочная система. Легкие забиваются слизью: их работа нарушается, развиваются опасные инфекции, которые трудно лечить. Слизь, которая копится в поджелудочной железе, нарушает работу ферментов — плохо усваиваются жиры и другие жизненно важные питательные вещества.
Как проявляется муковисцидоз?
Заболевание проявляется по-разному. Это зависит от мутации гена, которая приводит к нарушению функции белкового продукта — трансмембранного регулятора муковисцидоза (МВТР).
У некоторых людей оно проявляется сразу после рождения, и это считается «тяжелой» формой болезни. Если мутации «мягкие», муковисцидоз проявляются позднее, в 10-15 лет.
Признаки муковисцидоза у детей:
Взрослые больные страдают заболеваниями верхних и нижних дыхательных путей, кишечно-желудочного тракта. Постоянно повторяются бронхиты и бронхопневмонии. Также у больных муковисцидозом бывает диареи с большим количеством каловых масс, приступы кишечной непроходимости, боли в животе.
Наблюдается полипоз носа, человек постоянно кашляет по непонятной причине. Может развиваться остеопения (снижение плотности костной ткани) и остеопороз (повышение хрупкости костей) с риском тяжелых переломов. Воспалительный процесс поражает суставы, развивается артрит. У некоторых развивается сахарный диабет и цирроз печени.
Большинство мужчин с муковисцидозом не могут иметь детей естественным путем: мужское бесплодие развивается из-за непроходимости семявыносящих протоков. Это не влияет на сексуальные способности, а с помощью репродуктивных технологий мужчины с муковисцидозом могут иметь детей. Женщины с муковисцидозом обычно могут иметь детей естественным путем.
Новорожденных проверяют на муковисцидоз с 2006 года. Если скрининговый тест положительный, ребенок попадает в группу особого контроля, и уже к месяцу врачи могут поставить точный диагноз.
Основные критерии при диагностике муковисцидоза:
Обычно детей с муковисцидозом наблюдают врач-пульмонолог и врач-педиатр, а также врач-генетик. Заболевание поражает многие органы и требует комплексной терапии, поэтому пациентов наблюдают врачи разных профилей.
Как лечат муковисцидоз?
Состояние поддерживается дието- и витаминотерапией. При муковисцидозе в сутки нужно потреблять на 120-150% калорий больше, чем при стандартном рационе, пропорционально увеличивается потребление белка и жира. При недостаточности функции поджелудочной железы применяется ферментозаместительная терапия, для уменьшения вязкости мокроты и облегчения ее эвакуации прописывают муколитики. Для лечения печени назначаются гепатопротекторы.
В обязательном порядке проводится кинезитерапия — комплекс процедур и упражнений, который восстанавливает двигательную функцию, уменьшает риск возникновения осложнений и сохраняет общую физическую способность, способствует выделению мокроты из бронхиального дерева, улучшает вентиляцию легких и снижает риск развития множества опасных осложнений. Проводится антибактериальная терапия — плановые курсы в виде ингаляций через небулайзер, совместно с таблетками или внутривенно всем пациентам с легочными проявлениями муковисцидоза, а также при обострении заболевания и выявлении респираторной инфекции. При дыхательной недостаточности проводят кислородотерапию, а при острой дыхательной недостаточности — неинвазивную вентиляцию легких.
При необходимости используют:
Пересадка легких при муковисцидозе
Трансплантация легких — шанс для больных муковисцидозом, когда медикаментозная терапия уже не помогает.
В 2016 году в Национальном медицинском исследовательском центре трансплантологии и искусственных органов имени академика В.И. Шумакова трансплантацию легких впервые выполнили 13-летней Кате Матвеевой с муковисцидозом. Она — первый ребенок, которому в России пересадили легкие. Первый опыт оказался успешным: появилась возможность оказывать трансплантологическую помощь подросткам, используя органы взрослого умершего донора.
Первую в мире успешную одновременную трансплантацию печени и легких ребенку с муковисцидозом провели в начале 2019 года тоже в НМИЦ трансплантологии и искусственных органов им. Шумакова девятилетнему Мише из Южно-Сахалинска. Зарубежные трансплантологи и до этого пытались провести подобную операцию у детей этой возрастной группы, но все заканчивалось неудачно.
«Пациенты с муковисцидозом подходят к состоянию, когда трансплантация показана, обычно уже во взрослом возрасте. Все зависит от течения самого заболевания, в какой степени поражены органы, — поясняет директор Центра, главный трансплантолог Минздрава России Сергей Готье. — Либо это преимущественное поражение легких с развитием дыхательной недостаточности, и тогда показана трансплантация легких. Либо торпидное, то есть вялое, мягкое течение заболевания в отношении легких, но при этом формирование цирроза печени и показания к трансплантации печени. То есть бывают пациенты с показаниями к трансплантации печени и пациенты с показаниями к трансплантации легких. А посередине этих двух групп как раз наш Миша, которому пришлось делать сочетанную операцию в связи с тяжелым поражением и печени, и легких».
Председатель межрегиональной общественной организации «Помощь больным с муковисцидозом» Ирина Мясникова назвала эту операцию неоспоримым успехом. «Я очень обрадовалась, когда узнала, что Мише пересадили легкие и печень. Для больных муковисцидозом это самые-самые уязвимые органы, они больше всего страдают. Есть случаи, когда несмотря на все усилия врачей и семей с такими детьми, не получается поддержать таких пациентов. Это очень печальные ситуации, просто невозможные, особенно если речь идет о детях, которые кроме страданий ничего в этой жизни не видели. И до сих пор никакого выхода не было. Мы гордимся и рады, что именно российские врачи были первыми, кто такую уникальную операцию осуществил. Это дает надежду всем таким нашим пациентам и их родителям».
Современное лечение и разработка новых методов терапии муковисцидоза
До недавнего времени лечили только симптомы муковисцидоза. В последние годы произошел существенный прогресс в патогенетической терапии заболевания, а также возникли предпосылки для развития новых методов генной терапии.
Еще один новый препарат, применяемый при муковисцидозе — « Оркамби ». Он зарегистрирован в России, и в августе 2021 года утвержден в перечень ЖНВЛП. « Оркамби » используют для коррекции генетических причин муковисцидоза. Этот препарат разработан для пациентов, у которых две генетические мутации 508del. Согласно регистру пациентов с муковисцидозом от 2017 года, такую мутацию имеют 31% детей и 23% взрослых пациентов. При применении этого препарата у пациентов увеличивается объем легких, и болезнь протекает гораздо легче.
Паллиативная помощь при муковисцидозе
Отдельной паллиативной программы для пациентов с муковисцидозом нет, но хосписы берут под опеку людей с муковисцидозом в терминальной стадии заболевания. Среди них есть те, кто ждет трансплантацию легких: в этот сложный период людям нужна и куративная, и паллиативная помощь. Если человек после трансплантации легких чувствует себя хорошо, его снимают с учета в хосписе. Если пересадка неуспешна, его оставляют на учете.
За рубежом оказание паллиативной помощи пациентам с муковисцидозом распространено широко. По словам директора Благотворительного фонда «Детский паллиатив» по научно-методической работе Натальи Савва, в Англии такие люди могут лечиться и обратиться в хоспис, лечь туда для социальной передышки, симптоматического контроля, помощи в конце жизни, их может наблюдать выездная служба. Она подчеркивает, что паллиативная помощь — это не только помощь умирающим: «У нас большинство детей (с муковисцидозом) не являются умирающими. Они долго живут с момента постановки диагноза и/или развития комплекса проблем, нарушающих качество жизни, параллельно наблюдаются специализированной и паллиативной службами, могут перейти во взрослый возраст».
Муковисцидоз что это за болезнь у новорожденных
Массовое обследование новорожденных на наследственные болезни. Муковисцидоз
Прочтите и возьмите себе на заметку, особенно если вы молодые люди
В России уже много лет проводится массовое обследование новорожденных для выявления у них нескольких наследственных заболеваний. Такое обследование проводится во многих странах и называется скринингом новорожденных или неонаталъным скринингом.
Целью скрининга новорожденных является, конечно, не само выявление новорожденных с еще не проявившимися наследственными заболеваниями, а их лечение, которое позволяет предотвратить появление клинических симптомов, во многих случаях весьма тяжелых, или даже фатальных. В результате рано начатого и аккуратно проводимого лечения вместо тяжело больных детей, а затем подростков и взрослых, получаются здоровые люди, полноценные члены общества, нередко являющиеся гордостью семьи.
Скрининг новорожденных в России ведется в отношении 5 наследственных и врожденных заболеваний: фенилкетонурии, гипотиреоза, галактоземии, адрено-гениталъного синдрома и муковисцидоза.
ЧТО ТАКОЕ МУКОВИСЦИДОЗ?
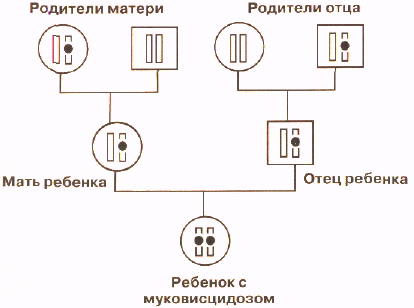
КАК НАСЛЕДУЕТСЯ МУКОВИСЦИДОЗ?
На рисунке для простоты изображена только хромосома, содержащая ген, мутации в котором вызывают муковисцидоз. У ребенка в обеих хромосомах содержится мутантный ген и поэтому он болен. У каждого из родителей мутантный ген содержится только в одной хромосоме, а вторая хромосома нормальная и поэтому они здоровы. Такие люди, которые имеют один нормальный и один дефектный ген называются носителями мутантного гена. У бабки по матери мутантный ген также имеется только в одной хромосоме, как и у деда со стороны отца. Они, как и родители ребенка, здоровы, но передали хромосомы, содержащие мутантный ген, своим детям. У вторых деда и бабки обе хромосомы содержат только нормальный ген. Таким образом, при рецессивном наследовании болен только тот член семьи, который получил от своих родителей обе хромосомы, несущие мутантный ген. Все остальные члены семьи здоровы, в том числе и те, кто является носителем мутантного гена. На схеме родословной видно, что у родителей больного ребенка могут еще появиться больные дети. Вероятность появления больного ребенка в семьях, в которых родители являются носителями мутантного гена, составляет 1/4 или 25%. Эта вероятность не меняется от числа больных или здоровых детей в семье: для каждого следующего ребенка риск, что он будет болен, составляет 25%. Вероятность рождения здорового ребенка, обе хромосомы которого содержат только нормальный ген, составляет также 25%. А 50% детей будут иметь один нормальный и один мутангный ген, как их родители. Это означает, что при каждой беременности родители-носители имеют шансы 3 из 4 (75%) родить здорового ребенка. Многие родители больных муковисцидозом детей и их родственники, первый раз встретившись с врачом-генетиком, настойчиво повторяют, что у их ребенка не наследственное заболевание, так как в их семье ни у кого из родственников никогда не было такого заболевания. Только объяснение, что правила наследования бывают разные, и не редко больной с наследственным заболеванием может быть единственным в семье, позволяют им понять с какой ситуацией они столкнулись.
КАКИЕ ПОРАЖЕНИЯ В ОРГАНИЗМЕ ВЫЗЫВАЕТ МУКОВИСЦИДОЗ?
СУЩЕСТВУЮТ ЛИ ТЕСТЫ НА РАННЕЕ ВЫЯВЛЕНИЕ МУКОВИСЦИДОЗА?
Больные с муковисцидозом могут быть выявлены с помощью скрининга новорожденных. В отличие от других наследственных болезней, выявляемых при скрининге, при которых раннее выявление заболевания позволяет его настолько эффективно лечить, что можно вообще избежать каких-либо клинических проявлений заболеваний, скрининг новорожденных при муковисцидозе преследует несколько иную цель. Врачи считают, что если муковисцидоз выявляется у новорожденного, и его начинают сразу же лечить, то ребенок нормально развивается физически и умственно. У него в меньшей степени будут поражаться легкие и другие органы, увеличится продолжительность жизни, которая в настоящее время, благодаря адекватному лечению, составляет в развитых странах более 35 лет. Скрининг на муковисцидоз начинается с того, что у новорожденного в родильном доме перед выпиской берут из пятки несколько капель крови, которую наносят на специально для этой цели используемую фильтровальную бумагу. Кровь высушивается, и такой бланк, на котором указана фамилия новорожденного и ряд других сведений, необходимых для его идентификации, переправляется в лабораторию региональной медико-генетической консультации. В лаборатории проводят специальное исследование, которое позволяет выявить новорожденных, у которых есть подозрение на муковисцидоз. В этом случае ребенок через педиатра вызывается в лабораторию на повторноетестирование. Родителям педиатр сообщает, что первый тест на муковисцидоз у их ребенка оказался ненормальным. У них появляется повод для беспокойства. Поэтому повторное тестирование образца крови у младенца, которое является очень важным, нужно сделать как можно быстрее. В большинстве случаев при повторном исследовании тест на муковисцидоз оказывается нормальным. Это означает, что результат первого исследования был неверный (его называют ложноположительным). Причины этого могут быть разными и связанными как с состоянием младенца, так и с какой-то ошибкой лаборатории. Этот результат, свидетельствующий о том, что у ребенка нет муковисцидоза, сразу же сообщается родителям, чтобы снять с них чувство страха.
ЧТО ДЕЛАТЬ, ЕСЛИ И ПОВТОРНЫЙ ЛАБОРАТОРНЫЙ ТЕСТ НА МУКОВИСЦИДОЗ ОКАЗАЛСЯ ПОЛОЖИТЕЛЬНЫМ?
Если и второе лабораторное исследование для выявления муковисцидоза оказалось положительным, то, в отличие от других скринируемых наследственных болезней, это еще не означает, что у ребенка есть муковисцидоз, хотя вероятность такого диагноза является высокой. Семья, в которой у ребенка повторно подтвердился положительный тест на муковисцидоз, приглашается на прием к врачу-генетику в медико-генетическую консультацию. Здесь семье объясняют, что собой представляет муковисцидоз и организуют прием у клиницистов, являющихся специалистами в диагностике и лечении муковисцидоза. Теперь наблюдение за ребенком берет на себя группа клиницистов. Для подтверждения диагноза муковисцидоза младенцу проводят так называемый лотовый тест. Это совершенно безобидный и безболезненный тест можно провести младенцу, начиная с возраста 3-4 недели жизни. Если лотовый тест оказывается отрицательным, то ребенок считается здоровым, хотя за ним клиницисты еще будут наблюдать некоторое время. Если же потовый тест оказался положительным, то диагноз муковисцидоза считается установленным, даже до появления каких-либо клинических проявлений заболевания. В этом случае врачи назначат ребенку лечение, которое надо будет строго соблюдать. Ребенок будет периодически обследоваться группой специалистов для постоянного контроля за состоянием его здоровья.
МОЖНО ЛИ ПОМОЧЬ СЕМЬЕ, В КОТОРОЙ ПОЯВИЛСЯ БОЛЬНОЙ С МУКОВИСЦИДОЗОМ, ИМЕТЬ ЗДОРОВЫХ ДЕТЕЙ?
Да, и довольно успешно. Для муковисцидоза возможна дородовая диагностика. Первым шагом в этом направлении является обращение в медико-генетическую консультацию, где врач-генетик определяет показания и возможные методические подходы к дородовой диагностике в каждом конкретном случае. Сама процедура заключается в том, что во время беременности в сроке 9-11 недель или 16-18 недель врач акушер-гинеколог проводит забор очень небольшого количества клеток плода и направляет этот материал в специальную лабораторию пренатальной диагностики. В этой лаборатории врачи лаборанты-генетики проводят молекулярную диагностику, т.е. определяют наличие или отсутствие мутации в гене, отвечающем за муковисцидоз. В случае положительного результата семья решает вопрос о прерывании беременности больным плодом или настраивается на появление еще одного больного ребенка. Это право выбора остается за семьей.
© 2021 краевое государственное бюджетное учреждение здравоохранения «Красноярский краевой медико-генетический центр» (КГБУЗ «ККМГЦ»)
Муковисцидоз: что за болезнь, как проходит лечение?
Симптомы муковисцидоза
Специалисты выделяют несколько форм заболевания: кишечную, легочную и смешанную.
К основным симптомам заболевания обычно относят:
Симптомы муковисцидоза зависят от формы болезни. Муковисцидоз легких сильно снижает иммунитет, а поскольку слизистые пробки легко поражаются бактериями стафилококка или синегнойной палочки, люди постоянно страдают от повторяющихся бронхитов и пневмоний.
Основные признаки муковисцидоза легких 1 :
Кишечная форма муковисцидоза характеризуется ферментной недостаточностью, нарушением всасывания полезных веществ в кишечнике. В результате нехватки ферментов стул становится «жирным», могут активно размножаться бактерии, в результате чего накапливаются газы, что приводит к выраженному метеоризму. Стул учащается, а объем каловых масс может в несколько раз превышать возрастную норму.
Причины муковисцидоза
Скопление слизи создает благоприятные условия для размножения условно-патогенной флоры, поэтому резко возрастает риск возникновения гнойных осложнений и сопутствующих заболеваний. При муковисцидозе у взрослых значительно страдает репродуктивная функция.
Диагностика муковисцидоза
Для диагностики муковисцидоза могут понадобиться как лабораторные, так и генетические обследования. Генетические исследования обладают высокой информативностью и позволяют заподозрить развитие болезни почти сразу после рождения. На данный момент обнаружить заболевание можно еще до рождения ребенка при неонатальном скрининге.
Для того, чтобы с уверенностью говорить о наличии у человека муковисцидоза, врач должен диагностировать следующие показатели 1 :
Лечение муковисцидоза
Лечение муковисцидоза должно быть комплексным и направленным на основные симптомы болезни: борьбу с инфекционными заболеваниями, очищение бронхов от мокроты, восполнение недостающих ферментов поджелудочной железы.
Часть терапии обязательно должна быть направлена на поддержку бронхолегочной системы, предупреждение осложнений от повторяющихся бронхитов и пневмоний. При развитии инфекционных заболеваний показано лечение антибиотиками. Обязательно используют методы и средства, которые способствуют разжижению мокроты и ее свободному удалению из бронхов и легких. Муколитики – препараты, разжижающие мокроту, используют длительными курсами, делая небольшие перерывы.
Диета при муковисцидозе – это не временные ограничения, а пожизненный образ питания. В рационе человека должно быть большое количество белка, получаемого из нежирного мяса, качественной рыбы, творога и яиц. Желательно, чтобы диета была высококалорийной, но необходимо ограничить количество поступающих жиров животного происхождения, трансжиров и грубой клетчатки, которая раздражает воспаленные стенки желудочно-кишечного тракта.
При развитии непереносимости лактозы из рациона исключают молоко. Из-за сухости слизистых оболочек и нарушения секреции слизи рекомендуется повышенный питьевой режим, особенно в жаркие месяцы.
Препарат Креон ® при муковисцидозе
Также в линейке Креон ® есть специальная форма – Креон ® Микро, выпущенная специально для лечения детей с муковисцидозом. Минимикросферы помещены во флакон россыпью, в комплекте идет мерная ложечка, которая позволяет удобно насыпать нужное количество препарата.
Подробнее о Креон ® Микро можно прочитать здесь.
Муковисцидоз — первые надежды
Муковисцидоз — первые надежды
CFTR — хлорный канал, мутации в котором являются причиной муковисцидоза. TMD — трансмембранный домен.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Муковисцидоз — самое распространенное из моногенетических заболеваний (обусловленных поломкой одного гена). При нем нарушено функционирование белка-переносчика ионов хлора через мембрану клетки — хлорного канала CFTR. Так как этот канал отвечает за нормальную работу эпителия в легких, кишечнике, поджелудочной железе и других органах, его дисфункция приводит к накоплению в этих органах слизи, повышению вероятности инфекций и в конце концов к преждевременной смерти. До последнего времени врачи могли лечить только симптомы муковисцидоза: разжижать слизь, расширять бронхи, снижать воспаление, а также уничтожать бактерий антибиотиками, причем все эти меры почти не продлевали жизнь. Но за последние годы был достигнут невиданный прогресс: средняя продолжительность жизни больных возросла более чем в два раза. В этой статье будет рассказано о препаратах, благодаря которым стал возможен такой успех, об истории их создания и перспективах. На данных примерах читатель также узнает, как происходит современная разработка лекарств.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Описание заболевания
Вначале рассмотрим подробнее, что за болезнь муковисцидоз и почему разработка лекарств против него оказалась таким непростым делом.
Большинство случаев этого страшного заболевания диагностируют в первые годы жизни, потому что муковисцидоз поражает все органы, но особенно — легкие и кишечник. Больные страдают от многочисленных нарушений работы почти всех систем организма: дыхательной, пищеварительной, опорно-двигательной, нервной, сердечно-сосудистой и других. Средняя продолжительность жизни больных составляет 30–40 лет (и сильно зависит от качества ухода), 90% пациентов умирает от легочных осложнений.
Муковисцидоз (или кистозный фиброз, как он называется по-английски) возникает у тех людей, у которых плохо работает или отсутствует белок CFTR. Его название расшифровывается как cystic fibrosis transmembrane conductance regulator, то есть регулятор трансмембранной проводимости при муковисцидозе. Сейчас разберемся, какова роль CFTR в норме и почему его недостаток приводит к таким тяжелым последствиям.
Знай врага своего
Муковисцидоз — самое распространенное заболевание, вызванное одной генетической причиной. Ежегодно в России рождается около 650 человек с муковисцидозом [2], а в мире — один на 2000–5000 новорожденных страдает этой болезнью. В России на 2016 год таких больных было зарегистрировано около 3000, а во всем мире порядка 100 000 [3].
То есть он пронизывает мембрану клетки насквозь.
АТФ — аденозинтрифосфорная кислота, основная молекула, которая запасает и передает химическую энергию в клетках.
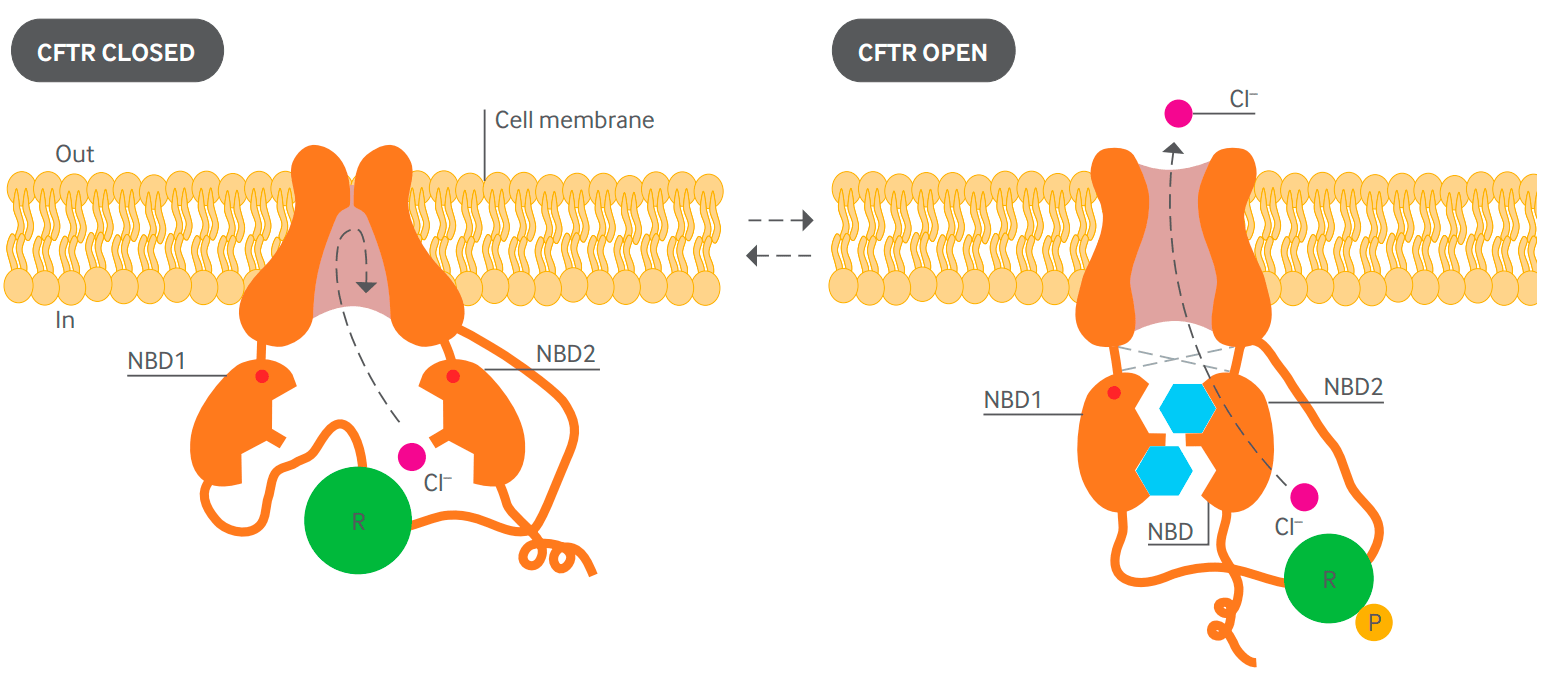
Рисунок 1. Диаграмма предполагаемой структуры белка CFTR в закрытом (слева) и открытом (справа) положениях. Два трансмембранных домена образуют канал. Открытие канала контролируется двумя внутриклеточными доменами (NBD1 и NBD2), которые способны связывать и гидролизовать АТФ (голубой). Регуляторный домен (зеленый) содержит сайты фосфорилирования (Р). Активация канала требует наличия остатка фосфорной кислоты на регуляторном домене. NBD1 и NBD2 связывают и гидролизуют АТФ, вызывая открытие канала путем взаимодействия с трансмембранными доменами. Одна из молекул АТФ остается связанной с NBD1 в течение нескольких минут. За это время происходит несколько циклов открывания-закрывания канала, обусловленных связыванием и гидролизом второй молекулы АТФ [4], [5].
Наличие ионов вблизи поверхности клеток необходимо для поддержания нормального осмотического давления, а это важно для циркуляции жидкости в околоклеточном пространстве. Поэтому постоянный контролируемый поток ионов хлора через мембрану необходим для нормального функционирования эпителия легких, кишечника, протоков поджелудочной железы, яичников, потовых желез.
При муковисцидозе в первую очередь поражаются именно эти органы: в железах образуется густая слизь, которая забивает протоки и мешает нормальной работе органов. А вот почему в легких и кишечнике нарушается работа врожденной иммунной системы, возникает хроническое воспаление и инфекции — стало более-менее понятно совсем недавно. На нынешний момент картина примерно такая: снижение концентрации ионов хлора в околоклеточном пространстве вызывает активацию эпителиального натриевого канала ENaC, который начинает закачивать натрий в клетку. Уменьшение концентрации NaCl возле поверхности клетки вызывает снижение осмотической силы, а, следовательно, количества воды, поступающей к клетке. В случае легких это приводит к осушению воздушных путей и снижению очищающей активности ресничек и слизистой оболочки (рис. 2 во врезке).
Патогенез муковисцидоза
Поверхностный реснитчатый эпителий легких покрыт слоем геля, который называется ASL (airway surface liquid, легочный сурфактант). Он состоит из белков (преимущественно муцинов) и ДНК в солевом растворе. В норме, во время дыхания, его толщина составляет 25 мкм. У больных муковисцидозом толщина геля сокращается до 3 мкм, и реснички при этом не работают в полную силу (рис. 2). Однако в ответ на механический стресс многие клетки, в том числе эпителиальные, выделяют АТФ, ионные каналы (не только хлорный, но и натриевый и кальциевый) получают дополнительную стимуляцию, и ASL увеличивается до 7 мкм. Поэтому постукивание по грудной клетке является эффективным способом помощи от удушья при муковисцидозе [6].
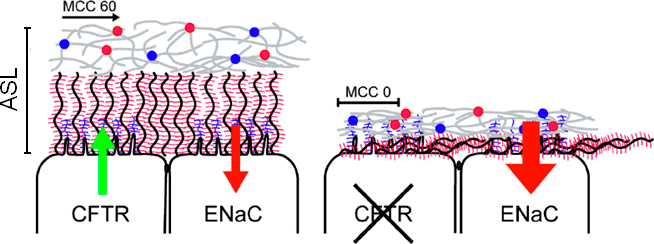
Рисунок 2. Модель патогенеза муковисцидоза. В нормальных воздушных путях (слева) толщина слизистого слоя (ASL) обусловлена нормальной работой каналов CFTR и ENaC. MCC — мукоцилиарный клиренс, то есть скорость очистки воздушных путей с помощью движения слизи (в мкм/с). При муковисцидозе (справа) из-за дефектного CFTR снижение количества ионов хлора вызывает усиленную абсорбцию ионов натрия, что приводит к дегидратации поверхности, повышению вязкости слизи и компрессии ресничек. Неподвижная слизь может вызывать воспалительную реакцию сама по себе, а также является идеальной средой для размножения бактерий.
Постоянный ток слизи вдоль поверхности воздушных путей очень важен для функционирования защитной системы легких. При этом слизь должна быть достаточно жидкой, чтобы растекаться по поверхности эпителия после секреции, но и достаточно вязкой, чтобы движение ресничек эпителия вызывало ее направленный ток. У больных муковисцидозом слизь содержит слишком мало воды, поэтому она густая и неподвижная, от нее трудно избавиться даже при кашле. Собственно, русское название болезни и происходит от двух латинских слов: mucus («слизь») и viscosus («вязкий»).
Поскольку слизь — это полимерная сетка, образованная белками, она содержит поры. Характерная черта слизи при патологии — слишком мелкий размер пор. В нормальной слизи они имеют диаметр 0,2–1 мкм, а при болезни — менее 0,1 мкм. В результате нейтрофилы — клетки иммунной системы, которые в первую очередь отвечают за защиту от бактерий, — не могут проникнуть изнутри сквозь слой слизи. Бактерии на поверхности воздушных путей размножаются беспрепятственно и вызывают хронические инфекции, которые являются главной причиной смертности при муковисцидозе (80% пациентов) [7]. Более того, на уплотненной слизи, в отличие от обычной, бактерии образуют макроколонии, так называемые биопленки, которые особенно устойчивы к действию иммунной системы и антибиотиков [8].
Из сказанного понятно, что одним из средств улучшить состояние больных муковисцидозом должна быть регидратация легких, которую можно обеспечить с помощью ингаляции гипертонического раствора соли. Это паллиативная мера, не воздействующая на причину болезни, но, тем не менее, она позволяет снизить количество осложнений [6].
Не только легкие: что еще поражается при муковисцидозе
В нашей статье речь идет в основном о легких, потому что легочные проявления муковисцидоза наиболее заметны, однако в той или иной мере при болезни затрагиваются все органы, где в норме экспрессируется CFTR.
У 85–90% пациентов наблюдается экзокринная поджелудочная недостаточность, то есть дисфункция протоков поджелудочной железы, которые вырабатывают пищеварительные ферменты. Из-за этого таким больным с рождения требуется специальное питание через трубку, так как они не способны переваривать грудное молоко и обычные смеси.
У большинства больных возникают проблемы с фертильностью, так как с разной степенью тяжести поражаются протоки половых желез, эпителий половых органов.
Помимо этого, в зависимости от типа заболевания могут поражаться носоглотка, желудочно-кишечный тракт (возникает непроходимость кишечника), желчный пузырь (появление камней), сердце (увеличение) и другие органы.
До открытия молекулярных причин болезни пациентов лечили только симптоматически — разжижая слизь, применяя антибактериальные, противовоспалительные препараты и физиотерапию. У пациентов с нарушениями ЖКТ и поджелудочной железы эффективна терапия диетами и пищеварительными ферментами. Все эти меры облегчают состояние пациентов, однако настоящий скачок в продлении жизни и улучшении ее качества стал возможным только благодаря открытиям молекулярной биологии и рациональной разработке лекарств [9], [10].
Фокус на CFTR
Курсивом обозначается ген, а прямым шрифтом — соответствующий ему белок.
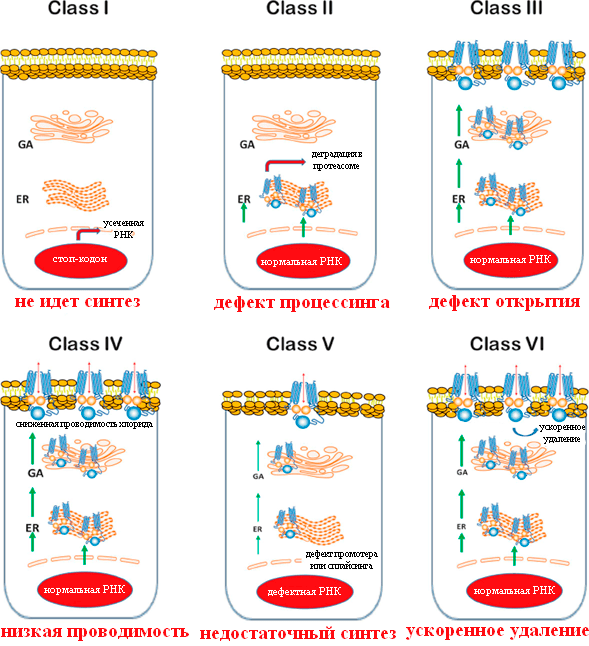
Мутации удобно разделить на несколько классов в соответствии с тем, какие последствия они вызывают (рис. 3) [12].
Рисунок 3. Классы мутаций CFTR при муковисцидозе. GA — аппарат Гольджи; ER — эндоплазматический ретикулум. Красный овал — ядро клетки.
Мутации I класса
Мутации I класса встречаются примерно у 10% пациентов. При них белок CFTR вообще не синтезируется или синтезируется в усеченном виде и сразу деградирует, потому что в гене произошла замена кодирующего аминокислоту кодона на стоп-кодон, или сдвиг рамки считывания, или появился сигнал неправильного сплайсинга. Самая частая мутация — замена глицина-542 на стоп-кодон.
Мутации II класса
Наиболее распространены мутации II класса, вызывающие неправильные сворачивание белка и последующий процессинг клеточными механизмами. Самая частая мутация — F508del (делеция фенилаланина в положении 508 ). 70% пациентов гомозиготны по этой мутации (то есть она присутствует в обеих копиях гена CFTR), а у 90% есть хотя бы один мутантный аллель [14]. У гомозиготных пациентов наблюдается тяжелое течение муковисцидоза, а гетерозиготы по CFTR-F508del, у которых одна из копий гена нормальна, не имеют симптомов болезни. Существует гипотеза, объясняющая стабильность такого тяжелого заболевания в человеческой популяции: у гетерозигот в меньшей степени происходит потеря воды при болезнях, сопровождающихся диареей, например, при холере и брюшном тифе. Соответственно, раньше, когда эти болезни были одной из основных причин смертности, особенно детской, шел отбор на дефектные копии гена [15].
F — обозначение фенилаланина, а del обозначает делецию, то есть отсутствие аминокислоты.
Мутация F508del приводит к тому, что белок неправильно сворачивается и еще в эндоплазматическом ретикулуме не проходит «контроль качества» со стороны клеточных систем и направляется на деградацию, не доходя до плазматической мембраны.
Подробности о мутации F508del
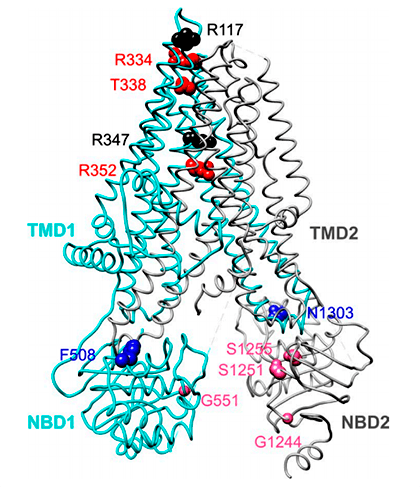
Рисунок 4. Расположение фенилаланина-508 (F508) в структуре CFTR
Фенилаланин-508 находится в домене NBD1 (рис. 4) в области контакта с трансмембранным доменом [16], [17]. Потеря фенилаланина в этом положении приводит к нестабильности контакта между доменами, и плохо свернувшийся белок распознается шаперонами эндоплазматического ретикулума — белками, которые обеспечивают дальнейшее присоединение убиквитиновой метки к дефектному белку. Помеченный убиквитином белок транспортируется в протеасому, где разрезается на части протеазами [18]. Кстати, эффективность транспорта нормального CFTR из эндоплазматического ретикулума к поверхности также сравнительно невелика и находится на уровне 60% [14].
Впрочем, 1% неправильно свернутого CFTR-F508del все же может достигнуть клеточной поверхности, но там он работает с очень низкой эффективностью из-за того, что мутация нарушает правильную подвижность доменов, необходимую для открывания и закрывания канала [19] (см. врезку). Кроме того, в течение 2,5 минут белок удаляется с поверхности в эндосомы, и там снова решается его судьба: он либо возвращается обратно в плазматическую мембрану клетки, либо уничтожается. Понятно, что большинство мутантных молекул будет при этом уничтожено.
Мутации III класса
Мутации III класса встречаются у 4–5% пациентов и приводят к неправильной регуляции открытия ионного канала. Из них наиболее обычная — G551D, то есть замена глицина в 551 положении домена NBD1 на аспарагиновую кислоту. Она приводит к тому, что канал остается преимущественно закрытым. Появление в этом положении остатка аспарагиновой кислоты с отрицательно заряженной боковой цепью —CH2–COO − препятствует связыванию АТФ и сближению доменов NBD1 и NBD2 из-за отталкивания отрицательных зарядов между аспартатом и фосфатными группами АТФ, а также кислотными остатками домена NBD2 [19].
Мутации IV и других классов
Некоторые исследователи различают также мутации классов V–VI, при которых производится работающий белок, но в недостаточных количествах, или происходит быстрое удаление CFTR с поверхности клеток. У таких пациентов течение болезни также сравнительно легкое [11].
Другие причины муковисцидоза
Мы разобрали тут мутации самого белка CFTR, однако понимание молекулярных причин патогенеза муковисцидоза осложняется тем, что CFTR взаимодействует с массой других белков в клетке. Мы уже упоминали выше шапероны, отвечающие за правильное сворачивание (фолдинг) CFTR, и транспортные белки, которые переносят его в плазматическую мембрану. В последние годы с помощью полногеномного секвенирования и поиска ассоциаций (genome-wide association studies, GWAS) [20] идентифицировали еще ряд партнеров по связыванию с CFTR, которые явно играют роль в конкретных проявлениях муковисцидоза. Это и белки, участвующие в иммунном ответе, и другие ионные каналы, и муцины — всего более сотни белков [21].
Почему для муковисцидоза — самого распространенного наследственного заболевания — первые препараты, направленные на молекулярную причину болезни, появились только недавно, в 2012 году? Причин несколько: во-первых, сломать проще, чем починить, поэтому среди лекарств гораздо больше ингибиторов, блокаторов, антагонистов, чем активаторов и агонистов. В случае CFTR требуется восстановить неработающую функцию, что гораздо сложнее. Во-вторых, при других наследственных заболеваниях, обусловленных дефектом одного гена (например, гемофилии или болезни Гоше), пациентам, как правило, помогает введение дефектного белка в виде инъекций. В случае муковисцидоза проблема так просто не решается. CFTR — мембранный белок, и если его просто ввести пациенту, он не попадет в мембрану эпителиальных клеток и не будет выполнять там нужные функции. Делаются попытки разработать генную терапию муковисцидоза, например, доставить ген CFTR в клетки с помощью вирусных частиц, но они пока не увенчались успехом.
А вот малые молекулы, которые были разработаны с учетом сведений о структуре и функции CFTR, уже произвели революцию в лечении муковисцидоза, и, надеемся, это только начало. О них мы и поговорим дальше.
«Калидеко»: первая ласточка
Сразу после открытия факта, что муковисцидоз вызван мутациями в гене CFTR, у исследователей возникло желание синтезировать вещества, которые могли бы хоть отчасти скомпенсировать эффект данных мутаций. Довольно быстро стало понятно, что эти вещества будут грубо делиться по своей функции на два типа — корректоры, которые будут повышать количество дефектного белка (например, с мутацией F508del) на поверхности клетки, и потенциаторы, которые будут усиливать активность белка, уже находящегося на поверхности. Наиболее простой мишенью при этом выглядят мутации класса III: при них белок правильно свернут, находится на мембране, но преимущественно в закрытом состоянии. Поэтому с 2000-х годов начали поиск таких соединений, которые бы повышали вероятность его пребывания в открытом состоянии [22].
Первые несколько классов соединений были либо недостаточно активны, либо малоселективны (то есть связывались и с другими белками), либо обладали неподходящими фармакологическими свойствами (плохая растворимость, стабильность, проникновение в ткани). Наконец в 2009 году, после многочисленных раундов поиска оптимальной структуры, была опубликована структура вещества VX-770 (рис. 5), позже получившего название ивакафтор (торговое наименование — «Калидеко», Kalydeco) [23]. Расскажем немного подробнее обо всём пути разработки этого соединения.
Рисунок 5. Химическая структура ивакафтора («Калидеко», VX-770) (а) и генистеина (б)
История разработки началась в 2000 году. В ту пору компания Aurora Biosciences, которая занималась разработкой систем скрининга для Большой фармы, решила инициировать свою собственную разработку и получила грант от Фонда муковисцидоза (Cystic Fibrosis Foundation). В 2001 году Aurora была куплена компанией Vertex Pharmaceuticals, и та продолжила исследования.
Скрининг — в данном случае процесс выбора нужной молекулы из большого множества.
Для начала потребовалось создать систему скрининга, которая бы подходила для отбора веществ, активных в отношении мутантов CFTR. Для первичного отбора использовали клеточную культуру мышиных фибробластов, синтезирующих мутантный CFTR-F508del. Для определения влияния исследуемой молекулы на хлорный канал ее добавляли к клеточной культуре, затем добавляли флуоресцентный маркер, чувствительный к изменениям мембранного потенциала из-за потока ионов хлора и «включали» CFTR, добавляя форсколин, активирующий канал.
Так было протестировано 228 000 соединений [24], многие из которых отдаленно напоминали генистеин — известный потенциатор CFTR, который, однако, не подходит для лекарственного применения из-за низкой активности и быстрой деградации в организме.
Путь «Калидеко»
Для дальнейшего тестирования брали те соединения, которые были на 65% сильнее генистеина. Так было отобрано 1535 молекул, из которых 278 подтвердили свою активность в повторном тесте. Из них было откинуто еще 145 соединений по причине наличия примесей и потенциальных сложностей синтеза. Оставшиеся 133 молекулы подвергли дополнительному отбору на других клеточных линиях и культурах эпителиальных клеток, в том числе синтезирующих мутант CFTR-G551D. Для лучшего соединения (оно называется «лид» — от англ. lead) был синтезирован ряд аналогов и подвергнут тестированию на способность потенцировать ряд мутантов CFTR, а также на селективность и благоприятные фармакокинетические свойства у животных.
Фармакокинетика — это превращения лекарства в организме, то есть его всасывание, распределение по тканям, метаболизм и выведение.
Время, за которое концентрация вещества, введенного в организм, падает в два раза.
Цитохромы P450 — белки печени, которые отвечают за метаболизм многих лекарств, причем у разных людей по-разному. Чем меньше лекарство на них влияет, тем меньше вероятность взаимодействия с другими лекарствами, потенциальная токсичность и вариабельность действия.
Затем VX-770 тщательно изучали in vitro (на изолированных клетках) и in vivo (на животных) [22]. Определили фармакокинетические параметры молекулы у мышей, крыс, собак и обезьян, показали пероральную биодоступность у крыс и собак на уровне 40–50% (то есть что почти половина проглоченного препарата попадает в кровь).
Исследования эффективности на животных моделях для ивакафтора не проводили, хотя, как правило, это необходимо для получения разрешения на клинические исследования. Но в данном случае подходящей модели не было, потому что ивакафтор не связывается с мышиным CFTR, а трансгенных мышей с человеческим белком не было на момент выхода препарата в клинические исследования.
Разработка препарата шла невероятно быстро: уже в 2008 году были опубликованы первые клинические данные для ивакафтора, а к моменту регистрации в 2012 году были доступны данные трех клинических исследований. На 2018 год в пяти двойных слепых клинических исследованиях [25], [26] уже приняли участие 342 пациента. Основным показателем, который изучается у больных муковисцидозом, является FEV1 — объем форсированного выдоха (forced expiratory volume) за одну секунду. Причем измеряется не абсолютный объем, а процент от нормы для данного пола, возраста, расы и роста. Другие важные показатели — безопасность препарата, частота легочных обострений (выражается в необходимости приема антибиотиков и госпитализации) и качество жизни (определяется по анкете, которую заполняет пациент).
Клинический случай
Вот как выглядит эффект ивакафтора у отдельного пациента: у мужчины 33 лет с муковисцидозом оказался генотип F508del/G551D. FEV1 за последние годы упал с 85% до 67% от нормального. Пациенту приходилось принимать 2–3 курса антибиотиков в год, он страдал поджелудочной недостаточностью, похудением, регулярными запорами и прогрессирующим поражением суставов. Через несколько дней после начала приема ивакафтора начали улучшаться все симптомы, мокроты стало меньше, и она стала лучше отходить. Через месяц функция легких улучшилась на 15% [27].
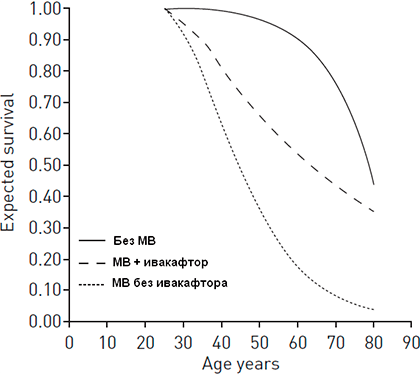
Рисунок 6. Ожидаемая продолжительность жизни без муковисцидоза, с муковисцидозом при применении ивакафтора и с муковисцидозом без ивакафтора
Ивакафтор у детей и взрослых с мутацией G551D через 24 недели приема по сравнению с плацебо улучшал FEV1 на 5–10% и снижал риск обострений на 55%. У взрослых (но не у детей) он также повышал качество жизни по сравнению с плацебо. Воздействие препарата на ионный канал подтверждалось снижением концентрации хлорида в потовой жидкости [27], [28]. Затем ивакафтор показал эффективность и при наличии других мутаций класса III [11]. Немаловажно, что препарат оказался очень безопасным — частота побочных эффектов не превосходила плацебо. К сожалению, в России он так до сих пор и не зарегистрирован.
Хотя пока недостаточно данных для того, чтобы говорить о снижении смертности от муковисцидоза под воздействием ивакафтора, но проведенное моделирование показывает, что его влияние на FEV1 способно вылиться в увеличение продолжительности жизни в среднем на 15 лет (рис. 6), а также снизить потребность в трансплантации легких [29].
Механизм действия «Калидеко»: пока гипотеза!
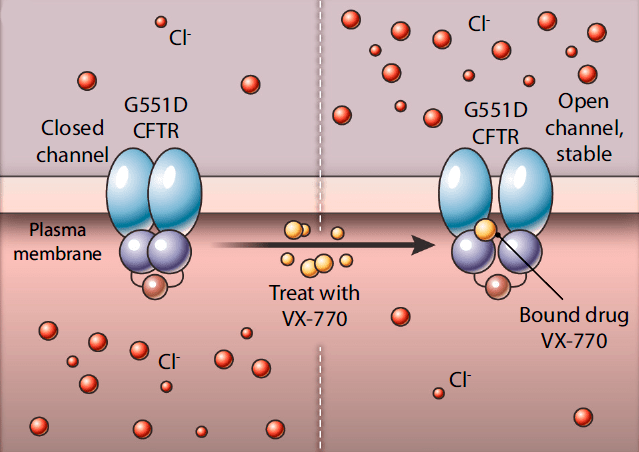
Точный молекулярный механизм действия ивакафтора пока так и не установлен. Только в 2018 году получили данные [32], говорящие о том, что он связывается с трансмембранным доменом CFTR и каким-то образом стабилизирует открытое состояние (рис. 7).
Рисунок 7. Предполагаемый механизм действия ивакафтора (VX-770). Ивакафтор (желтый) связывается с белком CFTR и стабилизирует его в открытом состоянии, позволяя ионам хлора выходить наружу.
Несмотря на то, что ивакафтор оказался настоящим прорывом в терапии муковисцидоза, его недостаток в том, что он помогает всего 4–5% больных — у пациентов с гомозиготной мутацией F508del он оказался неэффективен [34]. Такой факт мог бы показаться странным, если учесть, что ивакафтор был отобран по активности на клетках с CFTR-F508del. Однако не нужно забывать: эти клетки предварительно выдерживались при комнатной температуре, что помогает правильно свернуться даже мутантному белку, поэтому на их поверхности было достаточно CFTR-F508del.
Комбинации
Понятно, что для охвата большинства пациентов надо создавать молекулы, эффективные у пациентов с мутацией F508del (напомним, они называются корректорами). Компания Vertex взялась за разработку таких препаратов одновременно с потенциаторами. После скрининга 164 000 молекул и нескольких раундов оптимизации было синтезировано вещество VX-809, которое в клеточных тестах в семь раз улучшало созревание CFTR-F508del и в пять — его способность переносить ионы хлора [35]. Позже оно получило название люмакафтор (lumacaftor).
Люмакафтор пробовали применять в режиме монотерапии (без сочетания с другими препаратами), но он оказался малоэффективен. Поэтому Vertex провела клинические исследования комбинации люмакафтор/ивакафтор, которая получила название «Оркамби» (Orkambi), и зарегистрировала ее в 2015 году.
Оказалось, что добавление люмакафтора к ивакафтору несколько улучшало течение болезни у пациентов с гомозиготной мутацией F508del, хотя эффект был не таким сильным, как в случае применения ивакафтора у пациентов с CFTR-G551D. FEV1 улучшался примерно на 5% по сравнению с плацебо, примерно в полтора раза снижалось количество обострений, улучшалось качество жизни [31]. Комбинация оказалась не столь безопасной, как ивакафтор в одиночку: небольшая часть пациентов прекратила прием препарата из-за удушья. Тем не менее эта комбинация позволила охватить около 45% пациентов с муковисцидозом.
Однако параллельно обнаружили, что у пациентов с мутацией F508del ивакафтор вообще несколько снижает эффективность корректоров [36], и, следовательно, требуются новые препараты и комбинации, чтобы повысить эффективность терапии и охватить тех пациентов, кому не подходят существующие лекарства. Кроме того, оказалось, что люмакафтор активирует цитохром CYP3A — белок печени, который отвечает за метаболизм ивакафтора, что снижает эффективность последнего [37].
Компания Vertex не собирается останавливаться: в 2018 году она вывела на рынок новую комбинацию — тезакафтор + ивакафтор («Симдеко», Symdeco). Тезакафтор тоже был обнаружен в ходе высокопроизводительного скрининга 150 000 соединений в 2005 году [38]. В сочетании с ивакафтором на клетках эпителия бронхов, взятых у пациентов с гомозиготной мутацией CFTR-F508del, он продемонстрировал повышение транспорта хлорида до 15,7% от нормального. Также было показано, что комбинация увеличивает частоту биения ресничек эпителия [39].
В клинических исследованиях Symdeco оказался более эффективным, чем один ивакафтор, а главное — комбинация оказалась совсем безопасной: в группе препарата наблюдалось даже меньше нежелательных явлений, чем в плацебо-группе [31].
По структуре тезакафтор похож на люмакафтор, и в обоих случаях точно не известно, где именно они связываются с CFTR и каков механизм компенсации мутации F508del. Бесценные данные по трехмерной структуре CFTR были получены относительно молодым методом криоэлектронной микроскопии, за который в 2017 году присудили Нобелевскую премию по химии [40].
Механизмы связывания лекарств
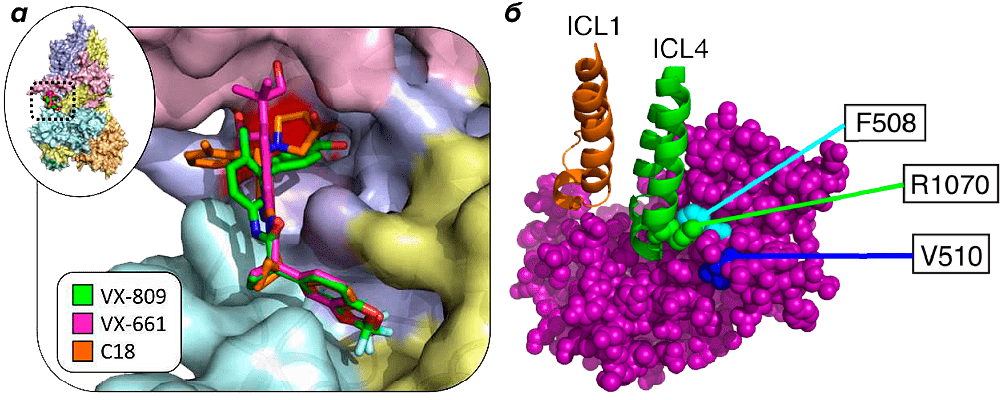
Расчеты методом молекулярного докинга позволили предположить, что обе молекулы связываются вблизи С-конца первого трансмембранного домена, как раз в том месте, где он контактирует с доменом NBD1 (рис. 8). В непосредственной близости от сайта связывания находятся остатки F508 и некоторые другие, мутации которых отвечают за неправильное сворачивание CFTR (то есть мутации класса II). Исследователи даже делают предположение, каким образом те или иные части молекул-корректоров компенсируют соответствующие мутации [3]. В дальнейшем такие трехмерные данные, вероятно, позволят разрабатывать новые лекарства от муковисцидоза с улучшенными характеристиками.
Рисунок 8. Трехмерная модель связывания корректоров CFTR в предположительном сайте связывания. а — Зеленым цветом обозначен люмакафтор, сиреневым — тезакафтор. б — Взаимодействие остатка F508 с α-спиралью ICL4 домена NBD1. Находящиеся рядом остатки R1070 и V510 в случае замены их на более объемные могут скомпенсировать дефект сворачивания белка, но не исправляют дефект функции.
Перспективы
Vertex ведет исследования новых, тройных комбинаций, где к комплексу тезакафтора и ивакафтора будет добавляться еще один корректор — VX-659, или VX-445, или VX-152. Эти три молекулы были идентифицированы в ходе скрининга в присутствии тезакафтора. На клетках комбинация каждого из этих веществ увеличивала поток ионов хлора до 68–75% от нормы [42].
Результаты исследования фазы 3 для первой такой комбинации станут известны в конце 2018 года, для второй — в середине 2019. В фазе 2 увеличение FEV1 по сравнению с плацебо для тройной комбинации тезакафтор + ивакафтор + VX-659 составило 13%, что свидетельствует о довольно высокой эффективности комбинации [41].
На более ранней стадии есть у Vertex и совсем новые разработки — в фазе 2 исследуется комбинация потенциатора, корректора и ингибитора ENaC. Разработчики надеются, что, снижая отток ионов натрия с поверхности эпителиальных клеток внутрь, они добьются еще лучшего восстановления слизистого слоя.
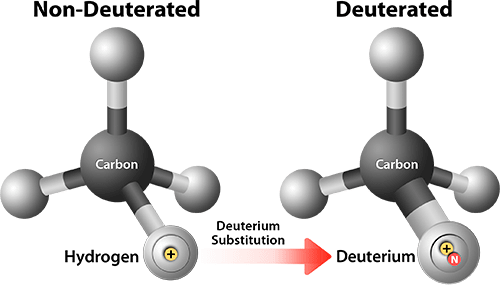
Еще одна интересная разработка — дейтерированный ивакафтор, то есть такой, у которого некоторые атомы водорода заменены на более тяжелый изотоп дейтерий (рис. 9). Это не влияет на активность ивакафтора по отношению к CFTR, но делает его более устойчивым к превращениям в организме. В итоге его период полувыведения примерно в полтора раза длиннее, чем у ивакафтора, что позволяет дозировать его один раз в день вместо двух. Сейчас для дейтерированного ивакафтора идут исследования фазы 2 [43].
Рисунок 9. Дейтерирование молекулы увеличивает размер атома водорода и меняет характер ее взаимодействия с некоторыми веществами
На совсем ранней стадии у Vertex есть и генная терапия, использующая систему CRISPR-Cas9 [45], и мРНК, компенсирующая дефекты CFTR. Однако множество провалов в этой области пока не дают основания утверждать, что именно эти подходы сработают.
Заключение
К сожалению, пока в России не зарегистрировано ни одно из новых средств, описанных в данной статье, но, надеемся, ситуация в ближайшие годы изменится.
На примере муковисцидоза интересно проследить взаимовлияние между разными уровнями организации материи: изменение всего нескольких атомов в молекуле белка CFTR отражается на работе клетки, затем ткани, органа и всего организма. А последствием этого является организация социальных структур из сотен людей, которые предпринимают усилия для компенсации дефекта на уровне молекул.
Вылечить муковисцидоз пока невозможно — для этого требуются более совершенные средства генной терапии, чем у нас есть сейчас. Но описанные в этой статье препараты позволяют значительно улучшить жизнь большинства больных. Главная задача — разработка таких средств, которые бы помогали всем пациентам независимо от мутаций CFTR.