Муковисцидоз у новорожденных по скринингу что это
Муковисцидоз у новорожденных по скринингу что это
Массовое обследование новорожденных на наследственные болезни. Муковисцидоз
Прочтите и возьмите себе на заметку, особенно если вы молодые люди
В России уже много лет проводится массовое обследование новорожденных для выявления у них нескольких наследственных заболеваний. Такое обследование проводится во многих странах и называется скринингом новорожденных или неонаталъным скринингом.
Целью скрининга новорожденных является, конечно, не само выявление новорожденных с еще не проявившимися наследственными заболеваниями, а их лечение, которое позволяет предотвратить появление клинических симптомов, во многих случаях весьма тяжелых, или даже фатальных. В результате рано начатого и аккуратно проводимого лечения вместо тяжело больных детей, а затем подростков и взрослых, получаются здоровые люди, полноценные члены общества, нередко являющиеся гордостью семьи.
Скрининг новорожденных в России ведется в отношении 5 наследственных и врожденных заболеваний: фенилкетонурии, гипотиреоза, галактоземии, адрено-гениталъного синдрома и муковисцидоза.
ЧТО ТАКОЕ МУКОВИСЦИДОЗ?
КАК НАСЛЕДУЕТСЯ МУКОВИСЦИДОЗ?
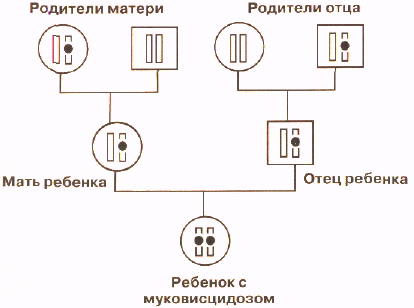
На рисунке для простоты изображена только хромосома, содержащая ген, мутации в котором вызывают муковисцидоз. У ребенка в обеих хромосомах содержится мутантный ген и поэтому он болен. У каждого из родителей мутантный ген содержится только в одной хромосоме, а вторая хромосома нормальная и поэтому они здоровы. Такие люди, которые имеют один нормальный и один дефектный ген называются носителями мутантного гена. У бабки по матери мутантный ген также имеется только в одной хромосоме, как и у деда со стороны отца. Они, как и родители ребенка, здоровы, но передали хромосомы, содержащие мутантный ген, своим детям. У вторых деда и бабки обе хромосомы содержат только нормальный ген. Таким образом, при рецессивном наследовании болен только тот член семьи, который получил от своих родителей обе хромосомы, несущие мутантный ген. Все остальные члены семьи здоровы, в том числе и те, кто является носителем мутантного гена. На схеме родословной видно, что у родителей больного ребенка могут еще появиться больные дети. Вероятность появления больного ребенка в семьях, в которых родители являются носителями мутантного гена, составляет 1/4 или 25%. Эта вероятность не меняется от числа больных или здоровых детей в семье: для каждого следующего ребенка риск, что он будет болен, составляет 25%. Вероятность рождения здорового ребенка, обе хромосомы которого содержат только нормальный ген, составляет также 25%. А 50% детей будут иметь один нормальный и один мутангный ген, как их родители. Это означает, что при каждой беременности родители-носители имеют шансы 3 из 4 (75%) родить здорового ребенка. Многие родители больных муковисцидозом детей и их родственники, первый раз встретившись с врачом-генетиком, настойчиво повторяют, что у их ребенка не наследственное заболевание, так как в их семье ни у кого из родственников никогда не было такого заболевания. Только объяснение, что правила наследования бывают разные, и не редко больной с наследственным заболеванием может быть единственным в семье, позволяют им понять с какой ситуацией они столкнулись.
КАКИЕ ПОРАЖЕНИЯ В ОРГАНИЗМЕ ВЫЗЫВАЕТ МУКОВИСЦИДОЗ?
СУЩЕСТВУЮТ ЛИ ТЕСТЫ НА РАННЕЕ ВЫЯВЛЕНИЕ МУКОВИСЦИДОЗА?
Больные с муковисцидозом могут быть выявлены с помощью скрининга новорожденных. В отличие от других наследственных болезней, выявляемых при скрининге, при которых раннее выявление заболевания позволяет его настолько эффективно лечить, что можно вообще избежать каких-либо клинических проявлений заболеваний, скрининг новорожденных при муковисцидозе преследует несколько иную цель. Врачи считают, что если муковисцидоз выявляется у новорожденного, и его начинают сразу же лечить, то ребенок нормально развивается физически и умственно. У него в меньшей степени будут поражаться легкие и другие органы, увеличится продолжительность жизни, которая в настоящее время, благодаря адекватному лечению, составляет в развитых странах более 35 лет. Скрининг на муковисцидоз начинается с того, что у новорожденного в родильном доме перед выпиской берут из пятки несколько капель крови, которую наносят на специально для этой цели используемую фильтровальную бумагу. Кровь высушивается, и такой бланк, на котором указана фамилия новорожденного и ряд других сведений, необходимых для его идентификации, переправляется в лабораторию региональной медико-генетической консультации. В лаборатории проводят специальное исследование, которое позволяет выявить новорожденных, у которых есть подозрение на муковисцидоз. В этом случае ребенок через педиатра вызывается в лабораторию на повторноетестирование. Родителям педиатр сообщает, что первый тест на муковисцидоз у их ребенка оказался ненормальным. У них появляется повод для беспокойства. Поэтому повторное тестирование образца крови у младенца, которое является очень важным, нужно сделать как можно быстрее. В большинстве случаев при повторном исследовании тест на муковисцидоз оказывается нормальным. Это означает, что результат первого исследования был неверный (его называют ложноположительным). Причины этого могут быть разными и связанными как с состоянием младенца, так и с какой-то ошибкой лаборатории. Этот результат, свидетельствующий о том, что у ребенка нет муковисцидоза, сразу же сообщается родителям, чтобы снять с них чувство страха.
ЧТО ДЕЛАТЬ, ЕСЛИ И ПОВТОРНЫЙ ЛАБОРАТОРНЫЙ ТЕСТ НА МУКОВИСЦИДОЗ ОКАЗАЛСЯ ПОЛОЖИТЕЛЬНЫМ?
Если и второе лабораторное исследование для выявления муковисцидоза оказалось положительным, то, в отличие от других скринируемых наследственных болезней, это еще не означает, что у ребенка есть муковисцидоз, хотя вероятность такого диагноза является высокой. Семья, в которой у ребенка повторно подтвердился положительный тест на муковисцидоз, приглашается на прием к врачу-генетику в медико-генетическую консультацию. Здесь семье объясняют, что собой представляет муковисцидоз и организуют прием у клиницистов, являющихся специалистами в диагностике и лечении муковисцидоза. Теперь наблюдение за ребенком берет на себя группа клиницистов. Для подтверждения диагноза муковисцидоза младенцу проводят так называемый лотовый тест. Это совершенно безобидный и безболезненный тест можно провести младенцу, начиная с возраста 3-4 недели жизни. Если лотовый тест оказывается отрицательным, то ребенок считается здоровым, хотя за ним клиницисты еще будут наблюдать некоторое время. Если же потовый тест оказался положительным, то диагноз муковисцидоза считается установленным, даже до появления каких-либо клинических проявлений заболевания. В этом случае врачи назначат ребенку лечение, которое надо будет строго соблюдать. Ребенок будет периодически обследоваться группой специалистов для постоянного контроля за состоянием его здоровья.
МОЖНО ЛИ ПОМОЧЬ СЕМЬЕ, В КОТОРОЙ ПОЯВИЛСЯ БОЛЬНОЙ С МУКОВИСЦИДОЗОМ, ИМЕТЬ ЗДОРОВЫХ ДЕТЕЙ?
Да, и довольно успешно. Для муковисцидоза возможна дородовая диагностика. Первым шагом в этом направлении является обращение в медико-генетическую консультацию, где врач-генетик определяет показания и возможные методические подходы к дородовой диагностике в каждом конкретном случае. Сама процедура заключается в том, что во время беременности в сроке 9-11 недель или 16-18 недель врач акушер-гинеколог проводит забор очень небольшого количества клеток плода и направляет этот материал в специальную лабораторию пренатальной диагностики. В этой лаборатории врачи лаборанты-генетики проводят молекулярную диагностику, т.е. определяют наличие или отсутствие мутации в гене, отвечающем за муковисцидоз. В случае положительного результата семья решает вопрос о прерывании беременности больным плодом или настраивается на появление еще одного больного ребенка. Это право выбора остается за семьей.
© 2021 краевое государственное бюджетное учреждение здравоохранения «Красноярский краевой медико-генетический центр» (КГБУЗ «ККМГЦ»)
Диагностика муковисцидоза. Неонатальный скрининг.
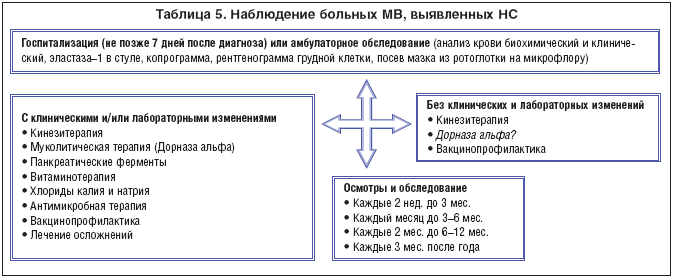
Одним из важных методов ранней диагностики муковисцидоза, определяющий своевременное начало терапии, увеличение продолжительности и улучшению качества жизни больных, является массовый скрининг новорожденных. В мире неонатальный скрининг на муковисцидоз успешно проводится более тридцати лет. Как показал многолетний опыт, активное диспансерное наблюдение и своевременное комплексное лечение вновь выявленных больных, позволяют предотвратить или, по крайней мере, замедлить развитие осложнений.
По сравнению с больными, диагностированными по симптомам заболевания в более позднем возрасте, для выявленных при неонатальном скрининге характерно хорошее самочувствие. К трем годам отмечены достоверно меньшие изменения в легких, меньшая частота обострений бронхолегочного процесса, более редкая частота высева патогенной микрофлоры. Наблюдается также значимо меньшая частота декомпенсации кишечного синдрома, лучшие показатели физического статуса, включая массо-ростовой индекс.
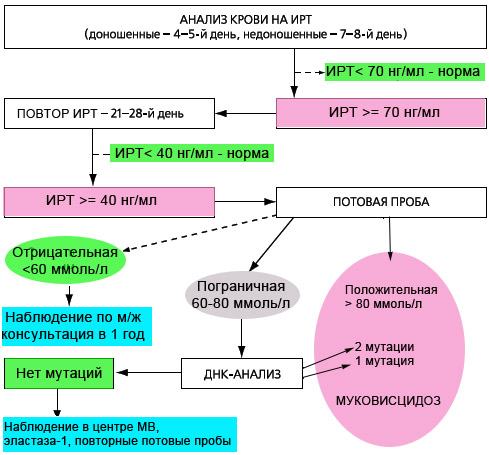
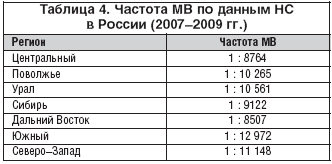
С июня 2006 года в ряде регионов РФ, а с 2007 года по всей России проводится скрининг новорожденных на муковисцидоз. Обследование состоит из 4х этапов, три из которых обязательны.
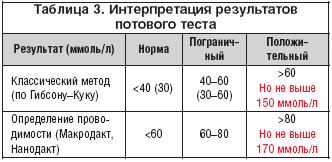
Повышение уровня ИРТ у новорожденных бывает не только при муковисцидозе, но и при ряде врожденных и наследственных патологий, таких как: внутриутробная гипоксия плода, внутриутробные инфекции, перинатальный стресс, незрелость плода, коньюгационная желтуха новорожденных, хромосомные перестройки и др., а также гетерозиготное носительство мутаций в гене CFTR, как следствие функциональной недостаточности поджелудочной железы. Поэтому для подтверждения диагноза МВ при положительных результатах 2го теста ИРТ (>40 нг/мл), а также при несоблюдении сроков проведения 2го теста (21-28 день) необходимо обязательно проводить потовую пробу. И наоборот, при некоторых состояниях (у недоношенных детей, при мекониальном илеусе, при вирусных инфекциях, после переливаний крови) возможно получение ложноотрицательных результатов. То есть диагноз МВ впоследствии может быть поставлен и при отрицательных результатах скрининга.
Если результаты потовой пробы не превышают 50 ммоль/л, за развитием ребенка наблюдают по месту жительства, повторная консультация проводится в 1 год.
Если мутаций не выявлено, то ребенок в течение года наблюдается в ближайшем центре муковисцидоза, необходимо провести исследование содержания эластазы 1 в кале, провести повторные потовые пробы.
При положительном результате потовой пробы (>60 ммоль/л по методу Гибсона-Кука или >80 ммоль/л при определении проводимости пота на аппарате Нанодакт) диагноз МВ считается подтвержденным. Ребенок наблюдается в центре муковисцидоза.
1. В.Д. Толстова, Н.Ю. Каширская, Н.И. Капранов. Массовый скрининг новорожденных на муковисцидоз в России. Фарматека № 1 — 2008
Особенности массового скрининга новорожденных на муковисцидоз
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Первые попытки проведения неонатального скрининга (НС) на муковисцидоз (МВ) в Европе предпринимались еще в начале 1970–х годов и сводились к определению содержания альбумина в меконии. И лишь обнаруженное в 1979 г. повышение уровня иммунореактивного трипсина (ИРТ) в плазме крови новорожденных с МВ послужило толчком к началу массового скрининга новорожденных на данное заболевание [1]. Дальнейшее усовершенствование программы НС стало возможным после клонирования в 1989 г. гена CFTR и последующей идентификации специфических CFTR–мутаций в общей популяции, что позволило включить анализ ДНК в скрининговые протоколы [2]. Ежегодно по программе НС в Европе обследовалось более 1,6 млн новорожденных и выявлялось более 400 больных детей. По данным за 2008 г., количество детей, прошедших скрининг, превысило 3 млн в год в связи с внедрением НС на МВ в Великобритании и России. Программа НС оправданна как с медицинской, так и с экономической точки зрения. Ранняя диагностика МВ дает возможность своевременно начать адекватную терапию, что ведет к значительному улучшению качества и продолжительности жизни больных. Кроме того, проведение НС и установка CFTR–генотипа новорожденных с МВ предполагает возможность более раннего генетического консультирования, что может повлиять на репродуктивное поведение супругов и их родственников [3].

Литература
1. Crossley JR, Elliott RB, Smith PA. Dried–blood spot screening for cystic fibrosis in the newborn. Lancet 1979;1(8114):472–4.
2. Southern KW, Munck A, Pollit R, Castellani C et al. A survey of newborn screening for cystic fibrosis in Europe. J of Cystic Fibrosis 2007; 6:57–65.
3. Castellani C, Southern KW, Brownlee K. et al. European best practice guidelines for cystic fibrosis neonatal screening. Journal of Cystic Fibrosis Volume 8 (2009) 153–173.
4. Priest FJ, Nevin NC. False positive results with immunoreactive trypsinogen screening for cystic fibrosis owing to trisomy 13. J Med Genet 1991;28:575–6.
5. Heeley AF, Fagan DG. Trisomy 18, cystic fibrosis, and blood immunoreactive trypsin. Lancet 1984;1:169–70.
6. Cheillan D, Vercherat M, Chevalier–Porst F, Charcosset M, Rolland MO, Dorche C. False–positive results in neonatal screening for cystic fibrosis based on a three–stage protocol (IRT/DNA/IRT): should we adjust IRT cut–off to ethnic origin? J Inherit Metab Disease 2005;28:813–8.
7. Giusti R. New York State Cystic Fibrosis Newborn Screening Consortium. Elevated IRT levels in African–American infants: implications for newborn screening in an ethnically diverse population. Pediatr Pulmonol 2008;43: 638–41.
8. Lakeman P, Gille JJP, Dankert–Roelse JE, et al. CFTR mutations in Turkish and North African cystic fibrosis patients in Europe: implications for screening. Genetic Testing 2008;12:25–35.
9. Kharrazi M, Kharrazi LD. Delayed diagnosis of cystic fibrosis and the family perspective. J Pediatr 2005;147:S21–5.
10. Толстова В.Д., Каширская Н.Ю., Капранов Н.И. Массовый скрининг новорожденных на муковисцидоз в России. Фарматека. – 2008. – №1. – С.1–5.
11. Comeau AM, Parad RB, Dorkin HL et al. Population–based newborn screening for genetic disorders when multiple mutation DNA testing is incorporated: a CF newborn screening model demonstrating increased sensitivity but more carrier detections. Pediatrics 2004;113(6):1573–81.
12. Муковисцидоз. Современные достижения и актуальные проблемы. Методические рекомендации. Издание третье (первое 2001) переработанное и дополненное. Под редакцией Капранова Н.И., Каширской Н.Ю. М.: ООО «4ТЕ Арт». 2008. – с.124.
13. Brice P, Jarrett J, Mugford M. Genetic screening for cystic fibrosis: An overview of the science and the economics. J of Cystic Fibrosis 2007; 6:255–261.
Актуальные вопросы диагностики муковисцидоза
Опубликовано в журнале:
«ПРАКТИКА ПЕДИАТРА»; март-аперль; 2015; стр. 20-27.
Е.И. Кондратьева, д. м. н., профессор, В.Д. Шерман, к. м. н., Н.И. Капранов, д. м. н., профессор, Н.Ю. Каширская, д. м. н., профессор, НКО муковисцидоза ФГБНУ «МГНЦ», ГБУЗ «ДГКБ № 13 им. Н.Ф. Филатова ДЗМ», г. Москва
Болезнь прежде всего характеризуется повышенной продукцией вязкого бронхиального секрета, частыми легочными инфекциями и обструкцией дыхательных путей. По мере прогрессирования легочной болезни образуются участки ателектазов, развивается эмфизема, постепенно разрушается паренхима легких с развитием бронхоэктазов и участков пневмосклероза, а больной имеет высокий риск погибнуть от легочно-сердечной недостаточности. В финальной стадии заболевания пересадка комплекса «сердце-легкие» остается для больного единственной надеждой. Помимо бронхолегочной системы у большинства больных муковисцидозом поражается поджелудочная железа, при этом это происходит внутриутробно. Недостаточность панкреатических ферментов обусловливает нарушение всасывания жиров и белков, развитие нутритивной недостаточности. В результате больные отстают в росте и страдают гипотрофией. Продукция инсулина также может быть нарушена, что ведет к развитию диабета. К частым осложнениям течения муковисцидоза относят остеопороз, а также жировой гепатоз с переходом в цирроз. При наличии «мягкой» мутации клинические проявления развиваются постепенно, преобладают моносимптомы, диагноз «муковисцидоз» устанавливается поздно или случайно.
Своевременная диагностика муковисцидоза, обеспечивающая в большинстве случаев раннее начало терапии, в том числе на доклиническом этапе, улучшает прогноз заболевания, повышает эффективность лечения, позволяет предупредить развитие тяжелых осложнений, значительного отставания в физическом развитии, а в ряде случаев и необратимых изменений в легких. Ранняя диагностика позволяет семье вовремя решить необходимые вопросы, связанные с рождением здорового ребенка (генетическое консультирование, пренатальная диагностика МВ в последующие беременности).
Диагностика делится на:
1) пренатальную диагностику;
2) диагностику по неонатальному скринингу (до клинических проявлений или при их дебюте);
3) диагностику при клинических проявлениях:
4) диагностику среди родственников больных.
Клинические признаки
1. Диагностика классической формы МВ обычно не представляет сложностей. Классический фенотип больного является результатом наличия двух мутантных копий гена муковисцидозного трансмембранного регулятора (CFTR) и характеризуется хронической бактериальной инфекцией дыхательных путей и придаточных пазух носа, стеатореей из-за внешнесекреторной недостаточности поджелудочной железы, мужским бесплодием из-за обструктивной азооспермии, а также повышенной концентрацией хлоридов потовой жидкости.
2. Проблемы диагностики МВ, как правило, связаны с фенотипическим разнообразием его форм, обусловленным генетическим полимор-
В ряде случаев атипичного течения МВ возможна его диагностика во взрослом возрасте. Как правило, в этой группе больных отмечается более мягкое течение болезни в связи с сохранностью функции поджелудочной железы и нетяжелым поражением органов дыхания.
Диагностика МВ у носителей «мягких» генотипов (актуально для детей, рожденных до 2006-2007 гг., и взрослых):
В настоящее время выделяют несколько групп риска по МВ.
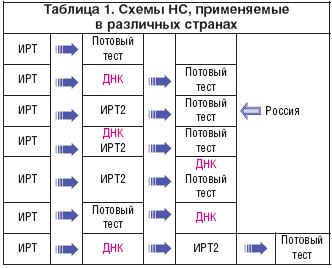
Основной группой риска по заболеванию в РФ в настоящее время являются новорожденные с неонатальной гипертрипсиногенемией. Учитывая возможность получения ложноотрицательных результатов неонатального скрининга, а также то обстоятельство, что в РФ неонатальный скрининг на МВ проводится с 2006-2007 гг., не теряет своей актуальности анализ групп риска, включающих пациентов с патологией желудочно-кишечного тракта, бронхолегочными нарушениями, патологией других органов и родственников больных МВ (табл. 1).
Таблица 1.
Группы риска для дифференциальной диагностики муковисцидоза
| I. Бронхолегочные нарушения |
| 1. Повторные и рецидивирующие пневмонии с затяжным течением, особенно двусторонние 2. Бронхиальная астма, рефрактерная к традиционной терапии 3. Рецидивирующие бронхиты, бронхиолиты, особенно с высевом Ps. aeruginosa 4. Двусторонние бронхоэктазы |
| II. Изменения со стороны желудочно-кишечного тракта |
| 1. Синдром нарушенного кишечного всасывания неясного генеза 2. Мекониальный илеус и его эквиваленты 3. Гиперэхогенность кишечника плода 4. Желтуха обструктивного типа у новорожденных с затяжным течением 5. Цирроз печени 6. Сахарный диабет 7. Гастроэзофагеальный рефлюкс 8. Выпадение прямой кишки |
| III. Патология со стороны других органов |
| 1. Нарушение роста и развития 2. Задержка полового развития 3. Мужское бесплодие 4. Хронический синусит 5. Полипы носа 6. Электролитные нарушения |
| IV. Члены семей больных муковисцидозом |
Среди клинических проявлений, характерных для МВ, можно выделить высоко-и менее специфичные (табл. 2). Состояния, представленные в левой колонке таблицы, в абсолютном большинстве случаев встречаются у больных МВ. Причиной состояний из правой колонки могут быть другие заболевания, например первичная цилиарная дискинезия, гуморальный иммунодефицит и т. д.
Таблица 2.
Клинические проявления, характерные для МВ
Генетическое исследование
Генетическое исследование проводится после потовой пробы. Однако в связи с ограниченными возможностями ДНК-диагностики в России данный метод не является обязательным, однако применяется с исследовательской целью и для окончательного подтверждения диагноза.
На первом этапе ДНК-обследования наиболее часто используется панель, включающая 28 мутаций, как наиболее частых в мире, так и специфичных для России: F508del, CFTRdele2,3(21kb), 3849+10kbC>T, W1282X, 2143delT, 2184insA, 1677delTA, N1303K, G542X, R334W, E92K, L138ins, 394delTT, 3821delT, S1196X, 2789+5G>A, G85E, 2183AA>G, 604insA, 621+1G>T, R117H, R347P, R553X, 3667insTCAA, G551D, I507del, 1717-1G>A, 2184delA. По данным лаборатории генетической эпидемиологии ФГБУ «Медико-генетический научный центр» (МГНЦ) РАМН, при использовании данной панели удается обнаружить лишь около 82,5% мутантных аллелей у больных МВ. В случае когда при положительной потовой пробе не будет найдено ни одной мутации гена (что само по себе маловероятно), может потребоваться секвенирование гена МВ, позволяющее идентифицировать примерно 98% мутаций в гене CFTR.
Рекомендации:
Для диагностики МВ или его исключения при пограничных результатах пробы необходимо:
В европейских странах для подтверждения дефекта ионного транспорта применяется метод определения разности назальных потенциалов или измерение электрического тока в биоптате кишки, отражающие нарушение функции хлорного канала. Оба метода основаны на электрическом характере транспорта ионов и являются высокоинформативными для диагностики МВ.
Диагностика панкреатической недостаточности включает:
У больных МВ показатель эластазы может снижаться в течение первых лет жизни, поэтому определяется в динамике. Низкий уровень панкреатической эластазы расценивается как один из признаков МВ. Приблизительно 1% пациентов с МВ имеет пограничный результат потового теста в комплексе с сохранной функцией поджелудочной железы и хроническим бронхитом.
Диагностика хронического бронхолегочного процесса:
В качестве дополнительных диагностических маркеров могут быть использованы азооспермия в постпубертатном возрасте, идентификация МВ-ассоциированных патогенов из респираторного тракта, рентгенологические признаки синусита.
Знание основных симптомов МВ и особенностей его течения в разные возрастные периоды позволяет своевременно заподозрить наличие заболевания и направить пациента для дальнейшего обследования. Нередкие случаи поздней диагностики МВ связаны как с отсутствием у врачей достаточных знаний о заболевании, так и с фенотипическим разнообразием его форм. Ограниченные возможности ДНК-диагностики МВ в России и ее низкая доступность затрудняют и затягивают окончательную верификацию заболевания.
Муковисцидоз у новорожденных по скринингу что это
Сейчас во многих странах всем новорожденным проводится обследование на наличие у них муковисцидоза. При выявлении в крови у ребенка повышенного уровня иммунореактивного трипсина его относят к группе риска, а окончательный диагноз устанавливается (или исключается) на основании исследования солей (хлоридов) в потовой жидкости. У многих родителей может возникать закономерный вопрос: зачем же проходить генетический тест, если диагноз ребенку уже подтвержден? Давайте разберемся.
Муковисцидоз – заболевание наследственное. И связано с нарушением работы гена CFTR на 7 хромосоме. Этот ген у всех здоровых людей вырабатывает особый белок, необходимый для поддержания малой вязкости слизи, вырабатываемой различными полыми органами (в основном, в системе дыхания и пищеварения). Если данный ген несет мутацию (поломку/дефект) на обеих 7-х хромосомах (полученных и от матери, и от отца), его белок не вырабатывается или вырабатывается в очень малом количестве. Если мутация присутствует только на одной из 7-х хромосом, это никак не проявляется и называется «носительством». Таким образом, если вашему ребенку поставлен диагноз муковисцидоз, вы и ваш супруг(а) являетесь носителями мутаций в гене CFTR.
Значит, при каждой последующей беременности вы имеете высокий риск того, что родившийся ребенок также будет болен муковисцидозом. Такой риск составляет 25%.
Если же вы хотите обезопасить себя от повторного рождения у вас ребенка с муковисцидозом, необходимо сначала выяснить, какими именно мутациями (дефектами) гена CFTR вызвана болезнь у вашего ребенка. Самое простое и недорогостоящее исследование – тест на мутации, встречающиеся наиболее часто. Их около 30, и все можно протестировать одновременно. Если же при этом мутации не будут выявлены, или выявится только одна, для поиска более редких придется протестировать всю последовательность гена. Этот тест называется секвенированием. Он позволит выявить все мутации, возможно ранее не описанные ни у одного больного муковисцидозом в мире.
Когда вы будете знать, носителями каких именно мутаций вы с мужем являетесь, можно проводить их исследование плоду (при наличии беременности) или эмбриону (при зачатии с помощью ЭКО).
Сейчас наиболее распространена пренатальная диагностика – это когда во время беременности в сроке 10-12 недель делают забор плодного материала (плаценты) через прокол передней брюшной стенки. Полученный материал исследуют на носительство уже известных мутаций. Если мутаций не выявлено или выявлена только одна мутация, ребенок будет здоровым. Если же обнаружены 2 мутации, то диагноз муковисцидоза можно считать установленным и семья оказывается перед тяжелым решением сохранить беременность с тем, чтобы родить ребенка с наследственным заболеванием, или же прервать.
Более оптимальным вариантом дородовой диагностики является преимплантационная генетическая диагностика (ПГД). ПГД позволяет исследовать генетический статус эмбриона, полученного при экстракорпоральном оплодотворении (ЭКО), до его попадания в полость матки и наступления беременности. При этом вы не будете стоять перед моральной проблемой прерывания беременности и в то же время будете точно знать, что ваш будущий ребенок не будет страдать муковисцидозом.
Кроме того, в ближайшем будущем станут доступны лекарственные генные препараты, действие которых будет зависеть от типа мутации. Тогда знание о том, какая именно мутация у Вашего ребенка,будет определяющим в назначении конкретного препарата.
В лаборатории Genetico Вы можете пройти генетическое тестирование для определения как частых, так и более редких мутаций гена муковисцидоза, а при уже известных мутациях провести преимплантационную генетическую диагностику эмбрионам, для того чтобы родить здорового ребенка. О необходимости, возможностях и ограничениях каждого теста Вас может проконсультировать врач-генетик центра.