Мутация лейдена что это такое и чем грозит
Мутация лейдена что это такое и чем грозит
Этиология и встречаемость тромбофилии. Венозный тромбоз (MIM № 188050) — панэтническое многофакторное заболевание; встречаемость увеличивается с возрастом и различается в разных расах. Заболевание редкое среди азиатов и африканцев и более частое среди европеоидов.
Конкретные факторы предрасположенности — стаз, повреждения эндотелия и повышенная свертываемость крови. Выявлены генетические факторы, присутствующие у 25% всех пациентов, включая дефекты ингибиции факторов свертывания и нарушения лизиса сгустка. Фактор V Лейдена бывает у 12-14%, мутации в гене протромбина — у 6-18% и недостаточность антитромбина III или белка С или S — у 5-15% пациентов с венозными тромбозами.
Мутация Arg506Gln в гене FV, фактора V Лейдена, встречается у 2-15% здоровых в европейских популяциях; чаще всего у шведов и греков, реже у азиатов и африканцев. Фактор V Лейдена, очевидно, возник вследствие мутации у родоначальника после отхождения европеодидов от негроидов и монголоидов.
Недостаточность белка С — панэтническое заболевание с частотой 0,2-0,4%. Мутации в гене PROC обычно понижают активность белка ниже 55% нормы.
Патогенез тромбофилии
Система свертывания поддерживает точный баланс образования и ингибиции сгустка; тем не менее, если свертывание преобладает над системой ингибиции свертывания и фибринолиза, возникают венозные тромбы. Протеазы и белковые кофакторы каскада свертывания активизируются в месте повреждения, формируя сгусток фибрина, а затем должны инактивироваться, чтобы предотвратить распространение свертывания. Активированный фактор V, кофактор фактора X, ускоряет преобразование протромбина в тромбин.
Фактор V инактивируется активированным белком С, расщепляющим активный фактор V в трех местах (Arg306, Arg506 и Arg679). Первым происходит расщепление в положении Arg506, что ускоряет расщепление в двух других точках; расщепление в точке Arg506 снижает активирующую функцию фактора V, тогда как расщепление в позиции Arg306 прекращает его функцию. Белок S, кофактор белка С, ускоряет инактивацию активного фактора V белком С и усиливает расщепление в положении Arg306.
Мутация фактора V Лейдена приводит к утрате точки узнавания белком С в активном факторе V, снижая его расщепление и инактивацию и предрасполагая пациента к тромбофилии. Риск тромбофилии более высок у пациентов, гомозиготных по фактору V Лейдена; риск венозного тромбоза в течение жизни для гетерозигот и гомозигот по фактору V Лейдена составляет приблизительно 10 и 80%, соответственно.
Унаследованная недостаточность белка С возникает вследствие мутаций в кодирующей последовательности и управляющих элементах гена PROC. Большинство мутаций спорадические, хотя некоторые, например, франко-канадская мутация 3363insC, появилась в этой популяции благодаря родоначальнику. В отличие от мутации показателя V Лейдена, приводящей к усилению функции, мутации в гене PROC нарушают функцию белка С, снижая инактивацию активных факторов свертывания V и VIII и предрасполагая к образованию тромбов.
Наличие двух мутантных аллелей в гене PROC обычно приводит к молниеносной пурпуре, форме распространенного внутрисосудистого свертывания, часто фатальной, если она быстро не распознана и не предпринято лечение. Гетерозиготные мутации белка С предрасполагают к тромбофилии, увеличивая риск венозного тромбоза в течение жизни до 20-75%.
В общих чертах, для пациентов, гетерозиготных по полиморфизмам фактора V Лейдена или мутациям гена PROC, переход из состояния повышенного светрывания в венозный тромбоз требует сосуществования генетических и средовых факторов. Негенетические факторы — беременность, использование пероральных противозачаточных средств, операции, пожилой возраст, новообразования, обездвиживание и патология сердца. Генетические аномалии — различные нарушения ингибиции факторов свертывания и нарушения лизиса сгустка.
Фенотип и развитие тромбофилии
Хотя тромбы могут образоваться в любой вене, чаще они возникают в местах повреждений, в больших венозных пазухах или точках пересечения карманов клапанов в венах ног. Тромбы нижних конечностей обычно ограничены венами задней части голени, но приблизительно в 20% случаев распространяются на более проксимальные сосуды.
Перекрытие глубоких вен ноги может вызывать припухание, чувство жара, покраснение, болезненность, вздутие поверхностных вен и расширение венозных колллатералей, хотя многие пациенты не имеют симптомов.
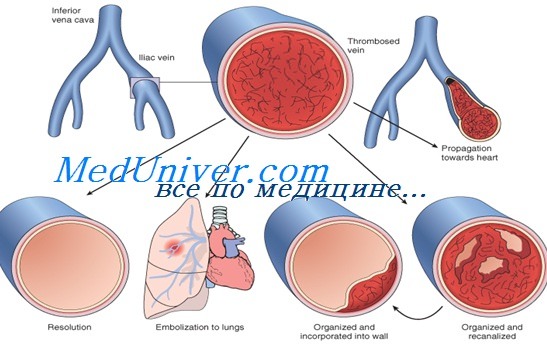
После формирования тромб может распространяться вдоль вены и, в конечном счете, перекрывать другие вены, вызывать эмболии, удаляться за счет фибринолиза или организовываться и, возможно, реканализироваться. Эмболия — серьезное осложнение и может быть фатальной, если перекрывает артериальную систему легких; эмболия легких происходит у 5-20% пациентов, первоначально имеющих глубокий венозный тромбоз (ГВТ) (икроножных вен).
В отличие от этого, формирование тромбов проксимальных вен длительно препятствует венозному возврату и вызывает посттромботический синдром, характеризующийся болями в ногах, отеками и частым образованием кожных язв.
За исключением возможного повышения риска повторения, симптоматика, течение и исходы у пациентов с мутациями в генах PROC и фактора V Лейдена подобны другим пациентам с тромбофилией. В целом, нелеченые пациенты с тромбозом проксимальных вен имеют 40% риск повторного венозного тромбоза.
Особенности фенотипических проявлений тромбофилии:
• Возраст начала: зрелость
• Глубокий венозный тромбоз
Лечение тромбофилии
Диагноз глубокого венозного тромбоза (ГВТ) голеней труден, поскольку пациенты часто не имеют симптомов, а большинство тестов сравнительно нечувствительны, пока тромб не распространится проксимальнее в глубокие вены икр. Чаще всего для диагностики глубокого венозного тромбоза (ГВТ) используют дуплексную ультрасоногра-фию вен; тромб обнаруживают или прямым визуальным наблюдением, или логически, если вена не сужается при сжатии. Допплеровское УЗИ позволяет обнаружить аномальный кровоток в венах.
Фактор V Лейдена может быть диагностирован непосредственно анализом ДНК или может быть заподозрен на основе определения активного белка С. Недостаточность белка С диагностируют измерением его активности; мутации в гене PROC определяют прямым анализом гена.
Лечение в остром периоде нацелено на снижение распространения тромба и сопутствующих осложнений, особенно эмболии легких; обычно оно включает антикоагулянты и возвышенное положение пораженной конечности. Последующая терапия сфокусирована на предотвращении повторного венозного тромбоза путем выявления и улучшения предрасположенности и профилактики свертывания крови. Рекомендации по лечению больных с недостаточность белка С и фактора V Лейдена продолжают разрабатывать.
Все они должны получать стандартную стартовую терапию противосвертывающими препаратами, по крайней мере, в течение 3 мес. Остается неясным, насколько долго должны получать лечение антикоагулянтами пациенты с единственным мутантным аллелем, но больным с повторным случаем венозного тромбоза обычно показан продолжительный, возможно пожизненный, прием антикоагулянтов.
В отличие от этого, гомозиготные пациенты по фактору V Лейдена, а также гомозиготы по другим мутациям или сложные гетерозиготы (как приведенный в примере пациент) нуждаются в продолжительном приеме антикоагулянтов уже после первого эпизода.
Риски наследования тромбофилии
Каждый ребенок у семейной пары, если один из родителей гетерозиготен по фактору V Лейдена, имеет 50% риск унаследовать мутантный аллель. При 10% пенетрантности каждый ребенок имеет 5% риска развития венозного тромбоза в течение всей жизни.
Каждый ребенок у семейной пары, если один из родителей гетерозиготен по мутации PROC, также имеет 50% риск унаследовать мутантный аллель. Оценка пенетрант-ности недостаточности белка С колеблется от 20 до 75%; следовательно, каждый ребенок имеет 10-38% риска развития венозного тромбоза в течение жизни.
Из-за неполной пенетрантности и доступности эффективной терапии для гетерозиготных носителей фактора V Лейдена и мутаций PROC, пренатальную диагностику проводят редко, за исключением необходимости обнаружения гомозиготных или компаундных гетерозиготных мутаций в гене PROC. Пренатальное обнаружение гомозигот или компаундных гетерозигот по мутациям PROC полезно вследствие тяжести болезни и быстрой потребности в лечении в периоде новорожденности.
Пример тромбофилии. У Ж.Ж., 45-летнего бизнесмена франко-шведского происхождения, на следующий день после перелета через Тихий океан внезапно развилась одышка. Его правая нога распухла и была горячей на ощупь. Последующие исследования выявили тромб в подколенных и подвздошных венах и эмболию легочных вен. У родителей Ж.Ж. отмечали венозные тромбозы ног, а сестра умерла от легочной эмболии во время беременности. Основываясь на возрасте Ж.Ж. и семейном анамнезе, врач заподозрил у него наследственную склонность к тромбофилии.
Скрининг на наследуемые причины тромбофилии выявил, что пациент — носитель мутации Лейдена фактора V. Последующие исследования других членов семьи идентифицировали ту же мутацию в гетерозиготном состоянии у его отца, умершей сестры и здорового старшего брата. Кроме того, сам пациент, его мать, скончавшаяся сестра и здоровая старшая сестра оказались гетерозиготными по мутации сдвига рамки (3363insC) в гене PROC, кодирующем белок С. Таким образом, пациент оказался двойной гетерозиготой в двух различных генах, предрасполагающих к тромбозу.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте
Лейденовская мутация в Москве
Исследование мутаций в гене фактора V (фактора Лейдена) для оценки наследственного риска тромбообразования.
Что входит в комплекс
Приём и исследование биоматериала
Когда нужно сдавать анализ Лейденовская мутация?
Подробное описание исследования
Свертывание крови при повреждении сосудов является жизненно необходимым. Нормальная вязкость крови обеспечивается балансом между факторами свертывания и противосвертывающей системой.
Факторы свертывания обозначены номерами, согласно которым они участвуют в каскаде реакций, обеспечивающих остановку кровотечения. Мутация гена фактора V (фактора Лейдена) приводит к тромбофилии — состоянию, при котором повышена вероятность формирования сгустков крови, то есть тромбов, в сосудах конечностей и внутренних органов. Обычно это проявляется тромбозом глубоких вен.
Лейденовская мутация увеличивает риск того, что сгустки оторвутся от своего первоначального места и будут перемещаться по кровотоку. Тромбоз глубоких вен чаще всего возникает в ногах, что проявляется болью и отеком, покраснением по ходу вены. Тем не менее тромбы могут обнаруживаться и в других частях тела, включая мозг, глаза, печень и почки.
Одним из самых тяжелых состояний, связанных со склонностью к тромбооразованию, служит тромбоэмболия легочной артерии (ТЭЛА). Это происходит, когда часть сгустка, образовавшегося при тромбозе ног, отрывается и поступает через правую половину сердца в легкое, где блокирует кровоток.
Признаки ТЭЛА могут включать:
В отсутствие своевременной медицинской помощи при ТЭЛА последствия для здоровья могут быть неблагоприятными.
Лейденовская мутация обнаруживается как у мужчин, так и у женщин. Для женщин ее наличие более важно, так как склонность к образованию тромбов увеличивается во время беременности. Блокирование кровотока в сосудах плаценты приводит к выкидышам, преждевременным родам, осложненному течению беременности. Прием эстрогенов также увеличивает вероятность тромбообразования при наличии лейденовской мутации.
Другие факторы, которые увеличивают риск тромбообразования при наличии лейденовской мутации, включают:
Исследование на наличие Лейденовской мутации позволяет провести диагностику наследственной склонности к тромбофилии.
Анализ на мутацию Лейдена

Выявить дефект гена FV Leiden можно, сдав анализ в лаборатории МЖЦ на Таганской. Наш центр является профильным по изучению, диагностике и лечению патологий гемостаза.
Цена анализа на лейденовскую мутацию*
Расчет стоимости лечения Все цены
* Принимаются пациенты старше 18 лет.
Зачем назначают анализ крови на фактор V Лейдена
Полиморфизм (изменение) в гене F5 диагностируется у 20-50% людей с рецидивирующими тромбозами и акушерскими осложнениями. Риск закупорки сосудов увеличивается с возрастом, при беременности, приеме гормонов, травмах и хирургических вмешательствах.
Зная, что пациент является носителем лейденовской мутации, врач сможет назначить профилактическую терапию на этапе подготовки к операции. Или использовать специальную тактику ведения беременности. Также, людям с дефектом F5 показан пожизненный прием антикоагулянтов – препаратов, защищающих от образования тромбов.
Специалисты
акушер-гинеколог, гемостазиолог, доктор медицинских наук
акушер-гинеколог, гемостазиолог, профессор, доктор медицинских наук, эксперт международного уровня по проблемам тромбозов и нарушений свертывания крови
Как сдают анализ на мутацию Лейдена
Материал для определения полиморфизма гена проакцелерина — венозная кровь. Ее забор проводят в первой половине дня, натощак. Результаты анализа действительны в течение всей жизни человека, повторная сдача не требуется.
Расшифровка исследования на фактор V, F5
Насколько опасна мутация, определяют по количеству измененных аллелей — форм гена, расположенных в одном участке хромосомы. Самый неблагоприятный прогноз, если полиморфизм присутствует в 2-х аллелях одного гена (гомозигота).
| Полиморфизм гена F5 (замена аргинина на глутамин в положении 506) | Не обнаружено | Нормальное значение |
| Полиморфизм гена F5 | Гомозигота АА | Носительство Лейденовской мутации. Риск тромбоза выше в 20 раз, по сравнению со здоровым человеком. |
| Полиморфизм гена F5 | Гетерозигота А/- | Носительство ЛМ: риск тромбоза и сердечно-сосудистых катастроф выше в 7 раз. Акушерских осложнений при беременности — в 15 раз, по сравнению со здоровой женщиной. |
Анализ на синдром Лейдена в МЖЦ
Риск тромбозов резко возрастает при сочетании дефекта F5 с мутациями других генов гемостаза. Чтобы узнать, имеете ли вы наследственную предрасположенность к нарушениям свертывания крови — сдайте анализы в Медицинском женском центре!
Мутация лейдена что это такое и чем грозит
Маркер связан с устойчивостью к действию активированного протеина С системы свертываемости крови (Лейденовская мутация). Исследуется для выявления генетической предрасположенности к тромбоэмболии, тромбозам, преэклампсии, тромбоэмболическим осложнениям во время беременности, ишемическому инсульту. Имеет прогностическое значение при приеме оральных контрацептивов и гормональной заместительной терапии.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Венозную кровь, буккальный (щечный) эпителий.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Локализация гена на хромосоме – 1q24.2
Ген F5 кодирует свертывающий фактор V (фактор Лейден), основной плазматический белок, регулирующий свертывание (коагуляцию) крови, выступая в качестве кофактора при превращении протромбина в тромбин фактором F10.
Генетический маркер F5 G1691A
Мутация гена F5 проявляется в замене гуанина (G) на аденин (А) в позиции 1691 и обозначается как генетический маркер G1691А (синонимы: фактор V Лейден, мутация Лейден, Лейденовская мутация). Следовательно, изменяются и биохимические свойства фермента, в котором происходит замена аминокислоты аргинин на глутамин.
G1691A – замена гуанина (G) на аденин (А) в позиции 1691 последовательности ДНК, кодирующей белок F5.
Arg506Gln – замена аминокислоты аргинина на глутамин в аминокислотной последовательности белка F5.
Возможные генотипы
Встречаемость в популяции
Встречаемость аллеля А составляет от 1 до 8 % в различных популяциях.
Ассоциация маркера с заболеваниями
Общая информация об исследовании
Система гемостаза представляет собой совокупность биохимических процессов, обеспечивающих жидкое состояние крови, поддержание ее нормальных реологических свойств (вязкости), предупреждение и остановку кровотечений. В нее входят факторы свертывающей, естественной противосвертывающей и фибринолитической систем крови. В норме процессы в ней уравновешены, что обеспечивает жидкое состояние крови. Смещение этого равновесия вследствие внутренних или внешних факторов может повышать риск кровотечений и тромбообразования, то есть тромбофилии.
Наследственная тромбофилия (патология, обуславливающая повышенную склонность к тромбообразованию) – одно из самых распространенных генетических нарушений. Она часто остается недиагностированной и проявляется обычно в форме тромбоза глубоких вен и венозной тромбоэмболии. Нарушение свертываемости крови при наследственной тромбофилии в большинстве случаев вызывается изменениями в генах факторов свертывания крови II и V, связанными с известными генетическими маркерами (F2 G20210A, F5 G1691A). Именно они играют главную роль в развитии тромбофилии и ассоциированных с ней заболеваний.
Ген F5 кодирует свертывающий фактор V, плазматический белок, постоянно циркулирующий в неактивной форме в крови. Его активация осуществляется белком – тромбином (F2), который с помощью ионов кальция объединяет вместе тяжелую и легкую цепь фактора V. Активированный фактор V (Vа) является основным белком, регулирующим свертывание (коагуляцию) крови, выступая в качестве кофактора при превращении протромбина в тромбин фактором F10.
Замена в положении 1691 аденина на гуанин в гене F5 приводит к замещению в молекуле белка F5 аминокислоты аргинина на глутамин в положении 506. Это один из трех участков фактора V, в которых он расщепляется естественным антикоагулянтом — активированным протеином C. При таком изменении в гене фактора V (мутация Лейден) риск образования тромбов значительно увеличивается за счет отсутствия возможности негативной регуляции работы фермента. Мутация в гене F5 наследуется по аутосомно-доминантному типу, поэтому патологический эффект реализуется даже при наличии одной копии поврежденного гена.
Проявление тромбофилических генетических мутаций зависит также от возраста, факторов окружающей среды и наличия других мутаций. У носителей аллеля, предрасполагающего к тромбофилии, заболевание может не проявляться до воздействия провоцирующих факторов, таких как беременность, прием оральных контрацептивов, гормональная заместительная терапия, длительная иммобилизация, курение.
Наряду с повышенным риском тромбозов наследственная тромбофилия может увеличивать вероятность развития акушерских и гинекологических осложнений (привычное невынашивание, задержка внутриутробного развития плода, гестозы и др.).
По исследованиям Gerhardt et al. (2000), среди беременных женщин с наличием в анамнезе венозной тромбоэмболии распространенность фактора V Лейден составила 43,7 %, по сравнению с 7,7 % среди здоровых женщин.
Риск тромбоза повышается при совместном носительстве мутации в гене F5 и по генетическому маркеру MTHFR (C677T), а также при наличии 20210G-мутации в гене протромбина. Такие сочетания увеличивают риск тромбофилии в раннем возрасте и способствуют более тяжелым тромбозам.
В исследованиях Casas et al. (2004) была показана ассоциация наличия мутации Лейден с ишемическим инсультом.
С другой стороны, мутация Лейден может быть выгодной с эволюционной точки зрения. Это объясняется тем, что у женщин – носительниц этой мутации имеется такое преимущество, как сниженный риск кровотечений при родах. Таким образом, высокая распространенность потенциально вредной мутации среди населения в целом может быть результатом эволюционного отбора.
Своевременная диагностика генетической предрасположенности к повышенной свертываемости крови и ранние профилактические и/или лечебные мероприятия помогут избежать серьезных последствий для сердечно-сосудистой системы и ассоциированных тяжелых заболеваний. Кроме того, профилактика тромбоэмболических осложнений важна для безопасного течения беременности при наличии наследственной тромбофилии.
Интерпретация результатов исследования должна проводиться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Исследование рекомендуется проводить в комплексах:
Мутация Лейдена
Лейденовская мутация – это изменение одного или двух (гетеро-, гомозигота) участков в гене, кодирующем активность V фактора свертывания крови, проакцелерина. В результате F5 становится устойчивым к воздействию протеина С – естественного антикоагулянта, нарушаются противотромботические механизмы крови и организм находится в постоянной тромботической готовности.
Мутация Лейдена – самая распространенная причина наследственной склонности к тромбозам, инфарктам, инсультам и акушерским осложнениям у людей европеоидной расы. Патология названа в честь города Лейден (Голландия), где впервые был описан механизм ее возникновения.
Почему вы узнали о мутации Leiden только сейчас
Нечувствительность к протеину С сразу у нескольких членов одной семьи впервые выявлена шведским ученым Б. Дальбеком в 1993, а детально описана голландским профессором Р. Бертиной в 1994 году. Открытие внесло коррективы в диагностику нарушений гемостаза и акушерских осложнений – теперь любой случай тромбоза или патологии беременности в анамнезе врачи связывают с возможной тромбофилией. Согласно данным последних исследований, полиморфизм гена F5 – главная причина генетической тромбофилии у 5-8% населения Земли. Его распространенность варьируется в зависимости от региона: достигает 15% у жителей Греции, Швеции, Ливана и практически не встречается в Африке, Азии, Гренландии и отдельных районах Северной Америки.
Что такое фактор V
F5, проакцелерин, фактор Лейдена – это молекула белка, В-глобулин, которая образуется в печени человека, циркулирует в крови и участвует в каскаде свертывания.
Благодаря F5 фактор 10 прикрепляется к тромбоциту и активирует протромбин. Также проакцелерин играет важную роль в инактивации комплекса протромбиназы: в норме молекула фактора V разрушается протеином С, после чего протромбиназный комплекс распадается.
Как мутация Лейдена влияет на тромбообразование
При Leiden-мутации в клетке ДНК, кодирующей фактор 5, происходит замена белка-нуклеотида гуанина на аденин в позиции 1691 (G1691A). Изменяется порядок аминокислот в составе «готового» F5 – в 506 положении глутамин сменяет аргинин.
В результате повреждается одно из 3 мест расщепления фактора V, и он теряет чувствительность к воздействию естественного антикоагулянта, протеина С. Действие F5 длится дольше обычного, из-за чего кровь становится излишне вязкой. Нарушается система комплекса протромбиназы, высвобождается больше тромбина и возрастает риск тромбоза.
Вероятность тромбоэмболического события увеличивается с возрастом и при сочетании Лейденовской с мутациями других генов гемостаза – протромбина, протеинов С и S. В развитии тромбозов у носителей полиморфизма фактора V играет роль и ряд других факторов: беременность, прием гормонов, климактерический период, травмы, инфекционные болезни, хирургические операции.
Когда надо сдать анализ на мутацию Лейдена
| Ситуативный случай | Разъяснение |
|---|---|
| Планирование беременности | Полиморфизм F5 является причиной синдрома потери плода, тяжелых форм гестоза, случаев отслойки плаценты и ВЗР. Риск акушерских осложнений у носительниц, в зависимости от формы мутации, при беременности возрастает в 7-80 раз. |
| Прием пероральных контрацептивов, ЗГТ при климаксе | Препараты гормонов повышают уровень гомоцистеина в крови и провоцируют хроническое внутрисосудистое свертывание, что при наличии генетической предрасположенности может закончиться тромбоэмболией. |
| Рецидивирующие тромбозы у пациентов младше 50 лет | Идиопатические (причина которых не установлена), рецидивирующие, тромбозы с необычной локализацией (церебральных, брыжеечных артерий и вен) – признак того, что вы являетесь носителем тромбофилии и нуждаетесь в антикоагулянтной терапии. |
| Отягощенный семейный анамнез | Важно проследить, были ли тромбоэмболические осложнения, инфаркты, инсульты у родителей, дедушек, бабушек, братьев и сестер, поскольку Лейденовская мутация наследуется по аутосомно-доминантному типу и диагностируется у всех близких родственников. |
| Плановое хирургическое вмешательство | После любого повреждения сосудов – травмы, в ходе хирургической операции из клеток высвобождается тканевый тромбопластин, фактор III, активирующий систему свертывания крови. При отсутствии реакции между фактором 5 и протеином С, что характерно для Лейденской мутации, это служит предпосылкой для образования тромбов в венозной системе. |
Признаки и симптомы
Полиморфизм фактора 5 Leiden – генетически детерминированное заболевание. Патология присутствует у человека с рождения, но дает о себе знать только в зрелом возрасте или под воздействием «провоцирующих» факторов – травмы, длительной иммобилизации во время болезни или после операции, при наступлении беременности. До этого момента клинические проявления носительства мутации обычно отсутствуют.
Лейденская мутация – самое значимое нарушение гемостаза, приводящее организм в предтромботическое состояние. При подозрении на тромбофилию анализ на фактор V является приоритетным. В зоне особого риска находятся пациентки с рецидивирующими тромбозами и невынашиванием беременности.
Почему мутация Лейдена опасна для беременных женщин
Во время беременности в организме включается адаптивный механизм: физиологическая гиперкоагуляция, которая нарастает с каждым триместром и достигает максимума в момент родов. Так срабатывает «программа защиты» от массивной кровопотери после родоразрешения.
Но для носительницы полиморфизма гена F5 этот процесс становится патологическим и может привести к тяжелым осложнениям. Уже доказано, что мутация Лейдена – главная причина:
75% случаев невынашивания беременности, синдромов потери плода; 90% случаев ПОНРП, преждевременной отслойки плаценты; 75% случаев резкого подъема уровня артериального давления и поздних токсикозов, а также внутриутробной задержки роста плода, самопроизвольного аборта на сроках как до 12, так и до 20 недель беременности, неудач ЭКО, преждевременных родов, синдрома системного воспалительного ответа. Акушерские осложнения можно предупредить, если на этапе планирования, и даже во время беременности обратиться к квалифицированному врачу гемостазиологу, который назначит поддерживающую антикоагулянтную терапию.
Полиморфизм гена фактора V: лечится или нет
«Поправить» дефектный ген в молекуле ДНК невозможно, но гемостазиологи предлагают, как вариант, предупредить осложнения тромбофилии профилактическими мерами. Медикаментозная терапия при мутации Лейдена назначается, исходя из прогнозируемого по результатам анализа риска тромбозов:
Обследование и сопровождение пациентов с мутацией Лейдена проводят в МЖЦ на Таганской – профильной клинике под руководством Татьяны Владимировны Кузнецовой, профессоров Александра Давидовича Макацария и Виктории Омаровны Бицадзе. На базе нашей Научной лаборатории патологии гемостаза вы сможете сдать анализ на мутацию в гене FV Leiden, который позволит определить риск тромбофилии и подобрать оптимальную противотромботическую терапию.
акушер-гинеколог, гемостазиолог, профессор, доктор медицинских наук, эксперт международного уровня по проблемам тромбозов и нарушений свертывания крови