Мутация вируса что это
Альфа, дельта, омикрон: откуда у коронавируса столько штаммов и почему не все из них опасны
COVID-19 регулярно мутирует и не всегда понятно, будут ли против него эффективны средства, которыми мы пользовались еще вчера. Ученые следят за новыми мутациями, чтобы заранее изучить их и предугадать, какой вред они потенциально могут нанести. «Хайтек» разбирается, как появляются мутации и от чего они зависят.
Читайте «Хайтек» в
Опасные штаммы коронавируса называют в честь букв греческого алфавита. Мы уже на «омикроне» — до конца осталось всего девять. Это значит, что коронавирус мутирует быстро? Если да, то увеличивается ли эта скорость? И почему какие-то мутации сохраняются и начинают распространяться, а другие нет?
Как появляются мутации?
После попадания в организм вирус начинает процесс репликации — происходит он только внутри живой клетки и засчет ее ресурсов. Поэтому после попадания внутрь вирус удваивает свою РНК. Во время этого сложного процесса, который состоит из нескольких шагов, могут возникать ошибки. Например, самые популярные — перестановка нуклеотидов, замена одного на другой. Это называют точечной мутацией. При удвоении РНК возможны потери небольших последовательностей или, наоборот, вставка.
Вирус старается исправить ошибки при размножении, но не всегда это получается. С другой стороны, если новая мутация помогает проникать в организм быстрее или лучше распространяться, то она может закрепиться.
Все мутации опасны. Это так или нет?
Нет, это не так. Вирусы часто мутируют, но не всегда успешно. Обычно, когда мы говорим о естественном отборе, то думаем о новых мутациях, которые имеют преимущество и распространяются, например, как альфа- и дельта-варианты COVID-19. Это называется положительный отбор.
Но большая часть мутаций вредит вирусу и ухудшает вероятность его выживания — это очищающие мутации или отрицательный отбор. Они не сохраняются в организме достаточно долго, чтобы их можно было секвенировать. Из-за этого их часто не учитывают при оценке количества генетических изменений.
При большом количестве мутаций повышается и число тех, которые дают вирусу преимущество. В августе 2021 года ученые из университетов Бата и Эдинбурга выяснили, что частота мутаций вируса COVID-19 стала на 50% выше. Ранее считалось, что вирус мутирует примерно раз в две недели.
Авторы отметили, что если пациент страдает от COVID-19 более нескольких недель, то вирус может эволюционировать. Подробнее об этом мы поговорим в следующей главе.
Я слышал, что ВИЧ повлиял на мутации COVID-19, каким образом?
Да, это правда. Но связь не так очевидна, поэтому надо понять, как образуются такие мутации. Влияние ВИЧ на COVID-19 начали активно обсуждать после появления B.1.1.529 или омикрон-штамма, который вызывает опасение у мирового сообщества.
Этот штамм произошел не от дельта-варианта, а от другой, еще более ранней разновидности COVID-19. Это необычная ситуация, так как новые штаммы образуются с небольшим определенным набором мутаций. Такие изменения в геноме вируса происходят, когда он естественным образом передается от человека к человеку.
В случае с омикроном ситуация другая — у него очень много мутаций. Их около 50 в самом геноме, от этого числа 35 — в S-белке и 10 находятся в области, контактирующей с рецептором ACE2. У других штаммов, например, у бета, в этой же области всего три мутации, а у дельты — две. Это говорит о том, что вирус не передавался, а наоборот находился в организме одного человека с иммунодефицитом. Предположительно, с ВИЧ. Дело в том, что иммунная система человека, переносящего ВИЧ, может не до конца победить вирус и он будет развиваться внутри организма неделями или месяцами.
Поэтому во время размножения вируса самые слабые частицы погибают, а быстрые и адаптированные начинают изменяться, чтобы быть устойчивыми к иммунитету. Пока что это только теория, но она объясняет, почему омикрон произошел от исходного штамма В.1.1. Сегодня его уже практически нет среди новых случаев.
Пока что исследований о корреляции между уровнем инфицирования ВИЧ и заболеваемостью COVID-19 не было, но можно отметить, что в Африке, где впервые нашли омикрон-штамм, также высокий уровень заболеваемости ВИЧ/СПИДа. Новый вариант COVID-19 нашли в Ботсване, в которой сейчас эпидемия — с вирусом живет каждый пятый человек в возрасте от 15 до 49 лет.
Как понять насколько опасен штамм и поможет ли от него вакцина?
Это достаточно сложный вопрос. Сперва нужно понять, опасен ли штамм. Для этого у больных делают забор образцов слизистой и расшифровывают геном возбудителя.
Дальше эту информацию переносят в общие базы данных и сравнивают. Например, в базе GISAID больше 2 млн геномов коронавируса со всего мира. Там есть трекер, визуализирующий, какой вариант в какой стране выявили. Также исследователи опубликовали эволюционное древо коронавируса — этим занимается проект Nextstrain. В зависимости от характеристик найденного штамма и его распространенности ученые делают вывод о его опасности.
После этого нужно понять, сработают ли существующие вакцины от нового штамма. Чтобы выяснить это, можно, например вести статистику в месте массового распространения штамма и смотреть на изменения в соотношении заболеваемости (есть ли всплеск), рост смертности, а также как меняются типичные симптомы, которые выявляют у пациентов.
Возьмем для примера «Спутник V». В основе вакцины есть S-белок, который изменяется при мутации. Значит нужно заменить его на новый образец. Дальше белок необходимо упаковать в оболочку аденовируса. Еще требуется время на наработку вакцины.
Еще одна популярная конфигурация — это мРНК-вакцины. Это более инновационный биотехнологический подход, который превращает клетки организма в молекулярные фабрики для производства белков. А они, в свою очередь, активируют специфический для патогенов иммунный ответ. Например, в BioNTech и Pfizer разрабатывают вакцину каждый раз при появлении новых штаммов вируса — это часть их стандартной процедуры.
Но после того, как вакцина адаптирована, ее нужно снова протестировать и сертифицировать. Несмотря на то, что есть упрощенные схемы этих процедур, на все уходит время. Глава Moderna заявил, что на разработку новой вакцины могут потребоваться месяцы.
Пандемия показала, как важно иметь четкий и отработанный алгоритм действий в случае появления нового вируса или опасного штамма. Пока что все процедуры выявления, подготовки и разработки препаратов выглядят разрозненно, поэтому занимают много времени и не всегда эффективны.
Так ли страшны новые штаммы? Ответы на самые важные вопросы о мутациях коронавируса
Появление новых штаммов коронавируса, имеющих необычные свойства, вызывают тревогу людей во всем мире. Руководитель научной группы разработки новых методов диагностики заболеваний человека Центрального научно-исследовательского института эпидемиологии Роспотребнадзора Камиль Хафизов рассказал о том, что сейчас известно о мутациях COVID-19 и нужно ли будет ежегодно от него прививаться, как мы это делаем в случае с гриппом.
— Сколько всего штаммов коронавируса выявлено на сегодняшний день в мире?
— В первую очередь стоит обратиться к определению штамма вируса как некоторого варианта патогена, который обладает уникальными и стабильными фенотипическими характеристиками. При этом стоит отметить, что вирусы, особенно РНК-содержащие, постоянно мутируют, перебирая разные варианты изменений в геноме, и даже внутри одного человека может содержаться множество версий одного вируса, отличающихся отдельными изменениями в геноме, которые далеко не всегда приводят к образованию нового штамма.
Варианты SARS-CoV-2 циркулируют во всем мире, и после появления некоторые варианты довольно быстро исчезают, другие, наоборот, закрепляются в популяции, процесс динамический. Сколько всего штаммов нового коронавируса существует в природе на данный момент, неизвестно, в том числе из-за размытости самого понятия и факта того, что свойства многих геновариантов вируса пока не изучены.
Так, популярный ресурс PANGO lineages выделяет значительное число отдельных линий патогена, и различные организации во всем мире изучают варианты вируса, чтобы понять, являются ли они более контагиозными, изменяющими тяжесть течения заболевания, детектируемыми доступными диагностическими тестами, отвечающими на терапию, изменяющими эффективность вакцин против COVID-19 и т.п. Потому куда чаще термин «штамм» используется для каких-то особо интересных вариантов патогена, как, например, британского или южноафриканского, которые характеризуются ключевыми изменениями в геноме и имеют важные (часто выгодные патогену) свойства. Так, было введено понятие VoC (от англ. Variants of Concern. — Прим. ред.) — «варианты, вызывающие беспокойство», к которым сейчас причисляют несколько штаммов, включая вышеперечисленные.
— Сколько из них есть в России?
— Строгого ответа нет. Какая-то доля всех штаммов коронавируса, которые распространяются на планете, есть уже и в России, какие-то будут завезены в будущем, какие-то появятся у нас в стране независимо. Ученые во многих лабораториях в мире и в нашей стране сейчас проводят активную работу по секвенированию геномов патогена из различных регионов, чтобы как можно быстрее выявлять новые варианты, мониторить скорость их распространения, устанавливать источники заносов из-за рубежа, определять свойства, корректировать тест-системы в случае необходимости. Из известных штаммов в РФ были выявлены британский, южноафриканский, индийский и несколько локальных.
— Какие штаммы коронавируса самые опасные и проникают внутрь всего организма, а какие — наоборот?
— Как уже говорил выше, само определение штамма подразумевает новые стойкие свойства патогена. Чаще всего приходится иметь дело либо с повышенной заразностью вируса (как, например, в случае с британским штаммом, который, по различным оценкам, примерно на 50% более заразен, чем другие, «старые» версии), либо же со снижением эффективности связывания с нейтрализующими антителами, возникшими после вакцинации или перенесенного ранее заболевания (так в случае с южноафриканским вариантом).
При этом сразу хотел бы отметить, что уменьшение эффективности вовсе не означает отсутствие защиты, но она может быть несколько снижена. В любом случае всячески выступаю за вакцинацию, которая если и не защитит на 100% от заболевания, то может кардинально снизить тяжесть его протекания.
— Какие штаммы наиболее всего распространены в Москве, какими больше всего болеют в России?
— За последнее время мы видим несколько сотен завозов британского штамма как по России, так и в Москве, что вполне ожидаемо ввиду его свойств. Появляются и некоторые локальные российские версии вируса, у которых встречаются мутации в геноме, характерные для британского и южноафриканского вариантов, но пока преждевременно говорить о том, что они действительно обладают какими-то особыми для людей свойствами. По этой же причине мы не хотели бы сейчас раздавать новые имена таким вариантам, по крайней мере до накопления достаточного объема данных.
— От всех ли штаммов болезнь длится одинаково или есть разница?
— В какой-то момент появилась информация, что пациенты с британским вариантом инфекции болеют тяжелее, и летальность в таких случаях выше. Это впоследствии было опровергнуто другими исследованиями, и с тех пор я не видел новой информации. Похожая информация появлялась и про калифорнийский вариант.
Нужно отметить, что тяжесть протекания заболевания зависит от множества факторов, и, как известно, многие вообще переносят болезнь бессимптомно, кто-то же крайне тяжело. Такие факторы, как наличие сопутствующих заболеваний, общее состояние организма, возраст, играют существенно большую роль в развитии тяжелой болезни, чем наличие мутаций в геноме патогена, по крайней мере известных на данный момент.
— Может ли бы такое, что к одному штамму коронавируса у человека есть иммунитет, а к другому нет?
— Перенесенная ранее коронавирусная инфекция или вакцинация в норме вызывают иммунный ответ, и в результате в организме появляются нейтрализующие антитела, хотя защита обусловлена не только ими, потому не стоит пугаться, даже если уровень антител невысок или падает. Но да, мы уже знаем, что ряд мутаций в геноме нового коронавируса приводит к изменениям в структуре его белков, придавая патогену новые свойства, иногда удачные для патогена, в том числе с точки зрения снижения связывания нейтрализующими антителами. Потому точно ответить, что к одному штамму у человека есть иммунитет, а к другому нет, нельзя, но эффективность защиты может быть разной, в зависимости от того, с каким новым вариантом вируса вновь встретился пациент.
В связи с этим достаточно вероятна ситуация, что вакцины против нового коронавируса придется периодически обновлять и иммунизироваться ежегодно, как это сейчас происходит с тем же вирусом гриппа. Думаю, к осени мы накопим достаточное количество данных по эффективности существующих вакцин против новых штаммов. Потому еще раз говорю: на данный момент известных причин избегать вакцинации нет, если только нет прямых противопоказаний по состоянию здоровья.
Вирусы и механизмы возникновения их мутаций
Вирусология занимает важное место среди биологических дисциплин. Современный медицинский или ветеринарный специалист должен знать не только клинико–патологическую сторону заболевания, но и иметь четкое представление о вирусах, их свойствах, методах лабораторной диагностики и свойствах постинфекционного и поствакцинального иммунитета.
Вирус (от лат. virus — яд) является простейшей неклеточной формой жизни в виде микроскопической биологической частицы, представляющей собой молекулы нуклеиновых кислот (ДНК или РНК), заключённых в защитную белковую оболочку (капсид) и способные инфицировать живые организма.
Мутации у вирусов
Поэтому ни структура белка, ни его биологические свойства не нарушаются. Природа использует своего рода синонимичный язык и, заменяя один кодон другим, закладывает в них одно и то же понятие (аминокислоту), тем самым сохраняя естественную структуру и функцию синтезируемого белка.
Другое дело, если аминокислота кодируется только одним триплетом, например, синтез триптофана кодируется и заменяется только триплетом УГГ, то есть синонимом, который отсутствует. В этом случае в белок включается еще одна какаялибо аминокислота, которая может привести к появлению мутантного признака.
Аберрация в фагах вызвана делециями (потерями) различного числа нуклеотидов, от одной пары до последовательности, вызывающей одну или несколько функций вируса. Как спонтанные, так и индуцированные мутации также делятся на прямые и обратные мутации. Мутации могут иметь разные последствия. В некоторых случаях они приводят к изменению фенотипических проявлений в нормальных условиях.
Например, увеличивается или уменьшается размер бляшек под агарным покрытием; увеличивается или ослабевает вирулентность для определенного вида животных; вирус становится более чувствительным к действию химиотерапевтического агента и т. д. 
В других случаях мутация является фатальной, поскольку она нарушает синтез или функцию жизненно важного вирусного белка, например, такого как вирусная полимераза. В некоторых случаях мутации являются условно летальными, так как вирусспецифический белок сохраняет свои функции при определенных условиях и теряет эту способность в неразрешающих (непермиссивных) условиях.
Типичным примером таких мутаций являются термочувствительные – ТS-мутации, при которых вирус теряет способность к размножению при повышенных температурах (+39-42°С), сохраняя эту способность при нормальных температурах роста (+36-37°С). Морфологические или структурные мутации могут влиять на размер вириона, первичную структуру вирусных белков и изменения в генах, определяющих ранние и поздние вирусные ферменты, обеспечивающие размножение вируса. Мутации также могут быть различными по своему механизму.
Изменения могут влиять на размер, форму, патогенность, антигенную структуру, тканевую тропность, устойчивость к физико-химическим воздействиям и на другие свойства вирусов. Значение причин, механизмов и характера изменений имеет большое значение при получении необходимых вакцин для вирусных штаммов, а также для разработки эффективных мер борьбы с вирусными эпизодами, в ходе которых, как известно, свойства вирусов могут существенно изменяться.
Мутация вирусов может происходить в результате химических изменений цистронов или нарушения последовательности их расположения в структуре молекулы вирусной нуклеиновой кислоты. В зависимости от условий различают естественную изменчивость вирусов, наблюдаемую в нормальных условиях размножения, и искусственную изменчивость, получаемую в результате многочисленных специальных пассажей или воздействия на вирусы определенных физических или химических факторов (мутагенов). В обычных природных условиях изменчивость проявляется не во всех вирусах одинаково.
Этот признак наиболее заметен у вируса гриппа и вирус ящера. Значительная изменчивость отмечается у вируса гриппа. Об этом свидетельствует большое количество вариантов у разных типов этих вирусов, а также значительные изменения его антигенных свойств в конце почти каждой эпизоотии.
Частота мутаций и механизмы их возникновения
Мутации бактериофагов изучались очень интенсивно не только с целью генетического анализа, но и с целью получения информации о свойствах самих фагов. Частота появления мутантов в потомстве фагов варьируется очень сильно: например, одни мутанты образуются с частотой не более 10, а другие-с частотой 10 и выше. Неблагоприятное воздействие высокочастотных мутаций обычно компенсируется эффектом отбора. Например, мутантный фаг может быть заменен диким типом, что дает более высокий выход фага. Высокая частота вспышек обычно характерна для таких мутаций, которые могут происходить как во многих локусах, так в одном и том же локусе.
В тех случаях, когда нормальный признак соответствует функциональной форме гена, а мутант появляется в результате изменения в любой точке локуса, частота прямых мутаций окажется выше, чем частота обратных мутаций, так как обратные мутации должны приводить к восстановлению нормального состояния. Иногда ревертанты на самом деле являются псевдоревертантами: это происходит либо из-за изменений в другом гене (мутации-супрессоры), либо из-за изменений в том же гене, которые вызывают другую, но также активную форму продукта.
У зрелых фагов частота спонтанных мутаций очень мала, но они могут быть индуцированы под влиянием таких мутагенных факторов, как рентгеновские или ультрафиолетовые лучи, азотистая кислота, гидроксиламин или алкилирующие агенты. Азотистая кислота дезаминирует основания нуклеотидов, а этилметилсульфат их этилирует. Гидроксиламин превращает шитозин в урацил. В результате ошибок, допущенных при репликации химически модифицированной нуклеиновой кислоты, происходят мутации, и потомство фагов, полученное из бактерии, содержит как нормальные, так и мутантные частицы. Однако, как и при обработке мутагенного фага, содержащего одноцепочную ДНК, образуется чистый мутантный клон.
Изучение мутационного процесса, происходящего при размножении фагов, непосредственно связано с анализом развития фагов. Давайте рассмотрим процесс спонтанной мутации. В бактериальной клетке, в которой произошла мутация фага, 6 образуются как нормальный, так и мутировавший фаги. Количество мутантных фаговых частиц, содержащихся в популяции фагов, происходящих из этой отдельной бактериальной клетки, очевидно, определяется характером размножения фагов, поскольку новые гены могут быть сформированы только путем репликации уже существующих. Если вероятность мутации одинакова для каждой репликации, то число мутантов зависит от механизма репликации.
Например, если каждая новая копия гена формируется независимо от других, то распределение мутантных копий в потомках фагов от разных инфицированных бактерий будет случайным. Если же, наоборот, каждая из полученных копий воспроизводится, то в свою очередь мутантные копии будут разделены на группы или клоны, состоящие из мутантных «сибсов».
Индуцированные хозяином модификации бактериофагов
Помимо мутаций, бактериофаги подвержены негенетическим изменениям, в которых главная роль принадлежит клетке-хозяину. Это явление было названо модификациями, вызванными хозяином. Значение этих модификаций для молекулярной биологии состоит в том, что они показали способность внутриклеточной среды вызывать такие изменения в химической структуре генетического материала, которые могут быть использованы для идентификации клеточных линий, синтезирующих ДНК.
Подобные явления были впервые обнаружены на фаговой ДНК, но они также справедливы и для каждой бактериальной клеточной ДНК. Есть также наблюдения, при которых это явление относится и к эукариотическим клеткам. В особых случаях могут возникнуть более сложные ситуации. Двустороннее ограничение фага двумя хозяевами иногда наблюдается, но оно не обязательно. Фаги, отторгнутые клетками, способны адсорбироваться на них и проникать в их ДНК добавляя часть собственной ДНК. Однако последняя часть быстро разрушается, и репликация не происходит.
Деградация ДНК вызывается специфическими эндонуклеазами (рестриктазами или R-нуклеазами), которые могут обнаруживать и расщеплять определенные участки ДНК, если они не были модифицированы под влиянием М-ферментов. После этого ДНК расщепляется экзонуклеазами на отдельные нуклеотиды. Бактериальный штамм может иметь одну или несколько R-нуклеаз и в то же время M-ферменты, которые защищают собственную ДНК клетки. Предложена удобная номенклатура этих ферментов. Согласно ряду данных, области детекции R-нуклеазы не всегда совпадают с областями расщепления ДНК; возможно, что фермент может мигрировать по цепочке до того, как найдет область, где происходит расщепление ДНК. Функциональная роль индуцированных хозяином модификаций неясна.
Они способны защитить этот штамм бактерий от массового уничтожения фагами, растущими на различных бактериях. В более общем плане роль модификаций можно определить как защиту от проникновения неприемлемой чужеродной ДНК в бактериальную клетку и ее последующего «приживления». Бактерия А, которая отвергает фаги, размноженные на штамме В, также отвергает ДНК бактерии В, когда она вводится путем конъюгации или трансдукции.
Как видим, мутирование вирусов проходит достаточно сложный и тернистый путь в приобретении новых вирулентных свойств. Эти свойства могут быть как ослабляющими для развития инфекционного процесса, так и крайне агрессивными в своём новом виде.
Как вирусы обманывают человека?
Метафорическая зарисовка. Представители различных генетических вариантов SARS-CoV-2 собрались за круглым столом и обсуждают план захвата мира. Рисунок в полном размере.
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Вирусы умеют не только размножаться внутри клеток хозяина, но и прятаться от его иммунитета. Способов избежать фатальных встреч с оборонными силами организма существует множество, но один из самых хитрых (и потому особенно интересных) механизмов демонстрируют вирусы с измененными генетическими последовательностями. Эта статья расскажет, что такое генотипы и генетические варианты вирусов и почему так важно о них знать.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Зачем нам знать о генетических вариантах вирусов?
Новости о коронавирусе на протяжении всего 2020 года оставались самыми читаемыми, а количество научных публикаций о SARS-CoV-2 почти в пять раз превысило число статей по другой «громкой» теме — системам CRISPR/Cas: по данным PubMed их уже больше 60 тысяч! И здесь важнее следить не столько за драматической статистикой заражений и исходов, сколько за потенциалом и способностями возбудителя. Ведь вирусы умеют мутировать и порождать таким образом новые генетические варианты [1].
Генетические варианты вируса — это геномы какого-то вида (или штамма) вируса, отличающиеся друг от друга по последовательности нуклеотидов, и эти отличия могут обусловливать появление новых штаммов. «Генотип», «субтип», «генетический вариант» — термины, отражающие степень геномных различий (в порядке убывания).
По мере накопления знаний по этой теме опасения ученых лишь крепли: мутации могут влиять как на вирулентность, так и на тяжесть протекания заболевания, развитие лекарственной устойчивости и вероятность повторного заражения [2].
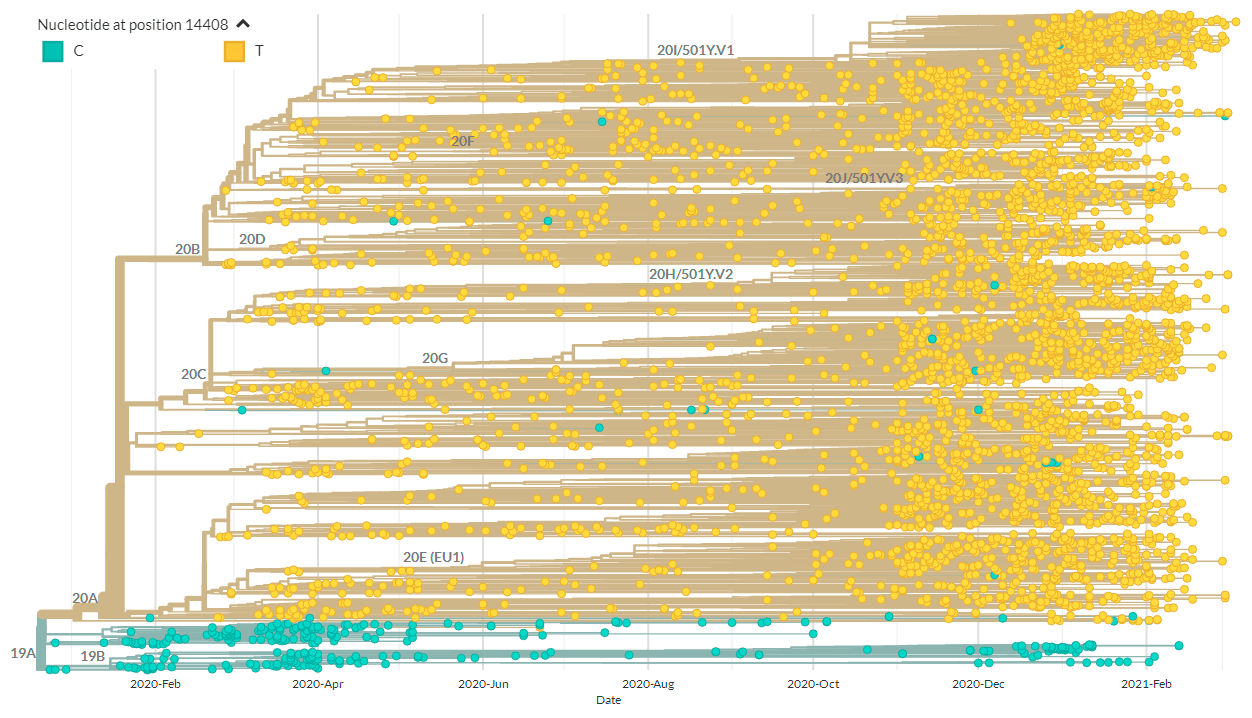
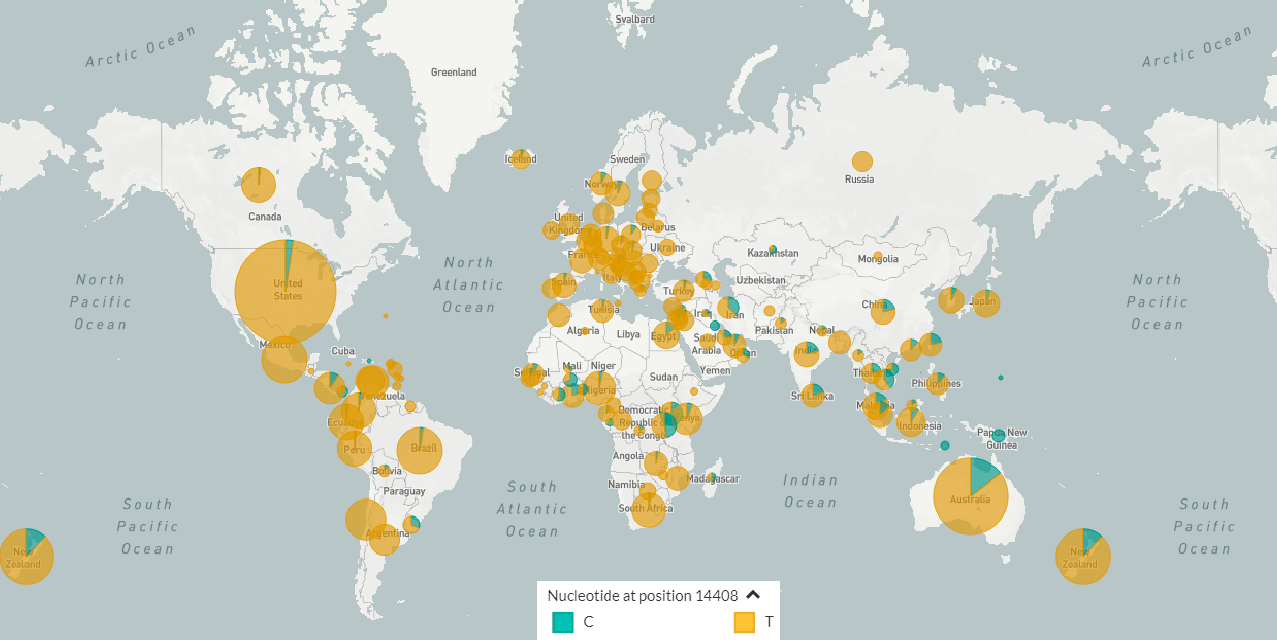
У SARS-CoV-2 весной 2020 года выделяли 3 генотипа: A, B и C [1]. Но сейчас особое внимание обращают на некоторые генетические варианты этого вируса и их географическое распределение (рис. 1) [3]. Известно, что даже самое маленькое изменение в генетическом материале возбудителя способно сильно сказаться на протекании либо распространении заболевания. На что же могли повлиять мутации в геноме SARS-CoV-2?
Рисунок 1а. Схематическое изображение эволюции SARS-CoV-2
Рисунок 1б. Карта распространения генетических вариантов SARS-CoV-2
Например, единственная мутация в гене поверхностного белка (spike-белка), вызвавшая замену его 614-й аминокислоты — D614G, — способствовала распространению SARS-CoV-2 по миру [4], [5].
Другая мутация, C14408T, в последовательности, кодирующей вирусную РНК-зависимую РНК-полимеразу (RdRp), потенциально способна влиять на развитие лекарственной устойчивости [6], [7]. Но самым поразительным можно считать случай, когда у пациента один генетический вариант SARS-CoV-2 заместился другим [8]. Дело в том, что наша иммунная система выстраивает защиту, по сути, от определенного вирусного генотипа. Если же вирус меняется, организм, встречавшийся с его предшествующим вариантом, новый может и не узнать.
Однако можно чуть-чуть успокоиться: мутации SARS-CoV-2 хоть и устроили хорошую суматоху, но так и не показали пока явной клинической значимости — в отличие от изменений ряда других вирусов. О них и пойдет речь дальше.
Вирусы гепатитов и компания
Гепатиты
В 2020 году Нобелевскую премию по физиологии или медицине вручили за открытие возбудителя одного из гепатитов — вируса гепатита С (ВГС, HCV) [9]. Болезнь может протекать без видимых симптомов, но при этом вирус сильно поражает печень. В крайних случаях развивается цирроз или даже рак печени [10]. К счастью, уже есть эффективные средства от гепатита С: по словам нобелевского лауреата Харви Олтера, противовирусные препараты прямого действия позволяют излечивать 95–98% пациентов [9]. Так в чем же подвох?
Интересно, что ВГС генотипов 1 и 4 обычно хуже поддаются терапии и требуют более продолжительного лечения, чем 2 и 3 [12].
| Генотипы ВГС | Субтипы |
|---|---|
| Генотип 1 | 1a, 1b |
| Генотип 2 | 2a, 2b, 2c, 2d |
| Генотип 3 | 3a, 3b, 3c, 3d, 3e, 3f |
| Генотип 4 | 4a, 4b, 4c, 4d, 4e, 4f, 4g, 4h, 4i, 4j |
| Генотип 5 | 5a |
| Генотип 6 | 6a |
| Генотип 7 |
При этом из-за высокой генетической вариативности, то есть больших различий между вирусными генотипами (до 30–35%), против ВГС не получается создать эффективную вакцину. Проблема усугубляется тем, что для тестирования прототипов вакцин нужны небольшие модельные животные, а получить мышей, способных одновременно болеть гепатитом С и имитировать человеческий иммунный ответ на инфекцию, очень трудно. И наконец, для изучения вируса in vitro нужно нарабатывать заразные частицы ВГС, а способные на это клеточные культуры появились лишь недавно [14].
Секвенирование вирусного генома показало, что в России циркулирует рекомбинантный вариант ВГС (RF2k/1b), генетически сходный с генотипами 1 и 2 одновременно. Из-за такой маскировки детекция этого генотипа затруднительна, а значит, и лечение бывает менее эффективным [15].
Итак, чтобы эффективно справиться с гепатитом С, нужно определить генотип его возбудителя. Не менее важно знать и генотип вируса, вызывающего другой гепатит — гепатит B. Да, от ВГВ (HBV) существует прививка [16]. Но! Есть основания считать, что генотипы ВГВ, несмотря на относительно небольшую вариативность (около 8% генома), по-разному влияют на тяжесть заболевания [17], [18].
Стоит, однако, учитывать, что результаты исследований связи вирусных генотипов с особенностями течения болезни весьма противоречивы. Чаще всего это связано с недостаточным размером изученных выборок, что, в свою очередь, обусловлено сложностями массового генотипирования. Из-за этого, например, на Тайване развитие гепатоцеллюлярной карциномы связывают с ВГВ генотипа В, а в Японии и КНР — с ВГВ генотипа С [19]. Тем не менее некоторые авторы приходят к выводу, что генотип ВГВ вообще не имеет большого клинического значения [20].
Хоть пока и нет общих рекомендаций проводить генотипирование ВГВ, ряд ученых призывает сделать его обязательным, поскольку пангенотипной терапии в случае гепатита В не разработано, а эффективность лекарств порой разнится в зависимости от генотипа.
Детекция генотипа вируса может стать хорошим подспорьем для врачей как минимум в двух направлениях: в определении вероятности развития той или иной формы болезни у конкретного пациента и в персонализации лечения. Однако подобных исследований крайне мало, можно даже сказать, что это поле еще совсем не пахано.
Денге
Мы уже заметили, что при разработке вакцин необходимо знать и учитывать разнообразие генотипов вируса. В этом отношении яркими примерами могут служить подходы к производству вакцин от гриппа и менее распространенной болезни — лихорадки денге, о возбудителе которой мы сейчас и расскажем [21].
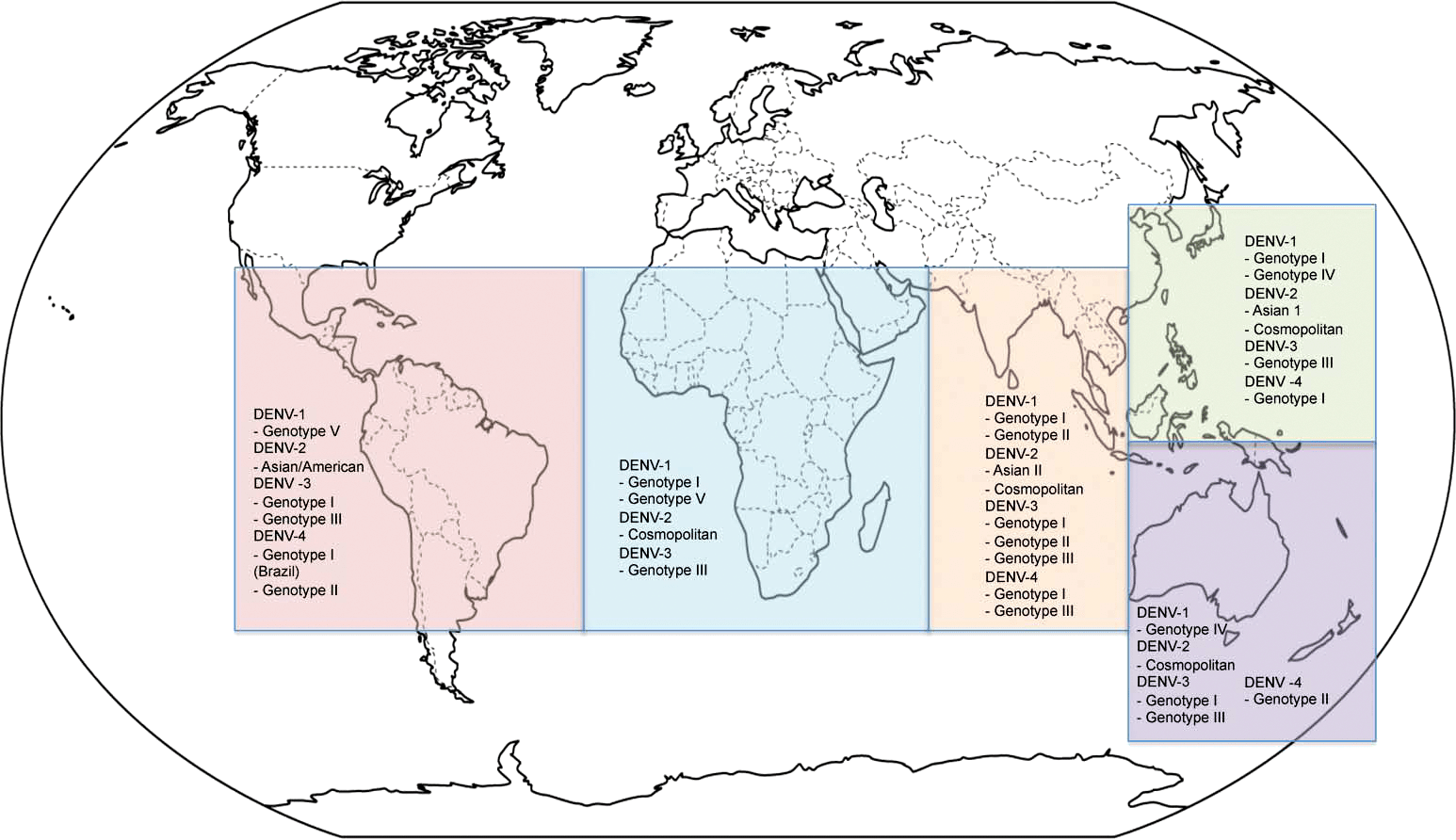
Рисунок 2. Географическое распределение эндемичных по вирусу денге районов в 2011 году
У вируса денге выделяют четыре серотипа, то есть четыре группы вирусов с общей антигенной структурой. Генотипов у этого возбудителя больше, соответственно, и отслеживать их сложнее. Увы, но знания серотипа порой недостаточно для качественной вакцинации. Например, низкую эффективность одной из проходивших клинические исследования вакцин против серотипа 2 можно объяснить большой вариативностью составляющих его генотипов [22].
Существует мнение, что если эффективность вакцин против денге в новых клинических исследованиях останется низкой, при создании вакцинных препаратов необходимо будет отталкиваться именно от результатов генотипирования [21]. Это нужно и для исключения возможного антителозависимого усиления инфекции в случае, если вакцина будет защищать не от всех серотипов/генотипов, с которыми может встретиться отдельный организм.
Примечание
Антителозависимое усиление инфекции (ADE, antibody-dependent enhancement) — феномен, при котором связывание вируса с cубоптимальными нейтрализующими или не нейтрализующими антителами способствует его проникновению в иммунные клетки с последующей репликацией в них. Из-за ADE непроверенные вакцины могут быть очень опасными: при встрече с инфекцией вместо обеспечения защиты некоторые из них способны утяжелять течение заболевания [23].
Подводя итог, можно сказать, что знание генотипов вирусов необходимо для отслеживания распространения заболеваний по миру, для их лечения, а также для получения эффективных вакцин. К сожалению, пока генотип-специфичная борьба с инфекциями сильно ограничивается в том числе и недостатком информации о вирусных штаммах.
Но как вообще появляется это штаммовое разнообразие?
Вирусная хитрость: механизмы изменения геномов
Вирусы способны изменять свои свойства внутри клеток хозяев и в результате становиться заразнее и опаснее. Впрочем, не стоит пугаться. Обычно вирусная эволюция протекает в сторону снижения летальности, поскольку вирусу, который не убивает своего носителя и почти не вызывает симптомов, намного проще распространиться в популяции. Хоть геномы вирусов и изменяются с довольно высокой частотой, на деле мутации чаще оказываются нейтральными, не влекущими заметных последствий для вируса и его хозяина. Очень немногие из них действительно вносят вклад в дальнейшую эволюцию [24].
В основе способности вирусов к изменениям лежат мутации и/или обмен генетическим материалом между разными вирусами, результаты которых закрепляются или не закрепляются давлением естественного отбора.
Мутация — это изменение последовательности нуклеотидов в определенном участке генома, нередко приводящее к изменениям структуры и/или функций организма или вируса. Мутации могут возникать из-за ошибок работы ферментов, создающих копии геномов, или под действием среды.
Когда одну и ту же клетку заражает два родственных вируса, могут образовываться гибридные вирусы, содержащие измененный по сравнению с родительскими формами генетический материал. Этот процесс называют рекомбинацией или реассортацией, если у вирусов сегментированный геном (в частицу он упаковывается отдельными сегментами типа мини-хромосом) [25].
Для справки
До введения термина «реассортация» в научный обиход рекомбинацией называли любой обмен генами, включая и те процессы, которые сейчас со знанием дела именуют реассортацией [25].
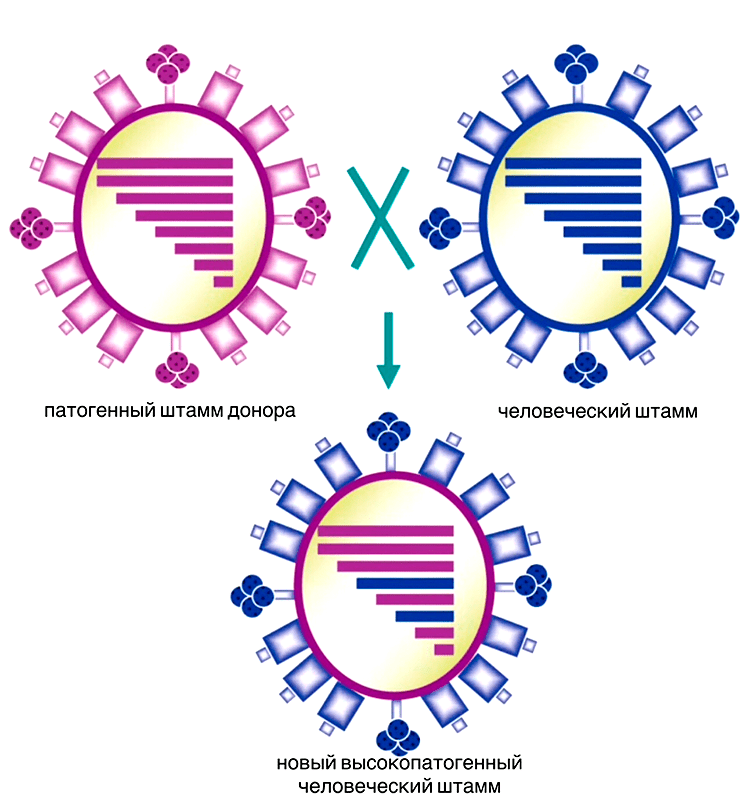
Реассортация очень напоминает появление детей у родителей: когда два разных вириона попадают в одну клетку и приступают к размножению, они могут обменяться частями геномов (рис. 3). В результате получится новая вариация (штамм) вируса, которая может значительно отличаться от своих предков [25]. Такие вирусы порой становятся неузнаваемыми для иммунной системы и распространяются, вызывая эпидемии и пандемии. Этот сценарий характерен, например, для вирусов гриппа. Некоторые исследователи винят в пандемии той же «испанки» именно вирусную реассортацию [26].
Рисунок 3. Реассортация вирусов, которая приводит к появлению штамма с измененным генетическим материалом
Благодаря мутациям и обмену генетическим материалом вирус может даже менять своего хозяина. Так SARS-CoV-1 от летучих мышей перешел в семейство виверровых (к мусангам и циветам), а затем и к людям. В начале 2000-х этот вирус вызвал эпидемию, охватившую 29 стран [28].
Новые генотипы могут возникать и в ходе лабораторных пассажей, когда вирусом последовательно заражают нескольких животных, выделяя из них новую чистую культуру возбудителя [29]. Такая процедура нужна, в частности, для тестирования противовирусных лекарств и вакцин.
Свойства вируса во время пассажей меняются ступенчато. В первых пассажах в основном обнаруживают вирионы, изменившие какой-то один генетический признак. Но с увеличением числа пассажей у подавляющего большинства вирусных частиц наблюдают изменение многих генетических признаков.
Кроме рекомбинации и мутаций, изменчивость вируса может быть обусловлена влиянием хозяина (host-controlled variation). Такие модификации не затрагивают генетический материал вируса и встречаются, например, у ДНК-содержащих бактериофагов, вирусов гриппа и Сендай. Клетка может влиять на характер синтезируемых в ней вирусных компонентов. Или в вирусную частицу могут попадать хозяйские белки и липиды. Поэтому при смене клетки-хозяина в структуре оболочки вириона меняются и антигены, с помощью которых организм узнает вирус.
Итак, образование новых вирусных генотипов — совершенно обычное явление, основанное на стандартных эволюционных процессах. Однако как нам эти генотипы детектировать?
Как выявляют генотипы вирусов?
Теперь, когда мы знаем, как возникают вирусные генотипы и как от генетического варианта возбудителя могут зависеть течение, распространение и лечение заболевания, перейдем к обсуждению лабораторных методов. Они позволяют нам определять, вирус какого генотипа вызвал болезнь у конкретного пациента. Рассмотрим методы детекции генотипов на примере вируса ВГС. В настоящее время лабораторные анализы, используемые в схемах диагностики и лечения гепатита C, представлены серологическими тестами для обнаружения антител к ВГС, молекулярными тестами для выявления и количественной оценки РНК ВГС, а также методами генотипирования возбудителя [30].
При первоначальной диагностике гепатита C учитывают симптоматику и уровни ферментов печени (особенно аланинаминотрансферазы, АЛТ) в крови. У пациентов с подозрением на гепатит C иммуноферментным анализом (EIA) [31] или хемилюминесцентным иммуноанализом (CIA) выявляют антитела к ВГС. В популяциях с низким риском инфицирования этим вирусом отрицательного результата EIA или CIA достаточно, чтобы исключить заражение гепатитом C. Но важно помнить, что у пациентов с ВИЧ или последней стадией почечной недостаточности серологические тесты на антитела к ВГС могут давать ложноотрицательные результаты. Если тест выявил антитела или допускается возможность ложноотрицательного результата, в организме пациента должны искать РНК самогό вируса.
Определение статуса инфекции ВГС, решение о лечении и мониторинг ответа на него зависят от трех важных факторов: обнаружения РНК вируса гепатита С, ее количества и вирусного генотипа. Для оценки всех этих параметров есть несколько коммерческих тест-систем. Они различаются по диапазону обнаружения, чувствительности, специфичности, стоимости и сложности использования.
Выявление РНК вируса гепатита С основано на принципе амплификации нуклеиновых кислот [32], причем применяют здесь комбинацию разновидностей полимеразной цепной реакции (ПЦР): качественную ПЦР, опосредованную транскрипцией амплификацию (ТМА) и количественную ПЦР в реальном времени.
Генотипирование ВГС необходимо для назначения оптимальной схемы лечения. Генотип этого вируса можно определить несколькими методами, нацеленными на гены вирусных белков (E1, NS4 и NS5) и на 5′-нетранслируемую область (5′-UTR) генома ВГС. Они включают простую ПЦР, гибридизацию с генотип-специфичными зондами и ПЦР в реальном времени. Однако для более точного определения вирусного генотипа следует прибегать к методам секвенирования нового поколения (NGS) [33].
Наш проект HaploSense
Как мы уже поняли, определять генотипы сложно, поскольку практически нет быстрых и доступных тестов. Наша команда студентов и аспирантов под названием Moscow 2020 решила изменить эту ситуацию.
На международном конкурсе iGEM в этом году мы представили проект детектора генотипов вируса гепатита С. В основе детекции лежит система CRISPR-Cas, с которой многие читатели уже знакомы [34], [35], а принцип работы напоминает популярные методы детекции SHERLOCK (Specific High sensitivity Enzymatic Reporter unLOCKing) и DETECTR (DNA Endonuclease Targeted CRISPR Trans Reporter) [35]. Но есть и важные отличия, о которых сейчас расскажем.
В своей тест-системе мы использовали самый маленький из открытых к этому моменту Cas-белков — CasX (или Cas12e) из Deltaproteobacteria: он состоит из 980 аминокислотных остатков по сравнению с 1300 у Cas9 [36]. Как и Cas13a с Cas12a, маленький CasX обладает коллатеральной нуклеазной активностью (может неспецифически резать нуклеотидные последовательности, с которыми встретится после связывания с мишенью): она позволяет разрезать олигонуклеотиды с флуоресцентными метками после прикрепления белка к геному вируса. Но ВГС — РНК-содержащий вирус, поэтому для связывания с ним CasX нужно провести дополнительную реакцию: с помощью обратной транскрипции получить комплементарную последовательность ДНК.
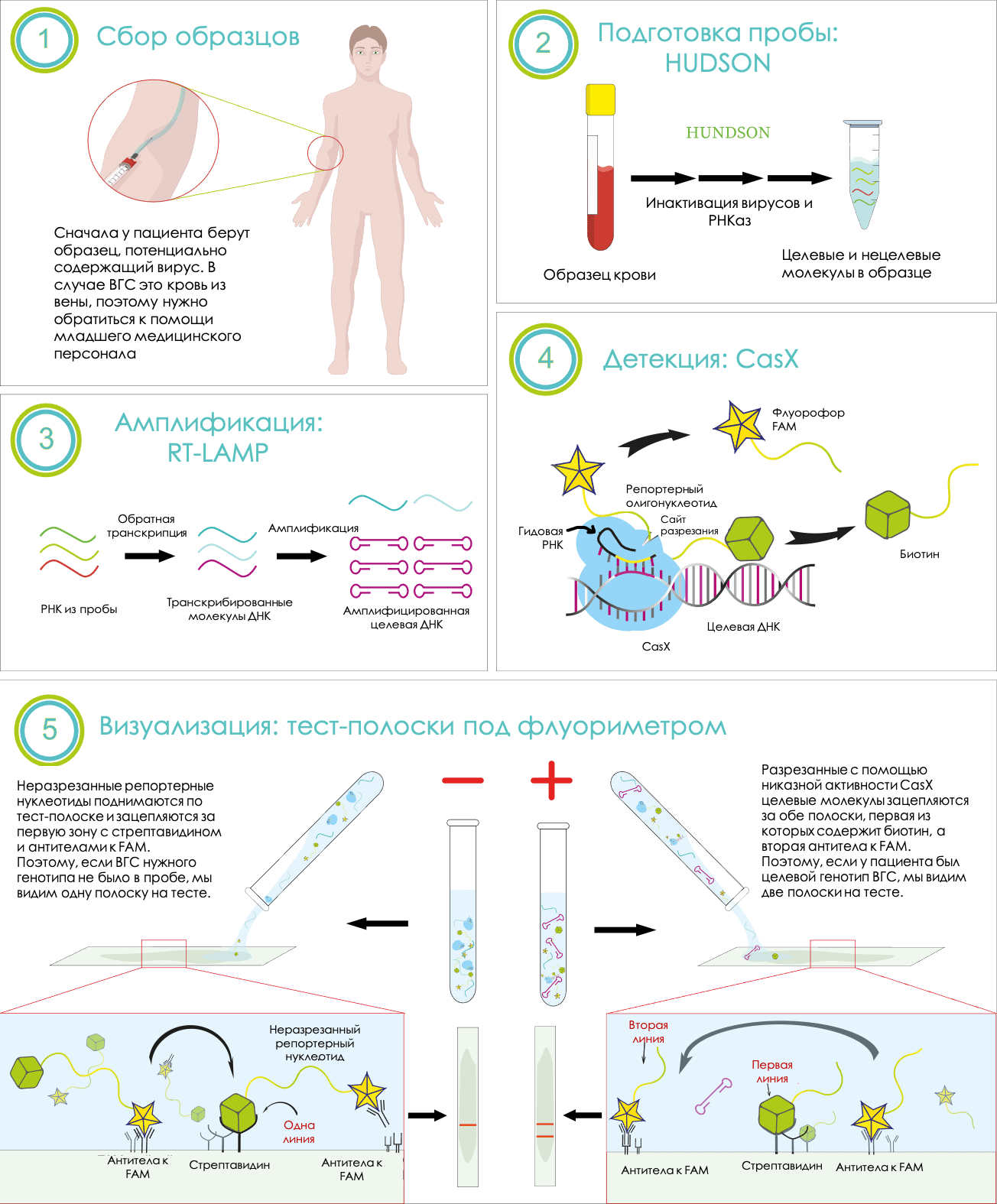
Итак, в нашей системе четыре основные стадии (рис. 4):
Пока наша тест-система предполагает определение только одного генетического варианта ВГС — рекомбинантного RF2k/1b, распространенного в России. В 2020 году доступ в лабораторию для нас был закрыт, поэтому систему предстоит еще собрать и протестировать. Если все лабораторные испытания пройдут успешно, мы планируем расширить специфичность системы на все генотипы вируса, не умножая при этом количество приборов.
Рисунок 4. Схема детекции генотипов ВГС с помощью HaploSense
Такая на первый взгляд сложная система позволит определять генотип возбудителя гепатита С быстрее, вне специально оборудованной лаборатории и с не меньшей точностью, чем ПЦР. Мы надеемся, что когда-нибудь такой подход поможет сделать тестирование массовым и доступным.
Подробнее о iGEM
В 2020 году команда студентов с биологического факультета МГУ представила свою разработку на самом престижном международном конкурсе по синтетической биологии — The International Genetically Engineered Machines competition (iGEM). С английского название переводится как «Международное соревнование генно-инженерных машин». Это соревнование учредили в 2003 году в Массачусетском технологическом институте (Бостон, США). Школьники, студенты и аспиранты со всего мира и с разным академическим бэкграундом, начиная от журналистов и экономистов и заканчивая айтишниками и биологами, собираются в команды, в течение года работают над актуальной задачей и представляют свои проекты на осенней, финальной конференции Giant Jamboree. Конкурс iGEM уникален тем, что формирует открытое сообщество людей, которые обмениваются друг с другом и миром своими наработками. Выгодно отличают конкурс также комплексность и разноплановость проектов: упор делается на применение инженерных принципов и подходов, использование методов моделирования, обсуждение и проработку проекта с потенциальными пользователями и экспертами из разных областей (науки, бизнеса, права, государственного управления и т.д.). Образовательная деятельность, популяризация наук, налаживание между учеными и обществом мостов с целью обсуждения актуальных проблем — все это тоже входит в задачи команды. В этом году из-за пандемии конкурс проходил онлайн. Ядро нашей команды составляли студенты биологического факультета МГУ, которые получили бесценный опыт и выиграли золотую медаль. Однако подробнее об iGEM мы поговорим с вами в следующий раз [39].
Работа в команде
В конце марта 2020 года команда Moscow 2019 собрала новый состав для участия в конкурсе iGEM (рис. 5). Тогда впервые встретились незнакомые друг другу люди с общим желанием — создать проект в области синтетической биологии, который мог бы что-то изменить в мире.
Идея нашего проекта появилась только спустя полтора месяца, в начале мая. iGEM предлагает полную тематическую свободу: можно делать хлеб из дрожжей на Марсе, очищать воду бактериями, синтезировать натуральную краску для волос или разрабатывать системы мониторинга заболеваний. На выбор темы для нашего проекта сильно повлиял руководитель команды, Алексей Константинович Шайтан. Его лаборатория использует в работе системы CRISPR-Cas, а на их основе можно создавать детекторы заболеваний. Пандемия COVID-19 только начиналась, но уже было ясно, что SARS-CoV-2 необходимо выявлять быстро, массово и с высокой точностью. Так мы и создали наш проект — с целью детектировать генотипы коронавируса.
Очень важное требование конкурса — актуальность разработки. Другими словами, важно было понять, что наш проект нужен людям и его будут использовать. Этим проекты iGEM сильно отличаются от рутинной работы научных лабораторий. Именно поэтому мы встречались с экспертами, писали письма главному эпидемиологу Министерства здравоохранения, Николаю Ивановичу Брико, размещали посты в социальных сетях. Обратная связь полностью изменила наш проект: HaploSense переориентировался на детекцию генотипов вируса гепатита С.
С другой стороны, важен был сам детектор — как он будет работать, выглядеть, сможем ли мы его вообще собрать. Здесь нам на помощь пришел спонсор, компания BIOCAD. Эксперты компании консультировали нас относительно идеи проекта и ее реализуемости в столь короткие сроки. Они рассказали нам, как готовить патенты и выводить продукт на рынок. А это далеко не простые процессы.
В результате мы проанализировали гору тематической литературы, смогли придумать целостную систему на основе технологий CRISPR-Cas, провели ее моделирование и биоинформатический анализ.
Надо сказать, что организаторы iGEM помогают командам на протяжении всего пути: устраивают семинары, знакомят со специалистами, создают удобные платформы. А особенно поддерживают взаимодействие между командами. Все полгода мы общались и встречались с мотивированными ребятами из Америки, Эстонии, Индии, Франции, Германии и России (в этом году в конкурсе участвовали две команды из нашей страны). После таких встреч мы понимали, что можем сделать хороший, качественный проект, даже будучи студентами.
Рисунок 5. Команда iGEM Moscow 2020
Пандемия, конечно, сыграла свою роль в работе нашей команды: мы работали дистанционно и встречались друг с другом офлайн всего четыре раза. По-настоящему сплоченными мы стали, когда приблизились конкурсные дедлайны. Мы уложились в срок благодаря слаженной работе команды. Одному человеку было бы невозможно справиться: кроме разработки идеи проекта, моделирования и проведения экспериментов нам предстояло сделать сайт с описанием проекта, два видео о команде и работе, заполнить форму безопасности, написать обзор по теме, да и это еще не все. Именно поэтому проект iGEM — прежде всего командная работа.
Итоги конкурса подводятся осенью, в начале ноября, на Giant Jamboree — огромной конференции, где команды, профессора, лекторы и судьи собираются, чтобы обсудить проекты, подметить их сильные и слабые стороны, сформировать новые коллаборации и просто хорошо провести время. Это финал iGEM: проекты уже подготовлены, критерии конкурса соблюдены. Казалось бы, можно выдохнуть… Но здесь же команды встречаются с судьями — исследователями, которые будут оценивать проекты и детально их рецензировать. Мы, конечно, тоже общались с судьями (в этом году онлайн): в воскресенье, в 17:00, нас спрашивали, почему мы использовали LAMP, сколько тест-полосок будем применять, ну и много чего другого. А после нашу команду ждала неделя, полная лекций по синтетической биологии и общения с коллегами со всего мира, а также викторины по синтетической биологии и церемония награждения. В итоге мы выиграли золотую медаль и создали хороший проект, который продолжим развивать и, надеемся, доведем до состояния полноценной тест-системы, подходящей для обычных поликлиник.
Мы советуем всем молодым исследователям принимать участие в iGEM. Этот конкурс стал для нас лучшим событием 2020 года. Создать проект с нуля возможно, нужно только желание!