Мышечные релаксанты что это
Миорелаксанты – лекарственные препараты для снижения мышечного тонуса
Миорелаксанты – лекарственные препараты, расслабляющие поперечнополосатую мускулатуру человека. Миорелаксанты – препараты, которые снижают тонус скелетных мышц, уменьшая при этом двигательную активность человека, вплоть до полного его обездвиживания. До определенного времени они широко применялись исключительно в анестезиологической практике для снятия мышечного тонуса во время операций. Сегодня сфера применения миорелаксантов в медицине и эстетической косметологии существенно расширилась.
Виды миорелаксантов
По механизму воздействия различают два основных вида миорелаксантов:
Центральные миорелаксанты – лекарственные средства, угнетающие центральные структуры мышечного тонуса. Эти химические вещества оказывают прямое влияние на отделы ЦНС, головной и спинной мозг, принимающие участие в регуляции тонуса мышц.
Периферические миорелаксанты – средства, внедряющиеся в непосредственную нервно-мышечную передачу. Эти лекарства расслабляют произвольную мускулатуру, блокируя сигнал, идущий с двигательного нерва на мышцу.
Принцип действия и сфера применения миорелаксантов
По химическому строению миорелаксанты центрального действия можно подразделить следующим образом:
Центральные миорелаксанты блокируют полисинаптические рефлексы, путем угнетения активности вставочных нейронов спинного мозга, при этом они практически не влияют на моносинаптические рефлекторные действия. Наряду с центральным расслабляющим эффектом, миорелаксанты наделены и другими видами воздействия, благодаря чему их широко применяют в медицинской практике:
Периферические миорелаксанты подразделяются:
Все они оказывают свое влияние на холинорецепторы скелетных мышц, поэтому их применяют для локальной релаксации мышечной ткани, а также уменьшения болевого синдрома и спазмов мышц. Они мягко снимают мышечный тонус при микрохирургических вмешательствах и репозиции костных фрагментов, облегчают проведение интубации трахеи. Миорелаксанты периферического механизма воздействия создают условия иммобилизации при выправлении вывихов и в медикаментозной терапии растяжений, во время эндоскопических манипуляций и искусственной гипотермии.
Возможные последствия миорелаксантов
Оказывая существенное влияние на ЦНС, миорелаксанты могут стать причиной следующих последствий для человеческого здоровья и самочувствия:
Длительный прием миорелаксирующих препаратов ведет к привыканию и лекарственной зависимости от них. Данная группа медикаментов не рекомендована к приему лицам, чей род деятельности связан с концентрацией внимания и высокой реакцией, а также детям и подросткам.
Миорелаксанты должны применяться только по назначению врача, с большой осторожностью при наличии противопоказаний и непереносимости некоторых компонентов, а также при хронических и тяжелых заболеваниях. Оценку эффективности данных препаратов, взаимодействие с другими лекарствами и корректировку их доз тоже должен осуществлять квалифицированный врач-специалист.
Грамотное назначение миорелаксантов уменьшает риск возникновения возможных последствий для человеческого организма. По причине частых осложнений данных лекарственных средств в клинической практике преимущественно используются препараты короткого миорелаксирующего действия.
ВНИМАНИЕ! Цены актуальны только при оформлении заказа в электронной медицинской информационной системе Аптека 911. Цены на товары при покупке непосредственно в аптечных заведениях-партнерах могут отличаться от указанных на сайте!
Мышечные релаксанты что это
По мере развития медицины возникла необходимость искусственно вызывать вялый паралич скелетных мышц. Он необходим при искусственной вентиляции легких (ИВЛ). Длительную анестезию невозможно больше представить без расслабления мышц и вентиляции легких. Функцию концевой пластинки двигательного нерва можно обратимо нарушить на уровне рецепторов по двум механизмам.
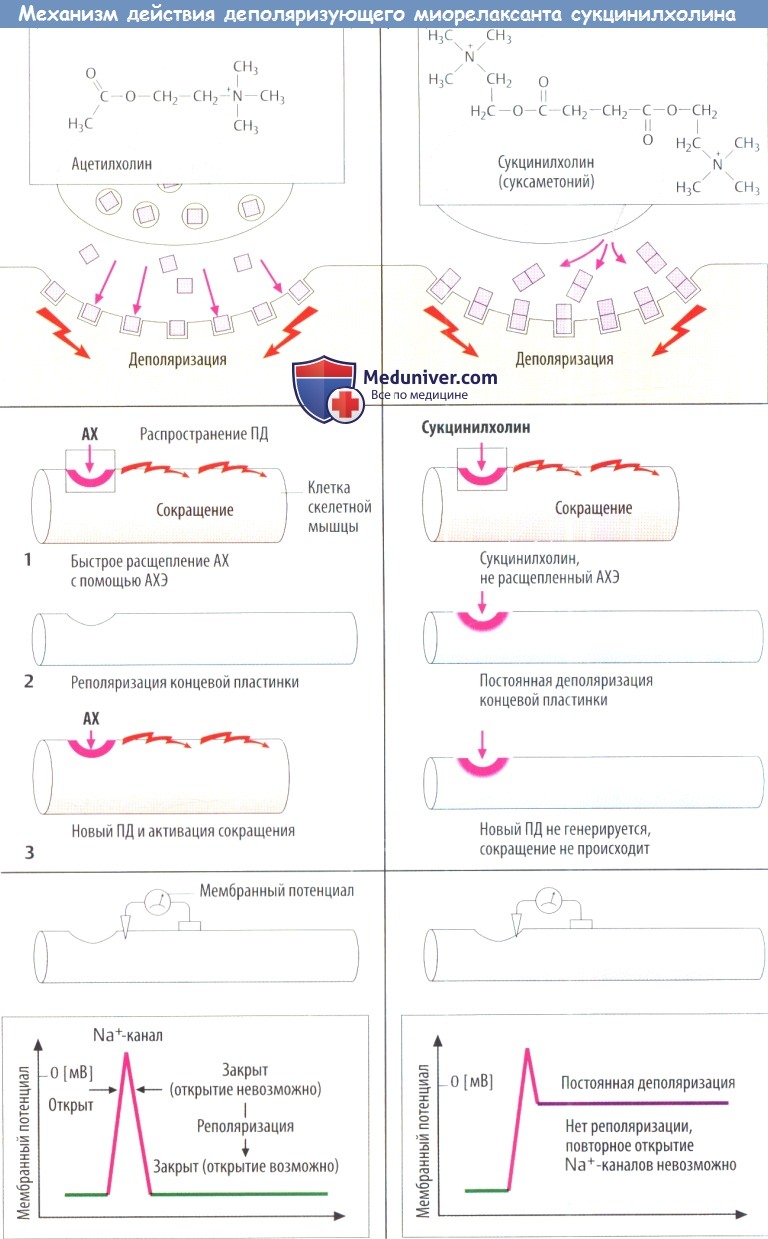
Первый механизм заключается в том, что агонист после связывания с рецептором вызывает одиночный ПД в прилежащей мембране, но остается связанным, тем самым сохраняя деполяризацию концевой пластинки двигательного нерва. По такому механизму действуют деполяризующие миорелаксанты. Ко второй группе относятся недеполяризующие миорелаксанты, которые действуют как антагонисты АХ-рецепторов.
а) Деполяризующие миорелаксанты. Простейшее химическое вещество, которое парализует мышцы, вызывая длительную деполяризацию, — декаметоний:
По химическому строению представляет собой углеводородную цепь с двумя положительно заряженными атомами азота, расположенными на расстоянии 1 нм друг от друга. Метаболически стабильный декаметоний использовался в анестезии, но из-за неудовлетворительных фармакокинетических характеристик его применение прекращено. Он имеет типичную структуру для всех миорелаксантов. Такую же структуру имеет и суксаметоний (сукцинилдихолин).
Структура сукцинилхолина — две молекулы АХ. Он имеет сродство к N-холинорецептору, но не разрушается специфической АХЭ. Неспецифическая сывороточная холинэстераза расщепляет сукцинилхолин медленно,поэтому активная концентрация сохраняется в синаптической щели в течение 5-10 мин (для сравнения: продолжительность действия АХ 1-2 мс).
Побочные эффекты сукцинилхолина — повышение концентрации К + в сыворотке, что может привести к нарушению функции сердца, подъему АД и тахикардии вследствие ганглионарной стимуляции. Сукцинилхолин стимулирует сокращение тонических волокон наружных мышц глаза и повышает внутриглазное давление.
Поэтому сукцинилхолин нельзя применять перед операциями на глазном яблоке. Кроме того, в хронически денервированных мышцах развиваются контрактуры, т. к. после повреждения двигательного нерва на неповрежденной поверхности денервированной скелетной мышцы появляются АХ-рецепторы. Подобная контрактура в сочетании с потерей К + может наблюдаться у пациентов, которым выполняют корректирующую операцию через определенное время послетравмы.
К преимуществам сукцинилхолина относится его очень быстрое начало действия. В последнее время созданы быстродействующие недеполяризующие миорелаксанты, поэтому использование сукцинилхолина сократилось. Сукцинилхолин служит основным миорелаксантом для экстренной интубации.
Деполяризация концевой пластинки двигательного нерва вызывает образование распространяющегося ПД в мембранах окружающих мышечных клеток, что приводит к сокращению мышечного волокна. Непродолжительное время после в/в инъекции наблюдаются мелкие подергивания мышц.
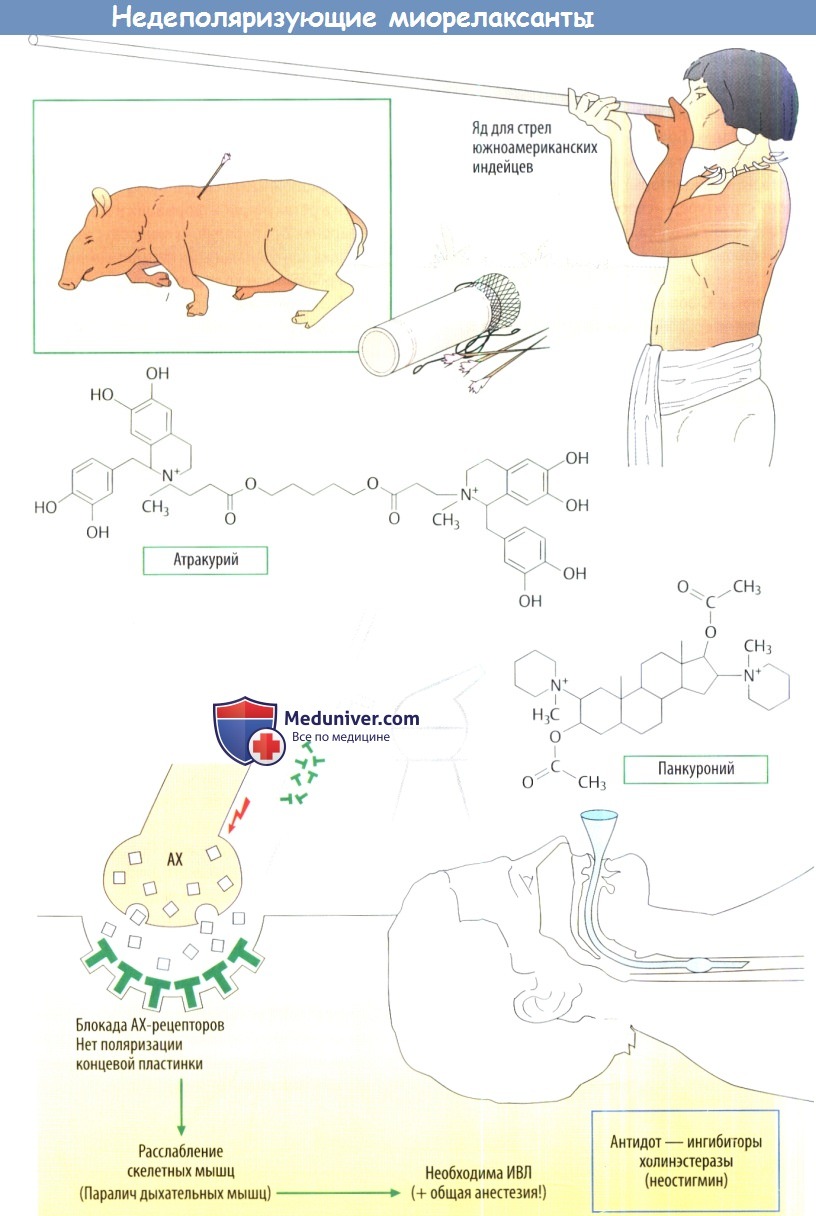
Подобные миорелаксанты имеют более сложную химическую структуру, чем декаметоний. В молекуле недеполяризующих миорелаксантов также имеется два ключевых положительно заряженных атома азота, но они расположены в системе колец. Эти два азотсодержащих кольца соединены либо длинной алифатической цепью, либо стероидной структурой. Формулы двух синтетических миорелаксантов показаны на рис. А. Эти крупные молекулы имеют высокое сродство к N-холинорецепторам, но не обладают собственной активностью, т. е. это чистые антагонисты.
Компонент яда кураре, D-тубокурарин, больше не используется в анестезии из-за неприемлемых побочных эффектов: высвобождение гистамина с падением АД, бронхоспазм и повышение секреции в бронхиальном древе. Также наблюдается ганглиоблокирующий эффект. Новыесинтетические миорелаксанты переносятся лучше. Они различаются по своим фармакокинетическим свойствам, например скорости начала и продолжительности действия.
В хирургии используются следующие препараты: панкуроний (длительного действия), векуроний (среднего действия), мивакурий (короткого действия), рокуроний (быстрое начало действия) и атракурий (расщепляется самопроизвольно после введения и не требует метаболической деградации, что важно для пациентов с заболеваниями печени).
Продолжительность действия недеполяризующих миорелаксантов можно сократить при использовании ингибиторов АХЭ, например неостигмина. АХ, секретируемый концевой пластинкой двигательного нерва, не расщепляется и накапливается в синаптической щели. Отношение антагониста к агонисту смещается в сторону нейромедиатора.
Наконец, следует отметить, что миорелаксанты не проникают в ЦНС. Это означает, что после введения миорелаксантов пациент будет находиться в сознании, однако возможна острая гипоксия вследствие паралича дыхательных мышц. В это время общение с пациентом невозможно из-за паралича всех мышц. При использовании миорелаксантов необходима анестезия и ИВЛ.
Восстановление иннервации происходит за счет роста новой концевой ветви аксона. Этот токсин используется в качестве лекарственного средства. Он вводится в мышцы при лечении болезненных мышечных спазмов, например блефароспазма. Токсин также используется в косметической медицине для модной в настоящее время подтяжки кожи лица.
в) Влияние на сократительную систему. ПД на короткое время деполяризует плазмолемму мышечных клеток, а также распространяется на саркоплазматический ретикулум. Это вызывает высвобождение Са 2+ из саркоплазматического ретикулума, что приводит к укорочению актомиозина. Данный процесс известен как электромеханическое сопряжение. Он ингибируется дантроленом, который используют для лечения болезненных спазмов мышц и злокачественной гипертермии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Выбор фармакологической терапии при спастическом мышечном гипертонусе
Основными препаратами, используемыми для снижения мышечного тонуса, являются миорелаксанты. Рассмотрены вопросы выбора терапии с использованием антиспастических препаратов в зависимости от заболевания, выраженности мышечной спастичности, побочных эффектов
Myorelaxants are the basic preparations used for reduction in the muscular tone. Issues of selection of therapy by anti-spastic preparations depending on the disease, manifestation of muscular spasticity, side effects and special features of the preparation effect are considered.
Основными препаратами, используемыми для снижения мышечного тонуса, являются миорелаксанты. По механизму действия различают миорелаксанты центрального действия (влияют на синаптическую передачу возбуждения в центральной нервной системе) и периферического действия (угнетают прямую возбудимость поперечно-полосатых мышц). При применении миорелаксантов могут возникать достаточно значимые побочные действия, которые при выборе препарата надо тщательно оценивать [1, 2].
При выборе антиспастических препаратов учитывают в основном их способность тормозить полисинаптические рефлексы (уменьшение спастики), оказывая при этом наименьшее влияние на моносинаптические рефлексы (сила мышц). Антиспастический препарат должен уменьшать мышечную спастичность при минимальном снижении мышечной силы [3, 4].
Медикаментозная терапия основана на использовании таблетированных и инъекционных форм. Применяемые внутрь антиспастические средства, уменьшая мышечный тонус, могут улучшить двигательные функции, облегчить уход за обездвиженным пациентом, снять болезненные мышечные спазмы, усилить действие лечебной физкультуры, предупредить развитие контрактур [5]. При легкой степени спастичности применение миорелаксантов может привести к значительному положительному эффекту, однако при выраженной спастичности могут потребоваться большие дозы миорелаксантов, применение которых нередко вызывает нежелательные побочные эффекты. Лечение миорелаксантами начинают с минимальной дозы, затем ее медленно повышают для достижения эффекта [6].
К миoрелаксантам центрального действия, наиболее часто используемым в России для лечения спастического мышечного гипертонуса, относятся баклофен, тизанидин, толперизон, диазепам [7, 8].
Баклофен (Баклосан, Лиорезал) оказывает антиспастическое действие преимущественно на спинальном уровне. Препарат представляет аналог гамма-аминомасляной кислоты (ГАМК), который связывается с пресинаптическими ГАМК-рецепторами, приводя к уменьшению выделения возбуждающих аминокислот (глутамата, аспартата) и подавлению моно- и полисинаптической активности на спинальном уровне, что и вызывает снижение спастичности. Препарат проявляет также умеренное центральное анальгезирующее действие. Баклофен используется при спинальном и церебральном спастическом мышечном гипертонусе различного генеза. Начальная доза составляет 5–15 мг/сут (в один или три приема), затем дозу увеличивают на 5 мг каждый день до получения желаемого эффекта. Препарат принимают во время еды. Максимальная доза баклофена для взрослых составляет 60–75 мг/сут. Побочные эффекты чаще проявляются седацией, сонливостью, снижением концентрации внимания, головокружением и часто ослабевают в процессе лечения. Возможно возникновение тошноты, запоров и диареи, артериальной гипертонии, усиление атаксии, появление парестезий. Требуется осторожность при лечении больных пожилого возраста, пациентов, перенесших инсульт, пациентов с язвенной болезнью желудка и двенадцатиперстной кишки. Баклофен противопоказан при эпилепсии, наличии судорог в анамнезе [9, 10].
При выраженной спастичности, когда обычное пероральное применение антиспастических препаратов не эффективно, показано интратекальное введение баклофена, которое впервые было предложено в 1984 г. R. Penn. Для достижения необходимой концентрации препарата в спинномозговой жидкости необходимо принимать довольно значительные дозы баклофена, что может привести к нарушениям сознания, сонливости, слабости. В связи с этим были разработаны системы, при помощи которых баклофен доставляется непосредственно в подоболочечное пространство спинного мозга при помощи подоболочечной баклофеновой насосной системы. При этом клинического эффекта добиваются гораздо меньшими дозами баклофена, чем при использовании таблетированных форм [11, 12].
Данная система состоит из резервуара, где содержится баклофен или аналогичный препарат, насоса (помпы), при помощи которого препарат дозированно подается в подоболочечное пространство спинного мозга через люмбальный катетер и блока питания. Из резервуара баклофен поступает непосредственно в спинномозговую жидкость, а его дозировка контролируется специальным радиотелеметрическим устройством. Количество поступающего в спинномозговую жидкость лекарственного препарата можно изменять в зависимости от клинической картины. Добавление баклофена в резервуар производится через 2–3 месяца при помощи чрезкожной пункции [13].
Использование баклофеновой помпы улучшает скорость и качество ходьбы больных с нефиксированными рефлекторными контрактурами, обусловленными высокой спастичностью мышц-синергистов и дисбалансом мышц-антагонистов. Имеющийся 15-летний клинический опыт применения баклофена интратекально у больных, перенесших инсульт, свидетельствует о высокой эффективности этого метода в уменьшении не только степени спастичности, но и болевых синдромов и дистонических расстройств. Отмечено положительное влияние баклофеновой помпы на качество жизни больных, перенесших инсульт [14].
Тизанидин (Сирдалуд) — миорелаксант центрального действия, агонист альфа-2-адренергических рецепторов. Препарат снижает спастичность вследствие подавления полисинаптических рефлексов на уровне спинного мозга, что может быть вызвано угнетением высвобождения возбуждающих аминокислот L-глутамата и L-аспартата и активацией глицина, снижающего возбудимость интернейронов спинного мозга. Тизанидин обладает также умеренным центральным анальгетическим действием. Препарат эффективен при церебральной и спинальной спастичности, а также при болезненных мышечных спазмах. Начальная доза препарата составляет 2–6 мг/сут в один или три приема, при индивидуальном подборе увеличение дозы происходит на 3–4 день на 2 мг. При пероральном приеме действие препарата проявляется через 30–45 минут, максимальный эффект наступает в течение 1–2 часов. Средняя терапевтическая доза составляет 12–24 мг/сут, максимальная доза — 36 мг/сут. В качестве побочных эффектов могут возникнуть сонливость, сухость во рту, головокружение и снижение артериального давления, что ограничивает использование препарата при постинсультной спастичности. Антиспастический эффект тизанидина сопоставим с эффектом баклофена, однако тизанидин при адекватном подборе дозировки лучше переносится, т. к. не вызывает общей мышечной слабости и не усиливает мышечную слабость в парализованной конечности [15, 16].
Толперизон (Мидокалм) — антиспастический препарат центрального действия, угнетает каудальную часть ретикулярной формации и обладает Н-холинолитическими свойствами. Толперизон снижает активность спинальных нейронов, участвующих в формировании спастичности, путем ограничения потока натрия через мембрану нервных клеток. Наиболее часто используется по 300–450 мг/сут в два или три приема. Снижение мышечного тонуса при назначении толперизона иногда сопровождается сосудорасширяющим действием, что следует учитывать при назначении больным с тенденцией к артериальной гипотонии. Также препарат может вызывать или усиливать у больных недержание мочи [17].
Основным побочным эффектом баклофена, тизанидина и толперизона является быстрое наступление мышечной слабости, причем в каждом случае врач должен находить баланс между снижением тонуса и усилением слабости. Кривая баланса между снижением спастического тонуса и усилением мышечной слабости у больных на фоне увеличения дозы Мидокалма, Сирдалуда или Баклофена показывает, что наиболее быстрое усиление слабости происходит при приеме Баклофена, а самый мягкий препарат, позволяющий эффективно подобрать индивидуальную дозировку, — Мидокалм. Во всех случаях, учитывая наличие узкого терапевтического окна, курс лечения начинают с небольшой дозы препарата, постепенно наращивая ее до достижения отчетливого антиспастического эффекта, но не до появления слабости [18, 19].
Диазепам (Реаланиум, Релиум, Сибазон) является миорелаксантом, поскольку обладает способностью стимулировать уменьшенное пресинаптическое торможение на спинальном уровне. Он не имеет прямых ГАМК-ергических свойств, увеличивает концентрацию ацетилхолина в мозге и тормозит обратный захват норадреналина и дофамина в синапсах. Это приводит к усилению пресинаптического торможения и проявляется снижением сопротивляемости растяжению, увеличением диапазона движений. Диазепам также обладает способностью уменьшать болевой синдром, вызываемый спазмом мышц. Наряду со снижением мышечного тонуса, развиваются заторможенность, головокружение, нарушение внимания и координации ввиду токсического действия на центральную нервную систему. Это значительно ограничивает применение диазепама в качестве миорелаксанта. Используется он, в основном, для лечения спастичности спинального происхождения при необходимости кратковременного снижения мышечного тонуса. Для лечения спастичности назначают в дозе 5 мг однократно или по 2 мг 2 раза в день. Максимальная суточная доза может составлять 60 мг. При больших дозах могут отмечаться расстройства сознания, преходящая дисфункция печени и изменения крови. Продолжительность лечения ограничена из-за возможного развития лекарственной зависимости [20].
Клоназепам является производным бензодиазепина. Клоназепам оказывает успокаивающее, центральное миорелаксирующее, анксиолитическое действие. Миорелаксирующий эффект достигается за счет усиления ингибирующего действия ГАМК на передачу нервных импульсов, стимуляции бензодиазепиновых рецепторов, расположенных в аллостерическом центре постсинаптических ГАМК-рецепторов восходящей активирующей ретикулярной формации ствола головного мозга и вставочных нейронов боковых рогов спинного мозга, а также уменьшения возбудимости подкорковых структур головного мозга и торможения полисинаптических спинальных рефлексов.
Быстрое наступление сонливости, головокружения и привыкания ограничивает применение этого препарата. Для снижения проявления возможных побочных реакций, достигать терапевтической дозы необходимо путем медленного титрования в течение двух недель. Для приема внутрь взрослым рекомендуется начальная доза не более 1 мг/сут. Поддерживающая доза — 4–8 мг/сут. Возможно назначение небольших доз в сочетании с другими миорелаксантами. Клоназепам эффективен при пароксизмальных повышениях мышечного тонуса. Противопоказан при острых заболеваниях печени, почек, миастении [21].
Дикалия клоразепат (Транксен) — аналог бензодиазепина, трансформируется в главный метаболит диазепама, обладает большей активностью и длительностью антиспастического действия, чем диазепам. Отмечен его хороший эффект при лечении в виде уменьшения фазических рефлексов на растяжение, обладает незначительным седативным эффектом. Первоначальная доза составляет 5 мг 4 раза в сутки, затем уменьшается до 5 мг 2 раза в сутки [22].
Дантролен — производное имидазолина, действует вне центральной нервной системы, преимущественно на уровне мышечных волокон. Механизм действия дантролена — блокирование высвобождения кальция из саркоплазматического ретикулума, что ведет к снижению степени сократимости скелетных мышц, редукции мышечного тонуса и фазических рефлексов, увеличению диапазона пассивных движений. Важным преимуществом дантролена по отношению к другим миорелаксантам является его доказанная эффективность в отношении спастичности не только спинального, но и церебрального генеза. Начальная доза — 25 мг/сут, при переносимости дозу увеличивают в течение 4 недель до 400 мг/сут. Побочные эффекты — сонливость, головокружение, тошнота, диарея, снижение скорости клубочковой фильтрации. Серьезную опасность, особенно у пожилых пациентов в дозе более 200 мг/сут, представляет гепатотоксическое действие, поэтому в период лечения надо регулярно следить за функцией печени. Элиминация дантролена на 50% осуществляется за счет печеночного метаболизма, в связи с этим он противопоказан при заболеваниях печени. Осторожность следует соблюдать и при тяжелых сердечных или легочных заболеваниях.
Катапресан — применяется в основном при спинальных повреждениях, действует на альфа-2-агонисты головного мозга, обладает пресинаптическим торможением. Из побочных эффектов отмечаются снижение артериального давления и депрессия. Первоночальная доза — 0,05 мг 2 раза в день, максимальная — 0,1 мг 4 раза в день.
Темазепам — взаимодействует с бензодиазепиновыми рецепторами аллостерического центра постсинаптических ГАМК-рецепторов, расположенных в лимбической системе, восходящей активирующей ретикулярной формации, гиппокампе, вставочных нейронах боковых рогов спинного мозга. В результате открываются каналы для входящих токов ионов хлора и таким образом потенцируется действие эндогенного тормозного медиатора — ГАМК. Рекомендуемая доза — 10 мг 3 раза в день. Эффективно его сочетание с баклофеном [23, 24].
Основные лекарственные средства, используемые для лечения спастического мышечного гипертонуса, представлены в табл.
Таким образом, выбор препарата определяется основным заболеванием, выраженностью мышечной спастичности, а также побочными эффектами и особенностями действия конкретного препарата.
Так, например, тизанидин и баклофен в большей степени действуют на тонус мышц-разгибателей, поэтому в случаях наличия значительного гипертонуса мышц-сгибателей руки, легкой спастичности мышц ноги их прием не показан, поскольку легкое повышение тонуса мышц-разгибателей ноги компенсирует мышечную слабость в ноге и стабилизирует походку больного. В таком случае средством выбора являются методы физического воздействия на мышцы верхней конечности.
При лечении церебральной спастичности наиболее часто применяют Сирдалуд, а при спинальной спастичности — Сирдалуд и Баклофен. Важным преимуществом перед другими миорелаксантами обладает Мидокалм, который не оказывает седативного эффекта и имеет благоприятный спектр переносимости, поэтому является препаратом выбора для лечения в амбулаторных условиях и для лечения пожилого контингента пациентов.
Допустима комбинация нескольких средств, что позволяет эффективно снижать тонус на меньших дозах каждого из препаратов. Сочетание препаратов с разными точками приложения, начиная от центров в головном мозге и до мышц, может привести к суммированию терапевтического эффекта.
Эффективность пероральных антиспастических препаратов снижается при их длительном использовании, часто возникает необходимость возрастающего повышения дозировок для поддержания начального клинического эффекта, что сопровождается увеличением частоты и тяжести побочных реакций [25–27].
В ситуации, когда спастичность носит локальный характер и системный эффект пероральных миорелаксантов нежелателен, предпочтительны локальные методы воздействия, одним из которых является локальное введение ботулотоксина [28, 29].
Литература
А. А. Королев, кандидат медицинских наук
ФГБУ «Всероссийский центр экстренной и радиационной медицины им. А. М. Никифорова» МЧС России, Санкт-Петербург









_575.gif)