Н2о что это такое
Вода: физические, химические свойства, химическая формула, плотность
Содержание:
Вода, или оксид (окись) водорода Н2О – важнейшая среда, в которой проходят все химико-биологические реакции. На 65-70 % организмы животных и человека состоят из воды. Ее содержание в растениях еще выше – 90 %. Вода – это основа жизни.
Строение воды
Кислород – электроотрицательный элемент, к которому смещены общие электронные пары. На кислороде возникает частично отрицательный заряд, а на водороде – частично положительный. Вода – электрический диполь. Многие свойства воды обусловлены ее полярностью.
Молекулы воды между собой образовывают водородные связи, которые объясняют высокую плотность и температуру кипения. Чем выше температура реакции, тем меньшее количество связей образуется.
Физические свойства воды
Лед всегда всплывает в водоемах или стаканах с водой. Это связано с тем, что плотность горячей и холодной воды отличается. Лед обладает меньшей плотностью, чем жидкая вода.
Воде свойственна высокая теплоемкость, поэтому она медленно нагревается и остывает. С помощью теплофизических свойств воды регулируется климат. Водные бассейны регулируют температуру на нашей планете. Вода задерживает до 60 % теплового излучения нашей планеты, не позволяя ей охлаждаться.
Теплопроводность воды небольшая. Вода в водоемах нагревается не с помощью молекулярной теплопроводности, а путем перемешивания с помощью волн и течений. Если вода не перемешивается, то она нагревается частями и образуется термическая слоистость (стратификация).
Физсвойства воды отражаются в агрегатных состояниях:
В химии физические свойства воды отражаются в количестве связей между молекулами. В парах находятся отдельные молекулы, в жидкостях между ними образуются водородные связи. Если вода находится в состоянии льда, то каждая молекула соединена с соседними молекулами с помощью четырех водородных связей.
Растворимость веществ в воде
Большинство твердых веществ при нагревании растворяется быстрее. Растворимость газов повышается при понижении температуры и повышении давления.
Растворение многих веществ в воде сопровождается образованием оболочки из молекул воды. Данный комплекс называется гидратом. После кристаллизации в составе таких комплексов сохраняется часть молекул воды, образуя кристаллогидрат:
Растворы
Химические свойства воды
Вода – важнейший компонент такой реакции как гидролиз. Гидролиз – взаимодействие соли с водой, в результате которого происходит ионный обмен между молекулами.
Очистка воды
В питьевой воде не должны содержаться примеси и болезнетворные бактерии. Чтобы вода из озер и рек была пригодна для питья, ей дают отстояться в специальных бассейнах. Затем ее фильтруют через слой песка. Очищенную от нерастворимых веществ воду обрабатывают хлором, озоном или ультрафиолетовыми лучами.
Для очищения воды от растворенных в ней веществ используют перегонку, или дистилляцию. Этим способом получают дистиллированную воду. Ее применяют в лабораториях, аптеках, охладительных системах машин и т. д.
Применение воды
Развитие промышленности привело к тому, что многие водоемы загрязнены отходами производства. Поэтому в каждом государстве должны приниматься меры по охране и рациональному использованию природных ресурсов.
Вода – важный ресурс для всего живого на планете. Если ее запасы на Земле иссякнут, то растения, животные и человек погибнут. Вода является более ценным природным богатством, чем нефть и газ, железо и уголь и т. д. Это связано с тем, что воду невозможно ничем заменить.
Н2о что это такое
Вода (оксид водорода) — бинарное неорганическое соединение с химической формулой H 2 O : молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях).
Вода является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии, возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле.
Всего на Земле около 1400 млн кубических километров воды. Вода покрывает 71 % поверхности земного шара (океаны, моря, озёра, реки, льды — 361,13 млн квадратных километров). Бо́льшая часть земной воды (97,54 %) принадлежит Мировому океану — это солёная вода, непригодная для сельского хозяйства и питья. Пресная же вода находится в основном в ледниках (1,81 %) и подземных водах (около 0,63 %), и лишь небольшая часть (0,009 %) в реках и озерах. Материковые солёные воды составляют 0,007 %, в атмосфере содержится 0,001 % от всей воды нашей планеты.
Содержание
Химические названия
С формальной точки зрения вода имеет несколько различных корректных химических названий:
Образование воды
Известно, что 2 объема водорода взаимодействуют с 1 объемом кислорода с образованием воды. При реакции выделяется большое количество тепла, как и при горении свечи. Продукт реакции — вода — не похожа на исходные вещества — водород и кислород. Следовательно, превращение, происходящее при взаимодействии водорода и кислорода, должно быть отнесено к химическим реакциям.
В соответствии с атомно-молекулярной теорией мы начинаем рассуждение, предполагая, что в реакции участвуют молекулы H2 и O2. В результате реакции образуются молекулы воды. Связи между атомами в реагирующих веществах разрываются и атомы перегруппировываются. При этом возникают новые связи в молекулах продукта реакции. Эти превращения легко представить с помощью молекулярных моделей. Молекулярную модель можно представить как две молекулы H2 (четыре атома) и одна молекула O2 (два атома). Если эти молекулы будут реагировать с образованием воды, то связи между атомами в молекулах водорода и кислорода должны разорваться. Затем «завязываются» новые связи и образуются две молекулы воды. Отметим, что в результате реакции происходит перегруппировка атомов, но общее число атомов при этом не изменяется.
Пример образования молекул воды
Один миллион молекул кислорода реагирует с достаточно большим количеством молекул водорода с образованием воды. Сколько молекул воды образуется? Сколько молекул водорода требуется для этой реакции?
Для получения 100 молекул воды расходуется 100 молекул водорода и 50 молекул кислорода. Таким образом, для получения 1 моля воды (6,02 · 10 23 молекул) нам потребуется 1 моль водорода (6,02 · 10 23 молекул) и 0,5 моля кислорода (3,01 · 10 23 молекул). Результаты приведены в таблице:
| Водород | Кислород | Вода | |
|---|---|---|---|
| Число молекул | 2 | 1 | 2 |
| 4 | 2 | 4 | |
| 100 | 50 | 100 | |
| 6,02 · 10 23 | 3,01 · 10 23 | 6,02 · 10 23 | |
| Число молей | 1 | 0,5 | 1 |
| 2 | 1 | 2 | |
| 10 | 5 | 10 |
Если реагируют 1 моль чистого водорода и 0,5 моля чистого кислорода, образуется 1 моль воды. Количество тепла, выделяющееся при образовании 1 моля воды, равно 68000 кал. Если же мы возьмем только 0,025 моля чистого водорода, то потребуется 0,5 · 0,025 моля кислорода. При этом образуется 0,025 моля воды. Если получено только 0,025 моля воды, то выделяется лишь 0,025 · 68 000 = 1700 кал тепла.
Источником этой тепловой энергии должны быть сами реагирующие вещества (водород и кислород), так как к системе извне подводится только тепло, необходимое для поджигания смеси. Отсюда можно сделать вывод, что вода содержит меньше энергии, чем реагирующие вещества, используемые для ее получения. Реакция, при которой выделяется тепло, называется экзотермической. Количество тепла, выделяющееся при сгорании 1 моля водорода (68 000 кал, или 68 ккал), называется молярной теплотой сгорания водорода.
Свойства
Физические свойства
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (H2S, CH4, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С.
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| Температура, °С | Удельная теплоёмкость воды, кДж/(кг*К) |
|---|---|
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах:
| Модификация воды | Максимальная плотность при температуре, °С | Тройная точка при температуре, °С |
|---|---|---|
| H2O | 3,9834 | 0,01 |
| D2O | 11,2 | 3,82 |
| T2O | 13,4 | 4,49 |
| H2 18 O | 4,3 | 0,31 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния
По состоянию различают:
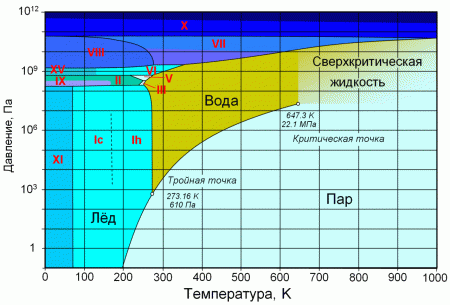
При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт:
| Давление, атм. | Температура кипения (Ткип), °C |
|---|---|
| 0,987 (10 5 Па — нормальные условия) | 99,63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Оптические свойства
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (H2O 17 и H2O 18 ) содержится больше, чем воды D2O 16 : их содержание, соответственно, 1,8 кг и 0,15 кг на тонну.
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней.
По стабильным изотопам кислорода 16 O, 17 O и 18 O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Её иногда рассматривают как амфолит — и кислоту и основание одновременно (катион H + анион OH − ). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Воду можно получать:
Под воздействием очень высоких температур или электрического тока (при электролизе), а также под воздействием ионизирующего излучения, как установил в 1902 году Фридрих Гизель при исследовании водного раствора бромида радия, вода разлагается на молекулярный кислород и молекулярный водород:
Вода реагирует при комнатной температуре:
Вода реагирует при нагревании:
Вода реагирует в присутствии катализатора:
Волновая функция основного состояния воды
Вода на Земле может существовать в трёх основных состояниях:
Вода может приобретать различные формы, которые могут одновременно соседствовать и взаимодействовать друг с другом:
Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды как источника жизни, её нередко подразделяют на типы по различным принципам.
Виды воды по особенностям происхождения, состава или применения:
Вода, входящая в состав другого вещества и связанная с ним физическими связями, называется влагой. В зависимости от вида связи, выделяют:
Вещество, содержащее влагу, называют влажным веществом. Влажное вещество, не способное более сорбировать (поглощать) влагу, — насыщенное влагой вещество.
Вещество, в котором содержание влаги пренебрежимо мало при данном конкретном применении, называют сухим веществом. Гипотетическое вещество, совершенно не содержащее влагу, — абсолютно сухое вещество. Сухое вещество, составляющее основу данного влажного вещества, называют сухой частью влажного вещества.
Смесь газа с водяным паром носит название влажный газ (парогазовая смесь — устаревшее название).
В природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая — криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, ледники — 1,81 %, подземные воды — около 0,63 %, реки и озера — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %.
Атмосферные осадки
Вода за пределами Земли
Вода — чрезвычайно распространённое вещество в космосе, однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не стоит, впрочем, забывать, что не любая водная среда пригодна для жизни.
В результате бомбардировки лунного кратера, проведённой 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах.
Вода широко распространена в Солнечной системе. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе, Тефии, Европе, Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.
Вода в виде паров содержится в атмосфере Солнца (следы), атмосферах Меркурия (3,4 %, также большие количества воды обнаружены в экзосфере Меркурия), Венеры (0,002 %), Луны, Марса (0,03 %), Юпитера (0,0004 %), Европы, Сатурна, Урана (следы) и Нептуна (найден в нижних слоях атмосферы).
Содержание водяного пара в атмосфере Земли у поверхности колеблется от 3—4 % в тропиках до 2·10 −5 % в Антарктиде.
Кроме того, вода обнаружена на экзопланетах, например HD 189733 A b, HD 209458 b и GJ 1214 b.
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет — наиболее вероятно, на Европе — спутнике Юпитера.
Биологическая роль
Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа (тритоны) переносят замораживание/оттаивание — считается что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании.
Применение
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90 % в некоторых странах.
Для питья и приготовления пищи
Живое человеческое тело содержит от 50 % до 75 % воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья.
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
В качестве теплоносителя
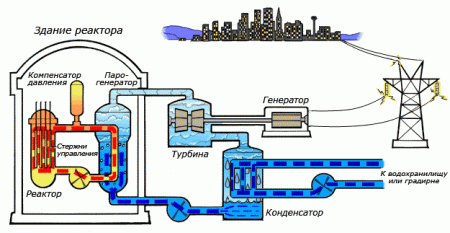
Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в виде льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Во многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжеловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены, так как горение поддерживается только при достаточном поступлении кислорода.
Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон, шорт-трек и др.
В качестве инструмента
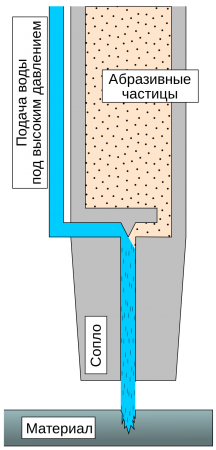
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках.
Исследования
Происхождение воды на планете
Происхождение воды на Земле является предметом научных споров. Некоторые учёные считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырёх миллиардов лет назад, когда планета уже сформировалась в виде шара. В настоящее время установлено, что вода появилась в мантии Земли не позже 2,7 миллиардов лет назад.
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Гидрогеология
Гидрогеоло́гия (от др.-греч. ὕδωρ «водность» + геология) — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования. Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.