На чем нельзя культивировать вирусы
Методы культивирования вирусов



Для выращивания клеточных культур используют питательные среды сложного состава, включающие источники энергии, минеральные вещества, аминокислоты, витамины и другие
 |
факторы роста. Клетки чрезвычайно чувствительны к изменению рН среды. Для контроля рН в среды добавляют индикатор. Большинство клеточных:, культур растет в виде монослоя (пласта, состоящего из одного слоя клетк), прочно прикрепляясь к поверхности контейнера для культивирования — пробирки, пластикового планшета или матрас) (флакон 4-гранной формы). Некоторые типы клеток способы расти также в суспензии.
Приготовление первичной культты клеток включает несколько последовательных этапов: измельчение ткани, разъединение клеток путем трипспозиции отмывание полученной однородной суспензии изолированных клеток от трипсина с последующим суспендированием клеток в питательной среде, обеспечивающей их рост (например, среде 199 с добавлением телячьей сыворотки крови). При оседании клетки довольно прочно прикрепляются к стенке пробирки или флакона, по которой распространяются в виде Монослоя. После получения монослоя жизнеспособной культуры клеток ее заражают материалом, содержащим вирусы. Упомянутые микробы проникают внутрь клеток, где и размножаются. В культурах клеток удается культивировать большинство вирусов, вызывающих заболевания человека.
Внутриклеточные паразиты оказывают цитопатическое действие (ЦПД) на клетки, в которых происходит их репродукция. ЦПД может проявляться деструкцией (лизисом) зараженных клеток, изменением их морфологии (изменением размеров и формы самой клетки, появлением вакуолей или включений, представляющих собой внутриклеточные скопления вирусов, образованием ощцития) и нарушением их функций.
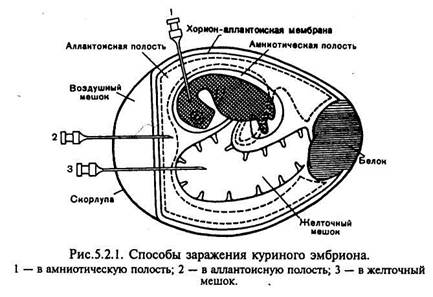
Куриные эмбрионы. Куриные эмбрионы по сравнению с культурами клеток значительно реже бывают контаминированы вирусами, а также обладают сравнительно высокой жизнеспособностью и устойчивостью к различным воздействиям. Они пригодны для некоторых вирусов, патогенных для человека.
Для получения чистых культур риккетсий, хламидий и ряда вирусов в диагностических целях, а. также для приготовления разнообразных препаратов (вакцины, диагностикумы) используют 8—12-дневные куриные эмбрионы. К недостаткам данного метода относятся невозможность обнаружения исследуемого микроорганизма без предварительного вскрытия эмбриона, а также наличие большого количеству белков и других соединений, затрудняющих последующую очистку возбудителя при изготовлении различных препаратор
Для заражения куриных эмбрионов исследуемый материал вводят в аллантоисную и амниотическую полости, на хорион-аллантоисную оболочку или в желточный мешок куриного эмбриона (рис.). Для заражения в аллантоисную полость в скорлупе над воздушной камерой (границы ее заранее обводят карандашом при просвечивании яйца) проделывают небольшое отверстие с помощью ножниц, скальпеля или специального буравчика. Шприцем вводят 0,1—0,2 мл вируссодержащего материала на глубину 2—3 мм ниже границы воздушной камеры. Отверстие в скорлупе заливают расплавленным парафином. Вскрытие зараженных эмбрионов производят в сроки максимального накопления вируса (через 48—72 ч инкубации при 37 °С). После обработки спиртом и 2 % раствором йода скорлупу рассекают ножницами немного выше очерченной карандашом границы воздушной камеры, наклоняя яйцо так, чтобы избежать попадания скорлупы в полость. Скорлупу отбрасывают, осторожно снимают ее оболочку и рассматривают хорион-аллантоисную оболочку вокруг места заражения, отмечая наличие или отсутствие очагов поражения — геморрагии, бляшек и др. Затем пастеровской пипеткой прокалывают хорион-аллантоисную оболочку в участке, свободном от сосудов, и отсасывают аллантоисную жидкость. После этого извлекают хорион-аллантоисную оболочку, дважды промывают ее изотоническим раствором хлорида натрия, помещают в чашку Петри и отмечают на черном фоне наличие специфических поражений.
Лабораторные животные. Видовая чувствительность животных, их возраст определяют репродуктивную способность вирусов. Во многих случаях только новорожденные животные чувствительны к тому или иному вирусу (например, мыши-сосунки к вирусам Коксаки). Преимущество метода культивирования облигатных внутриклеточных паразитов в организме лабораторных животных перед другими состоит в возможности выделения тех вирусов, которые плохо репродуцируются в культуре клеток или эмбрионе. К его недостаткам относятся высокая вероятность контаминации организма подопытных животных посторонними вирусами и микоплазмами, а также необходимость последующего заражения культуры клеток для получения чистой культуры данного вируса, что увеличивает сроки исследования.
Методы индикации вирусов. Для демонстрации присутствия вируса в клеточной культуре используют несколько методов.
I. О размножении (репродукции) вирусов в культуре клеток судят по цитопаттескому действию (ЦПД), которое может быть обнаружено микроскопически по морфологическим изменениям клеток.
а) Часть таких клеток погибает и отслаивается от стенок пробирки. б)Вирусные частицы, освобождающиеся при разрушении одних клеток, инфицируют другие, которые через некоторое время также погибают. В результате вместо сплошного клеточного монослоя остаются лишь отдельные клеточные островки.
Характер ЦПД, вызванного разными вирусами, неодинаков. При репродукции одних вирусов (парамиксовиру-сы, герпесвирусы) наблюдается слияние клеток с образованием синцития, других (энтеровирусы, реовирусы) — сморщивание и деструкция клеток, третьих (аденовирусы) — агрегация клеток. ЦПД вирусов оценивают в динамике, просматривая культуру клеток под микроскопом в разные сроки после ее заражения вируссодержащим материалом. Некоторые вирусы (энтеровирусы, герпесвирусы) вызывают ЦПД в течение 1—2 сут, другие — в более поздние сроки (на 4^-6-й день). Характер ЦПД используют как для обнаружения вирусов (индикации), так и ориентировочной идентификации, т.е. определения их видовой принадлежности.
Некоторые вирусы можно обнаружить и идентифицировать по включениям, которые они образуют в ядре или цитоплазме зараженных клеток. Форма включений различна, а размеры колеблются от 0,25 до 25 мкм. Они представляют собой места скопления вирусных частиц и могут быть выявлены в препаратах, приготовленных из зараженной ткани и окрашенных флюорохромами. В последнем случае используют люминесцентную микроскопию.
Для исследования морфологии контаминированных клеток используют специальный инвертированный микроскоп, у которого осветитель располагается сверху, а объективы — снизу от предметного столика. С помощью такого прибора можно оценивать морфологию клеток, растущих в виде монослоя на поверхности контейнера для культивирования. Морфологические изменения клеток выявляют при микроскопическом исследовании культуры с помощью объектива 8х или 40х. При сравнении клеточного монослоя, инфицированного вирусом, с незараженными клетками в контрольной пробе отмечают полное или островковое разрушение пласта клеток либо другие изменения, которые характеризуют ЦПД вируса. Для более детального изучения ЦПД в контейнер для культивирования помещают покровное стекло, на котором образуется монослой. В дальнейшем стекло извлекают, зараженные клетки фиксируют и готовят микроскопический препарат, который окрашивают флюорохромами и т.д.) и изучают иммерсионным методом.
ЦПД вирусов можно также продемонстрировать с помощью «цветной пробы»: метаболически активные клетки культуры в ходе жизнедеятельности выделяют кислые продукты, что вызывает изменение цвета индикатора, присутствующего в культуральной среде. При репродукции вируса клетки утрачивают способность к метаболизму и погибают, поэтому окраска среды с течением времени не меняется.
II. Реакцию гемадсорбции применяют для индикации гемаг-глютинирующих вирусов. Реакция основана на способности поверхности клеток, в которых репродуцируются такие вирусы, адсорбировать эритроциты. Для постановки реакции гемадсорбции в культуру клеток, зараженных вирусами, добавляют взвесь эритроцитов и после некоторого времени контакта клетки промывают изотоническим раствором хлорида натрия. На поверхности пораженных вирусами клеток остаются прилипшие эритроциты.
III. Реакцию гемагглютинации (РГА) применяют для обнаружения гемагглютинирующих вирусов в культуральной жидкости зараженной культуры клеток либо хорионаллантоисной или амниотической жидкости куриного эмбриона. Гемагглютинацию — «склеивание» эритроцитов разных видов животных (кур, гусей, морских свинок) — вызывают вирусы, содержащие в оболочке гемагглютинин.Для постановки реакции гемагглютинации к исследуемому материалу добавляют взвесь эритроцитов. В присутствии вирусов происходит агглютинация эритроцитов.
3 и т.д. За титр РГА принимают максимальное разведение, при котором наблюдается гемагглютинация (++). Титр РГА характеризует активность вируса и используется при постановке РТГА.
Для количественного обнаружения вирусных частиц используют методы титрования.Титр вируса можно определить в реакции гемагглютинации с 10-кратными разведениями культуральной среды, или материала из куриного эмбриона, или по ЦПД в культуре клеток. В последнем случае клетки культуры заражают 10-кратными разведениями материала, содержащего вирус. После 6—7-дневной инкубации их просматривают на наличие ЦПД. За титр вируса принимают наибольшее разведение, которое вызывает ЦПД в 50 % зараженных культур. Титр вируса выражают количеством цитопатических (инфекционных) доз (ИД5о)
—Более точным количественным методом учета отдельных вирусных частиц является метод бляшек. Культуру клеток заражают вирусом и покрывают тонким слоем агара. После инкубирования посевов в течение нескольких суток на поверхности агара появляются просветленные участки определенной формы (бляшки), представляющие собой участки погибших клеток в сплошном монослое культуры клеток. Каждая бляшка образуется при размножении одной вирусной частицы и хорошо заметна в виде круглого светлого участка на красном фоне клеток, прижизненно окрашенных нейтральным красным. Титр вируса, установленный этим методом, выражают числом бляшкообразующих единиц (БОЕ) в 1 мл. Размеры, морфология и сроки появления бляшек различаются не только у разных видов вирусов, но и у отдельных штаммов одного и того же вида. Перечисленные признаки используют для селекции штаммов и получения так называемых чистых линий вирусов.
