На чем основана кислотно основная классификация катионов
Кислотно-основная классификация катионов по группам
Данная классификация катионов по группам основана на использовании в качестве групповых реагентов водных растворов кислот и оснований — хлороводородной кислоты НС1, серной кислоты H2SО4, гидроксидов натрия NaOH или калия КОН (в присутствии пероксида водорода Н2О2) и аммиака NН3. Хотя эта классификация менее совершенна, чем сероводородная, однако используется чаще, т.к. при ее использовании не требуется получение и применение токсичного сероводорода.
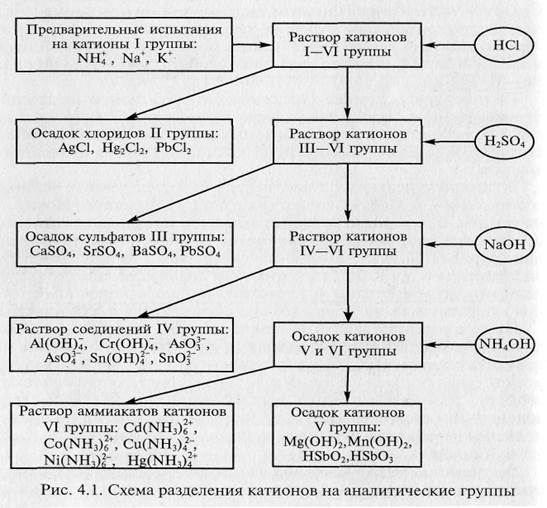
В соответствии с кислотно-основной классификацией систематический ход качественного анализа смеси катионов может быть представлен следующей схемой (рис. 4.1) [3].
В результате получается шесть фракций раствора, содержащих катионы только своей аналитической группы. После этого на последующих стадиях анализа каждый катион может быть обнаружен «внутри» группы с помощью характерных (уже не обязательно специфичных) реакций.
Полная схема систематического анализа катионов по этой классификации (как и по любой другой) практически никогда не применяется при контроле ОС, качества лекарств и минерального сырья, однако отдельные элементы ее все же иногда используются в анализе.
Катионы, открываемые в рамках кислотно-основной классификации, подразделяют на шесть аналитических групп.
Сульфаты кальция, стронция и бария практически нерастворимы в разбавленных кислотах и щелочах. Сульфат бария заметно растворяется в концентрированной серной кислоте с образованием кислой соли Сa(HS04)2. Сульфат кальция растворим в водном растворе сульфата аммония (NH4)2S04 с образованием комплекса (NH4)2[Ca(S04)2], сульфаты стронция и бария — вообще не растворяются.
Даже если бы исходное вещество и содержало формально мышьяк в виде катионов, например, АsС13, As2O3, As2O5 и т.д., то в водной среде оно гидролизуется с дальнейшим образованием анионной формы мышьяка(III) или мышьяка(V):
В соответствии с изложенным при проведении анализа по кислотно-основному методу обычно используют аналитические реакции на арсенит- или арсенат-анионы, а не на катионы мышьяка(III) или мышьяка(V).
На воздухе гидроксиды марганца(II) и железа(III) постепенно окисляются кислородом:
При действии группового реагента в присутствии пероксида водорода происходит окисление железа(II) до железа(III), марганца(II) – до марганца(IV), сурьмы(III) – до сурьмы(V):
Осадки основных солей меди(II), никеля(II) и гидроксида кадмия растворяются в избытке группового реагента с образованием соответствующих аммиачных комплексов:
Осадки, выпавшие из растворов солей кобальта(II) и ртути(II) при действии группового реагента, растворяются в избытке аммиака в присутствии солей аммония с образованием аммиачных комплексов:
Аммиачный комплекс кобальта(II) грязно-желтого цвета окисляется на воздухе до аммиачного комплекса кобальта(III) вишнево-красного цвета.
Контрольные вопросы и задания
1. Какие бывают аналитические классификации катионов и на чем они основаны?
2. Охарактеризуйте подробнее кислотно-основную классификацию катионов (нарисуйте схему разделения на группы).
3. Дайте подробную характеристику какой-нибудь одной группы катионов и напишите их реакции с групповыми реагентами.
4. Перечислите характерные реакции катионов одной из групп и напишите их уравнения для одного из них.
(Воспользуйтесь для этого электронными текстами: «Качественный анализ S- P- и D-катионов»)
Рекомендуемая литература:
1. Харитонов Ю.Я. Аналитическая химия (аналитика). Кн. 1. Общие теоретические основы. Качественный анализ. Учеб. для вузов. – М.: Высш. шк., 2001. – с. 288-291, 320-324.
2. Бессероводородные методы качественного полумикроанализа. /Под ред. А.П. Корешкова. – М.: Высш. школа, 1979.
3. Голубков Ю.М., Головачева В.А., Ефимова Ю.А. и др. Аналитическая химия. Учебник. /Под ред. А.А. Ищенко. – М.: Издательский центр «Академия», 2004. – с. 80.
Кислотно–основная классификация катионов
Кислотно–основная классификация катионов
Кислотно-основная классификация катионов основана на различии в свойствах их гидроксидов (основные или амфотерные, растворимые или не растворимые в NH3) и на различной растворимости в воде их хлоридов и сульфатов (хорошо или мало растворимые).
Деление катионов на группы по кислотно-основной классификации, групповые реагенты, а также свойства их хлоридов, сульфатов и гидроксидов даны в табл.2.
Кислотно-основная классификация катионов
Хлориды, сульфаты и гидроксиды растворимы в воде
Хлориды малорастворимы в воде
Сульфаты малорастворимы в воде
Al3+, Cr3+, Zn2+, As(III), As(V), Sn(II), Sn(IV)
2 моль/л NaOH (избыток) в присутствии H2O2
Гидроксиды растворимы в избытке NaOH
Bi3+, Fe2+, Fe3+, Mg2+, Mn2+, Sb(III), Sb(V)
Гидроксиды нерастворимы в избытке NaOH и NH3
Гидроксиды нерастворимы в избытке NaOH, но растворимы в избытке NH3
Систематический анализ смеси катионов I–IV аналитических групп, основанный на кислотно-основной классификации, начинают обычно с дробного обнаружения катионов I аналитической группы, а затем разделяют смесь на группы с помощью групповых реагентов.
Вначале осаждают хлориды катионов II аналитической группы, а затем переводят в осадок сульфаты катионов III аналитической группы. При обработке полученного раствора, содержащего катионы I, IV, V и VI аналитических групп, избытком раствора гидроксида натрия в присутствии пероксида водорода в осадок переходят основные по своей природе гидроксиды или гидратированные оксиды катионов V и VI аналитических групп. При этом катионы I и IV аналитических групп остаются в растворе. Гидроксиды катионов IV аналитической группы являются амфотерными и поэтому растворимы в избытке раствора гидроксида натрия. Осадок гидроксидов катионов V и VI аналитических групп растворяют действием разбавленного (2 моль/л) раствора азотной кислоты в присутствии пероксида водорода. Добавление к полученному раствору концентрированного раствора аммиака позволяет выделить в осадок гидроксиды катионов V аналитической группы, тогда как катионы VI аналитической группы остаются в растворе в виде комплексных амминов.
После разделения смеси катионов на группы с помощью групповых реагентов проводят обнаружение отдельных ионов внутри каждой группы с использованием их специфических реакций.
ПЕРВАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ
Катионы I аналитической группы не имеют группового реагента, так как нет соединения, которое одновременно осаждало бы все катионы данной группы.
Гидроксиды, а также почти все соли лития, натрия, калия и аммония хорошо растворимы в воде. Поэтому известно очень ограниченное число реакций, которые могут быть использованы в качестве аналитических при определении этих ионов. Некоторые из них представлены в табл.3.
Катионы лития, натрия, калия и аммония в водных растворах бесцветны. Соли, в состав которых входят катионы лития, натрия и калия, широко используются в медицине, входят в состав многих лекарственных препаратов. Например, гидрокарбонат натрия NаНСО3 содержится в минеральных водах и применяется для понижения кислотности желудочного сока, для ингаляций и полосканий. Сульфат натрия Nа2SО4·10Н2О (глауберова соль) используется в качестве слабительного и как противоядие при отравлении солями свинца, бария и производными бензола. Раствор хлорида натрия (0,9 %) используется в качестве изотонического раствора и как противоядие при отравлении нитратом серебра. Хлорид калия используется как антиаритмическое средство, бромид натрия или калия – как успокаивающее и снотворное средство, иодид натрия и калия – при лечении ряда заболеваний. Соли лития применяют в урологической практике и при лечении нарушений обмена веществ.
Некоторые аналитические реагенты и продукты их взаимодействия с катионами
Определение катионов кислотно-основным методом анализа
Разделы: Химия
Ключевые слова: химия
Для обнаружения ионов при их совместном присутствии в растворе, каком-либо природном или промышленном объекте применяют дробный или систематический методы анализа. Дробный метод анализа заключается в обнаружении иона посредством специфической реакции. Применение этого метода ограничено, поскольку таких реакций немного. В процессе систематического анализа проводится предварительное разделение всех ионов на так называемые аналитические группы и обнаружение того или иного иона осуществляется в присутствии ограниченного числа других ионов. Систематический ход анализа обычно проводят «мокрым» путем, так как реакции между ионами обычно протекают в водных растворах. Существуют разные схемы систематического анализа, основанные на различном отношении групп ионов к действию определенных реагентов. Наиболее распространены кислотно-щелочная и сероводородная схемы анализа катионов. Сероводородный метод анализа катионов является классическим. Он основан на различной растворимости сульфидов, гидроксидов, карбонатов и хлоридов. В этом методе катионы делят на пять аналитических групп. У каждой из них есть свой групповой реагент, за исключением первой группы катионов. В качестве группового реагента используется такой реактив, который реагирует со всеми катионами данной группы в одних и тех же условиях и дает возможность отделить катионы данной группы. Групповыми реагентами являются хлороводородная кислота, сероводород, сульфид аммония, карбонат аммония. Кислотно-щелочной метод анализа катионов основан на различной растворимости в воде хлоридов и сульфатов и на различной растворимости гидроксидов в воде, избытке щелочи и водном растворе аммиака. Групповыми реактивами являются хлороводородная и серная кислота, щелочь и водный раствор аммиака. В кислотно-щелочном методе катионы делят на шесть аналитических групп.
В соответствии с кислотно-щелочной схемой анализа принята следующая классификация катионов: