На чем основана классификация анионов
Лекция 5. Классификация анионов.
Классификация анионов на аналитические группы:
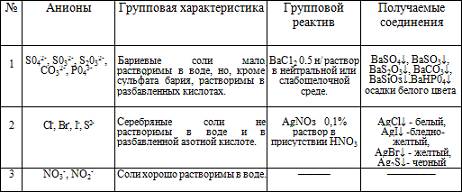
Первая аналитическая группа анионов:SO42-, SO32-. S2O32-, CO32-, SiO32-, PO43-
Все анионы первой группы образуют соли бария, нерастворимые в воде, но растворимые в разбавленных кислотах ( за исключением сульфата бария).Поэтому групповым реактивом первой группы является хлорид бария в нейтральном или слабо щелочном растворе. Серебряные соли, образуемые анионами 1 группы, в отличие от 2 группы растворимы в разбавленных кислотах, а сульфат серебра даже в воде.
Большинство солей серной кислоты хорошо растворяется в воде. К нерастворимым относятся только сульфаты бария, стронция, кальция, свинца. Сульфит-ион в растворе неустойчив и постепенно окисляется до сульфат-иона. К растворимым тиосульфатам относятся соли щелочных металлов, стронция, цинка, кадмия. Из средних солей угольной кислоты растворимы только карбонаты натрия, кадмия и аммония. Соли фосфорной кислоты в основном в воде нерастворимы. Исключение составляют фосфаты щелочных металлов и аммония и дигидрофосфаты щелочноземельных металлов. Все фосфаты растворяются в минеральных кислотах, а многие (кроме фосфатов железа и аммония) также в уксусной кислоте. Из силикатов растворимы в воде лишь соли щелочных металлов метакремниевой кислоты, которые называются «растворимыми стеклами». Водные растворы этих солей вследствие гидролиза имеют сильно щелочную реакцию. Часть нерастворимых силикатов разлагается минеральными кислотами с образованием свободных кремниевых кислот. Все анионы первой группы в растворах бесцвет.
Объектами качественного анализа на присутствие анионов 1 группы являются почвы, природные воды, растения, биологические жидкости.
Реакции анионов первой группы:
Анионы второй аналитической группы: Cl-, Br-, I-, S2-
Большинство солей, образуемых анионами второй группы, растворимы в воде.
Хлорид бария, групповой реактив анионов первой группы, анионы второй группы не осаждает. Все анионы второй группы бесцветны.
Реакции анионов второй группы:
Анионы третьей аналитической группы: NO3-, NO2-
Реакции анионов 3 группы:
Вопросы для самопроверки:
1. Что лежит в основе разделения анионов на группы и чем каждая характеризуется?
2. Чем существенно отличается анализ катионов от анализа анионов, какую роль играют групповые реактивы?
3. Как открывается ион SO42- в присутствии других ионов первой группы? Ответ пояснить.
Анализ анионов. Аналитические группы анионов
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Анионы, по наиболее распространенной классификации, делятся на три группы. Такое деление основано на различиях в растворимости бариевых и серебряных солей. Классификация анионов представлена в таблице.
Классификация анионов на аналитические группы
Первая аналитическая группа анионов:
Все анионы первой группы образуют соли бария, нерастворимые в воде, но растворимые в разбавленных кислотах ( за исключением сульфата бария).Поэтому групповым реактивом первой группы является хлорид бария в нейтральном или слабо щелочном растворе. Серебряные соли, образуемые анионами 1 группы, в отличие от 2 группы растворимы в разбавленных кислотах, а сульфат серебра даже в воде. Большинство солей серной кислоты хорошо растворяется в воде. К нерастворимым относятся только сульфаты бария, стронция, кальция, свинца. Сульфит-ион в растворе неустойчив и постепенно окисляется до сульфат-иона. К растворимым тиосульфатам относятся соли щелочных металлов, стронция, цинка, кадмия. Из средних солей угольной кислоты растворимы только карбонаты натрия, кадмия и аммония. Соли фосфорной кислоты в основном в воде нерастворимы. Исключение составляют фосфаты щелочных металлов и аммония и дигидрофосфаты щелочноземельных металлов. Все фосфаты растворяются в минеральных кислотах, а многие (кроме фосфатов железа и аммония) также в уксусной кислоте. Из силикатов растворимы в воде лишь соли щелочных металлов метакремниевой кислоты, которые называются “растворимыми стеклами”. Водные растворы этих солей вследствие гидролиза имеют сильно щелочную реакцию. Часть нерастворимых силикатов разлагается минеральными кислотами с образованием свободных кремниевых кислот. Все анионы первой группы в растворах бесцветны. Объектами качественного анализа на присутствие анионов 1 группы являются почвы, природные воды, растения, биологические жидкости.
Реакции анионов первой группы
Большинство солей, образуемых анионами второй группы, растворимы в воде.
Исключение составляют соли серебра, ртути и свинца. Групповой реактив на вторую группу анионов – нитрат серебра в присутствии азотной кислоты, который образует с анионами второй группы серебряные соли, не растворимые в воде и, в отличие от анионов первой группы, не растворимые в разбавленной азотной кислоте.
Хлорид бария, групповой реактив анионов первой группы, анионы второй группы не осаждает. Все анионы второй группы бесцветны.
Хлорид – ионы всегда присутствуют в почвах и в природных водах. Количество хлорид-ионов в питьевой воде не должно превышать 40мг на 1 литр. Многие хлориды используются в качестве удобрений: хлорид аммония и калия, сильвинит (KCI•NaCI) каинит (КСI•МgS04•ЗН2О). Хлорид натрия (поваренная соль) обязательный компонент рациона человека и животных, является активатором многих пищеварительных ферментов. Соляная кислота, содержащаяся в желудочном соке млекопитающих, участвует в процессе переваривания белков, активируя фермент пепсин. Хлориды бария и ртути (II) применяют как сельскохозяйственные яды. Иодид-ионы содержатся в питьевой воде и продуктах питания и играют огромную роль в процессах жизнедеятельности. Большое количество йода накапливается в щитовидной железе, секретирующей йодсодержащие гормоны. Бромиды используются в медицине как средства, успокаивающие центральную нервную систему. Сероводород образуется при разложении белковых соединений. Он очень ядовит, его вдыхание может вызвать потерю сознания и паралич дыхательного центра. Поэтому все работы с сероводородом проводятся под тягой.
Реакции анионов второй группы
Соли анионов третьей аналитической группы, включая бариевые и серебряные, хорошо растворимы в воде. Поэтому группового реактива на анионы этой группы нет. Для открытия нитрат- и нитрит-ионов применяют не реакции осаждения, а окислительно-восстановительные реакции, в которых эти анионы выступают как активные окислители. Нитраты образуются в большом количестве в природе в результате нитрификации, т.е. процесса биологического превращения аммиака в окисленные неорганические соединения. Этот процесс происходит в почве и воде и осуществляется бактериями – нитрификаторами. Промежуточным продуктом химических реакций окисления аммиака являются нитриты, а конечным – нитраты. В результате этого нитраты всегда содержатся в природных водах. Предельно допустимое содержание нитратов в питьевой воде составляет 20 мг/л. Содержание нитритов в питьевой воде вообще не допустимо. Однако в результате применения больших количеств аммонийных удобрений происходит накопление и нитратов и нитритов в почвах, водах и продукции растениеводства. Кроме того, нитраты широко используются в консервной и мясоперерабатывающей промышленности в качестве добавок, сохраняющих цвет продукции. Токсическое действие нитратов и нитритов обусловлено блокадой железа в железосодержащих дыхательных ферментах, что приводит к острой гипоксии тканей и может закончиться летально. Поэтому овощи, фрукты, колбасы, копчености, консервы мясные и плодоовощные подлежат обязательному анализу на содержание нитратов и нитритов.
Классификация анионов, основанная на их окислительно-восстановительных свойствах
Качественный анализ анионов. Аналитическая классификация анионов по группам (по способности к образованию малорастворимых соединений, по окислительно-восстановительным свойствам). Ограниченность любой классификации анионов по группам
Анализ анионов существенно отличается от анализа катионов. Если для катионов существует систематический ход анализа, построенный на последовательном делении их на группы с помощью групповых реакций, то для анионов такого строго систематического анализа нет.
Разнообразные классификации анионов основаны на реакциях осаждения, разложения, комплексообразования, окисления-восстановления. В качестве групповых реагентов используют соли бария, серебра, кальция, свинца, цинка, смеси солей бария и кальция. Эти реактивы применяют при различных значениях pH раствора. В качестве групповых реагентов на анионы легко разлагаемых кислот используют также растворы кислот (CH3COOH, HCl). Различные отношения анионов к окислителям (KMnO4 + H2SO4) или восстановителям (KI + H2SO4) также позволяет делить анионы на группы по различию их окислительно-восстановительных свойств. Есть классификации, основанные на использовании различных реактивов, в которых число групп анионов колеблется от 3 до 7.
Так, например, при делении анионов на три группы они распределяются следующим образом:
Анионы, образующие осадки с растворимыми солями бария;
Анионы, образующие осадки с растворимыми солями серебра;
Анионы, не образующие осадков ни с растворимыми солями бария, ни с растворимыми солями серебра;
Классификация анионов, основанная на реакциях осаждения
При делении анионов на семь групп различают:
Анионы кремниевой, титановой, циркониевой, вольфрамовой и некоторых других кислот, соли щелочных металлов, которые растворимы в воде, а бариевые и серебряные соли не растворимы.
По окислительно-восстановительным свойствам анионы также обычно делят на три группы. По этой классификации групповыми реагентами являются окислители или восстановители, у которых окислительная или восстановительная форма окрашена.
Классификация анионов, основанная на их окислительно-восстановительных свойствах
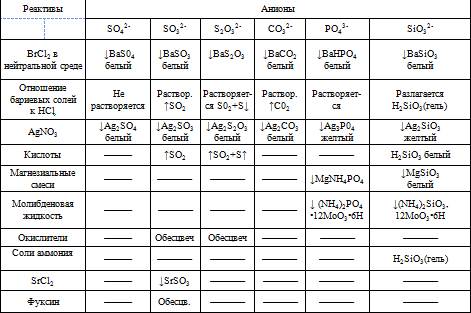
Групповой реагент – водный раствор BaCl2.
Реакции с групповым реагентом проводят в нейтральной или слабо щелочной среде, так как осадки соответствующих бариевых солей малорастворимы в данных условиях.
Сульфаты аммония и многих металлов хорошо растворяются в Н2О. Сульфаты кальция, стронция, бария, свинца (II) малорастворимы в воде, что широко используется в химическом анализе.
1. Реакция с катионами бария (фармакопейная).
ВаCl2 +Na2 SO4 →BaSO4↓ (белый мелкокристаллический) + 2NaCl
Ва 2+ +SO4 2- →BaSO4↓ (белый мелкокристаллический)
· BaSO4 не растворяется в минеральных кислотах, за исключением концентрированной Н2SO4, в которой он частично растворим с образованием Ba(HSO4)2:
2. Реакция с катионами свинца.
PbCl2+Na2 SO4→PbSO4↓ (белый кристаллический) + 2NaCl
Pb 2+ +SO4 2- →PbSO4↓ (белый кристаллический)
· Осадок PbSO4 частично растворяется в минеральных кислотах; растворяется в щелочах и в водных растворах ацетатов натрия СН3СООNa или аммония СН3СООNН4 с образованием комплексных соединений:
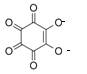
3. Реакция с родизонатом бария.
Сульфат-ионы при взаимодействии с красным родизонатом бария разрушают его с образованием сульфата бария, вследствие чего красный родизонат бария обесцвечивается:
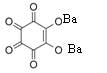
родизонат бария родизонат-анион — остаток родизоновой кислоты H2C6H6
Реакция высокочувствительна: предел обнаружения 5 мкг. Реакцию обычно проводят капельным методом на фильтровальной бумаге.
1. Реакция с хлоридом бария (фармакопейная).
Ва Cl2 +Na2 SO3→BaSO3↓(белый кристаллический) + 2NaCl
Ва 2+ +SO3 2- →BaSO3↓(белый кристаллический)
· Осадок растворяется в разбавленных НСl и HNO3 с выделением газообразного диоксида серы SO2:
2. Реакция с нитратом серебра.
2 Ag + + SO 3 2- → Ag 2 SO 3 ↓(белый)
· Осадок растворяется при избытке сульфит – ионов с образованием растворимых комплексных дисульфитоаргентат (I) – ионов [Ag(S2O3)2] 3- :
В другой пробирке аналогично получают белый осадок сульфита серебра и кипятят смесь осадка с раствором. Осадок постепенно темнеет, за счет выделения оксида серебра Ag2O:
3. Реакция разложения сульфитов кислотами (фармакопейная).
Выделяющийся диоксид серы SO2 обнаруживают по характерному запаху, а также по обесцвечиванию водного раствора йода или перманганата калия:
4. Реакция с перманганатом калия.
В кислой среде сульфит – ионы окисляются до сульфат – ионов, при этом розовый раствор перманганата калия обесцвечивается.
5. Реакция с раствором йода (фармакопейная).
Реакцию проводят в нейтральных или слабо кислых растворах.
6. Реакция восстановления сульфит – иона металлическим цинком в кислой среде.
SO3 2- + 2 Н + → SO2 + Н 2 О
SO2 + 3 Zn + 6 Н + → H2S + 3 Zn 2+ + 2 H2O
Признаки реакции: полоска фильтровальной бумаги, смоченная раствором соли свинца чернеет:
H2S+Pb 2+ →PbS+ 2H +
1. Реакция с хлоридом бария.
Ва Cl 2 + Na 2 СО3→ ВаСО3↓(белый мелкокристаллический)+ 2 NaCl
Ва 2+ + СО3 2- → ВаСО3↓(белый мелкокристаллический)
Осадок растворяется в минеральных кислотах и в уксусной кислоте. В растворе H2SO4 образуется белый осадок BaSO4.
· К осадку медленно, по каплям прибавляют раствор HCl до полного растворения осадка:
2. Реакция с сульфатом магния (фармакопейная).
Mg 2+ + CO 3 2- → MgCO 3 ↓(белый)
· Осадок MgCO3 растворяется в кислотах.
3. Реакция с минеральными кислотами (фармакопейная).
Признаки реакции: Выделяющийся газообразный СО2 обнаруживают по помутнению баритоновой или известковой воды в приборе для обнаружения газов.
4. Реакция с гексацианоферратом (II) уранила.
Коричневый раствор гексацианоферрата (II) уранила получают, смешивая раствор ацетата уранила (СН3СОО)2UO2 c раствором гексацианоферрата (II) калия:
К полученному раствору прибавляют по каплям раствор Na2CO3 или К2СО3 при перемешивании до исчезновения коричневой окраски.
5. Раздельное открытие карбонат – ионов и гидрокарбонат – ионов реакциями с катионами кальция и с аммиаком.
Если в растворе одновременно присутствуют карбонат – ионы и гидрокарбонат – ионы, то каждый из них можно открыть раздельно.
Для этого вначале к анализируемому раствору прибавляют избыток раствора СаСl2. При этом СО3 2- осаждаются в виде СаСО3:
Na2 СО3+ СаСl2→ СаСО3+ 2 NaCl
СО3 2- + Са 2+ → СаСО3
Гидрокарбонат – ионы остаются в растворе, так как Са(НСО3)2 растворами в воде.
Карбонат – ионы при реакции с хлоридом железа (III)FeCl3образуют бурый осадок Fe(OH)CO3, с нитратом серебра – белый осадок карбоната серебраAg2CO3, растворимый вHNO3и разлагающийся при кипячении в воде до темного осадкаAg2Oи СО2:
Качественый химический анализ катионов и анионов
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
КАЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ КАТИОНОВ И АНИОНОВ
Введение.
Под качественным химическим анализом вещества понимают определение его качественного состава, т.е. открытие (идентификацию) атомов, атомных групп, ионов и молекул в анализируемом веществе.
Существует два метода качественного анализа: дробный и систематический. Дробный качественный анализ предполагает обнаружение иона или вещества в анализируемой пробе с помощью специфического реагента в присутствие всех компонентов пробы. Примером такой реакции может служить обнаружение ионов аммония при подщелачивании раствора:
NH4 + + ОН – = NH3↑ + Н2O
Однако специфических реагентов известно немного. Более распространенны групповые реагенты, дающие сходные реакции с целой группой ионов.
Групповые реагенты используются в систематическом качественном анализе, который предусматривает разделение смеси анализируемых ионов по аналитическим группам, после чего внутри каждой группы с помощью тех или иных реакций разделяют и открывают индивидуальные ионы.
I. Качественный анализ катионов.
Аналитическая классификации катионов но группам.
В основу той или иной аналитической классификации катионов по группам положены их сходства или различия по отношению к действию определенных аналитических реагентов и свойства образующихся продуктов аналитических реакций (растворимость в воде, кислотах и щелочах, способность к комплексообразованию, окислительно-восстановительные свойства).
Существует ряд классификаций катионов по группам (или химических методов качественного анализа катионов). Наиболее распространенными среди них являются три классификации: сероводородная, аммиачно-фосфатная и кислотно-основная, причем сероводородный метод анализа в настоящее время практически не используется, т.к. требует применения токсичного сероводорода и довольно продолжителен.
Применение групповых реагентов позволяет подразделить многие катионы по аналитическим группам, однако не существует классификации, охватывающей все известные катионы или, по крайней мере, катионы всех металлов.
В таблицах 1.1, 1.2 и 1.3 представлены катионы в соответствии с сероводородной, аммиачно-фосфатной и кислотно-основной классификациями. В этих таблицах перечислены не все катионы, входящие в группу, а только те из них, которые наиболее часто встречаются в фармацевтическом анализе.
Таблица 1.1 Сероводородная классификация катионов.
Группа
Катионы
Групповой реагент
Раствор H2S, pH= 0,5 (HCI)
Таблица 1.2. Аммиачно-фосфатная классификация катионов.
Группа
Катионы
Групповой реагент
Раствор (NH4)2HPO4; фосфаты растворимы в водном аммиаке
* Фосфаты двухзарядных катионов растворимы в уксусной кислоте (2 моль/л), трехзарядных — нет.
Таблица 1.3. Кислотно-основная классификация катионов.
Группа
Катионы
Групповой реагент
Раствор NaOH в присутствии
H2O2
Раствор NaOH или раствор
аммиака (25 %)
Раствор аммиака (25 %)
II. Кислотно-основная классификация катионов.
Систематический анализ катионов по кислотно-основному методу.
2.1. Кислотно-основная классификация катионов.
Данная классификация катионов основана на использовании и качестве групповых реагентов водных растворов кислот и оснований – HCl, H2SO4, NaOH или KOH, NH3*H2O.
Катионы, открываемые в рамках кислотно-основной классификации, подразделяют на шесть аналитических групп (табл. 1.3).
| А1 3+ + 3ОН – = А1(ОН)3 | Al(ОН)3 + 3ОН – = [А1(ОН)6] 3- |
| Сг 3+ + 3ОН – = Сг(ОН)3 | Сг(ОН)3 + 3ОН – = [Сг(ОН)6] 3- |
| Zn 2+ + 2ОН – = Zn(OH)2 | Zn(OH)2 + 2OH – = [Zn(OH)4] 2- |
| Sn 2+ + 2ОH – = Sn(OH)2 | Sn(OH)2 + 4OH – = [Sn(OH)6] 4- |
2. Открытие NH4 + :
а) раствор + KOH (NaOH) → NH3↑ (водяная баня) – запах, влажная лакмусовая бумажка синеет
б) раствор + K2[HgJ4], KOH (реактив Несслера) = [(JHg)2NH2]J ↓ – красно-бурый осадок
II. Систематический анализ смеси катионов (см. схему 1).
Открыть ионы дробно в смеси невозможно, т.к. нет избирательного реагента, поэтому проводят систематический анализ.
К анализируемому раствору прибавляют на холоде групповой реагент-раствор (2 моль/л) HCI до полного выделения осадка, состоящего из AgCl, Hg2CI2, РиСl2 (если раствор остается прозрачным при добавлении 2 капель НCl, осаждение считается полным).
Ход систематического анализа смеси катионов данной группы представлен в схеме 2.
Анализ раствора, содержащего смесь катионов третьей аналитической группы, обычно проводят по следующей схеме.
Вначале проводят предварительные испытания: в отдельных небольших пробах анализируемого раствора дробно открывают катионы, присутствующие в растворе, учитывая их взаимное влияние друг на друга. Часто этим ограничиваются. При необходимости проводят систематический анализ, как описано в схеме 3.
I. Предварительные испытания.
1. Открытие катионов бария (II):
Ва 3+ + К2Сr2O7 (в прис. СН3СОО – ) → ВаСrО4 ↓ – желтый, осадок не растворяется в разбавленной уксусной кислоте;
2.2. Систематический анализ катионов по кислотно-основному методу.
Сначала будут рассмотрены схемы анализа смесей катионов каждой аналитической группы, а затем – ход анализа смеси катионов всех аналитических групп.
I. Предварительные испытания (проводят в отдельной порции анализируемого раствора).
1. Открытие катионов Li + :
а) раствор + Na2РО4 → белый Li3PO4 ↓ (рН=7-8);
б) раствор + NH4F → LiF ↓ (белый)
При анализе раствора, содержащего катионы четвертой аналитической группы, сначала целесообразно провести предварительные испытания, а затем систематический анализ.
I. Предварительные испытания.
1. Открытие Сr 3+ (если они присутствуют, раствор должен быть сине-зеленым):
[Cr(H2О)6] 3+ (зеленый)+ Н2О2(3%) + NaOH изб. → СrО4 2- (желтый)
2. Открытие Sn 2+ :
Sn 2+ + NaOH + Bi(NO3)3 (1-2 капли) → Вi ↓ +[Sn(OH)6] 2-
3. Открытие As 3+ (AsO3 3- в растворе):
AsO3 3- + AgNO3 → Ag3AsO3↓ желтый, аморфный
4. Открытие As 5+ (AsO4 3- в растворе):
AsO4 3- + AgNO3 = Ag3AsO4 аморфный осадок шоколадного цвета
II. Систематический анализ (см. схему 4).
Некоторые катионы данной аналитической группы удобнее открыть в предварительных испытаниях. Систематический анализ смеси катионов проводят по схеме 5.
1. Предварительные испытания.
1. Открытие ионов Fe 2+ :
4Fe 2+ +3 K3[Fe(CN)6] → Fe4[Fe(CN)6]3 +9K + – темно-синий осадок «турнбуленовой сипи»
2. Открытие ионов Fe 3+ (если ионы присутствуют в растворе, последний имеет желтоватую окраску):
а) 4Fe 3+ + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3 +12K + – темно-синий осадок «берлинской лазури»
б)Fe 3+ + 6SCN – → [Fe(SCN)6] 3- – красное окрашивание раствора
3. Открытие ионов Мn 2+ :
а) Mn 2+ + NaBiO3 +Н + → МnO4 – + Bi 3+ + Na +
б) Мn 2+ + РbO2 + H + → МnО4 – + Рb 2+
МnO4 – – ноны окрашивают раствор в малиновый цвет.
4. Открытие ионов Bi 3+ (реакцию проводят о щелочной среде, рH=10):
Bi(OH)3 +[Sn(OH)4] 2- → Bi↓ + [Sn(OH)6] 2- черный
2.6. Анализ смеси катионов шестой аналитической группы: Сu 2+ , Сd 2+ , Hg 2+ , Cо 2+ , Ni 2+ .
Перед проведением систематического анализа в отдельных пробах анализируемого раствора можно открыть некоторые катионы с помощью характерных для них реакций.
Некоторые выводы можно сделать по окраске анализируемого раствора: так, аквакатионы Ni 2+ придают раствору зеленоватую окраску, Со 2+ – розовую, Сu 2+ – голубую.
Примерная схема анализа такого раствора заключается в следущем.
Некоторые предположения можно сделать и на основании измерения рН pacтвора (например, с помощью универсальной индикаторной бумаги). Если значение pН раствора находится в пределах рН = 2 – 4 и раствор не содержит осадка, то о нем отсутствуют Sn(II), Sn(IV), Sb(III), Sb(V), Bi(III), Hg(II), Fe (III), т.к. в противном случае продукты их гидролиза выделились бы в форме осадков.
Анализируемый раствор обычно делят на 3 части. Одну часть используют для предварительных испытании, другую – для проведения систематического анализа, третью оставляют для контроля.
I. Предварительные испытания.
В отдельных небольших порциях анализируемого раствора (объемом примерно 0,3 – 0,5 мл) определяют наличие катионов II – VI аналитических групп действием групповых реагентов.
3. Открытие катионов IV, V, VI аналитических групп: анализируемый раствор + NaOH + Н2О2, t°→ образование осадка.
4. Открытие катионов NH4 + :
a). NH4 + + КОH → NH3↑ – запах, влажная лакмусовая бумажка синеет.
б) NH4 + + K2[HgJ4], КОН (реактив Несслера) — [(JHg)2NH2]J ↓ – красно-бурый осадок.
6. Открытие ионов Na (если NH4 + удалены):
Na + + K[Sb(OH)6] → ↓ Na[Sb(OH)6] – белый мелкокристаллический
7. Открытие ионов Fe 2+ :
Fe 2+ + K3[Fe(CN)6] → темно-синий осадок «турнбулеповой сини».
8. Открытие ионов Fe 3+ :
Fe 3+ + K4[Fe(CN)6] → темно-синий осадок «берлинской лазури».
9. Открытие ионов Мn 2+ :
Мn 2+ + NaBiO3 → MnO4 – – раствор малиновый.
10. Открытие ионов Сr 3+ :
а) Сr 3+ + H2O2 + NaOH изб. → СrO4 2- синий или зеленый раствор
б) Сr 3+ + КМnO4 + H2SO4 → СrO4 2- + Мn 2+ – желтый раствор
11. Открытие ионов Bi 3+ :
а) Bi 3+ + Sn 2+ → Bi ↓ + Sn 4+ – черный
б) Bi 3+ + Сl – + Н2О → BiOCl ↓, осадок растворяется в избытке HCl – белые хлопья
12. Открытие ионов Сu 2+ :
Сu 2+ + NH3*H2O → ярко-синий раствор (мешает Ni 2+ ).
13. Открытие ионов Ni 2+ :
Ni 2+ + диметилглиоксим → красное окрашивание (мешает Cu 2+ ).
II. Систематический анализ.
Определив наличие катионов различных групп, приступают к их разделению помощью групповых реагентов. Ход выполнения систематического анализа описан в схеме 7.
2.2.8. Анализ раствора с осадком.
Если анализируемый объект представляет собой раствор с осадком, то вначале эту смесь центрифугируют, отделяют осадок от раствора и обе фазы анализируют отдельно.
Наличие осадка свидетельствует о присутствии в нем малорастворимых в воле соединений, например, хлоридов катионов второй аналитической группы (AgCl, РbСl), сульфатов катионов II и III аналитической группы (CaSO4, SrSO4, SrSO4. BaSO4, PbSO4, Ag2SO4), продуктов гидролиза катионов других групп и т.д.
III. Качественный анализ анионов. Аналитическая классификация анионов но группам.
Обычно открытие анионов в фармацевтическом анализе осуществляют с использованием разных качественных аналитических реакций в растворах на тот или иной аннон. Разумеется, не исключается применение и других методов анализа (оптических, хроматографических, электрохимических и др.).
Аналитическая классификация анионов по группам, в отличие от аналитической классификации катионов, разработана не столь подробно. Не существует общепризнанной и повсеместно принятой классификации анионов по аналитическим группам. Описаны различные классификации анионов.
Чаще всего принимают во внимание растворимость солей бария и серебра тех или иных анионов и их окислительно-восстановительные свойства в водных растворах. В любом случае удастся логически разделить на группы только часть известных анионов, так что всякая классификация анионов ограничена и не охватывает все анионы, представляющие аналитический интерес.
В табл. 3.1 и 3.2. приведены примеры классификации анионов по аналитическим группам.
По аналитической классификации анионов, основанной на образовании малорастворимых солей бария и серебра, анионы обычно делят на три группы (табл.3.1).
Таблица 3.1. Классификация анионов, основанная на образовании малорастворимых солей бария и серебра.
Группа
Анионы
Групповой реагент
Раствор ВаС12 в нейтральной или слабо-щелочной среде
II 1
Раствор AgNO3 в разб. (2М) азотной кислоте
1 – Бромат-ион иногда относится к III группе, так как бромат серебра AgBrO3 растворяется в разбавленной HNО3.
Осадок Ag2S растворяется при нагревании в растворе HNO3.
Если осадок нерастворим во всех вышеперечисленных растворителях, то это указывает на возможное присутствие в нем соединений: AgCl, PbCl2, CaSO4, SrSО4, BaSO4. Осадок РbСl2 растворяют, обрабатывая его кипящей дистиллированной водой, a AgCl – концентрированным раствором аммиака. Сульфаты катионов третьей аналитической группы переводят в карбонаты обработкой раствором соды и растворяют в уксусной кислоте.
Полученный раствор присоединяют к центрифугату и анализируют далее вместе как описано выше (см. п. 2.2.7).
При аналитической классификации анионов, основанной на их окислительно-восстановительных свойствах, анионы обычно делят на три группы (табл. 3.2.): анионы-окислители, анионы-восстановители и индифферентные анионы, т.е. такие, которые не обладают выраженными окислительно-восстановительными свойствами в обычных условиях.
Таблица 3.2. Классификация анионов, основанная на их окислительно-восстановительных свойствах.
Группа
Анионы
Групповой реагент
I
Окислители
Раствор KI в сернокислой среде
II
Восстановители
Раствор КМnО4 в сернокислой среде
III
Индифферентные
1 – NO3 – – ион в слабокислой среде практически не реагирует с KI.
2 – NО2 – – ион относят к I или II группе.
3 – С2O4 – заметно обесцвечивает раствор КМnO4 только при нагревании.
4 – Cl – – ион в обычных условиях медленно реагирует с раствором КМnO4.
3.1. Анализ смеси анионов.
В фармацевтическом анализе систематический анализ смеси анионов с использованием любой классификации никогда не проводится, как и в подавляющем большинстве других случаев аналитической практики. Групповой регент можно использовать для доказательства присутствия или отсутствия в смеси (в растворе) анионов той или иной аналитической группы, после чего намечают и реализуют наиболее целесообразную схему анализа данного конкретного объекта. Лекарственные субстанции и лекарственные формы обычно содержат ограниченное число анионов, причем, как правило, бывает известно, какие анионы могут присутствовать в анализируемом препарате. Поэтому при анализе лекарственных препаратов входящие в их состав анионы открывают дробным методом с помощью тех или иных частных аналитических реакций на соответствующий анион.
Общая логическая схема анализа смеси анионов обычно состоит в следующем. Вначале на первом этапе проводят предварительные испытания, в ходе которых определяют рН раствора, устанавливают с помощью групповых реагентов присутствие или отсутствие анионов первой и второй аналитических групп, выясняют наличие анионов-окислителей, анионов-восстановителей, проводят пробу па выделение газов.
Затем на втором этапе дробным методом открывают отдельные анноны в небольших пробах анализируемого раствора.
3.1.1. Первод катионов II – VI аналитических групп о малорастворимые карбонаты.
2СН3СООН + Na2CO3 → 2CH3COONa + H2O + CO2↑.Предварительно в отдельных порциях анализируемого раствора открывают карбонат ион и ацетат – ион (как описано ниже).
Затем к пробе анализируемого раствора (
30 капель) осторожно, по каплям прибавляют разбавленный раствор соды для нейтрализации раствора до слабощелочной реакции, после чего добавляют еще
30 капель раствора соды. Смесь нагревают до кипения и кипятят около 5 минут, периодически добавляя по каплям дистиллированную воду по мере упаривания раствора, поддерживая объем жидкой фазы приблизительно постоянным. Полученную смесь центрифугируют, центрифугат отделяют от осадка (который сохраняют для дальнейшего анализа – в случае необходимости).
К центрифугату осторожно, при перемешивании, по каплям прибавляют разбавленную уксусную кислоту до рН
7 для удаления избытка карбонат – ионов. Полученный раствор анализируют далее на присутствие анионов.
3.1.2. Предварительные испытания (проводятся в отдельной порции раствора).
4. Проба на присутствие анионов второй аналитической группы (табл. 3.1).
Если в анализируемом растворе присутствуют анионы второй аналитической группы, то при добавлении к нему азотнокислого раствора AgNO3 образуется осадок. Если осадок не выпадает, то это означает, что анионы второй аналитической группы в анализируемом растворе отсутствуют (возможно, присутствие ионов BrO3 – ).
1) в присутствии раствора крахмала. Окислители переводят ионы J в йод J2, при образовании которого крахмальный раствор окрашивается в синий цвет.
6. Проба на присутствие анионов-восстановителей.
3.1.3. Дробное обнаружение анионов.
После проведения предварительных испытаний, отдельные анноны открывают дробным методом, учитывая их возможное мешающее влияние друг на друга.
Рассматриваемые анионы вступают в многочисленные реакции с различными реагентами. Многие из этих реакций представляют аналитический интерес. Ниже охарактеризованы только некоторые из этих реакций, рекомендуемые чаще других.
1. Открытие сульфат-нона.
SО4 2- – ион обнаруживают по реакции с катионами бария Ва 2+ :
SО4 2- + Ва 2+ → BaSО4 ↓
Образуется белый мелкокристаллический осадок, не растворяющийся в минеральных кислотах.
4. Открытие тиосульфат — иона.
Ионы S2O3 2- открывают по помутнению пробы раствора при подкислении серной или хлороводородной кислотой.
S2О3 2- + 2H + ↔ H2S2О3 → S ↓ + SО2 + Н2О.
Примечание: тиосульфаты щелочных металлов, стронция, цинка, кадмия, марганца (II), железа (II), кобальта (II), никеля (II) растворимы в воде; тиосульфаты других металлов малорастворимы в воде.
6. Открытие оксалат – иона.
При отсутствии и растворе карбонат-ионов и анионов-восстановителей, C2O4 2- иона открывают по реакции:
↓Agl +Na2S3О3 → Na[Ag(S2О3)] • Nal. желтый
7. Открытие нитрит – иона.
NO2 – – ион открывают по реакции с реактивом Грисса-Илошвая (смесь сульфаниловой кислоты HSO3C6H4NН2 с 1 – нафтиламином C10Н7NH2):
NO2 – + реактив Грисса → ярко-красное окрашивание.
NO3 – – ион не дает аналогичной реакции.
Если нитрит – ион открыт, то его обычно удаляют, поскольку он мешает открытию нитрат – иона NO3 – :
NО2 – + NH4CI → N2 + 2Н2О
Раствор используют для открытия нитрат – ионов.
8. Открытие нитрат – иона.
NO3 – + 1-дифениламин → синее окрашивание раствора; постепенно окраска изменяется на бурую, а затем на желтую.
9. Открытие ацетат – иона.
а). Ацетат – ион в сернокислой среде (H2SO4 конц.) реагирует со спирт образованием сложных эфиров уксусной кислоты:
СН3СООН + С2Н5ОН → СН3СООС2Н5 + Н2О.
Этилацетат СН3СООС2Н5 обладает характерным приятным запахом.
Реакцию катализируют соли серебра.
б). При растирании твердых проб, содержащих ацетаты, с твердыми NaНSО4, KHSO4 выделяется уксусная кислота, обнаруживаемая по характерному запаху укуса
10. Открытие тартрат-иона – ООС – СН(ОН) – СН(ОН) – СОО –
Тартрат-анион – аннон слабой двухосновной винной кислоты, хорошо растворим в воде. В растворе ионы обнаруживают по реакции с хлоридом калия о присутствии ионов:
С4Н4О6 2- + К + + Н + → ↓ KHC4H4O6. Образуется белый кристаллический осадок, растворимый в минеральных кислотах и щелочах
12. Открытие ортофосфат – иона.
РO4 3- – ионы можно обнаружить двумя способами:
а) Реакция с магнезиальной смесью (MgCl2 + NH3 + NH4Cl):
HPO4 2- + MgCI2 + NH3 + NH4MgPO4 ↓
Образуется белый мелкокристаллический осадок магнийаммонийфосфат растворяющийся в кислотах.
б) Реакция с молибдатом аммония (NH4) 2MoО4:
PO4 3- + 3NH4 + + 12MoO4 2- +24H + →↓(NH4) 3[PO4(Mo5O10) 12 + 12 H2O
Образуется желтый кристаллический осадок комплексной аммонийной фосфоромолибдеповой гетерополикислоты — фосфоромолибдат аммония.
Мешают анионы-восстановители, восстанавливающие продукт реакции молибденовой сини.
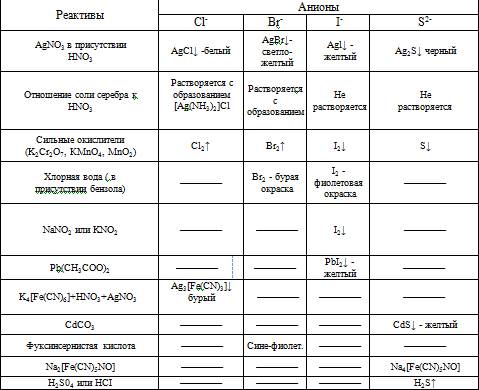
13. Открытие Сl – иона.
Хлорид-ионы осаждают в виде белого осадка хлорида серебра, который, в отличие от AgBr и AgJ, растворяется в насыщенном водном растворе (NH4) 2CО3:
Ag + + Cl – → AgCl,
AgCl + (NH4) 2CO3 → [Ag(NH3) 2]CI + CO2 + H2O.
Раствор отделяют от осадка и доказывают присутствие в нем хлорид-ионов:
[Ag(NH3) 2]CI + 2HNO3 (конц.)→ AgCI ↓ + 2NH4NO3
Открытию Сl – иона мешают SCN – ионы, поэтому их необходимо предварительно удалить.
15. Открытие бензоат-иона С6Н5СОО –
Бензоат-ион – анион слабой одноосновной бензойной кислоты, малорастворимой в воде.
При подкислении растворов, содержащих бензоаты, минеральными кислотам образуется белый осадок бензойной кислоты:
С6Р5СОО – + Н + → ↓C6Н5COOН.
Аналогичный эффект дают салицилат-ионы.
3.1.4. Систематический анализ смеси анионов.
Не существует такая схема систематического анализа смеси анионов в растворе, которая была бы общепринятой, в отличие от систематического анализа смеси катионов.
Ниже предложен один из вариантов анализа смеси анионов. Последовательность операций в общем случае заключается в следующем. Вначале проводятся предварительные испытания, затем дробно в отдельных порциях раствора открывают некоторые анноны, после чего осуществляют разделение анионов с помощью групповых реагентов с последующим открытием анионов в разделенных осадках и растворах.