На чем основана кристаллизация в химии
Кристаллизация и осаждение
Оптимизация размера кристаллов, выхода реакции и чистоты продукта на специализированном оборудовании
Что такое кристаллизация?
Кристаллизация — процесс выстраивания атомов и молекул в жесткую кристаллическую решетку с хорошо определенной энергетически устойчивой структурой. Мельчайший структурный элемент кристаллической решетки — ячейка. Она способна принимать атомы и молекулы, и благодаря этому свойству формируется макроскопический кристалл. В процессе кристаллизации атомы и молекулы соединяются между собой под определенными углами, образуя характерную форму кристалла с гладкими поверхностями и гранями. Хотя кристаллизация происходит в природе, у нее также есть широкое промышленное применение. Она используется на этапе разделения и очистки при производстве фармацевтических и химических продуктов.
Условия процесса кристаллизации напрямую влияют на размер и форму кристаллов и чистоту кристаллического продукта. Важно понимать сущность процесса кристаллизации и правильно подбирать его параметры. Это позволит получать однородные кристаллы нужного размера, формы и чистоты, а также предотвратить проблемы на последующих этапах, такие как слишком долгое время фильтрации или недостаточная сушка.
Почему кристаллизация так важна?
Кристаллизация широко применяется для производства различных необходимых нам продуктов — начиная от пищи и лекарств и заканчивая топливом. Большинство продуктов агрохимической и фармацевтической промышленности в ходе разработки и производства подвергается нескольким этапам кристаллизации. С помощью этого процесса получают такие ключевые пищевые ингредиенты, как лактоза и лизин. Однако нежелательная кристаллизация может быть опасна — например, кристаллизация газовых гидратов в глубоководных трубопроводах.
Основные понятия кристаллизации
Кристаллизация
— это процесс образования твердой фазы в виде кристаллов из растворов или расплавов.
Кристалл
— тело, частицы которого (атомы, ионы или молекулы) расположены в трехмерной периодической структуре, принимающей естественную форму многогранника.
Осаждение
— синоним кристаллизации, однако этот термин чаще всего употребляется в отношении кристаллизации, которая происходит очень быстро в результате химической реакции.
Растворимость
— свойство вещества, его количество, которое способно раствориться в данном растворителе при данной температуре.
Насыщенный раствор
— раствор, содержащий максимальное количество вещества, которое способно раствориться в данном растворителе при данной температуре. Кристаллизация происходит в насыщенном растворе. Количество растворенного на тот момент вещества определяется его растворимостью.
Пересыщение
— разница между реальной и равновесной концентрациями растворенного вещества при данной температуре.
Виды кристаллизации
Кристаллизация происходит, когда растворимость вещества в растворе понижается каким-либо способом. Стандартные методы снижения растворимости:
b) добавление антирастворителя;
d) реакция (осаждение).
Выбор метода кристаллизации зависит от имеющегося оборудования, целей процесса кристаллизации, растворимости и стабильности растворенного вещества в выбранном растворителе.
Типичные сложности при кристаллизации
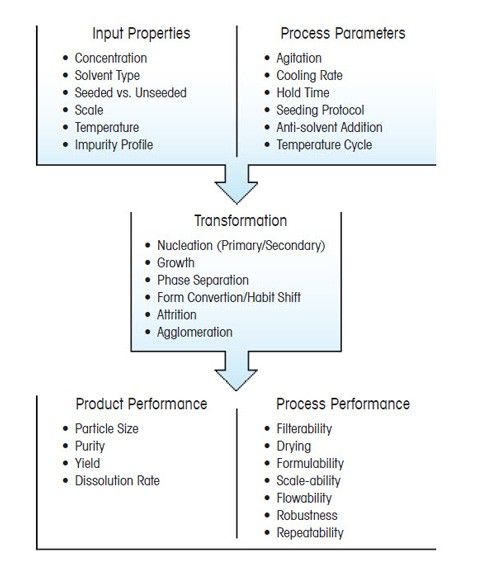
Кристаллизация происходит за счет нескольких взаимосвязанных процессов, на протекание которых влияют выбранные параметры. Основные этапы:
Данные процессы, которые часто протекают в скрытом виде, оказывают ключевое влияние на результат кристаллизации.
Этапы кристаллизации
Публикации по теме кристаллизации
Ознакомьтесь с подборкой статей по теме кристаллизации:
Классическая работа по нуклеации кристаллов из растворов
Jaroslav Nývlt, Kinetics of nucleation in solutions, Journal of Crystal Growth, Volumes 3–4, 1968.
Исследование механизмов выращивания кристаллов из раствора
Crystal Growth Kinetics, Material Science and Engineering, Volume 65, Issue 1, July 1984.
Описание причин, по которым в системах «растворенное вещество — растворитель» вместо кристаллизации происходит образование новой жидкой фазы
Kiesow et al., Experimental investigation of oiling out during crystallization process, Journal of Crystal Growth, Volume 310, Issue 18, 2008.
Подробное исследование причин агломерации кристаллов в процессе кристаллизации
Brunsteiner et al., Toward a Molecular Understanding of Crystal Agglomeration, Crystal Growth & Design, 2005, 5 (1), pp 3–16.
Исследование механизмов распада агломератов в процессе кристаллизации
Fasoli & Conti, Crystal breakage in a mixed suspension crystallizer, Volume 8, Issue 8, 1973, Pages 931–946.
Обзор алгоритмов разработки эффективных процессов кристаллизации в высокотехнологичных сегментах химической промышленности
Paul et al., Organic Crystallization Processes, Powder Technology, Volume 150, Issue 2, 2005.
Технологии, которые гарантируют получение нужной полиморфной формы в процессе кристаллизации
Kitamura, Strategies for Control of Crystallization of Polymorphs, CrystEngComm, 2009,11, 949–964.
Основные параметры и превращения в процессе кристаллизации
Кристаллы обладают множеством характеристик, но, пожалуй, важнейшая из них — это распределение кристаллов по размерам. От этого параметра в значительной степени зависят качество конечного продукта и эффективность процесса его получения. Размер и форма кристаллов непосредственно влияют на основные технологические этапы, следующие за кристаллизацией, — фильтрацию и сушку. Конечный размер кристаллов также определяет качество кристаллического продукта. Например, биологическая доступность и эффективность фармацевтических составов тем выше, чем мельче получаемые кристаллы, так как они лучше растворяются.
Оптимизировать дисперсность кристаллов можно путем тщательного подбора условий и параметров процесса кристаллизации. Чтобы кристаллический продукт приобрел нужные свойства, важно понимать, как параметры процесса влияют на основные превращения в ходе кристаллизации — образование зародышей (нуклеацию), рост и распад кристаллов.
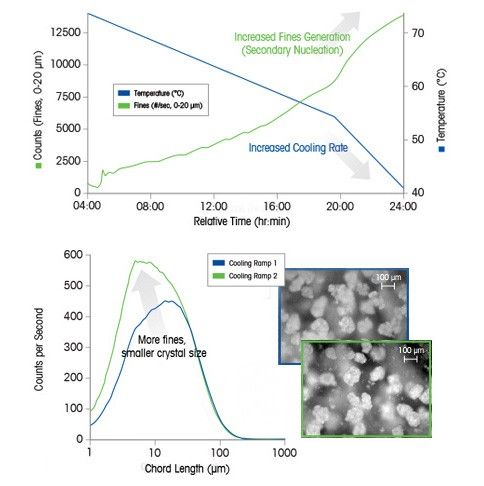
Практический пример: значение скорости охлаждения для кристаллизации
В этом примере охлаждение в конце цикла вызывает вторичную нуклеацию, которая приводит к образованию множества мелких частиц. Исследование проведено с использованием анализаторов размера частиц.
Увеличение скорости охлаждения раствора ведет к более быстрому пересыщению, в результате скорость образования зародышей кристаллов будет выше скорости их роста. Следовательно, чтобы получить нужное распределение кристаллов по размеру, чрезвычайно важно контролировать скорость охлаждения.
Дисперсность кристаллов льда, например, влияет на вкус и консистенцию мороженого: так, кристаллы размером менее 50 мкм предпочтительнее кристаллов, которые больше 100 мкм. Она влияет и на технологические свойства распыляемых агрохимикатов: их частицы должны быть малы настолько, чтобы не засорять сопла при распылении, но при этом достаточно большими, чтобы их не уносило на соседние поля.
При масштабировании получить кристаллический продукт нужного размера и формы с наименьшими издержками возможно лишь в случае понимания всех нюансов кристаллизации.
Оборудование для кристаллизации
Процессно-аналитическая технология для разработки процессов кристаллизации
Рабочая станция кристаллизации позволяет ученым получать максимум информации из каждого эксперимента с помощью централизованного программного решения. Средства процессно-аналитической технологии (PAT):
Автоматизированные реакторы
Точное регулирование критических параметров процесса
В дисперсных системах такие параметры, как температура, интенсивность перемешивания или режим дозирования, непосредственно влияют на качество процесса и конечного продукта. Приборы EasyMax, OptiMax, RC1 и RX-10 обеспечивают точное регулирование и регистрацию условий процесса для гибкого конструирования дисперсных систем.
Определение характеристик частиц
Изучение частиц в технологической среде
Размер, форма и концентрация — это важнейшие свойства частиц на каждой стадии процесса кристаллизации и на всех этапах масштабирования, поэтому они считаются критическими показателями качества (CQA). Анализаторы размера частиц оперативно отображают и количественно характеризуют частицы и важнейшие механизмы их формирования, что существенно облегчает разработку процессов кристаллизации.
Химический и структурный анализ
Достижение заданной конечной точки — в каждом эксперименте
Такие характеристики среды, как концентрация раствора, степень пересыщения и кристаллическая (полиморфная) модификация, часто связаны между собой и в совокупности определяют успех разработки технологического процесса кристаллизации. Системы ReactIR и ReactRaman анализируют состояние раствора и дисперсии для безошибочного достижения заданной конечной точки процесса.
Как разработать процесс кристаллизации
Разработка процесса кристаллизации для получения чистого продукта с оптимальным выходом и размером частиц включает в себя ряд важных элементов:
Кристаллизация в чем состоит, метод разделения, типы и примеры
кристаллизация это процесс, в котором твердое тело образуется с атомами или молекулами в организованных структурах, которые называются кристаллическими сетями. Кристаллы и кристаллические сети могут образовываться в результате осаждения раствора, путем синтеза и, в некоторых случаях, путем прямого осаждения газа..
Структура и природа этой кристаллической сети будет зависеть от условий, в которых происходит процесс, включая время, прошедшее до достижения этого нового состояния. Кристаллизация как процесс разделения чрезвычайно полезна, поскольку она позволяет гарантировать, что структуры получаются только из желаемого соединения..
Кроме того, этот процесс гарантирует, что прохождение других частиц не будет разрешено, учитывая упорядоченную природу кристалла, что делает этот метод отличной альтернативой для очистки растворов. Много раз в химии и химическом машиностроении необходимо использовать процесс разделения смешения.
Эта потребность возникает либо для повышения чистоты смеси, либо для получения ее конкретного компонента, и по этой причине существует несколько методов, которые можно использовать в зависимости от фаз, в которых обнаружена эта комбинация веществ..
Из чего состоит кристаллизация??
Кристаллизация требует двух шагов, которые должны произойти, прежде чем может быть образование кристаллической сети: во-первых, должно быть достаточно накопления атомов или молекул на микроскопическом уровне, чтобы началось так называемое зародышеобразование.
Эта стадия кристаллизации может происходить только в переохлажденных жидкостях (т. Е. Охлажденных ниже точки замерзания, не делая их твердыми) или перенасыщенных растворах..
После начала зародышеобразования в системе ядра могут быть сформированы достаточно стабильными и достаточно большими, чтобы начать второй этап кристаллизации: рост кристаллов.
зарождение
На этом первом этапе определяется расположение частиц, которые будут образовывать кристаллы, и наблюдается влияние факторов окружающей среды на образовавшиеся кристаллы; например, время, необходимое для появления первого кристалла, называется временем зарождения.
Существует две стадии нуклеации: первичная и вторичная нуклеация. В первом случае новые ядра образуются, когда в середине нет других кристаллов или когда другие существующие кристаллы не влияют на их образование..
Первичное зародышеобразование может быть гомогенным, при котором нет влияния на часть твердых веществ, присутствующих в среде; или он может быть гетерогенным, когда твердые частицы внешних веществ вызывают увеличение скорости нуклеации, которое обычно не происходит.
При вторичном зародышеобразовании новые кристаллы образуются под воздействием других существующих кристаллов; это может произойти из-за сил резания, которые делают сегменты существующих кристаллов новыми кристаллами, которые также растут с собственной скоростью.
Этот тип зародышеобразования выгоден в системах с высокой энергией или в потоке, где вовлеченная жидкость вызывает столкновения между кристаллами.
Рост кристаллов
Это процесс, в котором кристалл увеличивает свой размер путем агрегации большего количества молекул или ионов в промежуточные положения своей кристаллической сети..
В отличие от жидкостей, кристаллы растут равномерно только тогда, когда молекулы или ионы входят в эти положения, хотя их форма будет зависеть от природы рассматриваемого соединения. Любое неправильное расположение этой структуры называется дефектом кристалла..
Рост кристалла зависит от ряда факторов, среди которых, среди прочего, поверхностное натяжение раствора, давление, температура, относительная скорость кристаллов в растворе и число Рейнольдса..
Кроме того, важно отметить, что с маленькими кристаллами намного сложнее манипулировать, хранить и перемещать, и их фильтрация из раствора стоит дороже, чем более крупные. В подавляющем большинстве случаев самые крупные кристаллы будут наиболее желательными по этим и другим причинам..
Как метод разделения
Необходимость в очистке растворов является общей в химии и химической инженерии, поскольку может возникнуть необходимость в получении продукта, который гомогенно смешан с другими или другими растворенными веществами..
Вот почему было разработано оборудование и методы для проведения кристаллизации как процесса промышленного разделения..
Существуют различные уровни кристаллизации, в зависимости от требований, и могут быть выполнены в небольшом или крупном масштабе. Следовательно, его можно разделить на две основные классификации:
перекристаллизация
Это называется перекристаллизацией в технику, которая используется для очистки химикатов в меньших масштабах, обычно в лаборатории.
Это делается с помощью раствора желаемого соединения вместе с его примесями в подходящем растворителе, стремясь тем самым осаждать в виде кристаллов некоторые из двух частиц, которые впоследствии будут удалены..
Существует несколько способов перекристаллизации растворов, среди которых перекристаллизация с растворителем, с несколькими растворителями или с горячей фильтрацией..
-Единый растворитель
Когда используется один растворитель, для получения насыщенного раствора готовят раствор соединения «А», примеси «В» и минимально необходимого количества растворителя (при высокой температуре)..
Затем раствор охлаждают, что приводит к падению растворимости обоих соединений и перекристаллизации соединения «А» или примеси «В». В идеале желательно, чтобы кристаллы были из чистого соединения «А». Может быть необходимо добавить ядро, чтобы начать этот процесс, который может даже быть осколком стекла.
-Различные растворители
При перекристаллизации нескольких растворителей используют два или более растворителей, и проводят тот же процесс, что и с растворителем. Преимущество этого процесса состоит в том, что соединение или примесь будут осаждаться при добавлении второго растворителя, поскольку они не растворимы в нем. В этом методе перекристаллизации нет необходимости нагревать смесь.
-Горячая фильтрация
Наконец, рекристаллизация с горячей фильтрацией используется, когда есть нерастворимое вещество «С», которое удаляется с помощью высокотемпературного фильтра после выполнения той же процедуры перекристаллизации одного растворителя..
В промышленной сфере
В промышленной области мы хотим осуществить процесс, называемый фракционной кристаллизацией, который представляет собой метод, который очищает вещества в соответствии с их различиями в растворимости..
Эти процессы напоминают процессы перекристаллизации, но используют разные технологии для обработки больших количеств продукта.
Применяются два метода, которые будут лучше объяснены в следующем утверждении: кристаллизация охлаждением и кристаллизация испарением.
Будучи крупномасштабным, этот процесс генерирует отходы, но они обычно рециркулируются системой для обеспечения абсолютной чистоты конечного продукта..
Типы кристаллизации
Как указано выше, существует два типа крупномасштабной кристаллизации: охлаждение и испарение. Также были созданы гибридные системы, где оба явления происходят одновременно.
Кристаллизация при охлаждении
В этом методе раствор охлаждают, чтобы уменьшить растворимость желаемого соединения, заставляя его начать осаждаться с желаемой скоростью..
В химическом машиностроении (или процессах) кристаллизаторы используются в форме резервуаров со смесителями, которые циркулируют хладагенты в отсеках, которые окружают смесь, так что оба вещества не вступают в контакт, пока происходит теплопередача хладагента в раствор..
Для удаления кристаллов используются скребки, которые толкают твердые фрагменты в яму.
Кристаллизация выпариванием
Это еще один вариант достижения осаждения кристаллов растворенного вещества с использованием процесса испарения растворителя (при постоянной температуре, в отличие от предыдущего метода), чтобы концентрация растворенного вещества превышала уровень растворимости..
Наиболее распространенными моделями являются так называемые модели с принудительной циркуляцией, которые удерживают раствор кристаллов в однородной суспензии через резервуар, управляя их потоком и скоростью, и обычно генерируют кристаллы большего размера, чем те, которые образуются при кристаллизации. охлаждением.
примеров
— При добыче соли из морской воды.
— В производстве сахара.
— При образовании сульфата натрия (Na2SW4).
— В фармацевтической промышленности.
— При изготовлении шоколада, мороженого, масла и маргарина, в дополнение ко многим другим продуктам.
На чем основана кристаллизация в химии
Кристаллизация является простейшим методом разделения и очистки твердых веществ. Метод кристаллизации состоит из пяти стадий :
1.растворение твердого вещества в минимальном объеме кипящего растворителя (приготовление насыщенного раствора);
2.фильтрование горячего раствора для удаления нерастворимых примесей (если они присутствуют);
3.охлаждение раствора и образование кристаллов;
4.отделение кристаллов от маточного раствора фильтрованием;
5.высушивание кристаллов.
Для того чтобы достичь высокой степени чистоты, может потребоваться неоднократная перекристаллизация.
Для успешной кристаллизации чрезвычайно важным является правильный выбор растворителя, в котором очищаемое вещество легко растворяется при нагревании и практически не растворяется на холоду и в котором хорошо растворимы примеси.
На практике растворитель подбирают путем серии пробных кристаллизаций. Общая закономерность «подобное растворяется в подобном», т.е. полярные соединения более растворимы в полярных растворителях, чем в неполярных, и наоборот.
Некоторые общие характеристики растворимости и полярности растворителей приведены в таблице 1.
Таблица 1.
Общие характеристики растворимости некоторых классов соединений и растворителей, используемых при кристаллизации.
Приготовление насыщенного раствора.
После подбора растворителя очищаемый твердый продукт помещают в коническую колбу со шлифом. Добавляют минимальное количество растворителя, чтобы покрыть им твердое вещество. Присоединяют к колбе обратный холодильник и нагревают смесь на водяной бане или электроплитке до кипения. Нагревают в течение нескольких минут и при этом часть твердого вещества растворяется. Затем через обратный холодильник пипеткой добавляют растворитель небольшими порциями до полного растворения твердого вещества. После каждого добавления растворителя дают возможность содержимому в колбе кипеть в течение нескольких минут для растворения твердого вещества.
Помните, что необходимо использовать минимальный обьем растворителя.
Если в растворе присутствуют нерастворимые примеси,нужно провести фильтрование горячего раствора. Интенсивно окрашенные растворы, содержащие примеси смолы, обесцвечивают древесным углем.
Для этого раствор немного охлаждают, добавляют порошкообразный древесный уголь (1-3 % от массы органического твердого вещества), доводят раствор до кипения и кипятят с обратным холодильником в течение нескольких минут. Древесный уголь удаляют горячим фильтрованием.
Кристаллизацию проводят двумя способами :
после горячего фильтрования насыщенный раствор медленно охлаждают до комнатной температуры,а затем помещают в холодильник;
в насыщенный раствор при комнатной температуре добавляют по каплям второй растворитель, в котором вещество плохо растворимо, до тех пор пока не появится слабая опалесценция, а затем еще добавляют одну или две капли первого растворителя, чтобы устранить помутнение (образования двух фаз не должно происходить).
Наиболее часто применяют следующие смеси двух растворителей :
1) диэтиловыйэфир-н.гексан,
2) дихлорметан-н.гексан,
3) хлороформ-циклогексан,
4) ацетон-диэтиловый эфир,
5) ацетон-вода,
6) метанол-вода,
7) этанол-вода.
В некоторых случаях кристаллы при охлаждении раствора не образуются, даже если раствор пересыщен. Это может происходить из-за отсутствия центров, инициирующих образование кристаллов. Для ускорения процесса кристаллизации применяют несколько способов :
добавляют «затравочный» кристалл («затравку») того же самого вещества (для этой цели полезно оставлять небольшое количество неочищенного вещества),
потирают стеклянной палочкой с острыми краями по внутренней стороне колбы на уровне жидкости, что приводит к образованию неровностей на стеклянной поверхности, которые служат центрами роста кристаллов,
раствор переохлаждают (до –70 о С) и медленно нагревают до комнатной температуры с одновременным потиранием стеклянной палочкой.
Температура для наилучшего образования зародышей кристаллов лежит
на 100 о С, а для наилучшего роста кристаллов
на 50 о С ниже температуры плавления кристаллизующегося соединения.
Слишком сильное и быстрое охлаждение часто не приводит к кристаллизации.
Следует обратить внимание на то, чтобы температура кипения растворителя была ниже температуры плавления вещества, которое необходимо перекристаллизовать, как минимум на 30 о С. При нарушении такого интервала температур вещество, как правило, выделяется в виде масла.
Замечание : Кристаллизация – это трудоемкий процесс,требующий терпения и экспериментального мастерства, в котором пробуют всегда большое число растворителей и обязательно контролируют степень очистки по температуре плавления и хроматографическими методами (например, ТСХ).
После проведения кристаллизации кристаллы отфильтровывают, сушат и взвешивают. Низкий выход очищаемого вещества указывает на то, что используемый растворитель не был идеальным или его было взято слишком много. В таких случаях из фильтрата (маточного раствора) можно дополнительно выделить кристаллы после удаления избытка растворителя на роторном испарителе и охлаждении оставшегося раствора. Как правило, эти последующие порции вещества менее чистые, чем выделенные ранее.
Если вещество не растворяется, пробирку подогревают на водяной бане до кипения, периодически встряхивая пробирку. Если вещество растворилось не полностью, добавляют растворитель малыми порциями до общего объема примерно 1,5 мл.
Если часть твердого вещества не растворилась,то следует попробовать другой растворитель. При получении прозрачного раствора пробирку охлаждают. Если после стояния в течение нескольких минут кристаллы не появляются, добавляют в качестве “затравки“ кристалл или потирают стенку пробирки стеклянной палочкой.