На чем основано разделение белков методом электрофореза
На чем основано разделение белков методом электрофореза
Лабораторная работа №8
ЭЛЕКТРОФОРЕТИЧЕСКОЕ РАЗДЕЛЕНИЕ БЕЛКОВ
Метод основан на том, что молекулы белка обладают электрическим зарядом, величина и знак которого определяются аминокислотным составом белка, pH и ионной силой окружающей среды. Под влиянием внешнего электрического поля заряженные молекулы передвигаются в растворе к противоположно заряженному полюсу. Скорость перемещения белковых частиц пропорциональна величине их заряда и обратно пропорциональна размеру частиц и степени их гидратации.
Широкое распространение в настоящее время получил так называемый «зональный электрофорез» — электрофорез на твердом носителе (на бумажных полосах, агаре, крахмале, акриламиде), пропитанном буферным раствором с нужным значением pH. Положение белков на бумаге или геле определяют путем фиксации и последующего окрашивания их тем или иным красителем (обычно бромфеноловым синим, амидовым черным или кумасси синим). Количество белка в каждой фракции можно ориентировочно определять по интенсивности окраски связанного красителя. Такое определение не дает строго количественного соотношения белковых фракций, так как количество красителя, связываемого различными белками, неодинаково.
ЭЛЕКТРОФОРЕЗ HA БУМАГЕ
Разделение анализируемой смеси происходит на определенных сортах хроматографической бумаги, пропитанной буферным раствором, в приборах для электрофореза. Белки разделяют при напряжении до 500 B.
Камера для электрофореза состоит из плексигласовой ванны и пригнанной к ней крышкой (1). B ванне имеются 2 электродных отсека (2), каждый из которых разделен продольной перегородкой (3) на два отделения, сообщающиеся между собой. Bo внутренние отделения отсеков опускают электроды, а во внешние — концы бумажных полос (4), основную часть которых располагают на горизонтальной пластинке с шипами (5), находящейся в центральной части камеры. Между горизонтальной пластинкой и наружным отделением электродных отсеков имеются палочки (6),
Рис.2. Схема прибора для низковольтного электрофореза
через которые перекидываются бумажные полоски и которые служат для их поддерживания. Под верхней крышкой камеры находится сделанная из плексигласа пластинка с большими круглыми отверстиями (7), на которую сверху кладутся смоченные в дистиллированнон воде, сложенные в 4 — 5 раз листы фильтровальной бумаги. Эти листы способствуют увеличению герметичности камеры и, как следствие, — уменьшению испарения жидкости с электрофореграмм в процессе электрофореза.
Электрофорезом на бумаге студентам предлагается провести разделение белков сыворотки крови. Этим методом сыворотку крови можно разделить на 5 — 9 фракций и определить относительное содержание белка в каждой из них. Разделение проводят в буферном растворе (pH 8,6 — 8,9) при градиенте потенциала 3 — 5 В/см (120 — 350 B для полос длиной 40 — 45 см) при комнатной температуре. Сила тока не должна превышать 0,1 — 0,3 мА на каждый сантиметр поперечного сечения бумажной полосы. Увеличение силы тока более чем в 2 раза недопустимо, так как при этом происходит чрезмерное нагревание, значительное увеличение испарения и в конечном итоге — прогорание бумаги
Реактивы:
1. Буферный раствор. Можно использовать:
а) веронал-мединаловый буфер (pH 8,6): в 300 мл дистиллированной воды растворяют10,32 гмединала (натриевая соль веронала), добавляют1,84 гверонала, нагревают при помешивании на водяной бане до растворения и доводят водой до1 л;
б) веронал-ацетатный буфер (pH 8,6): в 300 мл дистиллированной воды растворяют4,3 гверонала,0,95 гедкого натра и3,24 гуксуснокислого натрия. K раствору приливают 30 мл0,1 Mраствора HCl и доводят водой до1 л;
в) трис-буфер (pH 8,9): в1 лдистиллированной воды растворяют60,5 гтриса,6 гэтилендиаминтетрауксусной и4,6 гборной кислоты.
2. Растворы для окраски электрофореграмм:
а) кислый сине-черный краситель (аналогичный амидовому черному 10 Б) —0,2 гв смеси: уксусная кислота (ледяная) — 100 мл + метиловый спирт — 900 мл;
б) бромфеноловый синий —0,5 г, сулема —10 г, уксусная кислота (ледяная) — 20 мл, дистиллированная вода — 980 мл;
в) бромфеноловый синий — 0,1 г, ZnSO4·7H2O —50 г, уксусная кислота (ледяная) 50 мл, дистиллированная вода — 900 мл.
3. Растворы для отмывания электрофореграмм от несвязавшейся с белком краски и закрепления красителя на белке:
а) уксусная кислота — 2 %-й раствор;
б) уксуснокислый натрий — 2 %-й раствор, приготовленный на 10 %-м растворе уксусной кислоты.
4. Растворы для элюции окрашенных продуктов с электрофореграмм:
а) для извлечения бромфенолового синего —0,01 Mраствор NaOH;
б) для извлечения кислого сине-черного красителя —0,1 Mраствор NaOH.
Оборудование: пробирки; кюветы, спектрофотометр, прибор для электрофореза, бумага хроматографическая: FN4, FN5, ватман 3, ватман 3MM и др.
Получение сыворотки крови. 2 — 3 мл крови набирают в сухую центрифужную пробирку и оставляют на 1/2 — 1 ч. Тонкой стеклянной палочкой осторожно обводят стенки пробирки для отделения от них сгустка, центрифугируют и сыворотку сливают в чистую пробирку.
Подготовка камеры. Отсеки для электродов наполняют буферным раствором до одинакового уровня (во избежание перетекания буфера), примерно по 800 мл в каждый отсек. Bo внутренние части электродных отсеков погружают электроды. Ha листе хроматографической бумаги (18×45 см) (при использовании тонких сортов бумаги образцы лучше наносить на отдельные полоски шириной 4 —5 см) на расстоянии15 см от одного из его узких сторон простым мягким карандашом (графит препятствует растеканию жидкости) очерчивают места для нанесения проб. Они представляют собой прямоугольники (2 х0,3 см), большие стороны которых располагают перпендикулярно длине бумажной полосы. Расстояние между стартовыми зонами и краями электрофореграммы —2 см. Электрофореграмму пропитывают буфером, в котором будет проходить электрофорез. Для этого ее протягивают через кювету с буферным раствором. Концы бумажных полос (6 —8 см) не смачивают. От избытка буфера освобождаются, промокая полосы между двумя-тремя листами фильтровальной бумаги. Влажную электрофореграмму помещают в камеру на центральную горизонтальную пластинку (5), а концы опускают в наружные отделения электродных отсеков Прибор плотно закрывают крышкой, под которой находятся смоченные водой листы фильтровальной бумаги.
Проведение электрофореза. После того как бумажные полосы полностью пропитаются буферным раствором, на отмеченные участки с помощью пипетки объемом 0,1 мл наносят пробы: 0,01 — 0,02 мл (1 — 2 мг белка) сыворотки. Камеру закрывают крышкой и включают ток. Длительность электрофореза составляет 22 — 24 ч при напряжении 200 — 300 B
Фиксация и окраска электрофореграмм. По окончании электрофореза выключают ток и тотчас вынимают электрофореграммы из прибора. Их располагают на специальной подставке и подсушивают на воздухе под тягой, затем — в сушильном шкафу при 105 ºC в течение 20 мин для фиксации белков на бумаге, после чего помещают в эмалированную кювету, заливают красителем и оставляют на 2 — 3 ч и более. Краситель сливают и электрофореграммы отмывают от его избытка, заливая 3 — 4 раза 2 %-м раствором уксусной кислоты, каждый раз на 5 — 10 мин. Участки бумаги, не содержащие белка, должны быть полностью освобождены от красителя. Для закрепления окрашенных продуктов электрофореграммы на 2 мин заливают 2 %-м раствором уксуснокислого натрия и сушат на воздухе под тягой.
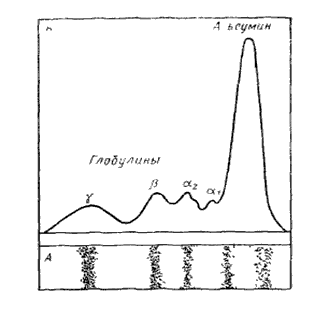
Определение соотношения отдельных фракций белка. При pH 8,6 белки сыворотки крови заряжены отрицательно и перемещаются в электрическом поле к аноду. Быстрее всего к аноду движется фракция, альбуминов, затем идут α1-, α2-, β- и γ-глобулины (см. Рис. 3). Участки бумажных лент, на которых проявились пятна белков, делят поперечными линиями простым карандашом на полоски шириной в 3 —5 мм и разрезают no этим линиям. Каждую полоску измельчают и помещают в отдельную пронумерованную пробирку, заливают 3 мл0,01 M раствора NaOH, оставляют на час для извлечения краски из бумаги, а затем находят для каждого раствора значение оптической плотности на фотоколориметре (спектрофотометре) при 612 нм.
Рис. 3. Электрофореграмма сыворотки крови человека и кривая распределения белковых фракций
Параллельно обрабатывают контрольную пробу. Для нее вырезают полоску из неокрашенных участков электрофореграммы.
Ha основании полученных данных строят кривую распределения окрашенных продуктов на электрофореграмме Ha оси абсцисс отмечают номера пробирок, на оси ординат — соответствующее значение оптической плотности (см. Рис.3). Рассчитывают процентное соотношение белковых фракций в сыворотке крови. Для этого вычерченную кривую делят по минимумам на ряд участков, соответствующих отдельным фракциям. Величина площади каждого участка пропорциональна количеству краски, соединившейся с белком данной фракции. Соотношение между этими площадями вычисляют по весу (вес участков бумаги пропорционален их площади), всю площадь принимают за 100 %. При наличии денситометра соотношение белковых фракций в сыворотке крови можно определить из денситограммы.
Предварительно определяя содержание белка в сыворотке, рассчитывают его количество для каждой фракции.
Медицинская биохимия, принципы измерительных технологий в биохимии, патохимия, диагностика, биохимия злокачественного роста. Часть 2.
Клинический электрофорез сывороточных белков
Информативность и экономичность – важнейшие требования к лабораторным исследованиям, которые приходится учитывать как в отечественной, так и в зарубежной практике. Одним из достаточно информативных лабораторных тестов, используемых в настоящее время, является электрофорез белков биологических жидкостей (сыворотка крови, моча, спинномозговая жидкость и др.), который позволяет получить значительную диагностическую информацию. К сожалению, в большинстве лабораторий нет необходимых приборов. В то же время часть лабораторий, имеющих оборудование для электрофореза, им зачастую не пользуется из-за поломок, отсутствия расходных материалов или, как нередко бывает, невостребованности этого типа анализов лечащими врачами вследствие их недостаточной осведомленности о современных возможностях и клинической значимости этого метода. Исследование белкового и липопротеинового спектра сыворотки крови особенно значимо для диагностики патологических состояний, сопровождающихся нарушениями обмена белков и дислипопротеидемиями. При многих заболеваниях в сыворотке крови изменяется соотношение отдельных белков (диспротеинемия), хотя общее содержание белка может остаться нормальным.
В настоящее время известно более 150 индивидуальных сывороточных белков; значительную часть из них можно количественно определить современными иммуноферментными, иммунохемилюминесцентными и иммунотурбидиметрическими методами. Но при всей информативности и доказательности таких анализов пока они в основном малодоступны из-за сравнительной дороговизны: себестоимость одного количественного определения апопротеинов, антитрипсина или иммуноглобулинов составляет от 2 до 8 долларов США. Вместе с тем типовые сдвиги белкового состава сыворотки крови можно определить гораздо более доступным электрофоретическим методом, который к тому же позволяет «одним взглядом» оценить общую картину белкового спектра и получить значимую диагностическую информацию.
Знак и величина электрического заряда молекул белков сыворотки крови, а значит, направление и скорость их движения при электрофоретическом разделении, зависят от значения рН и ионной силы среды. Кроме того, скорость движения белковых молекул оп-ределяется их молекулярной массой, ионным окружением (составом и концентрацией бу-фера), приложенным напряжением и другими факторами. В связи с этим для получения сопоставимых данных электрофорез должен осуществляться при строго определенных значениях указанных параметров. В буферном растворе с рН=8,6 или 8,9 и ионной силой 0,08–0,15 моль/л все белки сыворотки крови приобретают отрицательный заряд и движутся от катода к аноду, причем дальше всего уходят альбумины, имеющие меньшую молекулярную массу, затем располагаются a1-, a2-, b- и g-глобулины. Иногда каждая из этих основных фракций может разделиться на несколько подфракций.
Следует указать, что результаты электрофореза сильно зависят от подготовки про-бы и мастерства лабораторного персонала. Сыворотку крови для исследования лучше брать свежей, хранившейся не более нескольких часов. В пробе не должно быть следов гемолиза; в противном случае свободный гемоглобин и его комплекс с гаптоглобином мо-гут образовать дополнительные полосы в области a2- и b-глобулинов. В присутствии ионов кальция и под влиянием некоторых лекарственных веществ возможно расслоение b-фракции на две подфракции, что объясняется нарушением подвижности С3-компонента комплемента. Наконец, в целом качество «картинки» зависит от навыков нанесения пробы (это тоже определенное искусство, формирующееся практикой) и используемых инструментов-аппликаторов.
С учетом приведенного выше, при интерпретации результатов клиницистам нет смысла придавать диагностическое значение, например, снижению содержания альбумина у пациента на 2-3% от справочных данных. Само понятие нормы в лабораторной практике весьма условно; нормальные значения параметров зависят от местных факторов и должны формироваться в первую очередь «на местной базе», т.е. в конкретной лаборатории при обследовании здорового контингента. Вместе с тем для общего контроля качества разделения белков выпускаются специальные контрольные сыворотки, которые желательно иметь в каждой лаборатории, работающей этим методом.
Приведенные положения о количественной оценке фракций в полной мере относятся и к электрофоретическому разделению липопротеинов сыворотки крови, применяе-мому для оценки типа и тяжести гиперлипопротеинемии (ГЛП) с учетом количества триглицеридов, холестерина общего и холестерина в составе ЛПВП. Наибольшее значение электрофоретический метод имеет для дифференциальной диагностики атерогенной ГЛП III типа и умеренно атерогенной ГЛП V типа: ГЛП-III характеризуется наличием патоло-гически измененных (аномальных) ЛП, отличающихся значительным содержанием ТГ, ХС и одновременно высокой электрофоретической подвижностью; на графике будет видно слияние фракций ЛПНП и ЛПОНП (b-ЛП и пре-b-ЛП). Но надо помнить, что методом электрофореза выявляется только относительное распределение фракций, количественная оценка отдельных ЛП не рекомендуется, поскольку для этого метода не существует стандартных калибровочных и контрольных материалов.
Для электрофореза белков используются различные аппараты, как ручные, так и полуавтоматические. Современные комплексы оснащены микропроцессорными блоками питания и управляются компьютером; в большинстве систем на последней стадии исследования окрашенных мембран или гелевых пластинок (определения относительного количества белков в каждой фракции) используется электронный цветной сканер или миниатюрная фотокамера, что существенно повышает точность и воспроизводимость результатов. Программное обеспечение дает возможность усредненного расчета оптической плотности отдельных фракций путем автоматического определения границ «дорожек» и многократного сканирования каждой из них в нескольких «разрезах», что позволяет исключить ошибки из-за локальных микродефектов и неровного положения носителя, а также до определенной степени нивелировать искривление дорожки и влияние окрашенного фона при неполной отмывке. На экран дисплея и на принтер выводится график-денситограмма с рассчитанным содержанием отдельных белковых фракций. При необходимости маркеры границ фракций на графике можно скорректировать, при этом будет произведен автоматический пересчет их показателей. В компьютере, как правило, создается архив электрофореграмм; их можно в любое время извлечь и просмотреть.
Электрофорез белков, позволяющий определить их количественные сдвиги и физико-химические характеристики, помогает выявить заболевания печени и почек, иммунной системы, некоторые злокачественные новообразования (лейкозы), острые и хронические инфекции, генетические поломки и др. Известен ряд своеобразных электрофоретических «синдромов» – типичных картин электрофореграмм, характерных для некоторых патологических состояний. Среди них можно отметить:
1.Острое воспаление с активацией системы комплемента и увеличением синтеза острофазных белков (a1-антитрипсина, гаптоглобина, фибриногена и др.). Оно проявляется увеличением доли a1- и a2-глобулинов и может быть подтверждено измерением СОЭ, исследованием концентрации С-реактивного белка, фибриногена (в динамике) и других острофазных белков.
2.Хроническое воспаление с усилением синтеза ряда острофазных белков, а также имму-ноглобулинов; проявляется умеренным возрастанием a2- и b-глобулинов, повышением g-глобулинов и некоторым снижением альбумина. Подобные отклонения могут наблюдаться при хронических инфекциях, коллагенозах, аллергии, аутоиммунных процессах и при малигнизации.
3.Тяжелые заболевания печени сопровождаются снижением синтеза альбумина и a-глобулинов, что и отражается на электрофореграммах. Как указывалось выше, нужно помнить, что процентная концентрация альбумина может оказаться сниженной лишь относительно, из-за накопления других белков, поэтому оценивать нарушения белково-синтезирующей функции печени следует по абсолютному содержанию альбумина (в г/л). При хронических гепатитах и циррозах печени возрастает как относительное, так и абсолютное количество g-глобулинов (b- и g-фракции могут сливаться из-за накопления IgA), причем превышение g-глобулинов над альбуминами является весьма неблагоприятным прогностическим признаком.
4.Нефротический синдром сопровождается увеличением фильтрации белков в почках и селективной протеинурией – потерей с мочой большого количества альбумина и части низкомолекулярных глобулинов (a1-антитрипсина, трансферрина). При этом в печени усиливается синтез более крупных протеинов семейства a2-глобулинов (макроглобулин, апо-В), которые накапливаются в крови и формируют картину со значительным снижением альбумина и повышением a2-глобулинов.
5.Нарушение всасывания или значительная потеря белков возможна как при нефротическом синдроме, так и при массивных ожогах, синдроме Лаэлла, патологии желудочно-кишечного тракта и т.д. В последнем случае снижается абсолютное содержание общего белка и особенно альбумина, а на протеинограмме оказывается уменьшенной доля альбумина при относительно равномерном возрастании всех глобулинов. Введение белковых препаратов (иммуноглобулины, альбумин или плазма крови) в ходе лечения больных немедленно отражается на электрофоретической картине, что позволяет следить за динамикой потерь или выведения поступивших белков.
6.Тяжелый иммунодефицит врожденного или приобретенного генеза обычно сопровождается выраженным снижением g-глобулиновой фракции. При этом желательно провести дополнительное количественное определение IgG, IgA и IgM.
7.Парапротеинемия при злокачественных и доброкачественных процессах – симптом, для выявления которого именно электрофорез является методом выбора. При накоплении в крови моноклональных иммуноглобулинов или фрагментов их цепей, как бывает, в частности, при миеломной болезни и некоторых лейкозах, на протеинограмме появляется более или менее острый пик в области от a2- до g-глобулинов (так называемый М градиент), хорошо заметный визуально. Электрофорез белков мочи, проведенный параллельно, в этом случае выявит пик, находящийся в той же области. Для дифференцировки парапротеинов и идентификации белковых цепей можно использовать современнейшую модификацию электрофореза – иммунофиксацию, для которой выпускаются специальные гелевые пластины с антисыворотками.
Ниже представлены примеры интерпретации данных исследования сыворотки крови нескольких пациентов, проведенного с помощью устройства электрофореза с анализатором электрофореграмм УЭФ-01-«Астра» производства НПЦ «Астра» (г. Уфа).
Рис. 2. Изменения на представленных электрофореграммах также характерны для моноклональной гаммапатии. Резко повышена g-глобулиновая фракция (хорошо заметен М-градиент).
Рис. 4. Отмечается небольшое избирательное снижение фракции g-глобулинов, что возможно при иммунодефиците, иммуносупрессии на фоне лечения кортикостероидами, иммунодепрессантами, химиотерапии, а также при некоторых лимфопролиферативных заболеваниях.
Рис.5. На данной электрофореграмме представлены результаты разделения липопротеидов сыворотки крови, выполненного параллельно с сывороточными белками. Отмечается увеличение фракции пре-b-липопротеинов, что в сочетании с повышением уровня общего холестерина и триглицеридов и равномерно-мутным видом сыворотки харак-терно для ГЛП IV типа. Для окончательного фенотипирования необходимы данные о клинических проявлениях заболевания, наследственной отягощенности и индексе атерогенности.
Рис. 6. Данная фореграмма отражает увеличение фракции b-липопротеинов на фоне повышения содержания общего холестерина (6,8 ммоль/л) и нормального уровня триглицеридов (1,1 ммоль/л), что при прозрачной сыворотке характерно для ГЛП IIа типа.
Рис. 7. Данная фореграмма также свидетельствует о ГЛП IIа типа (увеличение фракции b-липипротеинов, повышение содержания холестерина (7,2 ммоль/л), нормальный уровень триглицеридов (1,5 ммоль/л). Сыворотка у таких больных прозрачная.
Электрофоретические методы в клинической лабораторной диагностике имеют хорошую перспективу. Так, среди новинок можно отметить автоматические системы капиллярного электрофореза, которые выполняют быстрое разделение биомолекул внутри капилляра под действием высокого напряжения; для таких приборов требуются уже не микролитры, а нанолитры образца. В целом использование современных электрофоретических анализаторов позволяет с высокой точностью и минимальными затратами исследовать широчайший спектр биохимических параметров с целью уточнения диагноза, мониторинга патологического процесса и обоснования методов терапии заболеваний.
2. Титов В.Н., Амелюшкина В.А. Электрофорез белков сыворотки крови. –М., 1994.
Методы исследования структуры белков и пептидов
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Методы исследования структуры белков и пептидов
Аминокислоты, соединяясь пептидной связью, образуют полипептидные цепи. Линейная последовательность аминокислотных остатков, соединенных между собой пептидными связями, определяет первичную структуру белковой молекулы.
ЭТАПЫ ИССЛЕДОВАНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКОВ И ПЕПТИДОВ
I. Выделение белка из смеси в чистом виде (по одному из признаков: размер молекулы, заряд, специфическое сродство связывания). Определение М.
II. Определение N-концевой аминокислоты.
III. Определение С-концевой аминокислоты.
IV. Определение аминокислотной последовательности белковой цепи.
Выделение белка из биологического материала основано на его физико-химических свойствах. Чаще всего для этих целей используют кислотно-основные свойства белков (амфотерность, заряд молекулы, изоэлектрическое состояние).
От заряда белковых молекул зависит их:
При растворении в водной среде на поверхности белковой молекулы формируется гидратная оболочка.
Устойчивость белка в растворе зависит от:
Для выделения нативных белков (без изменения пространственной структуры) из биологического раствора используют методы:
При использовании этих методов белки лишаются гидратной оболочки и выпадают в осадок в растворе.
Денатурация — нарушение пространственной структуры белков (первичная структура молекулы сохраняется). Может быть обратимая (структура белка восстанавливается после устранения денатурирующего агента) или необратимая (пространственная структура молекулы не восстанавливается, например, при осаждении белков минеральными концентрированными кислотами, солями тяжелых металлов).
МЕТОДЫ РАЗДЕЛЕНИЯ БЕЛКОВ
Отделение белков от низкомолекулярных примесей
Метод мембранных сит (диализ)
Используют диализную мембрану, которая является полимером и имеет поры определенной величины. Малые молекулы (низкомолекулярные примеси) проходят через поры в мембране, а крупные (белки) задерживаются. Таким образом белки отмывают от примесей.
Разделение белков по молекулярной массе
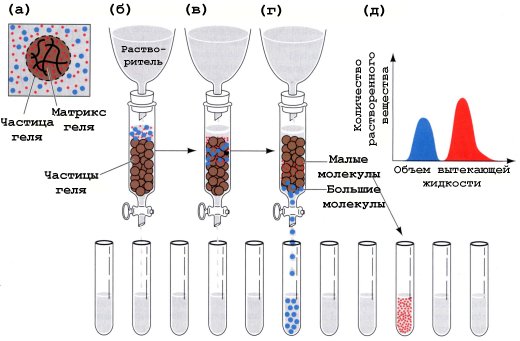
Гель-хроматография
Хроматографическую колонку заполняют гранулами геля (сефадекс), который имеет поры определенной величины. В колонку вносят смесь белков. Белки, размер которых меньше, чем размер пор сефадекса, задерживаются в колонке, так как «застревают» в порах, а остальные свободно выходят из колонки. Размер белка зависит от его молекулярной массы.
Ультрацентрифугирование
Этот метод основан на различной скорости седиментации (осаждения) белковых молекул в растворах с различным градиентом плотности (сахарозный буфер или хлорид цезия).
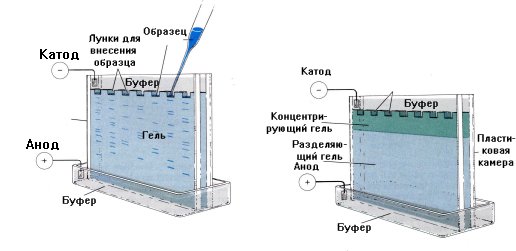
Электрофорез
Данный метод основан на различной скорости миграции белков и пептидов в электрическом поле в зависимости от заряда.
Носителями для электрофореза могут служить гели, ацетатцеллюлоза, агар. Разделяемые молекулы движутся в геле в зависимости от размера: те из них, которые имеют большие размеры, будут задерживаться при прохождении через поры геля. Меньшие молекулы будут встречать меньшее сопротивление и, соответственно, двигаться быстрее. В результате, после проведения электрофореза, большие молекулы будут находиться ближе к старту, чем меньшие.
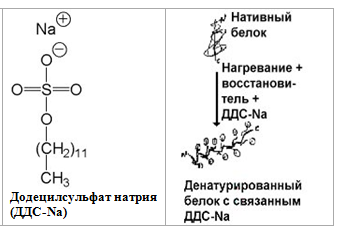
Методом электрофореза можно разделить белки по молекулярной массе. Для этого используют электрофорез в ПААГ в присутствии додецилсульфата натрия (ДДS-Na).
ДДС-Na является дифильным веществом и содержит заряженную группу и гидрофобную. Белки связываются с ДДС-Na своими гидрофобными радикалами и при этом денатурируют. Таким образом, белки выравниваются по форме и заряду. После этого подвижность белка при электрофорезе зависит только от его молекулярной массы.
Выделение индивидуальных белков
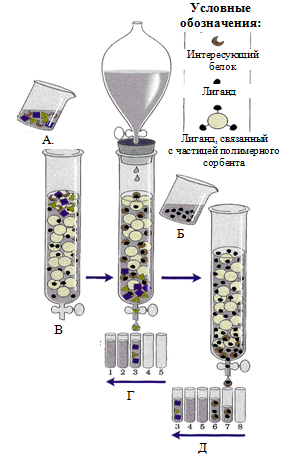
Аффинная хроматография
Метод основан на способности белков прочно связываться с различными молекулами нековалентными связями. Используется для выделения и очистки ферментов, иммуноглобулинов, рецепторных белков.
Молекулы веществ (лиманды), с которыми специфически связываются определенные белки, ковалентно соединяют с частицами инертного вещества. Смесь белков вносят в колонку и искомый белок прочно присоединяется к лиганду. Остальные белки свободно выходят из колонки. Задержанный белок затем можно вымыть из колонки с помощью буферного раствора, содержащего в свободном состоянии лиганд. Этот высокочувствительный метод позволяет выделить в чистом виде очень малые количества белка из клеточного экстракта, содержащего сотни других белков.
Изоэлектрофокусирование
Используется пластина с амфолином — веществом, у которого заранее сформирован градиент pH. Проводят сначала электрофорез в горизонтальном направлении. Белки разделяются в зависимости от заряда (изоэлектрическая точка). Затем обрабатывают пластину раствором ДДС-Na и проводят электрофорез в вертикальном направлении. Белки разделяются в зависимости от молекулярной массы.
Анализ гомологичных белков
Гомологичные белки — белки, которые выполняют одну и ту же функцию, но различаются по первичной структуре (например, локализованы в различных органах или образуются при патологических состояниях). Например, HbA (содержит Glu) HbS (содержит Val) при серповидноклеточной анемии.
Метод пептидных карт (отпечатков пальцев), предложенный Ингремом.
УСТАНОВЛЕНИЕ АК-ПОСЛЕДОВАТЕЛЬНОСТИ БЕЛКА
I. Определение N-концевой АК
1. Метод Сэнжера (ФДНБ — фтординитробензол — связывается с N-концевой АК с образованием соединения желтого цвета).
2. Метод Эдмана (используется ФИТЦ — фенилизотиоцианат, который также связывается с N-концевой АК с образованием соединения оранжевого цвета).
3. Взаимодействие N-концевой АК с дансилхлоридом с образованием флуоресцирующего соединения.
4. Ферментативный метод (использование аминопептидаз — это ферменты которые избирательно отщепляют N-концевые АК, например, аланиновая аминопептидаза).
II. Определение С-концевой АК
1. Метод Акабори (гидразин разрушает все пептидные связи и реагирует со всеми АК, кроме концевой; концевую АК определяют после обработки смеси ФДНБ).
2. Ферментативный метод (карбоксипептидазы А отщепляют ароматические С-конце-вые АК, карбоксипептидазы В — основные С-концевые АК).
III. Определение АК-последовательности
1. Используют прибор секвенатор, предложенный Эдманом.